Глюкокортикостероиды препараты список при витилиго
Обновлено: 04.05.2024
ГБОУ ВПО РНИМУ им. Н.И. Пирогова Минздравсоцразвития РФ, Москва
Российский государственный медицинский университет, Москва
Российский государственный медицинский университет им. Н.И. Пирогова
Современный взгляд на проблему лечения витилиго
Журнал: Клиническая дерматология и венерология. 2012;10(2): 118‑123
Усовецкий И.А., Шарова Н.М., Короткий Н.Г. Современный взгляд на проблему лечения витилиго. Клиническая дерматология и венерология. 2012;10(2):118‑123.
Usovetskiĭ IA, Sharova NM, Korotkiĭ NG. The current view of the problem of vitiligo therapy. Klinicheskaya Dermatologiya i Venerologiya. 2012;10(2):118‑123. (In Russ.).
ГБОУ ВПО РНИМУ им. Н.И. Пирогова Минздравсоцразвития РФ, Москва
Представлены результаты собственных исследований, посвященных особенностям клинического течения разных форм витилиго, некоторым патогенетическим аспектам развития данного заболевания и оценке клинической эффективности комплексной терапии сегментарной и несегментарной формы витилиго.
ГБОУ ВПО РНИМУ им. Н.И. Пирогова Минздравсоцразвития РФ, Москва
Российский государственный медицинский университет, Москва
Российский государственный медицинский университет им. Н.И. Пирогова
Витилиго характеризуется внезапным возникновением депигментированных пятен вследствие нарушения секреторной функции меланоцитов или их гибели, развивается у лиц с генетической предрасположенностью, сопровождается выраженными дисрегуляторными изменениями клеточно-опосредованных реакций иммунной системы, вегетативного дисбаланса с преобладанием симпатического тонуса и серьезной социальной дезадаптацией, обусловленной личностными особенностями и внешними социальными факторами.
Витилиго является распространенным дерматозом. В мире число больных с данным заболеванием превышает 1% всего населения. В 70% случаев заболевание начинается в возрасте 10—25 лет, дети младше 10 лет, в том числе новорожденные и грудного возраста, составляют приблизительно 25% всех больных витилиго [1]. Витилиго может возникнуть в любом возрасте, длиться неопределенно долго, самопроизвольное восстановление нормальной окраски кожи наблюдается редко.
Причины появления депигментированных очагов не известны. Недостаточно понятно, в результате каких нарушений резко прекращается синтез меланина и погибают меланоциты. Разные эндогенные и экзогенные факторы могут оказывать прямое и опосредованное повреждающее действие на меланоциты.
Среди внешних факторов наибольшее значение придают инфекционным и токсическим агентам, чрезмерному ультрафиолетовому облучению, стрессам. На протяжении многих десятилетий витилиго связывали с аутоиммунным тиреоидитом, ревматоидным артритом, красной волчанкой, атопическим дерматитом, заболеваниями печени инфекционного или токсического генеза, глистной инвазией и рядом врожденных синдромов [2]. Однако частота встречаемости витилиго у этих больных не выше, чем в популяции в целом. Ряд авторов [3, 4], подводя итоги многолетним исследованиям, считают, что больные витилиго в большинстве случаев не имеют никаких тяжелых или хронических сопутствующих заболеваний, а терапия выявленных у 28% больных функциональных расстройств органов пищеварения, вегетососудистой дистонии не оказывала влияния на результат репигментации.
Многие исследователи считают [5, 6], что витилиго является серьезным косметическим дефектом, возникает у лиц с генетической предрасположенностью и в у большинстве случаев, перенесших эмоциональные расстройства. Лишь у 4—7% больных витилиго сочетается с аутоиммунным тиреоидитом.
В современных генетических исследованиях продемонстрирована связь возникновения витилиго с разными аспектами наследования. Среди спорадических случаев витилиго в европейской популяции средний возраст возникновения заболевания составляет 24,2 года, тогда как в семьях с множественными случаями заболевания средний возраст составляет 21,5 года (статистически достоверные различия) [7]. Более раннее начало заболевания в «семейных» случаях и риск заболевания у отдаленных родственников является типичной характеристикой полигенного заболевания. Около 20% больных витилиго имеют не менее одного кровного родственника с подобным заболеванием. Формально-генетический сегрегационный анализ витилиго определяет существование многих локусов, нарушения в которых формируют предрасположенность к витилиго. Однако не обнаружены ключевые гены, ответственные за манифестацию, прогрессирующее течение или предрасположенность к данному заболеванию.
При витилиго обнаружено снижение антиоксидантного потенциала, приводящего к активному повреждающему воздействию на меланоциты свободных радикалов и накоплению продуктов перекисного окисления липидов [8, 9]. Позднее выяснилось, что свободные радикалы оказывают повреждающее действие на разные клетки, участвующие в воспалительных реакциях разного типа, и нарушения антиоксидантной защиты не являются основными механизмами депигментации при витилиго.
Теория нарушений иммунных механизмов регуляции является наиболее обоснованной. При длительном течении и распространенном патологическом процессе наблюдаются изменения в субпопуляционном составе Т-лимфоцитов. Одновременно с этим, особенно на начальных стадиях заболевания, повышаются уровни активационных рецепторов лимфоцитов, отражающие степень активации иммунокомпетентных клеток [10]. В настоящее время большинство исследователей полагают, что ведущая роль в развитии аутоиммунных заболеваний принадлежит клеточно-опосредованным реакциям, при которых наблюдается выраженный дисбаланс цитокинов. При витилиго выявляется снижение активности регуляторных Т-лимфоцитов, что подтверждается уменьшением количества трансформирующего фактора роста-β (TGF-β) и интерлейкина-10 (ИЛ-10) в сыворотке крови больных [11].
Лечение витилиго является сложнейшей задачей. Так как причины его возникновения неизвестны, в большинстве случаев заболевание развивается на фоне полного физического благополучия. Предлагается применять в основном топические стероиды и/или иммуномодуляторы при площади поражения до 20%, а также длительную фототерапию [12, 13]. В комплексную терапию включают ферментные препараты, гепатопротекторы, витамины и микроэлементы (цинк, медь) [14, 15]. В ряде рекомендаций содержатся сведения о применении седативных и антидепрессивных средств.
Цель настоящего исследования — изучение клинических особенностей течения витилиго и эффективности комплексной терапии, включающей иммуномодулирующий компонент — тимоген и наружно 1% пимекролимус, и коррекцию аффективных расстройств у больных разными формами витилиго с использованием препарата антидепрессивного действия агомелатин.
Материал и методы
Все больные разными формами витилиго были полностью обследованы (проведены клинические анализы крови и мочи, биохимический анализ крови, ультразвуковое исследование органов брюшной полости и щитовидной железы, гормоны щитовидной железы Т3, Т4, тиреотропный гормон — ТТГ и антитела к тиреоидной пероксидазе — АТ-ТПО по показаниям, консультация невропатолога по показаниям, консультация психиатра, иммунологические исследования — популяционный и субпопуляционный состав лимфоцитов, уровень провоспалительных и регуляторных цитокинов).
Результаты
Под нашим наблюдением с 2006 по 2011 г. находились 84 больных витилиго (46 женщин, 38 мужчин) в возрасте от 18 до 56 лет.

Давность заболевания варьировала от 6 мес до 30 лет, средняя продолжительность составила 6,5±4,8 года. Среди вероятных причин развития витилиго большинство больных называли перенесенный стресс (39 пациентов, 46%). Витилиго возникло после оперативных вмешательств у 3 (3,5%) пациентов, после травм — у 4 (4,5%). По мнению 4 (5%) женщин, впервые депигментированные пятна появились у них после родов, в период лактации, причем 1 пациентка отмечала, что после 2- и 3-х родов увеличивалась площадь поражения и появлялись свежие очаги. У 14 (17%) больных заболевание возникло после воздействия длительного ультрафиолетового излучения, 20 (24%) пациентов не могли связать появление депигментированных пятен с какими-либо значимыми причинами (рис. 1). Рисунок 1. Вероятные причины развития витилиго. У 21 больного среди ближайших родственников имелись проявления витилиго разной давности и степени распространенности, у 2 из них, помимо поражений кожи были обесцвечены участки волос.
При обследовании больных витилиго обнаружено, что наиболее часто (у 48 больных, 57,1%) встречаются дискинезия желчевыводящих путей и желчекаменная болезнь, хронический холецистит, жировой гепатоз. Гастрит обнаружен у 16 (19%) больных. В процессе обследования патология щитовидной железы (аутоиммунный тиреоидит, диффузный токсический зоб, кисты щитовидной железы) выявлена или подтверждена у 13 (15,4%) больных витилиго. Только у 4 больных из 13 с патологией щитовидной железы были обнаружены АТ-ТПО, что подтверждало диагноз аутоиммунный тиреоидит.

Гинекологические заболевания (дисфункциональные нарушения менструального цикла, миома) обнаружены у 5 (5,9%) женщин. У 10 (11,9%) больных подтверждена гипертоническая болезнь I—II степени, у 1 (1,2%) выявлен сахарный диабет 2-го типа, у 3 (3,5%) обнаружено алиментарное ожирение II—III степени. Достоверных отклонений от нормальных значений в клинических анализах крови не обнаружено. Тяжелых хронических заболеваний или декомпенсированных состояний у больных витилиго не выявлено (табл. 1).
Мы наблюдали за больными с разными формами витилиго (табл. 2). Среди них 7 (8,3%) больных имели сегментарную форму с площадью поражения 2% (рис. 2). Рисунок 2. Сегментарная форма витилиго. Вульгарная форма наблюдалась у 44 (52,3%) больных. В этих случаях площадь поражения составляла 3—70% площади кожного покрова (рис. 3, а, б). Рисунок 3. Пациентка (а) и пациент (б) с вульгарной формой витилиго. Отдельную группу составили больные с акрофациальной формой (31 человек, 36,9%) с депигментированными очагами на лице и конечностях (рис. 4, а—в). Рисунок 4. Акрофациальная форма витилиго (а—в). У 10 (11,9%) пациентов при клиническом обследовании обнаружены невусы Сеттона (рис. 5). Рисунок 5. Невусы Сеттона.
Витилиго является серьезной психологической проблемой [16, 17]. При исследовании уровня тревожности методом Спилбергера—Ханина низкий уровень реактивной тревожности наблюдается у 52 (61,9%) больных, а у 32 (38,1%) — умеренно выраженная реактивная тревожность. У 55 (77,4%) больных витилиго отмечен высокий уровень личностной тревожности, причем он не зависел ни от площади поражения, ни от давности заболевания. Наличие депрессивных расстройств подтверждены с помощью госпитальной шкалы Гамильтона (средний показатель 13,9±2,4 балла) и шкалы Бека (средний показатель 22,4±2,8 балла). У большинства обследованных выявлялись депрессивные расстройства невротического уровня, характеризующиеся подавленностью настроения, нарушением сна, тревожными и астеническими проявлениями.
Таким образом, в ходе обследования каких-либо тяжелых сопутствующих заболеваний не выявлено. По данным литературы, аффективные и вегетативные нарушения наблюдаются практически у всех больных витилиго и требуют адекватной коррекции.
При иммунологическом исследовании, проведенном 25 больным витилиго, обнаружены достоверные отклонения от контрольных значений в субпопуляционном составе Т-лимфоцитов и дисбаланс провоспалительных цитокинов (табл. 3; рис. 6). Рисунок 6. Содержание цитокинов в сыворотке больных витилиго. Примечание. ИЛ-2, ИЛ-8, ФНО-α, ИФН-γ, ИЛ-10 в пг/мл; TGFβ, в нг/мл. Так, содержание CD8+ в крови больных витилиго было достоверно выше, чем у здоровых, иммунорегуляторный индекс (ИРИ) также имел достоверные отличия от контрольных значений. В сыворотке крови больных витилиго обнаружено повышенное содержание ИЛ-2, ИЛ-6, ИЛ-8 и фактора некроза опухоли-α (ФНО-α), интерферона-γ (ИФН-γ) на фоне низкого уровня регуляторных цитокинов TGF-β и ИЛ-10 по сравнению с контролем.
Комплексное лечение больных проводили с учетом клинических особенностей витилиго, в том числе давности, распространенности и активности патологического процесса. Использовали направленную иммуномодулирующую терапию — тимоген (назальный спрей по 1 мл/сут в течение 20 дней) и пимекролимус (1% крем 2 раза в сутки в течение 4—6 мес). Психокорригирующую терапию проводили агомелатином, который является агонистом мелатонина (МТ1- и МТ2-рецепторов) и антагонистом 5НТ2с. Агомелатин больные витилиго принимали по 25 мг/сут 1 раз в день не менее 6 нед. После консультации психиатра 5 больным с умеренно выраженными признаками депрессии агомелатин был назначен в суточной дозе 50 мг на 12—24 нед.
Мы провели комплексное лечение 57 больным разными формами витилиго (3 пациента — с сегментарной формой, 25 — с акрофациальной, 29 — вульгарной).
У всех больных с сегментарной формой витилиго 100% репигментация наблюдалась через 4 мес после начала терапии.
У больных акрофациальной формой полная клиническая ремиссия отмечена в 16 (64%) случаях через 5 мес терапии. Значительное улучшение со 100% репигментацией большинства очагов и уменьшением площади очагов депигментации более чем на 60% имелось у 7 пациентов. Незначительная эффективность отмечена у 2 больных, причем полностью восстановилась нормальная окраска кожи в периорбитальных и периоральной областях, на тыльной поверхности кистей и в области фаланг площадь депигментированных очагов практически не изменилась, частично (до 40%) уменьшилась площадь очагов в области голеностопных суставов.
Положительные изменения после проведенной комплексной терапии наблюдались у всех больных вульгарной формой витилиго. Клиническая ремиссия отмечалась у 20 из 29 больных данной группы.
В течение первых 3 мес терапии (12 нед) у этих пациентов началась активная репигментация очагов, площадь которых сокращалась на 30—60%. К концу 6-го месяца цвет кожи восстановился полностью.

У 6 больных наблюдалось сокращение площади депигментированных очагов на 50—70% за счет полной репигментации отдельных очагов и частичного восстановления нормального цвета кожи отдельных участков. У 3 пациентов отмечались незначительные позитивные изменения, которые выражались в восстановлении пигментации свежих, небольших по площади участков (не более 2 см 2 ), сглаживании границ по периферии очагов депигментации (табл. 4).
Все больные хорошо переносили лечение, побочных эффектов, осложнений, отказов от терапии не было. В процессе терапии удалось изменить отношение пациентов к своему заболеванию, оценить позитивные изменения в процессе лечения. На фоне активной репигментации очагов нормализовались иммунологические показатели и произошла редукция признаков депрессивных расстройств.
Таким образом, полученные нами результаты свидетельствуют о возможности обоснованного эффективного и безопасного лечения витилиго.
БЕСПЛАТНАЯ КОНСУЛЬТАЦИЯ: поможем врачам и владельцам клиник выбрать оборудование для лечения витилиго
Оглавление
Витилиго — прогрессирующее нарушение пигментации кожи вследствие разрушения меланоцитов, приводящее к обесцвечиванию некоторых участков или всего тела.
В нашей компании Вы можете приобрести следующее оборудование для лечения витилиго:
Распространенность заболевания в мире находится на уровне 0,5–2,0%, средний возраст появления — 20 лет. Витилиго не имеет расовой или этнической принадлежности, хотя более заметно на темной коже.
Этиология и патогенез витилиго
Витилиго является многофакторным пигментным расстройством со сложным патогенезом, связанным как с генетическими, так и с негенетическими факторами. На сегодняшний день предложено несколько теорий возникновения данного заболевания, но его точная причина все еще остается неизвестной. Единственными доказанными фактами являются отсутствие функциональных меланоцитов в коже и потеря гистохимически распознаваемых пигментных клеток вследствие их разрушения.
Теории появления витилиго:
- Аутоиммунная теория — гуморальный и клеточный иммунный ответы меняются таким образом, что вызывают деструкцию меланоцитов. Наиболее убедительным доказательством аутоиммунного фактора является наличие циркулирующих антител против меланоцитов у пациентов с витилиго.
- Нейронная теория — нейрохимический медиатор разрушает меланоциты или ингибирует выработку пигмента ими.
- Окислительно-антиоксидантная теория — метаболический продукт синтеза меланина разрушает меланоциты.
- Теория внутреннего дефекта меланоцитов — пигментные клетки имеют врожденную аномалию, которая препятствует их нормальному росту и дифференцировке.
В наследовании участвуют определенные гены, связанные с биосинтезом меланина, клеток реакцией на окислительный стресс и регуляцией аутоиммунного ответа. Также считается, что генетические факторы влияют на возраст появления витилиго. В целом же вероятность развития данного заболевания у ближайших родственников (детей) пациента составляет около 30%.
Клинические проявления витилиго
В большинстве случаев витилиго диагностируется при стандартном медицинском осмотре. Оно проявляется в виде приобретенных депигментированных областей, окруженных нормальной кожей. Данные области, как правило, молочно-белого цвета, круглые, овальные или вытянутые, в том числе неправильной формы, с четкими контурами. С течением времени зоны депигментации увеличиваются в размерах, причем скорость этого процесса спрогнозировать невозможно. В некоторых случаях для диагностики небольших очагов витилиго может потребоваться лампа Вуда — обычно у людей с I фототипом, т.е. очень светлой, белоснежной кожей.
Чаще всего витилиго возникает на лице, шее, предплечьях, ступнях, дорсальной (внешней) стороне рук, а также на пальцах и коже головы. На лице поражения обычно распределяются вокруг глаз (периорбитально) и рта (периорально) (рис. 1). Если витилиго принимает генерализованную форму, могут обесцвечиваться половые органы, ареолы и даже соски.
У пациентов с витилиго зачастую проявляется феномен Кебнера — возникновение поражений в местах постоянного раздражения или травмы кожи. Области длительного трения, порезов и ожогов обесцвечиваются в 20–60% случаев. В пораженных зонах волосы некоторое время могут оставаться темными, но постепенно утрачивают пигмент — это явление называется лейкотрихией (рис. 2). Спонтанная репигментация таких волос маловероятна.
- Трехцветное витилиго — характеризуется промежуточной зоной гипопигментации между депигментированным центром и нормальной кожей. Постепенно гипопигментированные области становятся полностью белыми, но пока они существуют, у пациента есть 3 цветовых варианта кожи: естественный, осветленный и белый (рис. 3). Выраженность трехцветного витилиго зависит от исходного фототипа — чем он темнее, тем более заметна цветовая градация.
- Четырехцветное витилиго — в местах перифолликулярной репигментации присутствует дополнительный, темно-коричневый цвет.
- Краевое воспалительное витилиго — очень редкий вариант, при котором у поражений имеется красная выпуклая граница (рис. 4). Она присутствует сразу, либо появляется через несколько месяцев или лет. Также может присоединяться небольшой зуд.
Сегментарное витилиго
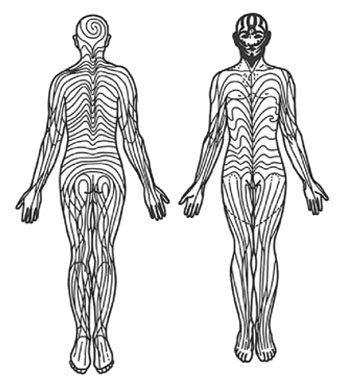
Проявляется в виде одного или нескольких пятен, которые повторяют линии Блашко на теле.
Линии Блашко представляют собой тип (паттерн) распространения приобретенных кожных заболеваний на коже и слизистых человека. Эти линии не соответствуют известным нервным, сосудистым и лимфатическим структурам, а отражают именно модель развития болезни. Считается, что характеристики данного паттерна «прописаны» в ДНК (рис. 5).
Сегментарное витилиго в большинстве случаев одностороннее и не пересекает срединную линию тела. Этот вариант болезни обычно начинается рано и быстро распространяется в пораженной области. Сегментарное витилиго не связано с патологиями щитовидной железы или другими аутоиммунными заболеваниями.
Несегментарное витилиго
Данный термин включает в себя все типы витилиго, которые нельзя классифицировать как сегментарное:
- Очаговое витилиго — проявляется одним или несколькими пятнами на разных сегментах тела.
- Генерализованное витилиго — обширные зоны поражения, охватывающие несколько сегментов:
- Акрофациальное витилиго — депигментация наблюдается вокруг рта и на пальцах.
- Вульгарное витилиго — множественные очаги депигментации, случайным образом рассеянные по телу.
- Универсальное витилиго — полная или почти полная депигментация всей кожи.
Микроскопия пораженных участков показывает отсутствие меланоцитов в сочетании с потерей эпидермальной пигментации. По краям наблюдаются поверхностные периваскулярные и перифолликулярные лимфоцитарные инфильтраты.
Рис. 1. Винни Харлоу (Winnie Harlow) — модель, которая благодаря витилиго стала одним из «ангелов» бренда Victoria’s Secret. Можно заметить симметричную депигментацию вокруг рта, на предплечьях, кистях и в подмышечной области (GettyImages)

Рис. 2. Лейкотрихия в области витилиго на волосистой части головы (Danish national service on dermato—venereology)
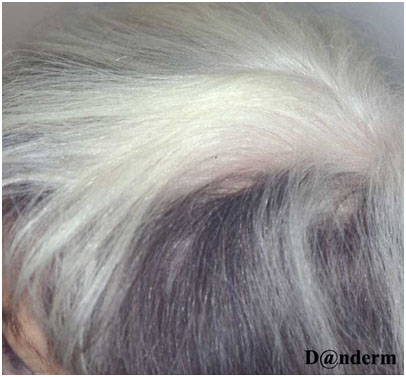
Рис. 3. Трехцветное витилиго (Vitiligo Centre Australia)
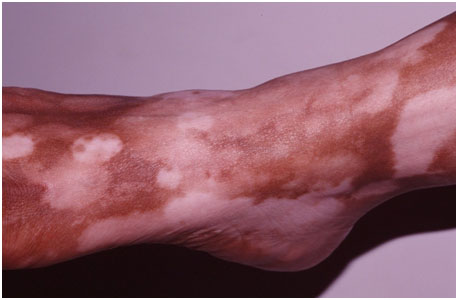
Рис. 4. Краевое воспалительное витилиго (Verma S. Inflammatory vitiligo with raised borders and psoriasiform histopathology. Dermatol Online J 2005; 11: 13)
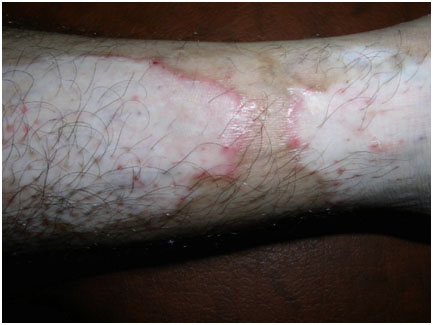
Рис. 5. Линии Блашко (Tenea D. The puzzle of the skin patterns. Integrative Med Int 2016; 4: 1–12)
Принципы лечения витилиго
Специфического патогенетического метода лечения витилиго или средства от витилиго на сегодняшний день нет. Это связано с тем, что мы пока не до конца понимаем причины данного заболевания и все звенья его патогенеза. Однако известно, что витилиго не является жизнеугрожающим состоянием и чаще всего вызывает лишь психологический дискомфорт у пациентов. Впрочем, он может быть достаточно сильным при локализации поражений на открытых участках кожи — например, лице.
Пациентам со светлой кожей (I–II фототипы) лечение может не потребоваться. Если у них нет обширных поражений, и/или они не сильно выделяются на фоне и без того светлой кожи, проводить терапию нецелесообразно. Лучшей стратегией в данном случае является качественная защита от солнца во избежание потемнения здоровых участков тела.
Для лечения витилиго сегодня используются различные методики. При этом ни одна из них не дает предсказуемо хороших результатов — ответ сильно варьируется в индивидуальном порядке.
Топические стероиды
Топические кортикостероиды популярны у пациентов с локализованным витилиго, поскольку их легко и удобно использовать. Однако результаты такой терапии признаны умеренно успешными. Обычно для лечения витилиго назначаются препараты средней силы — их применяют 1 месяц, после чего врач оценивает эффект и корректирует дозу. Среди нежелательных реакций возможно развитие кортикостероидной атрофии кожи, поэтому необходим постоянный врачебный контроль.
Ингибиторы кальциневрина
Мазь с такролимусом и крем с пимекролимусом являются достаточно эффективными средствами лечения витилиго, особенно при поражении головы и шеи. Эти препараты для лечения витилиго могут использоваться в сочетании с местными стероидами. Исследования показали, что применение ингибиторов кальциневрина вместе с лазерной терапией или узкополосным ультрафиолетом спектра B улучшает результаты лечения.
Аналоги витамина D
Аналоги витамина D (кальципотриол, такальцитол) регулируют местный иммунный ответ, а также влияют на созревание и дифференцировку меланоцитов. Хотя роль аналогов витамина D в лечении витилиго до конца не ясна, ученые склоняются к их использованию в качестве дополнительной терапии.
Афамеланотид
Афамеланотид — это синтетический аналог альфа-меланоцит-стимулирующего гормона (α-MSH). Он связывается с рецептором меланокортина-1, стимулируя пролиферацию меланоцитов и меланогенез. Афамеланотид поставляется в виде подкожного импланта. Побочные реакции включают в себя гиперпигментацию нормальной кожи, тошноту и боль в животе.
Ингибиторы янус-киназы
Ингибиторы янус-киназы (тофацитиниб) хорошо сочетаются с другими методами лечения витилиго. Результаты такого подхода многообещающие, но в целом необходимы дальнейшие исследования.
Макияж
При наличии небольших зон депигментации на фоне темной кожи можно использовать макияж. Это средство позволяет многим пациентам с витилиго чувствовать себя комфортно в обществе.
Отбеливание здоровой кожи
Если не получается вернуть окраску депигментированным областям, можно попробовать отбелить окружающую здоровую кожу. Обычно данный метод используют при генерализованных формах витилиго, когда зон с нормальной окраской меньше, чем обесцвеченных. Для этого используется гидрохинон и другие депигментирующие агенты.
Хирургия
Хирургические методы лечения витилиго заключаются в пересадке эпидермальных или дермо-эпидермальных графтов, а также культивированных меланоцитов в пораженные области. Эти подходы используются только при очаговом витилиго и только на небольших участках.
Фототерапия узкополосным UVB
Фототерапия узкополосным ультрафиолетом спектра В (narrowband UVB, NB-UVB) является методикой выбора у взрослых и детей с генерализованным витилиго. Обычно для этого используются длины волн 311–312 нм, частота процедур — 2–3 раза в неделю. Метод абсолютно безопасен, поэтому может применяться у детей, беременных и кормящих женщин. Краткосрочные побочные эффекты NB-UVB включают в себя зуд, жжение и ксероз, которые обычно проходят самостоятельно.
Пациентам с витилиго рекомендуется проводить фототерапию длительными курсами, поскольку для оценки результата требуется не менее 6 месяцев. При этом загорает и нормальная кожа, что в ряде случаев делает контраст с областями витилиго еще более заметным — особенно если в итоге репигментация пораженных зон не наступает. Поэтому перед началом фототерапии следует обсудить с пациентом возможные последствия данного лечения и использовать мощную фотозащиту на здоровой коже.
ПУВА-терапия
Фототерапия ультрафиолетом спектра А (UVA) с фотосенсибилизатором псораленом (psoralen) называется ПУВА-терапией (Psoralen and Ultraviolet A, PUVA). Псорален применяется местно или перорально перед облучением кожи для усиления ее чувствительности к свету. Побочные эффекты от препарата для лечения витилиго: тошнота, фототоксические реакции, риск появления рака кожи.
На сегодняшний день узкополосный ультрафиолет спектра В постепенно вытесняет ПУВА-терапию в лечении витилиго, поскольку он является достаточно эффективным, но имеет меньше побочных эффектов. Обзор научных статей за 2017 год показал, что пациенты в целом реагируют лучше на NB-UVB, чем на ПУВА.
Лазерная терапия
В ряде случаев внешний вид пациентов с витилиго можно улучшить, используя фракционные лазеры (неаблятивный и аблятивный фракционный фототермолиз). Поскольку неэстетический вид при этом заболевании в значительной степени вызван резкой границей между нормальной и пигментированной кожей, на ситуацию можно положительно повлиять путем сглаживания этой границы.
Фракционный лазер создает микрозоны повреждения на депигментированном и нормальном участке кожи, в ходе заживления которых происходит локальная миграция меланоцитов из областей здоровой кожи в зону депигментации — это позволяет сгладить границу перехода между участками и добиться улучшения внешнего вида. В качестве фракционных лазеров лучше всего использовать Fraxel, ResurFX M22 и Acupulse.
В статье приводятся сведения о витилиго, гетерогенном заболевании с полигенным типом наследования. За последние десятилетия отмечается значительный рост пациентов с витилиго. Приводятся патогенетические теории развития витилиго. В статье раскрываются данн
Витилиго — гетерогенное заболевание с полигенным типом наследования, представляет собой идиопатическую дисхромию кожи, характеризующуюся появлением депигментированных, часто симметрично расположенных пятен различных размеров, очертаний молочно-белого цвета с окружающей их зоной с умеренной гиперпигментацией и тенденцией к периферическому росту [1]. Для витилиго характерно хроническое, в большинстве случаев прогрессирующее течение, выражающееся в увеличении количества и размера очагов. Установлено, что появление очагов депигментации обусловлено разрушением меланоцитов в пораженной коже. Болезнь может появиться в любом возрасте, независимо от пола. Распространенность витилиго в зависимости от географического региона, в различных этнических группах разнообразна и составляет от 0,1 до 2 и более процентов населения. Витилиго может начаться в любом возрасте, однако чаще проявляется в возрастной группе 10–30 лет. Таким образом, данной патологией страдают преимущественно социально активные люди, у которых наличие косметического дефекта оказывает существенное влияние на качество жизни [2]. В то же время установлены предрасполагающие и провоцирующие факторы. Имеются данные о роли дисфункции нервной системы, стрессовых факторов, хронических воспалительных заболеваний урогенитального тракта, внутренних органов, дефицита цинка и меди в крови, интоксикаций, нарушений функций желез внутренней секреции, иммунной системы [3].
Наиболее признанными теориями патогенеза витилиго являются:
- теория иммунных нарушений (ведущая роль принадлежит клеточно-опосредованным реакциям);
- теория оксидативного стресса (свободные радикалы при недостаточности антиоксидантной защиты оказывают прямое повреждающее действие на кератиноциты и меланоциты);
- неврогенная теория (депигментация формируется вследствие функционального дефицита индоламиновой и катехоламиновой систем, возникающего в ответ на стресс, нарушений функционирования нейротрансмиттерной системы, пептидов и рецепторов), причем депигментация является одним из возможных симптомов соматизированных расстройств;
- генетическая теория (молекулярно-генетические исследования выявили значительное количество генов, которые могут быть вовлечены в молекулярный патогенез витилиго, однако назвать ключевые гены, ответственные за предрасположенность к заболеванию, пока невозможно) [4].
Вместе с тем, по мнению большинства экспертов, ведущее значение в повреждении меланоцитов и нарушении процессов меланогенеза в коже больных витилиго придается аутоиммунным механизмам [8].
Мультифакторная концепция патогенеза и выявленные нарушения при исследовании различных систем организма обосновывают необходимость применения в терапии данного заболевания широкого спектра традиционных лечебных мероприятий, так как течение и исход витилиго во многом зависят от правильного выбора фармакотерапии и методов лечения конкретного больного.
Актуальные подходы к терапии больных витилиго определены в отечественных и зарубежных клинических рекомендациях и включают следующие основные направления: системная терапия (глюкокортикоиды, иммунотерапия, антиоксиданты); фототерапия; наружная терапия (ингибиторы кальциневрина, кортикостероиды, антиоксиданты). Но несмотря на это в данном направлении проводятся активные научные исследования по разработке новых более рациональных и эффективных средств с высоким профилем безопасности, обладающих повышенной экономической эффективностью производимых затрат, учитывая, что данный дерматоз обусловлен длительным медикаментозным лечением. Основной целью лечения витилиго является остановка прогрессирования болезни, достижение стабилизации процесса, а затем и регресса клинических проявлений. В результате многочисленных исследований получены убедительные данные, свидетельствующие о том, что наиболее важным и значимым из указанных выше направлений терапевтического комплекса ведения больных витилиго является наружная терапия [5], что может быть связано не только с высокой эффективностью за счет непосредственного применения препарата на очаги витилиго, но и низкой абсорбцией лекарственных препаратов при местном применении, т. е. меньшей вероятностью развития системных побочных эффектов.
Топические кортикостероиды по-прежнему относятся к препаратам первой линии при поражении 10–20% кожного покрова. Характерной особенностью их является иммуносупрессивная активность, которая проявляется подавлением активности Т- и В-лимфоцитов, а также угнетением высвобождения цитокинов (ИЛ-1, ИЛ-2, интерферона-γ — 1 ККу) из лейкоцитов и макрофагов [7]. Кроме того, кортикостероиды снижают образование и увеличивают распад компонентов системы комплемента, блокируют Fc-рецепторы иммуноглобулинов, а также оказывают супрессивное действие на механизмы нарушения синтеза меланина в активную стадию заболевания. Но несмотря на столь высокую эффективность одновременно топические кортикостероиды имеют и местные побочные эффекты, такие как атрофия кожи, телеангиэктазии и вульгарные угри. В связи с этим с целью снизить риск развития местных побочных эффектов и достичь более быстрого процесса репигментации топические кортикостероиды комбинируют с различными терапевтическими методиками, среди которых выделяют физиотерапевтические методы, топические иммуномодуляторы и др. Известны также случаи применения топических кортикостероидов в сочетании с трансретиноевой кислотой (третиноин), способствующей не только предотвращению атрофии кожи, но и ингибированию апоптоза меланоцитов.
К числу современных препаратов для местного лечения относятся такие иммуносупрессивные средства, как такролимус и пимекролимус, принадлежащие к классу аскомициновых препаратов. Они являются препаратами выбора для иммуноопосредованных дерматозов благодаря их сравнимой эффективности, простоте применения и большей безопасности, чем их системные аналоги. Проведенные исследования in vitro показали, что взаимодействие между ингибиторами кальциневрина и кератиноцитами индуцирует высвобождение фактора стволовых клеток и повышение активности матриксной металлопротеиназы-9, что способствует меланогенезу.
Также в местном лечении витилиго с различным успехом применяют аналоги простагландинов. Известно, что простагландины участвуют в процессах пролиферации меланоцитов и меланогенеза, экспрессии тирозиназы, а также оказывают иммуномодулирующее действие. Сообщалось о топическом применении геля простагландина ПГ Е2 (0,5 мг динопростона в 3 г стерильного геля) на депигментированных участках кожи у 24 больных витилиго. Согласно результатам исследования, спустя примерно 6 мес выраженная репигментация наблюдалась у 15 пациентов.
Большие надежды возлагают на действие внутриочаговых инъекционных лекарственных препаратов, получивших широчайшее распространение в медицинской практике и имеющих большие достоинства, среди которых отмечают быстроту наступления и продолжительность эффекта, обеспечение максимальной биодоступности непосредственно в очаге поражения, что проявляется уменьшением длительности заболевания. Лекарственные средства, введенные внутрикожно, остаются в требуемой зоне на более продолжительный срок, чем при других парентеральных методах введения (внутримышечно и внутривенно), так как они медленнее эвакуируются из места введения, но при этом объем раствора не должен превышать 1–2 мл.
Одной из наиболее широко используемых форм инъекционного глюкокортикостероида является триамцинолон ацетонид, который характеризуется низкой растворимостью, медленной всасываемостью из места инъекции, при этом побуждая максимальное локальное действие, ограничивает диффузию и распространение через ткани, не порождая системных побочных эффектов при использовании в терапевтических дозах.
В последние годы в терапии восстановления нарушенной иммунной системы обоснованно применяют локальное (интрадермальное) введение иммунокорригирующих препаратов, которое является рациональным подходом особенно к лечению иммуноопосредованных заболеваний, в том числе и витилиго.
У больных распространенными формами витилиго с площадью поражения более 10–20% поверхности тела методами выбора являются узкополосная фототерапия с длиной волны 311 нм или широкополосная ультрафиолетовая средневолновая терапия с длиной волны 280–320 нм. У больных распространенными формами витилиго с площадью поражения более 10–20% поверхности тела методами выбора являются узкополосная фототерапия с длиной волны 311 нм или широкополосная ультрафиолетовая средневолновая терапия с длиной волны 280–320 нм [8, 9].
Таким образом, в последние годы возможности лечения витилиго расширились благодаря разработке новых способов введения препаратов. К сожалению, существующие методы показаны не при всех разновидностях витилиго, поэтому в настоящее время все еще остаются вопросы, касающиеся применения каждого метода, необходимого для создания стойких результатов и коррекции больших участков депигментации. Внедрение в практику терапии витилиго новых локальных современных технологий коррекции пораженной кожи, имеющих ряд преимуществ по сравнению с другими традиционными путями введения, способствует разработке более безопасных методов терапии, обладающих высокой терапевтической эффективностью [6].
Литература
- Юсупова Л. А., Юнусова Е. И., Гараева З. Ш., Мавлютова Г. И. Современные подходы к наружной терапии больных витилиго // Практическая медицина. 2014. № 8 (84). С. 24–26.
- Исмайлов Р. Г. Этиопатогенетические аспекты витилиго в современной интерпретации // Вестник проблем биологии и медицины. 2012. С. 14–17.
- Скрипкин Ю. К., Бутова Ю. С., Иванова О. Л. Дерматовенерология. Национальное руководство. М.: ГЭОТАР- Медиа, 2013. 917 с.
- Усовецкий И. А., Шарова Н. М., Короткий Н. Г. Клеточная дерматобиология — эффективный инструмент лечения витилиго // Лечебное дело. 2011. № 1. С. 76–79.
- Hossani-Madani A. R., Halder R. M. Topical treatment and combination approaches for vitiligo: new insights, new developments // G. Ital. Dermatol. Venerol. 2010; 145 (1): 57–78.
- Шарафутдинова Л. А., Ломоносов К. М. Современные аспекты топической терапии витилиго // Российский журнал кожных и венерических болезней. 2014. № 5, т. 17. с. 40–45.
- Юсупoвa Л. A. Иммунопатология хронических дерматозов. Казань: НБ КГМА. 2017. 108 с.
- Федеральные клинические рекомендации. Дерматовенерология 2015: Болезни кожи. Инфекции, передаваемые половым путем. 5-е изд., перераб. и доп. М.: Деловой экспресс. 2016. 768 с.
- Юнусова Е. И., Юсупова Л. А., Гараева З. Ш., Мавлютова Г. И., Климова Р. Н. Витилиго: современные концепции. Сборник материалов Всероссийской научно-практической конференции с международным участием «Казанские дерматологические чтения: синтез науки и практики». Казань, 2016. С. 66–70.
Е. И. Юнусова, кандидат медицинских наук
Л. А. Юсупова 1 , доктор медицинских наук, профессор
З. Ш. Гараева, кандидат медицинских наук
Г. И. Мавлютова, кандидат медицинских наук
ГБОУ ДПО КГМА МЗ РФ, Казань
Особенности патогенеза и терапии больных витилиго/ Е. И. Юнусова, Л. А. Юсупова, З. Ш. Гараева, Г. И. Мавлютова.
Для цитирования: Лечащий врач №11/2017; Номера страниц в выпуске: 24-25
Теги: кожные заболевания, дисхромия, качество жизни, иммунокррекция
Витилиго — это часто встречающийся дерматоз, распространенность которого составляет 3–4% в структуре кожной патологии. Витилиго может появиться в любом возрасте (Р. С. Бабаянц, Ю. И. Лоншаков, 1978; M. Halder et al., 1996); 50% случаев приходится на возр
Витилиго — это часто встречающийся дерматоз, распространенность которого составляет 3–4% в структуре кожной патологии. Витилиго может появиться в любом возрасте (Р. С. Бабаянц, Ю. И. Лоншаков, 1978; M. Halder et al., 1996); 50% случаев приходится на возраст 10–30 лет. Мужчины и женщины болеют одинаково часто. Это мультифакторное заболевание, причем в каждом конкретном случае могут быть разные механизмы его патогенеза и разные уровни нарушения образования меланина в коже (В. Г. Панкратов, И. А. Евсеенко, 1999). Заболевание возникает при сочетании предрасполагающих и провоцирующих факторов. Оно часто сочетается с заболеваниями щитовидной железы, сахарным диабетом, В12-дефицитной анемией и др.
Для лечения витилиго используются различные методы, так как одного радикального способа нет (S. Changgeng, Y. Ganyun, 1995).
Стабильность химического состава организма является одним из важнейших и обязательных условий его нормального функционирования (Н. А. Агаджанян, А. В. Скальный, 2001). Патология человека, обусловленная дефицитом жизненно необходимых (эссенциальных) элементов, избыточным количеством как эссенциальных, так и токсичных элементов, а также дисбалансом микроэлементов, получила название микроэлементозов (А. П. Авцын и др., 1991). Изучение роли эссенциальных и токсичных элементов в патогенезе витилиго дает возможность расширить спектр методов лечения данной патологии (A. Vaisov et al., 1985; M. Molokhia et al., 1973).
Для оценки влияния среды обитания, алиментарных факторов на организм, а также выявления хронических заболеваний в последнее время все чаще используют мультиэлементный анализ волос, позволяющий своевременно обнаружить доклинические изменения в организме и назначить индивидуальную программу для устранения нарушений минерального обмена (А. В. Скальный, 1999).
Целью работы является изучение элементного статуса волос больных с диагнозом витилиго.
В ходе выполнения работы проведено обследование образцов волос 49 мужчин и 91 женщины в возрасте от 18 до 55 лет с установленным диагнозом витилиго. В качестве референтных значений использованы данные по аналогичным половозрастным группам лиц, не страдающих данным заболеванием и не имеющих других хронических заболеваний (А. В. Скальный, 2000).
Все образцы волос подвергались пробоподготовке и анализу согласно методическим указаниям МУК 4.1.1482-03, МУК 4.1.1483-03 (С. И. Иванов и др., 2003).
Аналитические исследования выполнены методами атомной эмиссионной спектрометрии с индукционно связанной аргоновой плазмой (АЭС-ИСП) и масс-спектрометрии с индуктивно связанной аргоновой плазмой (МС-ИСП) на приборах Optima 2000 DV и Elan 9000.
В образцах волос определяли содержание 22 химических элементов: K, Na, Ca, Mg, P, Co, Cr, Cu, Fe, Mn, Zn, Se, As, Sn, V, Si, Ti, Ni, Al, Cd, Pb, Hg.
Статистическая обработка результатов исследований проводилась с использованием программ Microsoft Excel XP.
Результаты проведенного исследования элементного состава волос больных витилиго представлены в таблице.
Анализ полученных данных показал, что у больных, страдающих витилиго, частота отклонений в минеральном составе волос в зависимости от пола имеет определенные различия. Прежде всего хотелось бы обратить внимание на содержание меди и марганца. Эти элементы участвуют в синтезе меланина и являются антагонистами. В литературных данных главная роль в патогенезе витилиго отводится меди (А. С. Ваисов, Е. А. Кадыров, М. А. Рахимова, Ш. Н. Муратходжаева, 1985), хотя, как видно из представленных в таблице данных, у женщин в 2 раза, а у мужчин в 8 раз чаще наблюдается дефицит Mn в волосах по сравнению с дефицитом Cu (p < 0,001). При этом дефицит меди в волосах чаще встречается у женщин, а марганца — у мужчин.
Также обращает на себя внимание нарушение содержания Zn в волосах в обеих группах. Дефицит Zn в волосах больных витилиго чаще встречается у мужчин, чем у женщин.
Уровни содержания в волосах Fe и Co существенно отличаются у мужчин в сравнении с женщинами, а Se, Si и Cr достоверно не отличаются (p > 0,05).
Также в обеих группах наблюдается избыток содержания в волосах тяжелых металлов (Ti, Ni, Al, Cd, Hg, Pb), которые могут существенно влиять на нарушение обмена эссенциальных элементов. У мужчин преобладает избыток в волосах Ni, Cd, Pb, у женщин — Ti и Al.
Таким образом, в результате сравнительных исследований нами получен «элементный портрет» больных витилиго. Так, содержание жизненно важных элементов у женщин указывает на преобладание дефицита элементов, участвующих в гормональной регуляции (Cu, Mn, K, Na, ), а у мужчин — стрессовых элементов (Mn, Mg). У пациентов обеих групп выявилось нарушение обмена химических элементов, участвующих в регуляции углеводного обмена (Cr, Mn, Zn), функции печени (Fe, Co, Se, Cu), а также накопление тяжелых металлов (Ti, Ni, Al, Cd, Hg, Pb).
Полученные данные свидетельствуют о влиянии нарушений обмена макро- и микроэлементов, а также тяжелых металлов на риск развития и течение витилиго. Таким образом, нам представляются перспективными исследования в данной области: возможно, они позволят сформировать правильный подход к пониманию механизмов возникновения витилиго и предложить эффективные схемы лечения.
Терапия витилиго
Целью лечения является остановка прогрессирования заболевания и достижение репигментации в очагах витилиго. Традиционно для лечения витилиго используют витамины, гепатопротекторы, глюкокортикоиды, иммуномодуляторы, ферменты, препараты меди и цинка, наружно назначают Мелагенин, кварц, ПУВА-терапию (с незначительным эффектом).
Наиболее эффективны методы с использованием ультрафиолетового (UV) излучения (А. А. Кубанова, 2005).
Для лечения витилиго используются аппарат X-Traq, способный синтезировать световой пучок в диапазоне UVB длиной 308 нм, а также Multi Clear (производитель — Cure Lighl, Израиль), который дает возможность использовать UVB 290–320 нм и совмещать UVB и UVA в одной вспышке с длиной волны 290–400 нм. Эффект основан на локальном воздействии светового пучка, вследствие чего меланоциты начинают вырабатывать пигмент.
Под нашим наблюдением находилось 158 пациентов (35 мужчин, 123 женщины) с различными формами витилиго. Возраст пациентов варьировал от 6 до 72 лет (в среднем 28,5 года). Продолжительность заболевания — от 3 мес до 43 лет, в среднем — 11,6 года; 3 пациента имели витилиго с рождения. Распространенность варьировалась от единичного пятна диаметром 5 мм до 40% площади тела. Локализация высыпаний на лице наблюдалась у 126 человек (80%), на конечностях — у 131 пациента (83%), в том числе на стопах и кистях — у 56 (36%) человек, на коже туловища — у 64 (41%) и на гениталиях — у 17 (11%). Количество процедур колебалось от 5 до 56. При использовании аппарата X-Traq получили лечение 122, аппарата Multi Clear — 36 человек.
Эффективность применяемых методик варьировалась в различных группах пациентов. Так, наилучший эффект наблюдался у лиц молодого возраста и до 50 лет со смуглой кожей (3–4-й тип по Фитспатрику), на очагах, где пигмент пропал не полностью и волосы не потеряли окраску. Лучше всего пигмент восстанавливался в области лица. Эффект практически отсутствовал у светлокожих блондинов, на длительно существующих очагах и при локализации высыпаний на кистях и стопах.
Эффект от лечения проявлялся в виде уменьшения площади и репигментацией внутри пятна витилиго, которые постепенно сливались и заполняли весь очаг депигментации. На здоровой коже, прилегающей к обрабатываемому участку, при этом появлялась гиперпигментация, которая со временем проходила. Надо отметить, что при использовании аппарата X–Traq пациенты жаловались на сильные ожоги, которые сопровождались пузырями и мокнутием; подобных осложнений в случаях применения аппарата Multi Clear не наблюдалось.
Кроме этого, больным проводилась общая терапия с применением гепатопротекторов, витаминов, иммуномодуляторов и коррекция нарушений обмена микроэлементов.
Таким образом, использование селективной UVA- и UVB-терапии на сегодняшний день является наиболее эффективным методом лечения витилиго, особенно у пациентов со свежими высыпаниями и смуглой кожей. Однако для повышения ее эффективности пациенты нуждаются в тщательном обследовании и подборе индивидуальной комплексной терапии с учетом патогенеза заболевания.
По вопросам литературы обращайтесь в редакцию.
И. В. Верхогляд, кандидат медицинских наук
РМАПО, Москва
В каких случаях проводится терапия глюкокортикоидами? Какие виды гормональной терапии используются? История применения глюкокортикостероидов (ГКС) в клинической практике насчитывает чуть более полувека, хотя «антиревматическая субстанция Х» была изве
В каких случаях проводится терапия глюкокортикоидами?
Какие виды гормональной терапии используются?
История применения глюкокортикостероидов (ГКС) в клинической практике насчитывает чуть более полувека, хотя «антиревматическая субстанция Х» была известна еще с 20-х годов ХХ столетия. Детальное изучение клинической значимости гормонов коры надпочечников, начатое Edward Calvin Kendall и Tadeus Reichstein, было продолжено только после того, как Philip Hench в конце 40-х годов обратил внимание на улучшение течения ревматоидного артрита при желтухе и беременности. В 1950 году всем троим была присуждена Нобелевская премия за «. открытия в отношении гормонов коры надпочечников, их структуры и биологических эффектов».
В настоящее время к ГКС относятся как естественные гормоны коры надпочечников с преимущественно глюкокортикоидной функцией — кортизон и гидрокортизон (кортизол), так и их синтезированные аналоги — преднизон, преднизолон, метилпреднизолон и др., включая галогенированные (фторированные) производные — триамцинолон, дексаметазон, бетаметазон и др. Широкий спектр физиологических и фармакологических эффектов глюкокортикоидов (адаптогенный, противовоспалительный, обезболивающий и жаропонижающий, неспецифический мембраностабилизирующий и противоотечный, противоаллергический и иммуносупрессивный, гематологический, гемодинамический и противошоковый, антитоксический, противорвотный и др.) делает эти препараты чуть ли не универсальными лекарственными средствами, и сегодня трудно найти такое патологическое состояние, при котором на том или ином этапе развития они не были бы показаны. Среди показаний в первую очередь можно выделить так называемые ревматические заболевания, болезни почек, крови, аллергические заболевания, трансплантации, ургентные состояния.
В зависимости от цели различаются три варианта терапии ГКС; при этом любая из них может быть как ургентной, так и плановой.
- Заместительная терапия, проводимая при надпочечниковой недостаточности, должна имитировать как базальную секрецию надпочечников и ее суточный ритм, так и ее усиление при стрессе; при этом используемые дозы близки к суточной секреции гормона. Здесь предпочтительнее применять естественный гормон — гидрокортизон (солу кортеф), обладающий глюкокортикоидной и определенной минералокортикоидной активностью, в дозе от 20-25 до 30-37,5 мг в сутки. При незначительном выпадении минералокортикоидной функции (небольшие потери соли) бывает достаточно его одного. При выраженной потере соли или при использовании эквивалентных доз преднизолона (от 5 до 7,5 мг), который может оказаться более эффективным, добавляется кортикостероид с выраженной минерало- и некоторой глюкокортикостероидной активностью — флудрокортизон (кортинефф, кортеф). На практике применяются те минимальные дозы, которые обеспечивают хорошее самочувствие и работоспособность, нормальный уровень АД и электролитов крови. При стрессе доза гидрокортизона может достигать 250-300 мг в сутки. Для имитации ритма секреции 2/3 дозы назначаются в 8 часов и 1/3 — в 16.
- При блокирующей (подавляющей) терапии используется эффект, чаще всего рассматриваемый как побочный, — блокада оси гипоталамус-гипофиз-кора надпочечников (ГГКН). Так, при терапии адреногенитального синдрома вводимые извне ГКС кроме заместительной выполняют и блокирующую функцию в отношении гиперсекреции АКТГ и андрогенов. ГКС подавляют и секрецию ТТГ, что наряду со снижением уровня тиреоидсвязывающего глобулина и торможением конверсии Т4 в Т3 уменьшает тиреоидную активность и используется при лечении тиреотоксических кризов. Наиболее активно ось ГГКН подавляется естественными ГКС или препаратами с длительным тканевым периодом полураспада (фторированные гормоны — дексаметазон, бетаметазон); при этом применяются как физиологические, так и более высокие (фармакодинамические) дозы.
- Большинство показаний к фармакодинамической терапии базируются на одной особенности ГКС — уникальном сочетании противовоспалительного и иммунодепрессивного эффектов. Это сочетание лежит в основе традиционных представлений о том, что так называемые ревматические болезни, где воспаление является следствием иммунопатологического процесса, служат чуть ли не абсолютным показанием к ее проведению.
В отличие от плановой терапии применение ГКС в ургентных ситуациях носит, как правило, симптоматический, реже патогенетический характер и не заменяет, а дополняет другие методы лечения. В рамках неотложной терапии ГКС применяются при острой надпочечниковой недостаточности, тиреотоксическом кризе, аллергических заболеваниях (сывороточная болезнь, анафилактический шок, бронхиальная астма, крапивница, отек Квинке), заболеваниях печени (печеночно-клеточная недостаточность), неврологических заболеваниях (туберкулезный и бактериальный менингит, некоторые формы отека мозга), различных видах шока (кроме кардиогенного).
Из-за обилия побочных эффектов терапия ГКС направлена в основном на достижение максимального эффекта при назначении минимальных доз, величина которых определяется заболеванием и не зависит от массы тела и возраста; доза корректируется в соответствии с индивидуальной реакцией. Приняты две принципиально разные схемы назначения ГКС:
- начиная с наименьшей возможной дозы, увеличивают ее при недостаточном эффекте до оптимальной; при этом возникает опасность увеличения сроков лечения, потери эффективности и развития побочного действия;
- начиная с максимальных суточных доз, их снижают после получения клинического эффекта; при этом достигается скорейший эффект, уменьшаются длительность лечения и суммарная доза ГКС.
В зависимости от суточной дозы (в пересчете на преднизолон) и длительности применения ГКС принято выделять несколько видов терапии, имеющих различные показания:
- в ситуациях, непосредственно угрожающих жизни, назначается интенсивная терапия сверхвысокими (до 500–4000 мг внутривенно) или средними/высокими (25–150 мг внутрь) дозами (пероральная доза преднизолона эквивалентна примерно 1/6 внутривенной) — такая терапия может проводиться несколько дней и не требует постепенной отмены;
- при тяжелых обострениях или при хроническом течении тяжелых заболеваний (лейкозы, некоторые коллагенозы, гемолитическая анемия, тромбоцитопении) проводится лимитированная терапия, ограниченная неделями при использовании внутрь высоких доз (80–200 мг) и неделями или месяцами в случае применения средних доз (25–60 мг); максимальные дозы, назначаемые вначале, по мере улучшения состояния ступенчато уменьшаются с последующим переходом на поддерживающие;
- при ряде хронических заболеваний (бронхиальная астма, ревматоидный артрит) проводится длительная терапия низкими дозами (до 10 мг), однако дозы менее 5 мг скорее всего являются лишь заместительными и дают клинический эффект только при атрофии коры надпочечников, индуцированной длительной глюкокортикоидной терапией.
Результат терапии ГКС зависит не только от дозы, но и от режима дозирования. Наиболее перспективными можно считать прерывистые схемы применения, когда за счет увеличения суточной дозы препарат принимается не каждый день. Самой эффективной представляется внутривенная пульс-терапия максимальными дозами, однако она оказывается и самой небезопасной. Значительно более безопасным должен быть признан режим «мини-пульс», который, однако, уступает по эффективности пульс-терапии. Столь же эффективно назначение умеренной/высокой дозы, разделенной на несколько приемов; но по безопасности этот режим уступает «мини-пульсу». Далее по эффективности следуют альтернирующий режим (через день удвоенные суточные дозы с последующим постепенным уменьшением) и режим ежедневного однократного назначения умеренной/высокой дозы; первый из них безопаснее и по этому критерию приближается к «мини-пульсу». Наиболее безопасна терапия низкими дозами, которая, однако, обеспечивает лишь поддерживающий эффект. При всех ежедневных схемах ГКС следует назначать в ранние утренние часы (между 6 и 8 часами); если же одноразовый прием невозможен из-за величины дозы, 2/3 дозы назначаются в 8 часов и 1/3 — днем (около полудня). При любом режиме дозирования по достижении планируемого эффекта доза постепенно снижается до поддерживающей или препарат отменяется вовсе.
Важной проблемой терапии ГКС является выбор препарата. Фармакокинетические и фармакодинамические свойства ГКС, включая их побочные эффекты, существенно различаются у отдельных препаратов (табл. 1, табл. 2). Приняв за единицу выраженность различных эффектов гидрокортизона, можно получить количественные характеристики активности отдельных препаратов. При сравнении ГКС чаще всего анализируется противовоспалительное действие этих препаратов, в соответствии с которым и рассчитывается эквивалентная пероральная доза, снижающаяся по мере увеличения противовоспалительной активности. Ее возрастание, параллельное увеличению длительности действия отдельных ГКС, сопровождается уменьшением минералокортикоидной активности, которой у метилпреднизолона (солу-медрола) и фторированных соединений вообще можно пренебречь.
Соотношение терапевтического и побочных эффектов позволяет утверждать, что в настоящее время препаратом выбора для длительной и пожизненной терапии является метилпреднизолон (солу-медрол). В настоящий момент солу-медрол широко используется в лечении аутоиммунных заболеваний, в трансплантологии и интенсивной терапии. Многообразие форм выпуска позволяет использовать препарат во всех возрастных категориях в оптимальных дозировках.
Вторым по эффективности препаратом остается в большинстве случаев преднизолон. Во многих же ургентных ситуациях определенными достоинствами обладают фторированные соединения: дексаметазон (дексазон, дексона) и бетаметазон (целестон, дипроспан). Однако в случае неотложной терапии, при которой противовоспалительное действие не играет ведущей роли, сравнительная оценка эффективности и безопасности различных препаратов весьма затруднительна по крайней мере по двум причинам:
- соотносить эффективность и безопасность различных препаратов можно только на основе их эквивалентных доз. Между тем, если для различных побочных эффектов отдельных ГКС имеются характеристики относительной активности, из всех лечебных эффектов сравнивается только противовоспалительный, в соответствии с которым и рассчитывается эквивалентная доза;
- о соотношении доз при пероральном и парентеральном применении конкретных препаратов отсутствуют однозначные данные даже тогда, когда речь идет о противовоспалительном эффекте, не говоря уже о других лечебных или побочных свойствах.
В связи с вышеуказанными трудностями была предложена условная эквивалентная единица (УЭЕ), за которую принимаются минимальные эффективные дозы. Показано, что выраженные в УЭЕ максимальные суточные эффективные дозы фторированных ГКС (дексаметазона и бетаметазона) в пять раз меньше, чем у негалогенированных препаратов. Это обеспечивает не только более высокую эффективность и безопасность данной группы препаратов, назначаемых в определенных ситуациях, но и их фармакоэкономические преимущества.
Как бы тщательно ни проводился выбор препарата, режима дозирования и вида терапии, полностью предотвратить развитие тех или иных побочных эффектов при применении ГКС не удается. Характер побочных реакций может зависеть от ряда причин (табл. 3).
Вероятность и выраженность подавления оси ГГКН с развитием вначале функциональной недостаточности, а позже и атрофии коры надпочечников определяются дозой и длительностью терапии. Прекращение глюкокортикоидной терапии почти всегда сопряжено с угрозой развития острой надпочечниковой недостаточности.
Частым побочным действием ГКС оказываются инфекционные осложнения, которые в этом случае протекают атипично, что связано с противовоспалительной, аналгетической и жаропонижающей активностью этих средств. Это затрудняет своевременную диагностику и требует проведения ряда профилактических мероприятий. Из-за склонности к генерализации, затяжному течению, тканевому распаду и резистентности к специфической терапии эти осложнения становятся особенно грозными. Столь же коварны и «стероидные язвы», отличающиеся бессимптомным течением и склонностью к кровотечениям и перфорациям. Между тем желудочный дискомфорт, тошнота, другие диспепсические жалобы на фоне приема ГКС чаще не связаны с поражением слизистой. Экзогенный синдром Кушинга как осложнение терапии ГКС встречается далеко не всегда, однако отдельные нарушения метаболизма, гормональной регуляции и деятельности тех или иных систем развиваются почти во всех случаях глюкокортикоидной терапии.
С сожалением приходится отметить, что утверждение Е. М. Тареева, назвавшего терапию ГКС трудной, сложной и опасной, до сих пор справедливо. Как писал Тареев, такую терапию гораздо легче начать, чем прекратить. Однако ответственный подход к лечению позволяет значительно повысить его безопасность. Это достигается благодаря строгому учету противопоказаний (абсолютных среди которых нет) и побочных эффектов ГКС (оценка отношения «ожидаемый эффект/предполагаемый риск»), а также проведению «терапии прикрытия» в группах риска (антибактериальные препараты при хронических очагах инфекции, коррекция доз сахароснижающих средств или переход на инсулин при сахарном диабете и др.). Особое место при длительном применении ГКС занимает метаболическая терапия, которая проводится в целях предупреждения и коррекции нарушений электролитного обмена и катаболических процессов в первую очередь в миокарде (дистрофия) и костной ткани (остеопороз). Однако наиболее надежным путем обеспечения безопасности терапии ГКС остается соблюдение основного принципа клинической фармакологии и фармакотерапии — назначение лечения по строгим показаниям.
В. В. Городецкий, кандидат медицинских наук
А. В. Тополянский, кандидат медицинских наук
Читайте также:

