Гирудотерапия при красной волчанке
Обновлено: 24.04.2024
Авторы: Виноградова Е.С. 1 , Новиков П.И. 2 , Моисеев С.В. 3
1 Факультет фундаментальной медицины МГУ, Москва
2 Клиника нефрологии, внутренних и профессиональных болезней им. Е.М. Тареева, Москва
3 Факультет фундаментальной медицины МГУ, Москва; Клиника нефрологии, внутренних и профессиональных болезней им. Е.М. Тареева УКБ № 3, Первый МГМУ им. И.М. Сеченова, Минздрава России (Сеченовский Университет), Москва
Оптиконевромиелит, или синдром Девика — это воспалительное демиелинизирующее заболевание центральной нервной системы, поражающее преимущественно зрительный нерв и спинной мозг. В 50–70% случаев определяется ассоциация с системными заболеваниями соединительной ткани, такими как системная красная волчанка, болезнь Шегрена и др. В этом случае остается открытым вопрос о вторичном характере болезни. Клиническая картина характеризуется сочетанием синдромов оптического неврита и продольно-поперечного миелита. Для диагностики используются визуализирующие методы, такие как оптическая когерентная томография, метод вызванных потенциалов, магнитно-резонансная томография. В настоящее время ключевым методом постановки верного диагноза является обнаружение специфического серологического маркера — антител к аквапорину-4 (NMO-IgG), титр которых коррелирует с активностью заболевания и помогает проведению дифференциальной диагностики. Выявление синдрома Девика в сочетании с ревматическими заболеваниями определяет тактику более активного иммуносупрессивного лечения. В статье приводится описание клинического случая молодой пациентки с системной красной волчанкой и синдромом Девика. Прогноз и тяжесть заболевания определяло наличие оптиконевромиелита. В качестве индукционной терапии использовались сверхвысокие дозы глюкокортикоидов, циклофосфамид с заменой на азатиоприн в качестве поддерживающего лечения с положительным клинико-лабораторным ответом.
Ключевые слова: оптиконевромиелит, синдром Девика, аутоиммунная патология, системная красная волчанка, антитела к аквапорину-4, аквапорин-ассоциированные синдромы, демиелинизирующие заболевания центральной нервной системы.
Для цитирования: Виноградова Е.С., Новиков П.И., Моисеев С.В. Оптиконевромиелит (синдром Девика) — редкий вариант поражения нервной системы при системной красной волчанке. РМЖ. 2018;12(II):103-106.
Neuromyelitics optica (Devic’s syndrome) is a rare variant of the nervous system impairment in systemic lupus erythematosus
E.S. Vinogradova 1 , P.I. Novikov 2 , S.V. Moiseev 1,2
1 Faculty of Fundamental Medicine of the Moscow State University, Moscow
2 Tareev Clinic of Nephrology, Internal and Occupational Diseases, University Clinical Hospital No.3,
Sechenov University, Moscow
Neuromyelitics optica or Devic’s syndrome is an inflammatory demyelinating disease of the central nervous system, affecting mainly the optic nerve and spinal cord. In 50–70% of cases, association with systemic diseases of the connective tissue, such as systemic lupus erythematosus, Sjogren disease, and others, is determined. In this case, the question of the secondary nature of the disease remains open. The clinical picture is characterized by a combination of optic neuritis syndromes and/or longitudinal-transverse myelitis. Imaging methods are used for diagnostics, such as optical coherence tomography, event-related potentials method, magnetic resonance imaging. At present, the key method of making the correct diagnosis is the detection of a specific serological marker — antibodies to aquaporin-4 (NMO-IgG), the titer of which correlates with disease activity and helps the differential diagnosis. Detection of Devic’s syndrome in combination with rheumatic diseases determines the tactics of more active immunosuppressive treatment. The article describes the clinical case of a young patient with systemic lupus erythematosus and Devic’s syndrome. The prognosis and severity of the disease determined the presence of neuromyelitics optica. As induction therapy, ultrahigh doses of glucocorticosteroids, cyclophosphamide replaced with azathioprine as a supportive treatment with a positive clinical and laboratory response were used.
Key words: neuromyelitics optica, Devic’s syndrome, autoimmune pathology, systemic lupus erythematosus, antibodies to aquaporin-4, aquaporin-associated syndromes, demyelinating diseases of the central nervous system.
For citation: Vinogradova E.S., Novikov P.I., Moiseev S.V. Neuromyelitics optica (Devic’s syndrome) is a rare variant of the nervous system impairment in systemic lupus erythematosus // RMJ. 2018. № 12(II). P. 103–106.
В статье приводится описание клинического случая молодой пациентки с системной красной волчанкой и синдромом Девика (оптиконевромиелит)

Оптиконевромиелит (ОМ) относится к группе воспалительных демиелинизирующих заболеваний центральной нервной системы (ЦНС) и является вторым по частоте после рассеянного склероза. При ОМ очаги воспаления и повреждения миелина затрагивают почти исключительно оптический нерв и спинной мозг (поперечный миелит на уровне грудных, реже — шейных сегментов). ОМ чаще встречается у лиц африканского и азиатского происхождения. Распространенность ОМ среди европеоидов составляет 0,3–4,4 человека на 100 000 населения. Возраст дебюта варьирует со снижением заболеваемости после 50 лет. Женщины болеют гораздо чаще (85% случаев), чем мужчины. Довольно часто ОМ (50–70%) сочетается с другими аутоиммунными заболеваниями — синдромом Шегрена, системной красной волчанкой (СКВ), аутоиммунным тиреоидитом и др. [1].
В 1894 г. E. Devic и его ученик F. Gault предложили выделить ОМ в отдельную нозологическую форму, при которой очаги воспаления и повреждения миелина затрагивали главным образом оптический нерв и спинной мозг (поперечный миелит на уровне грудных, реже — шейных сегментов) [2]. В 2004 г. V. Lennon et al. была доказана аутоиммунная природа болезни путем обнаружения сывороточных аутоантител NMO-IgG (neuromyelitis optica — Immunoglobulin G). В настоящее время ОМ — единственное демиелинизирующее заболевание, при котором выявлен специфический биомаркер. В основе патогенеза заболевания лежит селективная связь NMO-IgG с аквапорином-4, одним из основных белков водных каналов ЦНС, локализующихся в ножках астроцитов, образующих гематоэнцефалический барьер (ГЭБ). Наибольшая концентрация аквапорина-4 в ЦНС отмечена в сером веществе спинного мозга, гипоталамусе, перивентрикулярных областях. Это приводит к развитию воспалительной реакции, активации системы комплемента, повышенной продукции воспалительных цитокинов (интерлейкинов ИЛ-17, ИЛ-8, гранулоцитарного колониестимулирующего фактора). Нарушение клеточных механизмов транспорта воды, повреждение ГЭБ и активная инфильтрация периваскулярного пространства нейтрофилами и эозинофилами способствуют развитию демиелинизации, сосудистой гиперплазии с гиалинизацией стенок капилляров, некрозу олигодендроцитов и нейронов и образованию специфических полостей как в белом, так и в сером веществе спинного мозга (рис. 1). Описанные особенности морфологических изменений в спинном мозге могут напоминать аутоиммунное воспаление, протекающее по типу васкулита [3].
Клиническая картина характеризуется сочетанием синдромов оптического неврита и продольно-поперечного миелита (табл. 1). Типичными симптомами миелита выступают мышечная слабость, спастичность, дискоординация, атаксия, симптом Лермитта (ощущение удара током при сгибании шеи), задержка мочи, вегетативная дисфункция, возможны расстройства ниже уровня поражения спинного мозга. Поражения зрительных нервов и спинного мозга в некоторых случаях возникают одновременно, но чаще — с интервалом, который может составлять месяцы, годы и даже десятилетия. Симптоматика нарастает в течение нескольких дней, а регрессирует неделями и месяцами, зачастую с сохранением остаточного неврологического дефицита.
В настоящее время допускается, что ОМ может иметь как монофазный, так и ремиттирующий тип течения [4].
Для диагностики оптического неврита используются оптическая когерентная томография (показывает истончение ретинальных волокон), вызванные потенциалы (замедление проведения по данным зрительных вызванных потенциалов вплоть до полного отсутствия ответа), магнитно-резонансная томография (МРТ) (в острую фазу может наблюдаться отечность зрительного нерва и накопление им контрастного вещества).
МРТ спинного мозга, выполненная в острую фазу миелита, позволяет выявить обширный непрерывный очаг поражения спинного мозга, который распространяется по длиннику более чем на 3 позвоночных сегмента, однако отсутствие очага или короткие очаги (менее 2 сегментов) могут определяться в периоды ремиссий или в отдаленные периоды заболевания, когда формируется атрофия спинного мозга.
При МРТ головного мозга на начальных стадиях заболевания нормальная картина наблюдается у 55–84% пациентов с ОМ, однако возможно появление очагов в белом веществе при развитии заболевания (рис. 2) [5]. Церебральные очаги по своей локализации имеют предрасположенность к тем участкам головного мозга, где отмечается высокий уровень иммунореактивности к аквапорину-4 (гипоталамус, ствол головного мозга, III и IV желудочки) [6].
Ключевым методом диагностики является обнаружение серологического маркера — антител к аквапорину-4 (NMO-IgG), чувствительность 75%, специфичность 85–99%. Уровень антител к аквапорину-4 коррелирует с активностью заболевания и снижается при иммуносупрессивной терапии и остается низким в течение ремиссии. Показана корреляция титра антител с тяжестью зрительных нарушений [3].
Прогноз заболевания серьезный, вплоть до инвалидизации и летального исхода. При своевременной и адекватной терапии возможно достижение длительных ремиссий, пятилетняя выживаемость при ОМ повышается с 68 до 91%.
В настоящее время общепринятого стандарта лечения синдрома Девика нет. Одним из вариантов лечения является применение препаратов, частично блокирующих В-клетки, таких как ритуксимаб. Для лечения атаки миелита и оптического неврита применяют высокие дозы кортикостероидов. Наряду с этим эффективно использование и плазмафереза. Эффективность превентивной иммуномодулирующей терапии у пациентов с ОМ формально не изучена. Терапией выбора считают комбинацию преднизолона и азатиоприна [7].
Клиническое наблюдение

Приводим собственное клиническое наблюдение больной оптиконевромиелитом Девика, ассоциированным с СКВ (см. рис. 3).
Больная К., 28 лет, домохозяйка.
В течение 2013–2014 гг. в связи с эпизодами субфебрилитета, одышкой, персистирующими рентгенологическими признаками нижнедолевой инфильтрации слева, устойчивыми к антибактериальной терапии широкого спектра, наблюдалась и получала противотуберкулезную химиотерапию в противотуберкулезном диспансере Хабаровска. Результаты многочисленных бактериологических исследований, полимеразно-цепной реакции, бронхо-альвеолярного лаважа и кожных туберкулиновых проб (диаскин-тест) были отрицательными на протяжении всего периода наблюдения. В августе 2014 г. — левосторонний плеврит, перикардит, лейкоцитопения до 2,3×10 9 /л, повышение маркеров острофазового воспаления (скорость оседания эритроцитов (СОЭ) 52–64 мм/ч, содержание С-реактивного белка (СРБ) 3,5N), впервые выявлены антитела к нативной ДНК. В ноябре 2014 г. возникли жалобы на головные боли, боли при пальпации и движении, ограничение подвижности в шейном отделе позвоночника, боли в верхнем плечевом поясе, артриты мелких суставов кистей рук. В январе 2015 г. при обследовании: ревматоидный фактор (РФ)+, антитела к нативной ДНК 10N, лейкоцитопения 2,6×10 9 /л, СОЭ 55 мм/ч, СРБ 4N. Состояние расценено как ревматоидный артрит, проводилась пульс-терапия глюкокортикоидами, далее назначен преднизолон 10 мг/сут, метотрексат 10 мг/нед. с положительным эффектом. В феврале 2015 г. самостоятельно прекратила прием глюкокортикоидов и метотрексата, на фоне чего отметила внезапное выпадение нижней половины поля зрения, а затем полную потерю зрения на левый глаз. В марте 2015 г. при МРТ-исследовании головного мозга патологии не выявлено.
В апреле 2015 г. была госпитализирована с диагнозом «энцефалопатия неясной этиологии». Объективно: сознание нарушено до степени заторможенности, ригидность затылочных мышц, координационные пробы не выполняет, нарушение функции тазовых органов (задержка мочи). МРТ головного мозга: в белом веществе лобных, теменных, височных долей выявлены множественные очаги измененного МР-сигнала (гиперинтенсивные в режиме Т2 и FLAIR, изо- и гипоинтенсивные в режиме Т1), полигональной формы с нечеткими и неровными контурами, сливного характера, размерами от 0,3 до 3,0 см. При постконтрастном исследовании: 2 супратенториальных очага (в левой лобной доле), минимально накапливающих контраст в виде небольших очагов на периферии. МРТ шейного, поясничного отделов спинного мозга: множественные интрамедуллярные зоны гиперинтенсивного характера протяженностью 5–13 мм. Анализ ликвора: цитоз 12/мм 3 (нейтрофилы 5, лимфоциты 7), глюкоза 2,8 ммоль/л, общий белок 0,8 г/л. В лейкоцитарной формуле: лейкопения, лимфопения, значительный моноцитоз. Антитела к вирусу Эпштейна — Барр IgM, антитела к Herpes simplex IgM, антитела к кардиолипинам не обнаружены. Проведена пульс-терапия метилпреднизолоном, далее назначен преднизолон в дозе 20 мг/сут с положительным эффектом в виде постепенного восстановления памяти, функции тазовых органов. В августе 2015 г. на фоне отмены глюкокортикоидов отметила снижение остроты зрения справа, снижение чувствительности нижних конечностей, головные боли, возникли артриты мелких суставов кистей рук. Осмотр окулиста: полная атрофия зрительного нерва слева, нисходящая частичная атрофия справа, миопия средней степени. Антитела к аквапорину-4 (NMO) выявлены в высоком титре 1:320 (N <1:10). Впервые установлен диагноз системной красной волчанки, двустороннего оптикомиелита. Возобновлена активная иммуносупрессивная терапия: выполнено 3 сеанса плазмафереза, проведена комбинированная пульс-терапия глюкокортикоидами и циклофосфамидом (по 1000 мг/мес.), назначен преднизолон в дозе 30 мг/сут. В декабре 2015 г. по данным МРТ головного мозга с контрастным усилением отмечена положительная динамика очагового поражения на фоне иммуносупрессивной терапии. С марта 2016 г. переведена на поддерживающее лечение, циклофосфамид был заменен на азатиоприн в дозе 150 мг/сут, доза преднизолона постепенно снижена до 15 мг/сут. В декабре 2016 г. впервые госпитализирована в клинику им. Е.М. Тареева. Учитывая клинико-анамнестические данные о полисерозитах, артритах мелких суставов кистей рук, демиелинизирующем очаговом поражении центральной нервной системы, а также лейкопению, гипокомплементемию, выявление антител к нативной ДНК в диагностически значимых титрах, положительную динамку состояния на фоне проводимой иммуносупрессивной терапии, диагноз системной красной волчанки сомнений не вызывает (SLE SLICC 4 клинических и 2 иммунологических критерия). Особенностью данного случая является развитие двустороннего оптиконевромиелита, NMO-IgG-ассоциированного, осложнившегося полной потерей зрения слева. По результатам проведенного обследования данных за активность системного заболевания не выявлено, иммунологические тесты в норме. Ввиду наличия инвалидизирующего и потенциально жизнеугрожающего поражения ЦНС рекомендованы: продолжение иммуносупрессивной терапии азатиоприном в прежней дозе — 150 мг/сут, постепенное медленное снижение дозы преднизолона по 1,25 мг/мес. до 10 мг/сут, динамический МР-контроль очаговых изменений головного и спинного мозга, наблюдение ревматолога, невролога, окулиста. Ввиду ремиттирующего течения заболевания строго противопоказана самостоятельная отмена препаратов.
Таким образом, представленное наблюдение демонстрирует редкий вариант поражения ЦНС при системной красной волчанке. Остается открытым вопрос, следует ли рассматривать развитие ОМ в качестве самостоятельной нозологической формы или как проявление основного заболевания, в нашем случае системной красной волчанки. С одной стороны, наличие специфических антител (NMO-IgG) и возможное ухудшение течения ОМ вне контекста системных проявлений являются аргументами в пользу нозологической самостоятельности этой патологии. С другой стороны, эффективность контроля активности основного заболевания и проявлений ОМ, совпадение периодов обострения ОМ с системными проявлениями, однонаправленные изменения иммунологических маркеров ОМ и СКВ позволяют трактовать ОМ у нашей пациентки как вторичный. Важно, что определение титра NMO-IgG помогает контролировать активность болезни. Так, уровень антител к аквапорину-4 снижается и остается низким в течение ремиссии. Хороший ответ на лечение позволяет рассчитывать на длительный контроль активности при сохранении приверженности терапии.
1. Аутоиммунные заболевания в неврологии: Клиническое руководство / под ред. И.А. Завалишина и др. Т.1. М., 2014 [Autoimmunny`e zabolevaniya v nevrologii: Klinicheskoe rukovodstvo / рod red. I.A. Zavalishina i dr. T.1. M., 2014 (in Russian)].
2. Maticlo M., Weinshshenker B. Neuromyelitis optica // Multiple sclerosis. 2010. P.258–275.
3. Lennon V.A., Kryzer T.J., Pittock S.J. et al. IgG marker of optic-spinal multiple sclerosis binds to the aquaporin-4 water channel // J Exp Med. 2005. Vol. 202. P.473–477.
4. Мироненко Т.В., Хубетова И.В. Оптикомиелит (болезнь Девика). Научный обзор и собственное клиническое наблюдение // Международный неврологический журнал. 2015. T.1(71). C.141–147 [Mironenko T.V., Xubetova I.V. Optikomielit (bolezn` Devika). Nauchny`j obzor i sobstvennoe klinicheskoe nablyudenie // Mezhdunarodny`j nevrologicheskij zhurnal. 2015. T.1(71). C.141–147 (in Russian)].
5. Kitley J., Woodhall M., Waters P. et al. Myelin-oligodendrocyte glycoprotein antibodies in adults with a neuromyelitis optica phenotype // Neurology. 2012. Vol. 79(12). P.1273-1277. DOI: 10.1212/WNL.0b013e31826aac4e.
6. Симанив Т.О., Воробьёва А.А., Смирнова Н.В. и др. Оптикомиелит и аквапорин-ассоциированные синдромы // Журнал неврологии и психиатрии им. С.С. Корсакова. 2015. №2(2). С.31–37 [Simaniv T.O., Vorob`yova A.A., Smirnova N.V. i dr. Optikomielit i akvaporin-associirovanny`e sindromy` // Zhurnal nevrologii i psixiatrii im. S.S. Korsakova. 2015. №2(2). S.31–37 (in Russian)].
7. Marios C. Papadopoulos, Jeffrey L. Bennett, Alan S. Verkman. Treatment of neuromyelitis optica: state-of-the-art and emerging therapies // Nature Reviews Neurology. 2014. Vol. 10. P.493–506.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Авторы: Башкова И.Б. 1, 2 , Мадянов И.В. 1, 3
1 ФГБОУ ВО «ЧГУ им. И.Н. Ульянова», Чебоксары
2 ФГБУ «ФЦТОЭ» Минздрава России, (г. Чебоксары), Чебоксары, Россия
3 ГАУ ДПО «Институт усовершенствования врачей» Минздрава Чувашии, Чебоксары
Системная красная волчанка (СКВ) характеризуется широким спектром клинических проявлений, что диктует необходимость проведения тщательной дифференциальной диагностики СКВ с другими заболеваниями. Особое место при этом занимают свойственные СКВ поражения кожи. Иногда волчаночноподобные изменения кожи могут маскировать дебют других заболеваний, в т. ч. онкогематологических. Пример такого случая приведен в статье.
К ревматологу направлена женщина 40 лет, у которой дерматологом заподозрена СКВ. Из анамнеза известно, что 6 мес. назад во время отдыха в палаточном лагере простудилась. Через 1 мес. появились слизисто-гнойные выделения из носовых ходов, а чуть позже в носовой и ротовой полости — безболезненные язвочки. В последующем у пациентки развился отек правой молочной железы с диффузным уплотнением тканей и покраснением кожи, подобным рожистому воспалению. Наблюдалось умеренное увеличение переднешейных и подмышечных лимфоузлов. Больная была направлена на консультацию к онкологу-маммологу, который на основании ультразвукового и маммографического исследований диагноз «рак молочной железы» отверг и направил пациентку на консультацию к дерматологу. После проведенных исследований дерматолог на основании двустороннего поражения ткани молочной железы, наличия участков эритемы кожи в области туловища, незначительной гиперемии кожи в области щек, увеличения периферических регионарных лимфоузлов, язв слизистых оболочек полости рта и носа, выпадения волос, похудания за время болезни на 7 кг заподозрил у пациентки дебют СКВ. Рекомендованные ревматологом иммунологические исследования диагноз СКВ у пациентки не подтвердили, что явилось основанием для проведения биопсии молочной железы. Совокупность гистологических и иммуногистохимических данных, полученных при исследовании биопсийного материала, позволила диагностировать у пациентки первичную анапластическую крупноклеточную лимфому с поражением ткани молочной железы. В целом с момента первого обращения к врачу до постановки точного диагноза
прошло 6 мес.
Ключевые слова: системная красная волчанка, поражение кожи и слизистых, рак молочной железы, анапластическая крупноклеточная лимфома, диагностические ошибки.
Для цитирования: Башкова И.Б., Мадянов И.В. Волчаночноподобные дерматологические «маски» анапластической крупноклеточной лимфомы кожи. РМЖ. 2020;7:24-27.
Lupus-like dermatological “masks” of cutaneous anaplastic large-cell lymphoma
I.B. Bashkova 1,2 , I.V. Madyanov 1,3
1 I.N. Ulianov Chuvash State University, Cheboksary
2 Federal Center for Traumatology, Orthopedics and Arthroplasty, Cheboksary
3 “The Postgraduate Doctors’ Training Institute”, Cheboksary
The systemic lupus erythematosus (SLE) is characterized by a wide range of clinical manifestations, which dictates the need for thorough differential diagnosis of SLE with other diseases. A special place in this case is occupied by skin lesions peculiar to SLE. Sometimes cutaneous lupus-like changes can mask the onset of other diseases, including oncohematological ones. The article gives an example of such a case.
A 40-year-old female patient whose dermatologist suspected SLE was referred to a rheumatologist. From medical history, it was known that 6 months ago during rest in camping site she caught a cold. A month later, mucopurulent discharge from the nasal passages occurred. Later, painless ulcers appeared in the nasal and oral cavity. Subsequently, right mammary gland swelling with diffuse induration and skin redness, similar to erysipelas, occurred. There was a moderate increase in the antero-cervical and axillary lymph nodes. The patient was referred for consultation to an oncologist-mammologist, who rejected the diagnosis of breast cancer based on ultrasound and mammography results and referred the patient to a dermatologist for consultation. After the research, the dermatologist suspected the onset of SLE on the basis of bilateral lesions in breast tissue, cutaneous erythema on the trunk, mild cutaneous hyperemia on the cheeks, increase in peripheral regional lym ph nodes, ulcers of the mucous membranes in the oral and nasal cavity, hair loss, weight loss during the disease by 7 kg. The immunological tests recommended by the rheumatologist did not confirm SLE in the female patient, which was the reason for conducting a breast biopsy. The combination of histological and immunohistochemical data obtained during the study of the biopsy material made it possible to diagnose primary anaplastic large-cell lymphoma with breast tissue lesions in the patient. In general, it took 6 months from the first visit to the doctors to establish a precise diagnosis.
Keywords: systemic lupus erythematosus, cutaneous and mucosal lesions, breast cancer, anaplastic large-cell lymphoma, diagnostic errors.
For citation: Bashkova I.B., Madyanov I.V. Lupus-like dermatological “masks” of cutaneous anaplastic large-cell lymphoma. RMJ. 2020;7:24–27.
Введение
Системная красная волчанка (СКВ) — аутоиммунное ревматическое заболевание, характеризующееся широким спектром клинических проявлений и непредсказуемым течением, поражающее любые органы и системы [1]. Дебютировать СКВ может с необъяснимой лихорадки, быстрого похудания, поражения кожи, артралгий/артрита, синдрома Рейно, серозитов, почечной патологии, гематологических (анемия, лейкопения, тромбоцитопения) или психоневрологических (судороги или психоз) нарушений, рецидивирующих тромбозов [2].
Многообразие дебютов, клинических проявлений и вариантов течения нередко вызывает трудности дифференциальной диагностики СКВ с другими заболеваниями. По мнению Н.Г. Клюквиной, существует около 50 заболеваний, течение которых похоже на течение СКВ, особенно на начальных стадиях. Нужно проводить дифференциальную диагностику СКВ с другими ревматическими заболеваниями (ранний ревматоидный артрит, ювенильный хронический артрит, системные васкулиты, системная склеродермия, идиопатические воспалительные миопатии, первичный антифосфолипидный синдром, лекарственная волчанка, фибромиалгия), с инфекционными заболеваниями (болезнь Лайма, туберкулез, бактериальный эндокардит, менингиты, инфекционный мононуклеоз, ВИЧ-инфекция, сифилис, вирусные гепатиты, вирусные артриты), а также с воспалительными заболеваниями кишечника, идиопатической тромбоцитопенической пурпурой, гемолитической анемией, лимфопролиферативными опухолями, саркоидозом и паранеопластическим синдромом [3]. Таким образом, СКВ справедливо называют болезнью-«хамелеоном» или «великим имитатором».
Подтвердить или опровергнуть диагноз СКВ позволяет знание характерных особенностей клинической картины, а также гематологических и иммунологических нарушений при СКВ. И тем не менее даже этих знаний бывает недостаточно для своевременной диагностики СКВ. В отдельных случаях, наоборот, чрезвычайное «увлечение» диагнозом СКВ в силу многообразия ее клинических проявлений способно заметно затруднить своевременную диагностику других серьезных заболеваний, которые могут дебютировать волчаночоподобными проявлениями, в т. ч. со стороны кожи.
В качестве примера, демонстрирующего трудности постановки основного диагноза при наличии у пациента в дебюте волчаночноподобных поражений кожи, приводим клиническое наблюдение.
Клиническое наблюдение
Больная К., 40 лет, обратилась на консультацию к ревматологу с жалобами на заложенность носа, гнойные выделения из носовых ходов, появление безболезненных язвочек в полости рта, чувство «жжения» в правой половине лица, отечность и покраснение в сосково-ареолярной области молочных желез с обеих сторон, больше справа, покашливание по утрам, выпадение волос, похудание на 7 кг за 6 мес.
Из анамнеза известно, что полгода назад, в августе 2017 г., в течение нескольких дней отдыхала с семьей в палаточном лагере на берегу озера, где постоянно подвергалась укусам насекомых, от которых зудела кожа. Особого значения этому не придавала, использовала кремы для защиты кожи от укусов. К концу отдыха на природе пациентка отмечала катаральные явления в носоглотке («простудилась») с гастроинтестинальными проявлениями (вздутие живота, диарея), что предположительно можно было расценить как ротавирусную инфекцию. Через 1 мес. гастроинтестинальные явления возобновились в более легкой форме, но уже сопровождались заложенностью носа, слизисто-гнойными выделениями из носовых ходов, а чуть позже в полости носа появились язвочки, покрытые гнойными корочками. Через несколько дней безболезненные язвочки стали формироваться в ротовой полости. Обратилась к отоларингологу, который направил пациентку на компьютерную томографию (КТ) придаточных пазух носа. На основании клинических данных, в т. ч. результатов КТ (тотальное затемнение обеих верхнечелюстных пазух), отоларингологом был диагностирован двусторонний гнойный гайморит, по поводу которого пациентка получала цефтриаксон в дозе 1,0 г/сут на протяжении 10 дней. Эффект от антибактериальной терапии был незначительным.
В октябре 2017 г. впервые заметила небольшой участок эритемы в области соска правой молочной железы с последующим быстрым распространением эритемы на ареолярную область и появлением новых эритематозных очагов. При осмотре отмечался отек правой молочной железы с неоднородным бугристым уплотнением тканей в месте поражения и покраснением кожи груди с синюшным оттенком, подобным рожистому воспалению. На коже туловища, конечностей, левой молочной железы — рассеянные эритематозные элементы в диаметре до 2 см, вокруг ареолы левой железы — застойная гиперемия, местами с уплотнением (рис. 1). Также наблюдалось умеренное увеличение переднешейных, надключичных и подмышечных лимфоузлов. С подозрением на отечно-инфильтративную форму злокачественного новообразования молочной железы пациентка была отправлена на консультацию к онкологу-маммологу, который по результатам ультразвукового и маммографического исследований (отсутствие очаговых образований) отверг диагноз «рак молочной железы». Биопсия молочной железы не проводилась. Были рекомендованы неспецифическая антибактериальная терапия (комбинированный препарат амоксициллина и клавулановой кислоты) и консультация дерматолога.

В общем анализе крови на тот момент имели место нормохромная анемия (гемоглобин 105 г/л), лейкопения (3,4×10 9 /л), относительная лимфопения, СОЭ (по методу Панченкова) равнялось 26 мм/ч. Уровень С-реактивного белка (СРБ) составил 6 мг/л. Учитывая двустороннее поражение ткани молочной железы, наличие участков эритемы кожи в области туловища, незначительную гиперемию кожи в области щек, увеличение периферических регионарных лимфоузлов, язвы слизистых оболочек полости рта и носа, не купирующиеся антибиотиками, выпадение волос, похудание за время болезни на 7 кг, гематологические нарушения, у пациентки заподозрили дебют СКВ. При этом поражение кожи молочной железы расценивалось как соответствующее васкулиту кожи в рамках диффузного заболевания соединительной ткани. Поэтому дерматологом был выставлен диагноз «СКВ с поражением кожи», пациентке было рекомендовано обратиться к ревматологу.
В этой связи заметим, что в классификационных критериях СКВ (Systemic Lupus International Collaborating Clinics, SLICC) 2012 г. учитываются следующие варианты поражения кожи:
острое, активное поражение кожи:
токсический эпидермальный некроз;
подострая кожная волчанка (неиндурированные псориазоформные и/или круговые полициклические повреждения, которые проходят без образования рубцов, но с возможной поствоспалительной депигментацией или телеангиэктазиями);
хроническая кожная волчанка:
классическая дискоидная сыпь (локализованная и генерализованная);
гипертрофические (бородавчатые) поражения кожи;
поражение слизистых оболочек;
отечные эритематозные бляшки на туловище;
дискоидная красная волчанка по типу красного плоского лишая [1].
При консультации пациентки и ознакомлении со всеми имеющимися данными обследования, включая дерматологические поражения, нам для подтверждения диагноза СКВ необходимо было провести дополнительные исследования. Дело в том, что, согласно современным требованиям (классификационные критерии SLICC, 2012), для установления диагноза СКВ необходимо наличие четырех критериев, из которых должно быть не менее одного клинического проявления и одного иммунологического показателя. Таким образом, без иммунологического критерия, отсутствующего у больной на момент нашей консультации, диагноз СКВ был неправомочен. Поэтому пациентка в рамках диагностики системного ревматического исследования прошла соответствующие иммунологические исследования [1], результаты которых не подтвердили диагноз СКВ. В частности, оказались отрицательными антинуклеарные антитела, антитела к двуспиральной ДНК класса IgG (3,9 Ед/мл), Smith-антигену (0,1 Ед/мл), антинейтрофильные цитоплазматические антитела (0,1 Ед/мл), антифосфолипидные антитела. Не был повышен ревматоидный фактор (1 Ед/мл). С3-, С4-фракции комплемента оказались в пределах референсных значений, была отрицательной реакция Вассермана. Поэтому дальнейшие исследования были направлены на поиск других причин (патологий), объясняющих столь своеобразное клиническое течение заболевания у женщины.
Антитела к ВИЧ, тестируемые онкомаркеры (раково-эмбриональный антиген, СА 125, СА 15.3, СА 19.9, СА 72.4), маркеры парентеральных вирусных гепатитов не обнаружены. Диаскинтест ® — отрицательный. При проведении рентгенографии органов грудной клетки очагово-инфильтративных изменений в легочных полях не выявлено. Зафиксированы ультразвуковые признаки умеренного увеличения и диффузных изменений печени и селезенки без реакции внутрибрюшных лимфоузлов.
Для уточнения причины поражения кожи была проведена биопсия молочной железы. При гистологическом исследовании биопсийного материала определялась диффузная инфильтрация атипическими клетками с крупными гиперхромными эксцентрично расположенными ядрами и скудной цитоплазмой; поверхность кожи была очагово изъязвлена, в эпидермисе выявлялись признаки акантоза и гиперкератоза. Атипичные (крупные анапластические) клетки инфильтрировали эпидермис. При иммуногистохимическом исследовании в большинстве опухолевых клеток выявлена выраженная экспрессия антигенов CD30, CD4, CD3, а экспрессия антигенов CD5, CD8, CD20, ALK (киназа анапластической лимфомы) отсутствовала. Индекс пролиферативной активности Ki-67 составил 65% позитивных клеток опухолевого субстрата.
Совокупность полученных гистологических и иммуногистохимических данных соответствовала первичной кожной анапластической крупноклеточной лимфоме — одной из разновидностей злокачественных (неходжкинских) лимфом при раке молочной железы. Пациентка для дальнейшей курации была передана врачам-онкогематологам. Первым этапом лечения явилось проведение адъювантной химиотерапии — режим CHOP (циклофосфамид, доксорубицин, винкристин, преднизолон), не менее 6 курсов.
В связи с установленным диагнозом уместным будет заметить, что первичная анапластическая крупноклеточная лимфома с поражением ткани молочной железы встречается достаточно редко и составляет около 0,5% от всех новообразований молочной железы и 1,7–2,2% от всех экстранодальных неходжкинских лимфом [4]. Под «первичной» лимфомой подразумевается Т-клеточная лимфома кожи без вовлечения в патологический процесс внутренних органов.
Наиболее частой локализацией анапластической крупноклеточной лимфомы является кожа конечностей, далее в порядке убывания следует кожа головы и шеи, в редких случаях развивается поражение кожи над ареолярной областью [5]. Большинство задокументированных случаев развития анапластической крупноклеточной лимфомы связано с наличием имплантатов молочных желез [6–13]. Считается, что имплантат молочной железы является первичным фактором, инициирующим иммунный ответ. В результате длительной антигенной стимуляции происходит накопление множественных онкогенных мутаций в иммунокомпетентных клетках, что в свою очередь приводит к злокачественной трансформации реактивного процесса [6]. В вышеприведенном случае пациентка косметической/реконструктивной операции с установкой имплантатов в молочные железы не подвергалась.
Весьма интригующими применительно к описанному нами случаю выглядят наблюдения отдельных исследований, предполагающих провоцирующую роль в развитии первичной кожной анапластической крупноклеточной лимфомы такого фактора, как укус насекомых [14, 15]. В частности, L. Lamant et al. приводят пять клинических случаев развития этого грозного заболевания после укуса насекомых [15]. В нашем примере, как было отмечено в анамнезе, больная на отдыхе, после которого начались признаки манифестации заболевания, постоянно подвергалась укусам насекомых, от которых зудела кожа. Предполагается, что укусы насекомых через ряд «передаточных» звеньев, включающих увеличение притока в место укуса CD4 + Т-лимфоцитов, последовательно обусловливают экспрессию онкогенного белка слияния NPM-ALK, что создает предпосылки для неконтролируемой клеточной пролиферации [15].
Вероятно, трудностями верификации первичной кожной лимфомы в нашем случае явилось панникулитоподобное поражение кожи, реакция со стороны периферических лимфоузлов, сопутствующие конституциональные и гематологические нарушения, а также отсутствие своевременного проведения биопсии ткани молочной железы. Касаясь несколько запоздалой диагностики лимфомы кожи в описанном нами случае, следует отметить, что в доступной нам литературе мы нашли лишь единичные описания клинических наблюдений первичных кожных Т-клеточных лимфом, которые протекали под маской СКВ [16, 17].
Таким образом, волчаночноподобные дерматологические «маски» анапластической крупноклеточной лимфомы кожи встречаются нечасто. В то же время практикующему врачу о них следует знать, в т. ч. для того, чтобы своевременно проводить биопсию пораженных тканей сразу после исключения диагноза СКВ.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.

Новость
Знаменитый телесериал «Доктор Хаус» запоминается не только циничным и сварливым нравом главного героя — гения медицинской диагностики, — но и аутоиммунным заболеванием системной красной волчанкой, появляющейся там едва ли не в каждой серии и даже ставшей своеобразным рефреном сериала.
Автор
Редакторы
Системная красная волчанка — это мультифакторное заболевание, развивающееся на основе генетического несовершенства иммунной системы и характеризующееся выработкой широкого спектра аутоантител к компонентам клеточного ядра. Молекулярно-генетические основы болезни изучены довольно плохо, в связи с чем специфического лечения до сих пор не создано, а в основе проводимой в клинике патогенетической терапии лежат иммунодепрессанты — глюкокортикостероиды и цитостатики. И вот, после более чем 50 лет попыток разработать специфическое лечение волчанки, произошел сдвиг: Управление по контролю за качеством пищевых продуктов и лекарств США официально утвердило в качестве лекарства от волчанки препарат Бенлиста (Benlysta) на основе моноклональных антител, специфически блокирующих B-лимфоцит-стимулирующий белок (BLyS).
Системная красная волчанка (СКВ) — одно из самых распространённых аутоиммуных заболеваний, в основе которого лежит генетически обусловленное комплексное нарушение иммунорегуляторных механизмов. При заболевании происходит образование широкого спектра аутоантител к различным компонентам ядра клеток и формирование иммунных комплексов. Развивающееся в различных органах и тканях иммунное воспаление приводит к обширным поражениям микроциркуляторного кровяного русла и системной дезорганизации соединительной ткани [1], [2].
Патогенез СКВ
В патогенезе СКВ важное место отводится иммунным механизмам, многие аспекты которых, несмотря на интенсивное изучение, остаются невыясненными. СКВ характеризуется обескураживающей «пестротой» иммунологических феноменов, что связывают с изменением практически всех известных функций иммунокомпетентных клеток (рис. 1).

Рисунок 1. Патогенез СКВ
Волчанка во многом связана с нарушениями на уровне пролиферации различных клонов В-клеток, активируемых многочисленными антигенами, в роли которых могут выступать медицинские препараты, бактериальная или вирусная ДНК и даже фосфолипиды мембраны митохондрий. Взаимодействие антигенов с лейкоцитами связано либо с поглощением антигенов антиген-презентирующими клетками (АПК), либо с взаимодействием антигена с антителом на поверхности В-клетки.
В результате поочередной активации то T-, то B-клеток увеличивается продукция антител (в том числе, аутоантител), наступает гипергаммаглобулинемия, образуются иммунные комплексы, чрезмерно и неконтролируемо дифференцируются Т-хелперы. Разнообразные дефекты иммунорегуляции, свойственные СКВ, связаны также с гиперпродукцией цитокинов Th2-типа (IL-2, IL-6, IL-4, IL-10 IL-12).
Одним из ключевых моментов в нарушении иммунной регуляции при СКВ является затрудненное расщепление (клиренс) иммунных комплексов, — возможно, вследствие их недостаточного фагоцитоза, связанного, в частности, с уменьшением экспрессии CR1-рецепторов комплемента на фагоцитах и с функциональными рецепторными дефектами.
Распространённость СКВ колеблется в пределах 4–250 случаев на 100 000 населения; пик заболеваемости приходится на возраст 15–25 лет при соотношении заболевших женщин к мужчинам 18:1. Наиболее часто заболевание развивается у женщин репродуктивного возраста с увеличением риска обострения во время беременности, в послеродовом периоде, а также после инсоляции и вакцинации.
СКВ часто становится причиной инвалидности. В развитых странах в среднем через 3,5 года после постановки диагноза 40% больных СКВ полностью прекращают работать, — в основном, в связи с нейрокогнитивными дисфункциями и повышенной утомляемостью. К потере трудоспособности чаще всего приводят дискоидная волчанка и волчаночный нефрит.
Клинические проявления СКВ чрезвычайно разнообразны: поражение кожи, суставов, мышц, слизистых оболочек, лёгких, сердца, нервной системы и т.д. У одного пациента можно наблюдать различные, сменяющие друг друга варианты течения и активности заболевания; у большинства больных периоды обострения заболевания чередуются с ремиссией. Более чем у половины больных есть признаки поражения почек, сопровождающиеся ухудшением реологических свойств крови [4].
Поскольку молекулярные и генетические механизмы, лежащие в основе заболевания, до сих пор как следует не изучены, специфического лечения волчанки до недавнего времени не существовало. Базисная терапия основана на приёме противовоспалительных препаратов, действие которых направлено на подавление иммунокомплексного воспаления, как в период обострения, так и во время ремиссии. Основными препаратами для лечения СКВ являются:
- глюкокортикоиды (преднизолон, метилпреднизолон);
- цитостатические препараты (циклофосфамид, азатиоприн, метотрексат, мофетила микофенолат, циклоспорин).
«Я знаю пароль, я вижу ориентир»
В конце 1990-х в биофармацевтической компании Human Genome Sciences (Роквилл, Мэриленд, США) открыли молекулярный путь, «сузив» который, можно в какой-то степени сдержать развитие СКВ. В этом пути участвует белок, получивший название «стимулятор B-лимфоцитов» (или BLyS), — цитокин из семейства фактора некроза опухолей. Было обнаружено, что ингибирование BLyS позволяет несколько сдержать разыгравшуюся иммунную систему и уменьшить число колоний B-лимфоцитов, производящих аутоантитела, атакующие здоровые ткани.
Исследователи, желая специфически блокировать BLyS, сделали ставку на человеческое моноклональное антитело, разработанное совместно с английской биотехнологической фирмой Cambridge Antibody Technology, и названное белимумаб (belimumab). В начале марта 2011 года американское Управление по контролю за качеством пищевых продуктов и лекарственных препаратов (FDA) впервые за 56 лет одобрило препарат, предназначенный для специфического лечения системной красной волчанки. Эти препаратом стал Бенлиста — коммерческое название антитела белимумаба, производством которого уже занимается компания GlaxoSmithKline. До того FDA одобряла для терапии СКВ гидроксихлорохин — лекарство от малярии; было это в 1956 году.
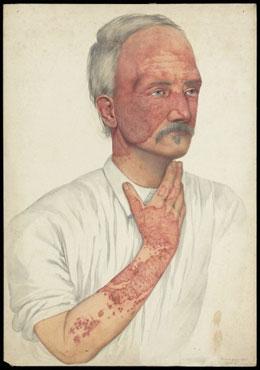
Рисунок 2. Человек, больной системной красной волчанкой (акварель 1902 года кисти Мэйбл Грин). Свое название заболевание получило ещё в средневековье, когда людям казалось, что характерная волчаночная сыпь на переносице напоминает волчьи укусы.
Дорога к этому свершению была долгой, потому что до 2009 года, когда белимумаб успешно прошел первые две фазы клинического тестирования, ещё ни одно лекарство против волчанки не добиралось до фазы III испытаний — рандомизированного мультицентрового исследования с участием большой популяции пациентов. (О процессе разработки лекарств и о клинических испытаниях см. «Драг-дизайн: как в современном мире создаются новые лекарства» [5].) Дело в том, что «строгая» система клинических проверок, основанная на идеологии доказательной медицины, просто не пропускала препараты-«кандидаты», оказывавшиеся на поверку просто неэффективными или опасными для здоровья пациентов.
«Под проекты разработки лекарств против волчанки было просто не получить финансирования, поскольку все знали, что эти разработки как одна проваливаются», — говорит Ричард Фьюри (Richard Furie), ревматолог из Нью-Йорка, руководивший клиническими исследованиями белимумаба. — «Люди открыто говорили: „вы никогда не добьетесь успеха [в клинических исследованиях]“» [6].
Целенаправленная терапия
Когда исследователи из Human Genome Sciences (HGS) открыли цитокин BLyS [7] на основе анализа генетической активности белых клеток крови, полной последовательности генома человека [8] еще не было. «Это было чудное время», — рассказал Дэвид Гилберт (David Hilbert), бывший руководитель исследований этой компании. — «Мы каждый день сидели над лимфоцитами и получали последовательности все новых и новых генов, про которые совершенно не было понятно, что они такое» [6].
В процессе исследования BLyS сотрудники HGS обнаружили, что количество этого цитокина сильно увеличивается при воспалении, а особенно — у больных волчанкой. Это была очень важная зацепка, хотя и было понятно с самого начала, что дорога предстоит нелёгкая, учитывая количество уже провалившихся клинических испытаний препаратов. Ситуация особенно осложнялась тем, что клинические проявления СКВ крайне разнообразны — от лёгкого дискомфорта у одних до тяжкого бремени на всю жизнь у других, — что и побудило, наверное, авторов «Доктора Хауса» включить волчанку в сериал в таком утрированном контексте.
Кстати, цитокину BLyS даже есть памятник, причем в процессе его синтеза на рибосоме: дочь основателя компании HGS, увлекающаяся молекулярной скульптурой [9], «позаимствовала» у отца белок для ваяния. Скульптура установлена в американском НИИ Колд Спринг Харбор.
Действие лекарств, селективно на молекулярном уровне «выключающих» некоторые ветви иммунитета, должно быть очень точным. Например, в 2008 закончились неудачей клинические испытания атацицепта (atacicept), ингибирующего не только BLyS, но и ещё один родственный белок. Тестирование на больных тяжелой формой волчанки — волчаночным нефритом — пришлось срочно прекратить из-за аномально высокого числа побочных инфекций у принимавших лекарство. Аналогичная ситуация была с антителом окрелизумабом (ocrelizumab), блокировавшим работу B-лимфоцитов по другому механизму.
Следующие на очереди
Белимумаб — только первое лекарство из находящихся на очереди в процессе тестирования у различных фармацевтических фирм (таких как Anthera, Eli Lilly и других). Часть разрабатываемых лекарств действуют также на BLyS, другие — ингибируют работу T-лимфоцитов, «атакуя» белок под «научным» названием B7-родственный белок, ещё один препарат ингибирует медиатор воспаления интерферон-γ. Самому же белимумабу пророчат светлое будущее — с точки зрения фармацевтических гигантов, это обозначает миллиардные продажи, выводящие препарат в заветный список «блокбастеров». Между прочим, это совершенно не обозначает полного излечения от болезни миллионам пациентов — эффективность препарата не такая уж и высокая (согласно официальной информации, помогает он одному пациенту из 11), тем более что тестирование проводили не на тяжелой форме заболевания [10]. Кроме того, белимумаб оказался неэффективен в лечении чернокожих пациентов. Впрочем, это все равно лучше, чем неспецифически «глушить» иммунитет пациентов. Жаль только, что большинству российских больных придется по старинке использовать преднизолон, хоть менее эффективный, но зато намного более дешевый, чем инновационный препарат «с пылу-жару».

Красная волчанка – аутоиммунная патология, при которой происходит поражение кровеносных сосудов и соединительной ткани, а как следствие – кожи человека. Заболевание носит системный характер, т.е. происходит нарушение в нескольких системах организма, оказывая негативное влияние на него в целом и на отдельные органы в частности, в том числе и на иммунную систему.
Подверженность болезни женщин в несколько раз выше, чем мужчин, что связано с особенностями строения женского организма. Наиболее критичным возрастом для развития системной красной волчанки (СКВ) считается период полового созревания, во время беременности и некоторый интервал после него, пока организм проходит этап восстановления.
Кроме этого, отдельной категорией для возникновения патологии считается детский возраст в периоде от 8 лет, но это не определяющий параметр, потому что не исключается врожденный вид заболевания или его проявление на ранних сроках жизни.

Что это за болезнь?
Системная красная волчанка (СКВ, болезнь Либмана-Сакса) (лат. lupus erythematodes, англ. systemic lupus erythematosus) — диффузное заболевание соединительной ткани, характеризующееся системным иммунокомплексным поражением соединительной ткани и её производных, с поражением сосудов микроциркуляторного русла.
Системное аутоиммунное заболевание, при котором вырабатываемые иммунной системой человека антитела повреждают ДНК здоровых клеток, преимущественно повреждается соединительная ткань с обязательным наличием сосудистого компонента. Название болезнь получила из-за своего характерного признака — сыпи на переносице и щеках (поражённый участок по форме напоминает бабочку), которая, как считали в Средневековье, напоминает места волчьих укусов.
История
Свое название красная волчанка получила от латинского слова «люпус» – волк и «эритематозус» – красная. Это название было присвоено из-за схожести кожных признаков с повреждениями после укуса голодным волком.
История болезни красная волчанка получила свое начало в 1828г. Это случилось после того, как французский дерматолог Biett впервые описал кожные признаки. Гораздо позже, спустя 45 лет врач дерматолог Kaposhi подметил, что некоторые заболевшие наряду с кожными признаками имеют болезни внутренних органов.
В 1890г. было обнаружено английским врачом Osler, что системно красная волчанка может протекать без кожных проявлений. Описание феномена LE-(ЛЕ) клеток – это обнаружение осколков клеток в крови, в 1948г. позволило идентифицировать больных.
В 1954г. были обнаружены в крови заболевших определенные белки – антитела, действующие против собственных клеток. Это обнаружение стало использоваться в разработках чувствительных тестов для диагностирования системной красной волчанки.
Причины возникновения
Причины болезни окончательно не выяснены. Установлены только предполагаемые факторы, способствующие возникновению патологических изменений.
Генетические мутации — выявлена группа генов, связанных со специфическими нарушениями иммунитета и предрасположенностью к системной красной волчанке. Они отвечают за процесс апоптоза (избавления организма от опасных клеток). При задержке потенциальных вредителей происходит поражение здоровых клеток и тканей. Другой способ — дезорганизация процесса управления иммунной защитой. Реакция фагоцитов становится чрезмерно сильной, не прекращается с уничтожением чужеродных агентов, за «чужих» принимаются собственные клетки.
- Возраст — максимально системной красной волчанкой болеют люди от 15 до 45 лет, но есть случаи, возникшие в детском возрасте и у пожилых.
- Наследственность — известны случаи семейного заболевания, вероятно, передающегося от старших поколений. Однако риск рождения больного ребенка остается низким.
- Раса — американские исследования показали, что чернокожее население болеет в 3 раза чаще белых, также эта причина более выражена у коренных индейцев, уроженцев Мексики, азиаток, испанок.
- Пол — среди известных больных женщин в 10 раз больше, чем мужчин, поэтому ученые пытаются установить связь с половыми гормонами.
Среди внешних факторов наиболее патогенным является интенсивное солнечное облучение. Увлечение загаром способно спровоцировать генетические изменения. Есть мнение, что чаще болеют системной волчанкой люди, профессионально зависимые от деятельности на солнце, морозе, резких колебаний температуры среды (моряки, рыбаки, сельскохозяйственные работники, строители).
У значительной части пациентов клинические признаки системной волчанки появляются в период гормональных изменений, на фоне беременности, климакса, приема гормональных контрацептивов, в период интенсивного полового созревания.
Также болезнь связывают и с перенесенной инфекцией, хотя доказать роль и степень влияния какого-либо возбудителя (идут целенаправленные работы по роли вирусов) пока невозможно. Попытки выявить связь с синдромом иммунодефицита или установить заразность болезни пока неуспешны.

Патогенез
Как развивается системная красная волчанка у здорового на первый взгляд человека? Под влиянием определенных факторов и сниженной функции иммунной системы в организме происходит сбой, при котором начинают вырабатываться антитела против «родных» клеток организма. То есть ткани и органы начинают восприниматься организмом, как чужеродные объекты и запускается программа самоуничтожения.
Такая реакция организма носит патогенный характер, провоцируя развитие воспалительного процесса и угнетение здоровых клеток разными способами. Чаще всего изменениям подвержены кровеносные сосуды и соединительная ткань. Патологический процесс приводит к нарушению целостности кожи, изменению ее внешнего вида и снижению кровообращения в очаге поражения. При прогрессировании заболевания поражаются внутренние органы и системы всего организма.
Классификация
В зависимости от области поражения и характера течения заболевание классифицируют на несколько видов:
- Красная волчанка, вызванная приемом некоторых препаратов. Приводит к появлению симптоматики СКВ, которая может самопроизвольно исчезать после отмены препаратов. Лекарственными средствами, способными приводить к развитию красной волчанки, становятся препараты для лечения артериальной гипотензии (артериолярные вазодилататоры), антиаритмические, противосудорожные средства.
- Системная красная волчанка. Заболевание склонно к быстрому прогрессированию с поражением любого органа или системы организма. Протекает с лихорадкой, недомоганием, мигренями, сыпью на лице и теле, а также болями разного характера в любом участке тела. Наиболее характерны мигрени, артралгии, боли в почках.
- Неонатальная волчанка. Возникает у новорожденных, зачастую сочетаясь с пороками сердца, серьезными нарушениями работы иммунной и кровеносной систем, аномалиями развития печени. Болезнь встречается чрезвычайно редко; меры консервативной терапии позволяют эффективно снижать проявления неонатальной волчанки.
- Дискоидная волчанка. Самая распространенная форма болезни – центробежная эритема Биетта, основными проявлениями которой являются кожные симптомы: красная сыпь, утолщение эпидермиса, воспаленные бляшки, трансформирующиеся в рубцы. В некоторых случаях заболевание приводит к поражению слизистых оболочек рта и носа. Разновидностью дискоидной является глубокая волчанка Капоши-Ирганга, для которой характерно рецидивирующее течение и глубокие поражения кожных покровов. Особенностью течения этой формы болезни становятся признаки артритов, а также снижение работоспособности человека.
Симптомы красной волчанки
Являясь системным заболеванием, красная волчанка характеризуется следующими симптомами:
- синдром хронической усталости;
- припухание и болезненность суставов, а также мышечная боль;
- необъяснимая лихорадка;
- грудные боли при глубоком дыхании;
- повышенное выпадение волос;
- красные, кожные высыпания на лице или изменение окраски кожных покровов;
- чувствительность к солнцу;
- отеки, припухание ног, глаз;
- увеличение лимфатических узлов;
- посинение или побеление пальцев на руках, на ногах, пребывая на холоде или в момент стресса (синдром Рейно).
Отдельные люди испытывают головные боли, судороги, головокружение, депрессивные состояния.
Новые симптомы способны появляться спустя годы и после постановки диагноза. У одних больных страдает одна система организма (суставы или кожа, органы кроветворения), у других заболевших проявления способны затронуть многие органы и нести полиорганный характер. Сама тяжесть и глубина поражения систем организма у всех различна. Зачастую поражаются мышцы и суставы, при этом вызывая артрит и миалгию (боль в мышцах). Кожные высыпания имеют схожесть у разных пациентов.
Если у больного полиорганные проявления, то происходят следующие патологические изменения:
- в почках воспаление (волчаночный нефрит);
- воспаления кровеносных сосудов (васкулиты);
- воспаление легких: плеврит, пневмонит;
- заболевания сердца: коронарный васкулит, миокардит или эндокардит, перикардит;
- заболевания крови: лейкопения, анемия, тромбоцитопения, риск образования тромбов;
- поражения мозга или центральной нервной системы, а это провоцирует: психоз (изменение в поведение), возникает головная боль, головокружение, паралич, нарушение памяти, проблемы со зрением, судороги.
Как выглядит красная волчанка, фото
На фото ниже показано, как проявляется заболевание у человека.

Проявление симптоматики данного аутоиммунного заболевания могут существенно различаться у разных больных. Однако общими местами локализации очагов поражения, как правило, становятся кожные покровы, суставы (преимущественно рук и пальцев), сердце, легки и бронхи, а также пищеварительные органы, ногти и волосы, которые становятся более хрупкими и склонными к выпадению, а также головной мозг и нервная система.
Стадии течения болезни
В зависимости от выраженности симптоматики заболевания системная красная волчанка имеет несколько стадий течения:
- Острая стадия – на этом этапе развития красная волчанка резко прогрессирует, общее состояние пациента ухудшается, он жалуется на постоянную усталость, повышение температуры до 39-40 градусов, лихорадку, боль и ломоту в мышцах. Клиническая картина развивается стремительно, уже за 1 месяц заболевание охватывает все органы и ткани организма. Прогноз при острой форме красной волчанке не утешительный и зачастую продолжительность жизни пациента не превышает 2 лет;
- Подострая стадия – скорость прогрессирования заболевания и степень выраженности клинических симптомов не такая, как в острой стадии и от момента заболевания до появления симптоматики может пройти более 1 года. На этой стадии заболевание часто сменяется периодами обострений и стойкой ремиссии, прогноз в целом благоприятный и состояние пациента напрямую зависит от адекватности назначенного лечения;
- Хроническая форма – заболевание имеет вялую форму течения, клинические симптомы слабо выражены, внутренние органы практически не поражены и организм в целом нормально функционирует. Несмотря на относительно легкое течение красной волчанки, вылечить заболевание на данной стадии невозможно, единственное, что можно сделать – это облегчить выраженность симптомов при помощи медикаментов в момент обострения.
Осложнения СКВ
Основные осложнения, которые провоцирует СКВ:
1) Болезни сердца:
- перикардит — воспаление сердечной сумки;
- отвердение коронарных артерий, питающих сердце по причине скопления тромботических сгустков (атеросклероз);
- эндокардит (инфицирование поврежденных клапанов сердца) из-за уплотнения сердечных клапанов, скопления кровяных сгустков. Нередко проводят пересадку клапанов;
- миокардит (воспаление мускула сердца), вызывающий тяжелые аритмии, заболевания сердечного мускула.
2) Почечные патологии (нефриты, нефроз) развиваются у 25% больных, страдающих СКВ. Первые симптомы – отеки на ногах, наличие в моче белка, крови. Крайне опасен для жизни отказ почек нормально работать. Лечение включает применение сильных препаратов от СКВ, диализ, пересадку почки.
3) Заболевания крови, опасные для жизни.
- снижение эритроцитов (питающих клетки кислородом), лейкоцитов (подавляющих инфекции и воспаления), тромбоцитов (способствуют свертываемости крови);
- гемолитическая анемия, вызванная недостатком эритроцитов или тромбоцитов;
- патологические изменения органов кроветворения.
4) Заболевания легких (у 30%), плевриты, воспаление мышц грудной клетки, суставов, связок. Развитие острой туберкулезной волчанки (воспаление ткани легких). Легочная эмболия – закупорка артерий эмболами (кровяными сгустками) в связи с повышенной вязкостью крови.
Диагностика
Предположение о наличии красной волчанки можно сделать на основании красных очагов воспалений на кожных покровах. Внешние признаки эритематоза со временем могут изменяться, поэтому по ним трудно поставить точный диагноз. Необходимо применение комплекса дополнительных обследований:
- общие анализы крови и мочи;
- определение уровня печеночных ферментов;
- анализ на Антинуклеарные тела (АНА);
- рентгенография грудной клетки;
- эхокардиография;
- биопсия.

Дифференциальная диагностика
Хроническую красную волчанку дифференцируют от красного плоского лишая, туберкулезной лейкоплакии и волчанки, раннего ревматоидного артрита, синдрома Шегрена (см. сухость во рту, синдром сухого глаза, светобоязнь). При поражении красной каймы губ хроническую СКВ дифференцируют от абразивного преканцерозного хейлита Манганотти и актинического хейлита.
Поскольку поражение внутренних органов всегда схоже по течению с различными инфекционными процессами, СКВ дифференцируют от болезни Лайма, сифилиса, мононуклеоза (инфекционный мононуклеоз у детей: симптомы), ВИЧ-инфекции.
Лечение системной красной волчанки
Лечение должно быть максимально подходящим для конкретного пациента.
Госпитализация необходима в следующих случаях:
- при стойком повышение температуры без видимой причины;
- при возникновении угрожающих жизни состояний: быстропрогрессирующая почечная недостаточность, острый пневмонит или легочное кровотечение.
- при появлении неврологических осложнений.
- при значительном снижении количества тромбоцитов, эритроцитов или лимфоцитов крови.
- в случае, когда обострение СКВ невозможно вылечить в амбулаторных условиях.
Для лечения системной красной волчанки в период обострения широко применяются гормональные препараты (преднизолон) и цитостатики (циклофосфамид) по определенной схеме. При поражении органов опорно-двигательной системы, а также при повышении температуры назначаются нестероидные противовоспалительные препараты (диклофенак).
Для адекватного лечения заболевания того или иного органа необходима консультация специалиста в этой области.
Правила питания
Опасные и вредные продукты при волчанке:
- большое количество сахара;
- все жаренное, жирное, соленое, копченое, консервированное;
- продукты, на которые есть аллергические реакции;
- сладкие газировки, энергетики и алкогольные напитки;
- при наличии проблем с почками противопоказана пища, содержащая калий;
- консервы, колбасы и сосиски фабричного приготовления;
- магазинный майонез, кетчуп, соусы, заправки;
- кондитерские изделия с кремом, сгущенкой, с искусственными наполнителями (заводскими джемами, повидлами);
- фаст фуд и продукты с ненатуральными наполнителями, красителями, рыхлителями, усилителями вкусовых качеств и запаха;
- продукты, содержащие холестерин (булочки, хлеб, красное мясо, молочные продукты с высокой жирностью, соусы, заправки и супы, в основе приготовления которых взяты сливки);
- продукты, имеющие большой срок годности (имеются ввиду те продукты, которые быстро портятся, но благодаря различным химическим добавкам в составе, могут храниться очень долгое время – сюда, как пример, можно отнести молочные продукты с годовым сроком годности).
Употребляя эти продукты можно ускорить процесс прогрессирования болезни, что может повлечь за собой смертельный исход. Это максимальные последствия. А, как минимум, спящая стадия волчанки перейдет в активную, из-за чего все симптомы обострятся и самочувствие значительно ухудшится.
Продолжительность жизни
Выживаемость через 10 лет после постановки диагноза системная красная волчанка — 80 %, через 20 лет — 60 %. Основные причины смерти: люпус-нефрит, нейро-люпус, интеркуррентные инфекции. Есть случаи выживаемости 25—30 лет.
В целом качество и длительность жизни при системной красной волчанке зависит от некоторых факторов:
- Возраст пациента: чем моложе пациент — тем выше активность аутоиммунного процесса и агрессивней протекает заболевание, что связано с большей реактивностью иммунитета в молодом возрасте (больше аутоиммунных антител разрушают собственные ткани).
- Своевременность, регулярность и адекватность терапии: при длительном приеме гормонов глюкокортикостероидов и других препаратов можно добиться длительного периода ремиссии, снижения риска развития осложнений и как результат – улучшения качества жизни и ее длительности. Причем, очень важно начать лечение еще до развития осложнений.
- Вариант течения заболевания: острое течение протекает крайне неблагоприятно и через пару лет могут возникнуть тяжелые, угрожающие жизни осложнения. А с хроническим течением, а это 90% случаев СКВ, можно жить до старости полноценной жизнью (если соблюдать все рекомендации врача ревматолога и терапевта).
- Соблюдение режима значительно улучшает прогноз заболевания. Для этого необходимо постоянно наблюдаться у врача, придерживаться его рекомендаций, своевременно обращаться к медикам при появлении каких-либо симптомов обострения заболевания, избегать контакта с солнечными лучами, ограничивать водные процедуры, вести здоровый образ жизни и соблюдать другие правила профилактики обострений.
Если вам выставили диагноз волчанки, то это не значит, что жизнь закончилась. Старайтесь победить болезнь, может быть, не в прямом смысле. Да, вероятно, вы будете в чем-то ограничены. Но миллионы людей и с более тяжелыми заболеваниями живут яркой, полной впечатлений жизнью! Значит, сможете и вы.

Профилактика
Цель профилактики – предупредить развитие рецидивов, длительно поддерживать больного в состоянии стойкой ремиссии. Профилактика волчанки основана на комплексном подходе:
Читайте также:

