Гиперпигментация при гипокортицизме патогенез
Обновлено: 18.04.2024
Болезнь Аддисона (гипокортицизм, хроническая надпочечниковая недостаточность) — это редкое заболевание, характеризующееся недостаточной выработкой надпочечниками глюкокортикоидного гормона кортизола и минералокортикоидного гормона альдостерона.
Чаще всего гипокортизицм, которому подвержены как мужчины, так и женщины, возникает в 30-50 лет, однако дебют (первое клиническое проявление) заболевания может наблюдаться в любом возрасте.
Распространенность болезни Аддисона во всем мире составляет 40-60 пациентов с установленным диагнозом БА на 1 миллион человек.
Причины возникновения
Как правило, болезнь Аддисона возникает из-за повреждения или разрушения коры надпочечников в результате развития аутоиммунного процесса (иммунная система воспринимает кору надпочечников как чужеродную, атакует и разрушает ее) или другого аутоиммунного заболевания, имеющегося у пациента.
К другим причинам возникновения заболевания относятся:
-
(в основном в развивающихся странах);
- другие (вторичные, например — грибковые) инфекции;
- злокачественные опухоли (с распространением опухолевых клеток из первичного очага, лимфомы);
- кровотечение в надпочечниках (надпочечниковый инфаркт);
- генетическая предрасположенность (в редких случаях).
Дефицит глюкокортикоидных и минералокортикоидных гормонов, вызванный снижением функции коры надпочечников, называют первичной надпочечниковой недостаточностью. Если надпочечники не способны продуцировать эти гормоны по другим причинам (например, из-за аномалий гипофиза или его дисфункции), речь идет о вторичной надпочечниковой недостаточности.
Симптомы
Болезнь Аддисона прогрессирует медленно, в течение нескольких месяцев. Симптомы могут варьироваться от человека к человеку. Первые клинические проявления часто неспецифичны, то есть сходны с симптомами других — распространенных — заболеваний.
Обычно на начальных стадиях заболевания пациент не ощущает никаких симптомов. К сожалению, дебют БА ассоциирован с 90% повреждения коры надпочечников.
К симптомам болезни Аддисона относятся:
- повышенная утомляемость;
- снижение энергии;
- общее недомогание;
- гиперпигментация кожи, затрагивающая ладонные сладки, фаланги пальцев, шрамы, слизистые оболочки полости рта, места трения;
- нарушение пигментации кожи (витилиго);
- снижение аппетита и потеря веса;
- обезвоживание;
- низкий вес и отставание в физическом развитии (у детей);
- тяга к соли или соленой пище; , рвота; , диарея;
- обмороки;
- мышечная и суставная боль;
- раздражительность, снижение концентрации, депрессия;
- гнездная алопеция; на некоторых участках тела, сухость кожи, снижение либидо, нарушения менструального цикла (у женщин);
- гипогликемия (снижение концентрации глюкозы в крови);
- постуральная гипотензия (резкое снижение АД при изменении положения тела).
Иногда болезнь Аддисона, не проявлявшая себя ранее, может возникнуть внезапно и остро — например, при отсутствии необходимого лечения или в результате воздействия стрессовых факторов (несчастный случай, травма, хирургическое вмешательство), инфекции, другого заболевания. В этом случае речь идет о жизнеугрожающем состоянии — т. н. аддисоническом кризе или острой надпочечниковой недостаточности. Характерные признаки: сильная слабость, спутанность сознания, боли в спине, ногах и животе, рвота и диарея, низкое артериальное давление, гиперкалиемия, гипонатриемия.
Диагностика
Диагноз устанавливается на основании анамнеза, жалоб и симптомов пациента, результатов лабораторной и инструментальной диагностики (КТ, МРТ).
Анализы крови направлены на определение уровня натрия, калия, кортизола и адренокортикотропного гормона (АКТГ), который стимулирует выработку гормонов корой надпочечников, а также на выявление специфических антител, ассоциированных с болезнью Аддисона.
Пациенту может быть назначена стимуляционная проба АКТГ, во время которой (для стимуляции выработки кортизола) вводится адренокортикотропный гормон. Если стимуляция не приводит к выработке нормального уровня кортизола, это указывает на повреждение надпочечников или нарушение их функции.
Также проводится инсулин-индуцированная гипогликемическая проба, которая помогает установить взаимосвязь характерных симптомов болезни Аддисона с аномалиями гипофиза или нарушениями его функции. Во время этого теста пациенту вводится быстродействующий инсулин, уровень сахара в крови замеряется до и после инъекции.
Для оценки функции надпочечников и их структурных особенностей дополнительно проводится визуализация с помощью КТ и МРТ. Эти исследования помогают уточнить характерные изменения, наблюдаемые при развитии болезни Аддисона.
Дифференциальный диагноз
Чаще всего болезнь Аддисона дифференцируют (различают) со следующими заболеваниями:
- вторичной надпочечниковой недостаточностью, вызванной снижением выработки гипофизом адренокортикотропного гормона;
- врожденной гиперплазией надпочечников (группа наследственных патологий, возникающих из-за нарушения биосинтеза кортизола);
- адренолейкодистрофией (наследственное дегенеративное заболевание ЦНС, которое передается по X-сцепленному рецессивному типу и ассоциируется с надпочечниковой недостаточностью);
- аутоиммунным полиэндокринным синдромом 2 типа (синдром Шмидта, редкое аутоиммунное заболевание, при котором происходит резкое снижение функции нескольких эндокринных органов: надпочечников, щитовидной железы, паращитовидных желез, гонад, поджелудочной железы);
- аутоиммунным полиэндокринным синдромом 1 типа (редкий генетический синдром APECED, который характеризуется поражениями кожи и слизистых оболочек грибами рода Candida, снижением функции паращитовидных желез и аутоиммунной недостаточностью функции надпочечников).
Лечение болезни Аддисона
Лечение болезни Аддисона основано на применении медикаментозной терапии, направленной на замещение глюкокортикоидного и минералокортикоидного гормонов. Рекомендуется пероральный прием гидрокортизона и флудрокортизона, дозировка препаратов подбирается индивидуально. Терапия проводится на протяжении всей жизни.
Некоторым пациентам может быть предложена андроген-заместительная терапия (тестостерон или андростендион). Больные, получающие такое лечение, сообщают о снижении проявлений усталости, улучшении настроения и психоэмоционального состояния в целом, повышении либидо (у женщин), однако эти подходы к лечению пока исследуются.
Лечение аддисонического криза включает внутривенное введение гидрокортизона, жидкостей, электролитов и препаратов, нормализующих артериальное давление.
Особенности и преимущества лечения болезни Аддисона в клинике Рассвет
Своевременная диагностика и эффективное лечение редких синдромов и болезней входят в область интересов всех врачей клиники Рассвет.
Наши эндокринологи — врачи высокой квалификации, прекрасно подготовлены и имеют большой практический опыт.
Пациентам с подозрением на болезнь Аддисона проводятся все необходимые диагностические исследования для подтверждения или исключения диагноза. При необходимости индивидуально подбирается адекватная схема терапии.
Рекомендации врача-эндокринолога клиники Рассвет пациентам с болезнью Аддисона
Помимо приема препаратов заместительной терапии, пациенту необходимо следить за тем, чтобы получать достаточное количество соли (натрия) из рациона, особенно во время физических нагрузок, при жаре или желудочно-кишечных расстройствах.
Дозировка принимаемых лекарств может быть временно увеличена, если пациент испытывает стресс, связанный с проведением операции, инфекционными и другими заболеваниями. Если из-за тошноты и рвоты пациент не может принимать необходимые препараты перорально, ему назначаются инъекции.
Пациентам с болезнью Аддисона важно знать, что прием стероидов в их случае не связан с серьезными побочными эффектами, поскольку осуществляется восполнение недостатка выработки гормонов. При правильном подборе дозировки лекарств побочные эффекты практически не наблюдаются.
Пациентам с болезнью Аддисона необходимо постоянно иметь при себе медицинский документ, свидетельствующий о наличии заболевания, для случаев оказания экстренной медицинской помощи.
Болезнь Аддисона нельзя предотвратить, но для нее существует эффективное лечение. При своевременной диагностике, правильном подборе терапии, соблюдении мер профилактики острой надпочечниковой недостаточности, ожидаемая продолжительность жизни у пациентов с этим заболеванием не снижается.
Что такое болезнь Иценко — Кушинга? Причины возникновения, диагностику и методы лечения разберем в статье доктора Ворожцова Е. И., эндокринолога со стажем в 12 лет.
Над статьей доктора Ворожцова Е. И. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Болезнь Иценко — Кушинга (БИК) — тяжёлое многосистемное заболевание гипоталомо-гипофизарного происхождения, клинические проявления которого обусловлены гиперсекрецией гормонов коры надпочечников. [1] Является АКТГ-зависимой формой гиперкортицизма (заболевания, связанного с избыточным выделением гормонов корой надпочечников).
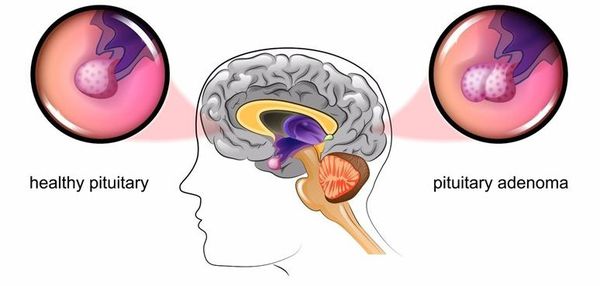
Основная причина заболевания — кортикотрофная микроаденома (доброкачественная опухоль) гипофиза. Возникновение последней может быть связано со множеством факторов. Часто заболевание развивается после травмы головного мозга, беременности, родов, нейроинфекции.
Болезнь Иценко — Кушинга является редким заболеванием, частота встречаемости которого составляет 2-3 новых случая в год на один миллион населения. [2]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы болезни Иценко — Кушинга
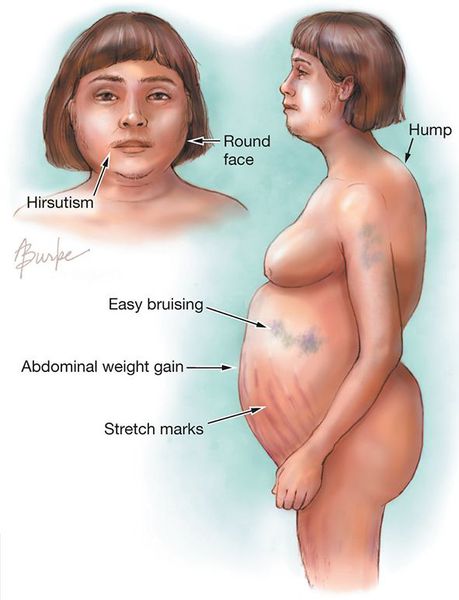
Клинические признаки данной болезни обусловлены гиперсекрецией кортикостероидов. В большинстве случаев первым клиническим признаком является ожирение, которое развивается на лице, шее, туловище и животе, при этом конечности становятся тонкими. Позднее проявляются кожные изменения — истончение кожи, трудно заживающие раны, яркие стрии (растяжки), гиперпигментация кожи, гирсутизм (избыточное появление волос на лице и теле).
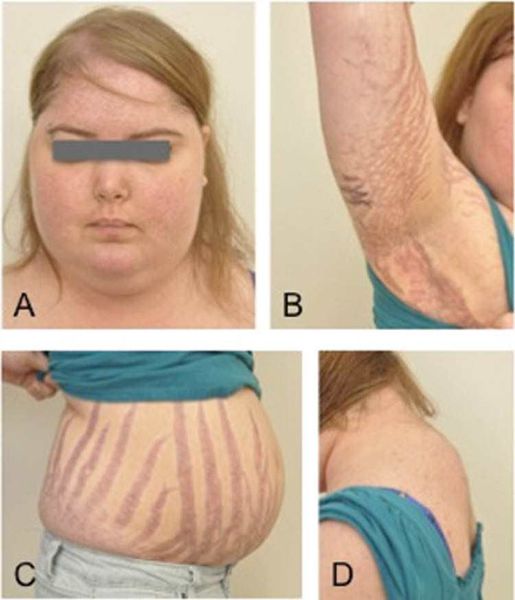
Также важным и частым симптомом является мышечная слабость, развитие остеопороза.
Артериальная гипертензия при БИК носит постоянный и умеренный характер, в редких случаях артериальное давление остаётся в норме. Это связано с тем, что глюкокортикоиды (гормоны, вырабатываемые корой надпочечников) повышают сосудистый тонус и чувствительность адренорецепторов к катехоламинам (природным веществам, контролирующим межклеточное взаимодействие в организме).
Более чем у половины больных возникают нарушения психики. Наиболее частые из них: эмоциональная неустойчивость, депрессия, раздражительность, панические атаки, расстройство сна.
Нарушения менструального цикла (редкие, скудные менструации или их отсутствие) встречается у 70-80% пациенток, также довольно часто встречается бесплодие. У мужчин при БИК снижается половое влечение и возникает эректильная дисфункция.
Болезнь Иценко — Кушинга сопровождается иммунодефицитом, который проявляется в виде рецидивирующей инфекции (чаще всего возникает хронический пиелонефрит).
Частота клинических проявлений БИК: [3]
- лунообразное лицо — 90%;
- нарушенная толерантность к глюкозе — 85%;
- абдоминальный тип ожирения и гипертензия — 80%;
- гипогонадизм (недостаток тестостерона) — 75%;
- гирсутизм — 70%;
- остеопороз и мышечная слабость — 65%;
- стрии — 60%;
- отёк суставов, акне и отложение жира в области VII шейного позвонка — 55%;
- боли в спине — 50%;
- нарушения психики — 45%;
- ухудшение заживления ран — 35%;
- полиурия (избыточное мочеобразование), полидипсия (чрезмерная жажда) — 30%;
- кифоз (искривление позвоночника) — 25%; и полицитемия (увеличение концентрации эритроцитов в крови) — 20%.
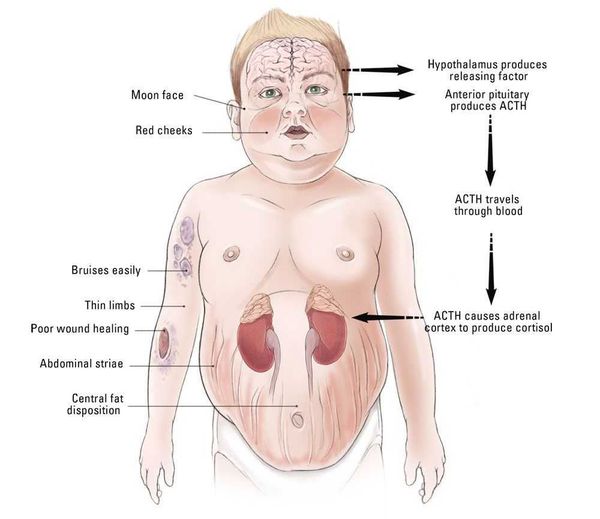
Патогенез болезни Иценко — Кушинга
Патогенез данного заболевания носит многоступенчатый характер.
В кортикотрофах гипофиза возникают характерные рецепторно-пострецепторные дефекты, в дальнейшем приводящие к трансформации нормальных кортикотрофов в опухолевые с гиперпродукцией адрено-кортикотропного гормона и последующим развитием гиперкортицизма. [4]
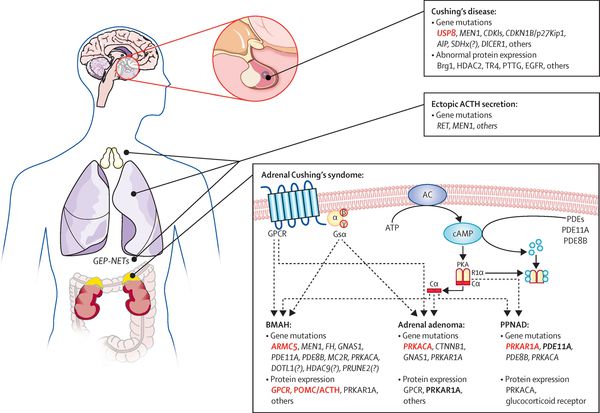
На трансформацию нормальных кортикотрофов в опухолевые влияют гормоны гипоталамуса и местные ростовые факторы:
- эпидермальный фактор роста (стимулирует рост клеток эпителия);
- цитокины (отвечают за межклеточное взаимодействие);
- грелин (нарушает углеводный обмен); [14]
- сосудистый эндотелиальный фактор роста (способствует росту клеток эндотелия).
Хронически повышенная концентрация АКТГ приводит к повышенной секреции кортизола, который и обуславливает характерную клиническую картину БИК.
Классификация и стадии развития болезни Иценко — Кушинга
Классификация БИК по степени тяжести: [5]
- лёгкая форма — симптомы выражены в умеренной степени;
- средняя форма — симптомы явно выражены, осложнения отсутствуют;
- тяжёлая форма — при наличии всех симптомов БИК возникают различные осложнения.
Классификация БИК по течению:
- торпидное (патологические изменения формируются постепенно, на протяжении 3-10 лет);
- прогрессирующее (нарастание симптомов и осложнений заболевания происходит в течение 6-12 месяцев от начала заболевания);
- циклическое (клинические проявления возникают периодически, непостоянно).
Осложнения болезни Иценко — Кушинга
- Сосудистая исердечная недостаточность. Данное осложнение развивается у половины пациентов после 40 лет. Данная патология может привести к смерти. В большинстве случаев это происходит по причине тромбоэмболии лёгочной артерии, острой сердечной недостаточности и отёка легких.
- Патологические остеопоретические переломы. Наиболее часто встречаются переломы позвоночника, рёбер, трубчатых костей.
- Хроническая почечная недостаточность. У 25-30% больных снижается клубочковая фильтрация и канальцевая реабсорбция (обратное поглощение жидкости).
- Стероидный сахарный диабет. Данное осложнение наблюдается у 10-15% пациентов с данным заболеванием.
- Атрофия мыщц, в результате которой появляется выраженная слабость. У больных возникают трудности не только при передвижении, но и в момент вставания.
- Нарушения зрения (катаракта, экзофтальм, нарушение полей зрения).
- Психические расстройства. Наиболее часто встречается бессонница, депрессия, панические атаки, параноидальные состояния, истерия.
Диагностика болезни Иценко — Кушинга
Диагноз «Болезнь Иценко — Кушинга» можно установить на основании характерных жалоб, клинических проявлений, гормонально-биохимических изменений и данных инструментальных исследований.
Исключительно важными гормональными показателями для данной патологии будут АКТГ и кортизол. Уровень АКТГ повышается и колеблется в пределах от 80 до 150 пг/мл. [7] Повышение уровня кортизола в крови не всегда является информативным, так как увеличение данного показателя может быть обусловлено рядом других причин (стрессы, алкоголизм, беременность, эндогенная депрессия, семейная резистентность (споротивляемость) к глюкокортикоидам и т. д.). В связи с этим разработаны методы исследования уровня свободного кортизола в суточной моче или слюне. Наиболее информативным является исследование свободного кортизола в слюне в 23:00. [6]
Для доказательства гиперкортицизма используется малый дексаметазоновый тест. При БИК данная проба будет отрицательной, так как подавление кортизола при приёме 1 мг дексаметазона не происходит. [7]
Биохимический анализ крови способен выявить многочиселнные измения:
- повышение в сыворотке крови уровня холестерина, хлора, натрия и глобулинов;
- снижение в крови концентрации калия, фосфатов и альбуминов;
- снижение активности щелочной фосфатазы.
После подтверждённого гиперкортицизма необходимо проведение инструментальных методов исследования (МРТ гипофиза, КТ надпочечников).
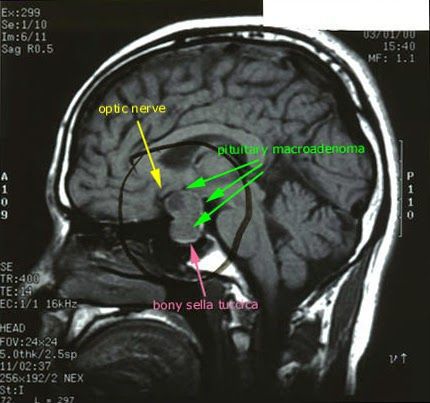
При БИК в 80-85% случаев выявляют микроаденому гипофиза (опухоль до 10 мм), у остальных 15-20% — макроаденому (доброкачественное новообразование от 10 мм). [7]
Лечение болезни Иценко — Кушинга
Медикаментозная терапия
В настоящее время эффективных лекарственных препаратов для лечения данной патологии не существует. В связи этим они используются либо при наличии противопоказаний для оперативного лечения, либо как вспомогательная терапия. Применяются следующие медикаменты:
- нейромодуляторы — блокируют образование АКТГ аденомой гипофиза (каберголин, бромкриптин, соматостатин); [8]
- препараты, блокирующие синтез стероидов в надпочечниках (кетоконазол, аминоглютетимид, митотан, метирапон);
- антагонисты глюкокортикоидов (мифепристон). [9]
Кроме препаратов данных групп пациентам назначается симптоматическая терапия для снижения симптомов гиперкортицизма и улучшения качества жизни пациента:
- гипотензивная терапия (ингибиторы АПФ, антагонисты кальция, диуретики, бета-адреноблокаторы);
- антирезорбтивная терапия при развитии стероидного остеопороза;
- препараты, корректирующие нарушения углеводного обмена (метформин, препараты сульфанилмочевины, инсулин);
- терапия, направленная на коррекцию дислипидемии;
- антиангинальная терапия.
Оперативная терапия
- Транссфеноидальная аденомэктомия в настоящее время считается наиболее эффективным и безопасным способом лечения БИК. [7] Противопоказаниями для данного вида лечения служат супраселлярный рост аденомы с прорастанием в боковые желудочки, тяжёлые сопутствующие заболевания, определяющие общий плохой послеоперационный прогноз. К осложнениям транссфеноидальной аденомэктомии относятся: ликворея (потеря спиномозговой жидкости), пансинусит (воспаление всех пазух носовой полости), несахарный диабет, приходящий гипокортицизм.
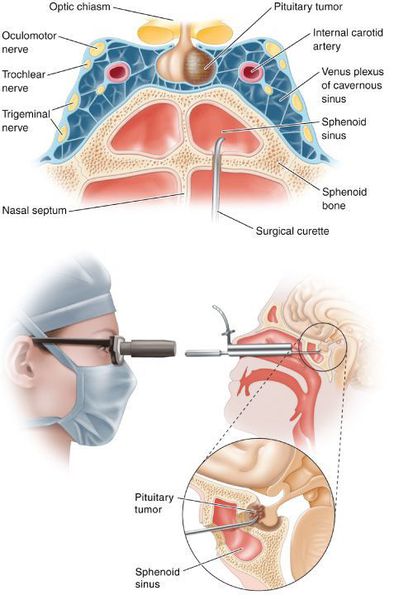
- Двусторонняя адреналэктомия используется при неэффективности аденомэктомии и радиохирургии. [10]
Радиохирургия
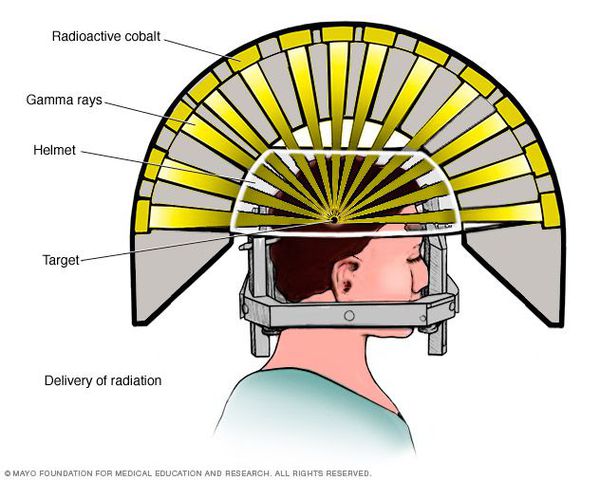
- Операция с помощью гамма-ножа. Во время проведения хирургического вмешательства луч радиации, направленный непосредственно в аденому гипофиза, разрушает её клетки. Данный метод лечения предотвращает рост опухоли при помощи однократной дозы радиации. Процедура длится около двух-трёх часов. Она не затрагивает окружающие структуры мозга, производится с точностью до 0,5 мм. Осложнения данной терапии — гиперемия (увеличение притока крови) в зоне облучения, алопеция (выпадение волос).
- Протонотерапия. [11] Данный вид лечения использует протонную энергию, которая генерируется в ядерных ускорителях. Протоны повреждают ДНК клеток, вследствие чего они погибают. Протоновый пучок фокусируют непосредственно на аденому, не повреждая окружающие ткани. Голова пациента фиксируется в специальной маске, которая изготавливается для каждого индивидуально. Во время процедуры облучения врач контролирует состояние больного, а операторы дистанционно наблюдают за пучком. Данный вид лечения обычно хорошо переносится пациентами. Улучшение самочувствия наблюдается уже через 1-1,5 месяца.
- Мегавольтное тормозное излучение медицинских ускорителей позволяет проникать электронам на большие расстояния. Данный вид терапии часто даёт хорошие результаты, но, одновременно с этим, усложняет дозиметрию (расчёты ионизирующих излучений), что может привести к опасным радиационным авариям.
Прогноз. Профилактика
Прогноз БИК зависит от нескольких показателей: формы и длительности заболевания, наличия осложнений, состояния иммунитета и других факторов.
Полное выздоровление и восстановление трудоспособности возможно при лёгкой форме болезни и небольшом стаже заболевания.
При средней и тяжёлой формах БИК трудоспособность крайне снижена или отсутствует. После проведённой двусторонней адреналэктомии развивается хроническая надпочечниковая недостаточность, которая диктует пожизненный приём глюко- и минералкортикоидов.
В целом любое лечение, как правило, приводит к улучшению качества жизни больного, однако она остаётся ниже, чем у лиц без данной патологии.
Болезнь Иценко — Кушинга — тяжёлое хроническое заболевание, которое при отсутствии своевременного лечения может стать причиной летального исхода. Смертность при данной патологии составляет 0,7%.
Пятилетняя выживаемость при БИК без проведения лечения составляет 50%, но заметно улучшается даже если проводить только паллиативное лечение (при двухсторонней адреналэктомии выживаемость увеличивается до 86%). [13]
Первичной профилактики БИК не существует. Вторичная профилактика заболевания направлена на предотвращение рецидива болезни.
Для цитирования: Древаль А.В. Синдром Иценко – Кушинга (лекция). РМЖ. Медицинское обозрение. 2016;24(1):2-5.
Лекция посвящена внегипофизарным болезням, вызывающим гиперсекрецию глюкокортикоидов надпочечниками
Для цитирования. Древаль А.В. Синдром Иценко – Кушинга (лекция) // РМЖ. 2016. No 1. С. 2–5.
Клинический синдром, который развивается вследствие повышенного содержания глюкокортикоидов в крови, называют синдромом Иценко – Кушинга.
Эндогенный синдром Иценко – Кушинга развивается при аденоме или карциноме коры надпочечников, а также на фоне гиперпродукции адренокортикотропного гормона (АКТГ) опухолью гипофиза или АКТГ-секретирующей опухолью, локализованной вне гипофиза (эктопический АКТГ-синдром), и очень редко при эктопической секреции опухолью кортикотропин-рилизинг-гормона (КРГ).
Ятрогенный (экзогенный) синдром Иценко – Кушинга — частое осложнение терапии глюкокортикоидами, когда их используют как противовоспалительные или иммуносупрессивные средства.
Перечень патологических состояний, при которых продукция глюкокортикоидов повышена, представлен в таблице 1. Следует заметить, что кроме указанных в таблице болезней описан и ряд очень редких генетически детерминированных заболеваний, при которых развивается синдром Иценко – Кушинга.
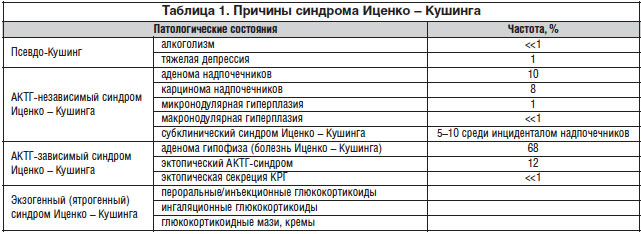
В данной лекции рассмотрим внегипофизарные болезни, вызывающие гиперсекрецию глюкокортикоидов надпочечниками.
Доброкачественная адренокортикальная аденома
Доброкачественная адренокортикальная аденома обычно инкапсулирована, ее размер – менее 4 см в диаметре. Чаще всего она секретирует только глюкокортикоиды.
Лечение хирургическое — односторонняя адренал-эктомия, которую обычно выполняют лапароскопически. В послеоперационном периоде может развиваться надпочечниковая недостаточность. Это следствие атрофии неудаленного надпочечника из-за подавленной секреции АКТГ на фоне гиперпродукции кортизола аденомой. Длительность заместительной терапии глюкокортикоидами может составлять 2 года.
Прогноз после операции благоприятный, вероятность рецидива низкая.
Адренокортикальная карцинома
Адренокортикальная карцинома обычно более 6 см в диаметре, хотя бывают опухоли и меньшего размера. Нередко на момент выявления обнаруживают локальную инвазию опухоли, возможны метастазы. Чаще всего злокачественная опухоль продуцирует несколько гормонов. Наиболее типичная комбинация — кортизол и андрогены (предшественники), реже – минералокортикоиды или эстрогены.
Лечение карциномы надпочечников необходимо проводить в специализированных центрах, где есть хирурги, онкологи и эндокринологи, имеющие достаточный опыт лечения такого рода больных.
Главным методом лечения служит хирургическое удаление опухоли. После операции может понадобиться заместительная терапия. В случае неполного удаления опухоли и/или метастазов назначают препараты, подавляющие секрецию глюкокортикоидов (метирапон, кетоконазол и др.).
Прогноз неблагоприятный. Несмотря на оперативное лечение, 5-летняя выживаемость составляет 22%, а медиана выживаемости — 14 мес. Если больной получает лечение в специализированных центрах, показатели выживаемости оказываются лучше вследствие комплексного лечения, назначаемого онкологами и эндокринологами.
Синдром Иценко – Кушинга, вызванный эктопическим синтезом АКТГ (эктопический АКТГ-синдром)
Эктопический АКТГ-синдром вызывается в 50% случаев злокачественной мелкоклеточной опухолью легкого. Этот синдром может быть и проявлением нейроэндокринных опухолей, которые локализованы в тимусе (15%), поджелудочной железе (10%) или бронхе (10%). Эктопическая продукция КРГ встречается крайне редко.
Отличительные особенности эктопического АКТГ-синдрома:
•Очень высокий уровень кортизола.
•Доминируют клинические проявления артериальной гипертензии, гипокалиемии и метаболического алкалоза, что обусловлено стимуляцией минералокортикоидных рецепторов высоким уровнем кортизола.
•Нет абдоминального ожирения, если злокачественная опухоль быстро прогрессирует, вызывая кахексию.
•Наблюдаются другие симптомы гиперкортизолизма, в частности нарушение толерантности к глюкозе, склонность к инфекциям, тонкая кожа, плохое заживление ран, психические нарушения и др.
•Возможна выраженная гиперпигментация вследствие совместной с АКТГ гиперпродукции проопиомеланокортина, обладающего биологической активностью меланоцит-стимулирующего гормона.
•Уровень АКТГ может быть очень высоким (обычно более 100 пг/мл).
•В 90% случаев в большом дексаметазоновом тесте (2 мг 4 р./сут) содержание кортизола не снижается более чем на 50% от базального уровня, т. к. в опухоли нарушен механизм саморегуляции секреции АКТГ.
•В случае нейроэндокринной опухоли клиническая картина и результаты диагностических тестов могут быть неотличимы от таковых при болезни Иценко – Кушинга (гиперпродукции АКТГ гипофизом), что требует для дифференциальной диагностики проведения селективного забора крови на АКТГ, оттекающей от гипофиза.
•У некоторых больных, несмотря на выраженную клиническую картину гиперкортизолизма, опухоль может быть очень небольших размеров (несколько миллиметров в диаметре), что делает невозможной ее локализацию. В этом случае назначают консервативное лечение гиперкортизолизма, а при очень выраженной клинической картине проводят двустороннюю адренал-эктомию. После устранения симптомов гиперкортизолизма у больного регулярно исследуют потенциально наиболее вероятные зоны локализации опухоли до тех пор, пока она не станет очевидной — тогда ее удаляют.
Лечение заключается в удалении АКТГ-продуцирующей опухоли, где это возможно. В противном случае назначаются препараты, блокирующие продукцию глюкокортикоидов (кетоконазол, например). Если удалить опухоль по тем или иным причинам невозможно, а общее тяжелое состояние больного определяется только гиперкортизолизмом, который трудно контролируется, удаляют надпочечники.
АКТГ-независимая двусторонняя макронодулярная гиперплазия надпочечников
Это редкий эктопический синдром Иценко – Кушинга, который чаще бывает спорадическим, реже – семейным. Наиболее частая причина — эктопический синтез в надпочечниках рецепторов гастроинтестинального полипептида. Секреция этого полипептида клетками желудочно-кишечного тракта повышается после приема пищи, что стимулирует секрецию глюкокортикоидов в надпочечниках, т. е. развивается связанный с приемом пищи гиперкортизолизм. Могут эктопически синтезироваться в надпочечниках и другие рецепторы — к лютеинизирующему гормону или β-адренергические.
Комплекс Карнея
Диагноз «комплекс Карнея» (генетически детерминированная болезнь, аутосомно-доминантная) устанавливают в том случае, когда обнаруживают не менее 2 из нижеперечисленных клинических признаков:
– участки пигментации кожи;
– миксомы сердца, кожи или мукозные;
– чаще всего первичная пигментная узловая гиперплазия надпочечников (может быть как микро-, так и макроузловая), сопровождаемая гиперпродукцией глюкокортикоидов (синдром Иценко – Кушинга);
– СТГ/пролактин-секретирующая опухоль гипофиза, а также гиперплазия соматотрофов/пролактотрофов;
– аденома щитовидной железы;
– псаммоматозная меланотическая шваннома.
Синдром Мак-Кьюна – Олбрайта
Редкая болезнь (частота от 1:100 000 до 1:1000000), генетически обусловленная, но не наследственная, т. к. возникает вследствие постзиготной соматической мутации, что проявляется мозаицизмом. Возможна генетическая диагностика мутации, выявляемой в пораженных тканях или клетках крови.
Диагноз устанавливают, если присутствуют 2 из 3нижеперечисленных признаков.
– появление кист в костях нижних и верхних конечностей, таза, грудной клетки, с чем связаны самопроизвольные переломы с вовлечением нервных стволов и появлением на месте перелома очагов гипертрофии костей;
– чаще всего страдают бедренная кость и кости таза, и эту особенность можно использовать для скрининговой диагностики болезни;
– остеосаркома возникает редко;
– поражение костей проявляется обычно до 10-летнего возраста.
•Пигментация отдельных участков кожи:
– появляются бурые пятна на задней поверхности шеи, спине, в области поясницы и бедер величиной от маленькой родинки до больших пятен;
– контуры пигментации неровные, не пересекают средней линии тела;
– локализованы обычно на стороне поражения костей;
– степень пигментации часто соответствует величине поражения скелета.
– синдром Иценко – Кушинга (гиперплазия надпочечников или аденома);
– преждевременное половое созревание;
– узлы в щитовидной железе;
– СТГ-секретирующая опухоль гипофиза и пролактинома;
Кроме указанных выше диагностически значимых поражений, также возможны:
– кардиомегалия, тахиаритмия, внезапная кардиальная смерть;
– поражение гепатобилиарной системы;
– микроцефалия, задержка психического развития.
Субклинический синдром Иценко – Кушинга
Дать определение субклинического синдрома Иценко – Кушинга несложно: патологическое состояние, при котором, несмотря на повышенную секрецию кортизола, нет характерного (специфического) симптомокомплекса (стрии, центрипетальное ожирение, лунообразное лицо, плетора и др.). Однако это определение не годится для реальной практической работы клинициста-эндокринолога, т. к. оно неконструктивно, т. е. нет явных указаний, в каких клинических ситуациях следует использовать это понятие как диагноз. В связи с этим уточним определение. Сначала ответим на вопрос, который возникает в первую очередь: какие диагностические тесты и алгоритмы следует использовать для диагностики субклинического гиперкортицизма? Ответ: те же, что и для диагностики манифестного гиперкортицизма! При этом эти тесты обычно разбиваются на 2группы: скрининговые (предварительные) и верифицирующие (позволяющие с более высокой надежностью установить диагноз гиперкортизолизма, чем скрининговые).
К скрининговым (стартовым) диагностическим тестам чаще всего относят следующие:
– исследование кортизола в суточной моче (проводится двукратно для верификации гиперкортизолизма, если не сочетается с другим тестом);
– малый ночной (1 мг) дексаметазоновый тест (проводится однократно);
– кортизол слюны в полночь (проводится двукратно, если не сочетается с другим тестом);
Ключевым моментом в диагностике субклинического гиперкортизолизма является существенное ограничение группы обследования только больными, у которых выявлена инциденталома надпочечников. То есть поводом для обследования с целью выявления субклинического гиперкортизолизма может быть только выявленная у больного опухоль надпочечника, причем абсолютно случайно, а не в связи с симптомами гиперкортизолизма. Следовательно, в клинической практике диагноз «субклинический гиперкортизолизм» может быть установлен только у больного с инциденталомой. В результате спектр больных с субклиническим синдромом Иценко – Кушинга сужается до АКТГ-независимых случаев, а фактически ограничивается только аденомой надпочеников. Этот подход позволяет существенно повысить выявляемость субклинического гиперкортицизма, что сохраняет финансовые ресурсы здравоохранения или больного. Однако вместе с тем из поля зрения клиницистов выпадают пациенты с субклиническим течением болезни Иценко – Кушинга, например.
Другие исследователи указанный комплекс результатов обследования (инциденталома + скрининговые тесты) полагают недостаточным, чтобы быть абсолютно уверенным в диагнозе «субклинический синдром Иценко – Кушинга», и тогда больному назначают более надежные с точки зрения клинициста-исследователя верифицирующие тесты диагностики гиперкортизолизма.
В этом случае диагноз субклинического гиперкортизолизма сохраняется до тех пор, пока не будут получены результаты верифицирующих тестов. Если и с их помощью диагноз эндогенного гиперкортизолизма подтверждается, тогда диагноз субклинического синдрома Иценко – Кушинга считают доказанным.
В результате дополнительного обследования у части больных в этих тестах диагноз гиперкортизолизма может не подтвердиться, тогда диагноз субклинического гиперкортизолизма пересматривают, и скрининговые (стартовые) тесты интерпретируют с точки зрения неэндокринной патологии. К примеру, лабораторная ошибка, связанная с недостаточной надежностью скрининговых тестов, или наличие у больного депрессии, при которой секреция кортизола в дексаметазоновом тесте часто не подавляется, и т. п. Очевидно, что в этих случаях ранее поставленный предположительный диагноз субклинического гиперкортизолизма снимают.
Выше был представлен алгоритм обследования больного на субклинический гиперкортизолизм в клинической практике, где ключевым или стартовым поводом для обследования была выявленная инциденталома надпочечника.
Вместе с тем в научных исследованиях может быть поставлена задача выявления субклинического гиперкортицизма в других, кроме пациентов с инциденталомой, группах риска, например среди больных сахарным диабетом, который с высокой частотой сопровождает гиперкортизолизм. В этом случае именно сахарный диабет становится поводом для начала обследования на гиперкортизолизм, и точно так же, как в случае инциденталом, стартовый набор тестов, в котором дифференцируется истинный гиперкортизолизм от функционального, остается тем же. Следует заметить, что при таком подходе появляется возможность выявления не только АКТГ-независимого варианта субклинического синдрома Иценко – Кушинга, но и АКТГ-зависимого, т. е. спектр субклинических синдромов Иценко – Кушинга расширяется. Следовательно, в отличие от случая инциденталом, после подтверждения истинного гиперкортизолизма далее следует уточнять локализацию процесса путем визуализации надпочечников (синдром Иценко – Кушинга) и исследования АКТГ в крови (дифференциальная диагностика АКТГ-зависимого и АКТГ-независимого синдрома Иценко – Кушинга).
Дифференциальная диагностика синдрома Иценко – Кушинга
Первый этап диагностического поиска
Заключается в диагностировании эндогенного гиперкортизолизма. Однако следует заметить, что до сих пор общепринятого набора тестов для диагностики гипекортизолизма нет, и в разных клинических центрах он может существенно различаться. В таблице 2 приведены перечень тестов, которые используют для скрининга при подозрении на синдром Иценко – Кушинга, и их диагностическая значимость.
Второй этап диагностического поиска
К нему приступают после того, как диагностирован эндогенный гиперкортизолизм (синдром Иценко – Кушинга). Этот этап заключается в поиске причины гиперпродукции кортизола надпочечниками, а фактически в определении локализации патологического процесса, с которым связана гиперсекреция кортизола. С одной стороны, очевидно, что только надпочечник может продуцировать кортизол. С другой стороны, синтез кортизола надпочечниками управляется АКТГ, который может вырабатываться как в гипофизе, так и вне его (эктопически). В итоге получаем три точки возможной локализации: надпочечник (опухоль и/или гиперплазия), гипофиз (аденома) или эктопическая секреция опухолью (обычно легкие), что и составляет предмет дифференциальной диагностики второго этапа. Тесты для определения АКТГ-зависимого гиперкортизолизма представлены в таблице 3.
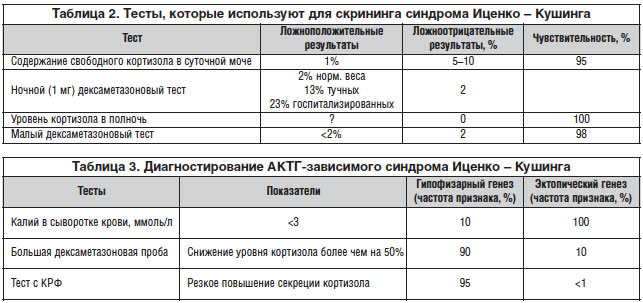
•У больных с подтвержденным на первом этапе диагностики синдромом Иценко – Кушинга определяют базальный уровень АКТГ в сыворотке крови, чтобы с помощью этого исследования дифференцировать АКТГ-зависимый синдром Иценко – Кушинга (уровень АКТГ повышен) от АКТГ-независимого (содержание АКТГ снижено). Уровень АКТГ >4 пмоль/л — показатель АКТГ-зависимого синдрома Иценко – Кушинга.
•По уровню АКТГ дифференцировать гипофизарную гиперсекрецию АКТГ от эктопической практически невозможно, хотя при эктопической секреции содержание АКТГ несколько выше.
•Большую дексаметазоновую пробу проводят по такой же схеме, как и малую, но доза гораздо выше.
◊ 2 мг дексаметазона принимаются каждые 6 ч (120мкг/кг/сут) в течение 2 дней, начиная с 9:00.
◊ Уровень кортизола исследуют натощак в день начала пробы до приема дексаметазона и затем через 48ч.
◊ При болезни Иценко – Кушинга уровень кортизола через 48 ч снижается более чем на 50% по сравнению с исходом, в меньшей степени — при эктопическом синдроме Иценко – Кушинга. Однако следует заметить, что у 10% пациентов с болезнью Иценко – Кушинга уровень кортизола не снижается более чем на 50%.
◊ Внутривенно вводят 100 мкг КРГ.
◊ Кровь на кортизол берут натощак за 15 мин и 0мин до введения КРГ, а затем каждые 15 мин в течение 2ч.
◊ У больных с гипофизарной секрецией АКТГ уровень кортизола уже повышается через 15 мин и достигает максимума на 30-й мин теста (повышение на 14–20%), снижаясь до исходого уровня через 60 мин. Аналогично повышается и концентрация АКТГ (на 35–50%).
◊ У больных с эктопической продукцией АКТГ уровни кортизола и АКТГ не реагируют на введение КРГ.
•Забор крови из нижнего каменистого (петрозного) синуса.
◊ Этот тест желательно проводить со стимуляторами секреции АКТГ (например, с кортикотропин-рилизинг-фактором (КРФ)).
◊ Уровень АКТГ в оттекающей от гипофиза крови по сравнению с периферическим в 2 раза выше, если именно в гипофизе продукция АКТГ повышена, и такой разницы нет в случае АКТГ-эктопического синдрома.
◊ При МРТ в сочетании с контрастированием гипофиза (гадолиний) аденома выявляется в 80% случаев.
◊ Однако следует иметь в виду, что аденома гипофиза выявляется у 10% лиц без нарушения функции гипофиза, поэтому биохимические исследования гормонов имеют решающее значение.
◊ В случае подозрения на АКТГ-независимый синдром Иценко – Кушинга при МРТ/КТ в надпочечниках можно выявить характерные морфологические изменения.
Третий этап диагностического поиска
После того как локализован первичный патологический процесс, вызвавший гиперпродукцию кортизола, исследуют его природу, что и представляет собой третий, завершающий этап диагностического поиска. Обычно окончательно диагноз уточняют при морфологическом изучении операционного материала, а в некоторых случаях необходимо также и генетическое обследование больного и его родственников.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Категории МКБ: Аддисонов криз (E27.2), Болезнь надпочечников неуточненная (E27.9), Другая и неуточненная недостаточность коры надпочечников (E27.4), Другие уточненные нарушения надпочечников (E27.8), Первичная недостаточность коры надпочечников (E27.1)
Общая информация
Краткое описание
Первичная надпочечниковая недостаточность
Возрастная категория: дети
Год утверждения: 2016 (пересмотр каждые 5 лет)
Надпочечниковая недостаточность (НН) – синдром, обусловленный дефицитом синтеза и секреции кортизола в коре надпочечников.

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 800 RUB / 4500 KZT / 27 BYN - 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место - 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
Классификация
В зависимости от уровня поражения в системе гипоталамус-гипофиз-надпочечники, НН бывает первичной, которая обусловлена патологией самих надпочечников, и центральной - вторичной (связанной со сниженной секрецией адренокортикотропного гомона (АКТГ) гипофиза) или третичной (связанной с нарушением секреции кортикотропин-рилизинг-гормона (КРГ) в гипоталамусе).
Этиология и патогенез
В большинстве случаев (но не во всех) дефицит глюкокортикоидов (кортизола) сочетается с дефицитом минералокортикоидов (альдостерона). При отсутствии заместительной терапии надпочечниковая недостаточность является смертельно опасным заболеванием. Пациент, страдающий хронической первичной надпочечниковой недостаточностью (ПНН), нуждается в постоянной заместительной терапии глюкокортикоидами (и, в большинстве случаев, минералокорикоидами).
Хроническая ПНН – этиологически гетерогенное заболевание. Поражение надпочечников может развиваться в результате воздействия внешних факторов – кровоизлияние (чаще у детей до 1 года), инфекционное (туберкулез), опухолевое (лимфома, метастазы), адреналэктомия (при опухолях надпочечников, болезни Кушинга). У детей чаще причиной ПНН является одно из наследственных заболеваний, сопровождающихся нарушением эмбриогенеза, деструкции надпочечников или дефектами стероидогенеза
Таблица 1. Этиология ПНН
Клиническая картина
Cимптомы, течение
Недостаточность глюкокортикоидов (кортизола) проявляется слабостью, быстрой утомляемостью, снижением аппетита и потерей веса, обмороками, судорогами с потерей сознания. Судорожный синдром обусловлен низким уровнем глюкозы в крови (гипогликекмией), чаще развивается после длительного ночного перерыва в приемах пищи.
Недостаточность минералокортикоидов (альдостерона) проявляется тошнотой, повышенной потребности в соли, рвотой, повторной и не приносящей облегчения, приводящей к обезвоживанию, что принято называть «сольтеряющими кризами». Симптомы обычно резко усиливаются на фоне других заболеваний, высокой температуры, стрессовых ситуаций.
Почти все симптомы дефицита кортизола и альдостерона являются неспецифичными, то есть могут быть признаком заболеваний других органов и систем (желудочно-кишечного тракта, центральной нервной системы и др).
Наиболее специфическими проявлениями первичной надпочечниковой недостаточности являются гиперпигментации кожи и /или слизистых и повышенная потребность в соли. Часто окружающие впервые замечают гиперпигментацию на открытых участках тела (лицо, кисти рук). Максимальные проявления гиперпигментации отмечаются на коже наружных половых органов, подмышечных областей, коленей, локтей, а также пигментируются соски, пупок, перианальная область и рубцы на месте повреждения кожи. Участки гиперпигментации могут быть на слизистых оболочках полости рта.
При центральных формах гипокортицизма никогда не бывает гиперпигментаций, т.к. уровень АКТГ всегда низкий. Для вторичной и третичной надпочечниковой недостаточности не характерен дефицит минералокортикоидов (альдостерона), следовательно, симптомов потери соли у таких пациентов не будет. Остальные клинические признаки являются общими для первичной, вторичной и третичной надпочечниковой недостаточности.

- Анализы
- Беременность и роды
- Беременность обзор
- Бесплодие и репродуктивный статус
- Бессонница и расстройства сна
- Болезни желудочно-кишечного тракта
- Болезни легких и органов дыхания
- Болезни органов кровообращения
- Болезни щитовидной железы
- Боль в спине
- Восстановительная медицина
- Генитальный герпес
- Гинекология
- Головная боль
- Грипп
- Депрессия
- Детская онкология
- Детские болезни
- Детское развитие
- Заболевания молочных желез
- Здоровое питание. Диеты
- Здоровье и душевное равновесие
- Из истории болезни
- Иммунология
- Импотенция (эректильная дисфункция)
- Инфекции передаваемые половым путем
- Кардиология
- Кровеносная и лимфатическая система
- Лейкемии
- Лечение рака
- Лимфогранулематоз
- Маммология
- Медицина в спорте
- Менопауза
- Микробиология, вирусология
- Педиатрия (детские болезни)
- Проблемная кожа
- Путь к себе
- Рак желудка
- Рак молочной железы (рак груди)
- Рак ободочной, прямой кишки и анального канала
- Рак предстательной железы (рак простаты)
- Рак тела матки
- Рак шейки матки
- Рак яичников
- Сахарный диабет
- Сексология и психотерапия
- Сексуальная жизнь
- Современная контрацепция
- Урология
- Уход за кожей
- Факты о здоровом старении
- Химиoтерапия
- Школа здоровья
- Эндокринология
| Надпочечниковая недостаточность (гипокортицизм) |
| Автор: http://www.eurolab.ua/ |
| 23 Февраля 2011 |
|
Надпочечниковая недостаточность (недостаточность коры надпочечников, гипокортицизм) - клинический синдром, обусловленный недостаточной секрецией гормонов коры надпочечника в результате нарушения функционирования одного или нескольких звеньев гипоталамо-гипофизарно-надпочечниковой системы. Надпочечниковая недостаточность подразделяется на первичную, являющуюся результатом деструкции самой коры надпочечников, и вторичную (гипоталамо-гипофизарную), возникающую вследствие недостаточности секреции АКТГ аденогипофизом. В клинической практике наиболее часто встречается первичная хроническая надпочечниковая недостаточность (95 % случаев). Заболевание, обусловленное деструктивным процессом в надпочечниках, впервые было описано в 1855 г. английским врачом Томасом Аддисоном (1793-1860). Первичный гипокортицизм аутоиммунной и туберкулезной этиологии обозначается как болезнь Аддисона. Основными причинами первичной хронической надпочечниковой недостаточности являются: Аутоиммунное разрушение коры надпочечников (98 % случаев). В крови большинства пациентов обнаруживаются антитела к ферменту 21-гидроксилазе (Р450с21). Кроме того, у 60-70 % пациентов развиваются другие аутоиммунные заболевания, чаще всего, аутоиммунный тиреоидит. Адренолейкодистрофия (1-2 %) - Х-сцепленное рецессивное заболевание, при котором наследуется дефект ферментных систем, осуществляющих обмен длинноцепочечных жирных кислот, в результате происходит их аккумуляция в белом веществе ЦНС и коре надпочечников, приводящая к дистрофическим изменениям. Редкие причины (коагулопатии, дусторонний геморрагический инфаркт надпочечников (синдром Уотерхауса-Фридериксена) метастазы опухолей, двусторонняя адреналэктомия, ВИЧ-ассоциированный комплекс. Основными причинами вторичного гипокортицизма являются различные опухолевые и деструктивные процессы в гипоталамо-гипофизарной области. Острая надпочечниковая недостаточность (аддисонический криз), в подавляющем большинстве случаев, имеет те же причины, что и хроническая и представляет собой ее декомпенсацию. При первичном гипокортицизме в результате разрушения более 90% коры обоих надпочечников формируется дефицит альдостерона и кортизола. Дефицит альдостерона приводит к потере натрия задержке калия (гиперкалиемия) и прогрессирующему обезвоживанию. Следствием водных и электролитных расстройств являются изменения со стороны сердечно-сосудистой и пищеварительной систем. Дефицит кортизола приводит к снижению адаптивных возможностей организма, снижению процессов глюконеогенеза и синтеза гликогена. В связи с этим первичная хроническая надпочечниковая недостаточность манифестирует на фоне различных физиологических стрессов (инфекции, травмы, декомпенсация сопутствующей патологии). Дефицит кортизола по механизму отрицательной обратной связи приводит к повышению продукции АКТГ и его предшественника проопиомеланокортина. В результате протеолиза проопиомеланокортина кроме АКТГ образуется и меланоцит-стимулирующий гормон. Таким образом, при первичном гипокортицизме параллельно избытку АКТГ формируется избыток меланоцит-стимулирующпго гормона, который и обуславливает наиболее яркий симптом первичной хронической надпочечниковой недостаточности - гиперпигментацию кожи и слизистых. В связи с тем, что продукция альдостерона корой надпочечников происходит практически независимо от эффектов АКТГ, при вторичном гипокортицизме вследствие недостатка АКТГ развивается дефицит одного только кортизола, а продукция альдостерона сохраняется. Именно это определяет тот факт, что вторичный гипокортицизм имеет относительно более легкое течение по сравнению с первичным. Клинические проявления Основными клиническими симптомами первичного гипокортицизма (болезни Аддисона) являются: Гиперпигментация кожи и слизистых. Выраженность гиперпигментации соответствует тяжести и давности процесса. Вначале темнеют открытые части тела, наиболее подверженные действию солнца, - лицо, шея, руки, а также места, которые и в норме более сильно пигментированы (соски, мошонка, наружные половые органы). Большую диагностическую ценность имеет гиперпигментация мест трения и видимых слизистых оболочек. Характерны гиперпигментация ладонных линий, которые выделяются на относительно светлом фоне окружающей ткани, потемнение мест трения одеждой, воротником, поясом. Оттенок кожи может варьировать от дымчатого, бронзового (бронзовая болезнь), цвета загара, грязной кожи, вплоть до выраженной диффузной гиперпигментации. Достаточно специфична, но не всегда выражена гиперпигментация слизистых оболочек губ, десен, щек, мягкого и твердого неба. Отсутствие меланодермии является достаточно серьезным доводом против диагноза первичной хронической надпочечниковой недостаточности, тем не менее встречаются случаи так называемого «белого аддисонизма», когда гиперпигментация почти отсутствует. На фоне гиперпигментации у больных часто обнаруживаются беспигментные пятна (витилиго). Размер их колеблется от мелких, едва заметных, до крупных, с неправильными контурами, ярко выделяющихся на общем темном фоне. Витилиго характерно исключительно для первичной хронической надпочечниковой недостаточности аутоиммунного генеза. Похудение. Его выраженность колеблется от умеренного (3-6 кг) до значительного (15-25 кг), особенно при исходно избыточной массе тела. Общая слабость, астения, депрессия, снижение либидо. Общая слабость прогрессирует от легкой, до полной потери работоспособности. Пациенты подавлены, вялы, неэмоциональны, раздражительны, у половины из них диагностируются депрессивные расстройства. Артериальная гипотензия вначале может иметь только ортостатиеский характер; пациенты часто сообщают об обморочных состояниях, которые провоцируются различными стрессами. Обнаружение у пациента артериальной гипертензии - веский довод против диагноза надпочечниковой недостаточности, хотя, если первичная хроническая надпочечниковая недостаточность развилась на фоне предшествовавшей гипертонической болезни, артериальное давление может быть нормальным. Диспепсические расстройства. Наиболее часто отмечаются плохой аппетит и разлитые боли в эпигастрии, чередование поносов и запоров. При выраженной декомпенсации заболевания появляются тошнота, рвота, анорексия. Пристрастие к соленой пище связано с прогрессирующей потерей натрия. В ряде случаев оно доходит до употребления соли в чистом виде. Гипогликемия в виде типичных приступов практически не встречается, но может выявляться при лабораторном исследовании. Клиническую картину вторичного гипокортицизма отличает отсутствие гиперпигментации и симптоматики, связанной с дефицитом альдостерона (артериальная гипотония, пристрастие к соленой пище, диспепсия). На первый план выступают такие малоспецифические симптомы, как общая слабость и приступы гипогликемии, которые описываются, как эпизоды плохого самочувствия через несколько часов после еды. Клиническая картина острой надпочечниковой недостаточности (аддисонического криза) представлена комплексом симптомов, по преобладанию которых можно выделить три клинические формы: Сердечно-сосудистая форма. При этом варианте доминируют явления острой недостаточности кровообращения: бледность лица с акроцианозом, похолодание конечностей, выраженная артериальная гипотония, тахикардия, нитевидный пульс, анурия, коллапс. Желудочно-кишечная форма. По симптоматике может напоминать пищевую токсико-инфекцию или даже состояние острого живота. Преобладают боли в животе спастического характера, тошнота, неукротимая рвота, жидкий стул, метеоризм. Нервно-психическая форма. Преобладают головная боль, менингеальные симптомы, судороги, очаговая симптоматика, бред, заторможенность, ступор. Диагностика Лабораторное подтверждение гипокортицизма. Для первичной хронической надпочечниковой недостаточности характерна гиперкалиемия, гипонатриемия, лейкопения, лимфоиитоз, сниженный уровень кортизола и альдостерона, высокий уровень АКТГ и ренина. Маркером хронической надпочечниковой недостаточности аутоиммунного генеза являются антитела к Р450с21. При хронической надпочечниковой недостаточности туберкулезного генеза практически всегда выявляются изменения со стороны легких. Проводится тест с инсулиновой гипогликемией, которая в норме приводит к значительному выбросу АКТГ гипофизом и последующему повышению продукции кортизола. Проба противопоказана пожилым пациентам с сердечно-сосудистой патологией. Лечение Включает пожизненную заместительную терапию препаратами кортикостероидов. После постановки диагноза в большинстве случаев лечение начинается с внутримышечного или внутривенного введения гидрокортизона (100-150 мг/сут на 2-3 инъекции). Выраженный положительный эффект от терапии гидрокортизоном является важным свидетельством правильности установленного диагноза. После стабилизации состояния пациента с хронической надпочечниковой недостаточности назначается поддерживающая терапия: комбинация препаратов с глюко- и минералокортикоидной активностью. Особенность заместительной терапии при вторичном гипокортицизме состоит в отсутствии необходимости назначения флудрокортизона, за исключением отдельных случаев выраженной гипотонии. Лечение острой надпочечниковой недостаточности базируется на следующих основных принципах: Регидратационная терапия: изотонический раствор в объеме 2-3 литра впервые сутки в сочетании с 10-20 % раствором глюкозы. Заместительная терапия гидрокортизоном: 100 мг в/в, затем каждые 3-4 часа по 50-100 мг в/в или в/м. По мере стабилизации состояния пациента доза снижается до поддерживающей. При отсутствии гидрокортизона, например на время доставки пациента в клинику возможно назначение эквивалентных доз преднизолона. Симптоматическая терапия сопутствующих заболеваний, вызвавших декомпенсацию хронической надпочечниковой недостаточности (чаще всего - антибактериальная терапия инфекционных заболеваний). Читайте также:
|


