Герпес пятого типа что это
Обновлено: 18.04.2024
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Генитальный герпес: причины появления, классификация, симптомы, диагностика и способы лечения.
Определение
Генитальный герпес – хроническое рецидивирующее заболевание вирусной этиологии, передающееся преимущественно половым путем. Герпес считается крайне распространенным эрозивно-язвенным заболеванием половых органов - ежегодно в мире регистрируется 500 000 новых случаев обращений по этому поводу. В Российской Федерации у лиц старше 18 лет инфицированность вирусом, вызывающим генитальный герпес, составляет 17,2 случая на 10 000 населения.
В 70% случаев заболевание протекает бессимптомно, что и обусловило широкое распространение этой патологии.
Причины появления генитального герпеса
Генитальный герпес вызывает вирус простого герпеса (ВПГ) I и/или II типов. Вирус герпеса I типа чаще всего поражает слизистую оболочку рта и носит название орального (лабиального) герпеса. При заражении этим вирусом очаги поражения локализуются на лице в области губ.
Вирус герпеса II типа чаще вызывает генитальный герпес, однако оба типа могут провоцировать развитие патологии оральной и генитальной локализации. Для ВПГ II типа более характерно рецидивирующее течение, чем для ВПГ I.
- Половой путь – самый часто встречающийся путь передачи генитальной герпетической инфекции.
- Передача вируса бытовым путем является самой редкой.
- Аутоинокуляция – перенос вируса с зараженных участков слизистой на здоровые самим больным.
- Трансплацентарный – через плаценту от инфицированной матери плоду.
- Перинатальный – в процессе родов.
- Контактно-бытовой (при несоблюдении правил ухода и гигиены).
- Аутоинокуляция (см. выше).
- Беспорядочная половая жизнь без использования барьерной контрацепции (презервативов).
- Нарушение правил личной и бытовой гигиены.
- Снижение иммунитета (в силу наличия длительно текущих хронических заболеваний, несбалансированного питания, подверженности частым стрессам, нарушения режима сна).
- Первый эпизод развития клинической симптоматики генитального герпеса.
- Рецидивирующая герпетическая инфекция.
- Инфекция мочеполовых органов.
- у мужчин,
- у женщин.
- Инфекция прямой кишки и перианальной кожи.
- Герпес с типичной клинической картиной.
- Атипичное течение.
Если иммунная система справляется с вирусом на этом этапе, то формируется иммунитет и носительство вируса, не исключающее рецидива заболевания при ослаблении защитных функций организма.
Если у организма нет ресурсов противостоять ВПГ, то вирус проникает во внутренние органы и фиксируется на них. При снижении иммунитета, прочих вирусных инфекциях или при обострениях хронических заболеваний ВПГ из органов вновь выходит в кровь и с ее током разносится по организму.
Симптомы генитального герпеса
При первичном инфицировании инкубационный период составляет от 1 до 10 дней, а клинические проявления длятся от 18 до 24 дней с нарастанием симптоматики в течение недели. До возникновения очагов повреждения у 50% больных появляются продромальные симптомы - парестезии, чувство жжения в генитальной области, невралгии в ягодичной, паховой бедренной областях, дизурия - и продолжаются до 24 часов. В последующем вирусное повреждение эпителия проявляется в виде везикул на эритематозном фоне с дальнейшим характерным разрешением (образованием корочек). Симптомы общей интоксикации, свойственные любой вирусной инфекции, – недомогание, слабость, субфебрилитет, головная боль - развиваются, как правило, при первичном инфицировании, при рецидиве они минимальны.
Непервичная генитальная герпетическая инфекция протекает менее выраженно: длительность клинических проявлений составляет до 15 дней, реже наблюдается бессимптомное выделение вируса, длительность слущивания поврежденного эпителия составляет всего 4-5 дней.
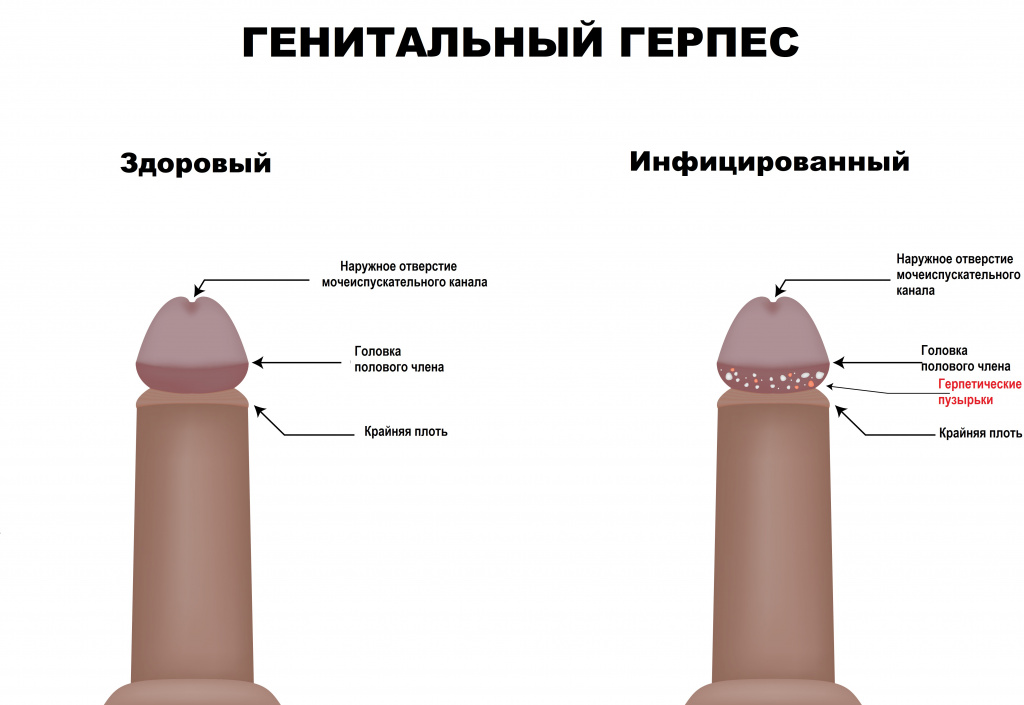
Высыпания на половых органах и/или в перианальной области всегда носят пузырьковый характер, содержимое прозрачное, основание пузырьков гиперемировано (красного цвета); могут быть множественными и единичными.
Пораженная область слизистой оболочки отечная. У мужчин самая частая локализация высыпаний – мошонка, половой член, лобок, промежность, перианальная область.
У женщин – клитор, влагалище, вульва, лобок, шейка матки, перианальная область. В случае присоединения вторичной (чаще бактериальной) инфекции появляются гнойные и слизисто-гнойные выделения.
В случае обострения генитального герпеса присутствует боль при половом контакте.
Диагностика генитального герпеса
Диагностика этого заболевания строится на характерной клинической картине высыпаний и на выявлении ДНК вируса в крови или в отделяемом с пораженных тканей.
Необходимо сдать анализы крови для подтверждения инфицированности вирусом герпеса и определения активности процесса, для выявления ДНК вируса в эякуляте, секрете простаты, в соскобе клеток урогенитального тракта, а также в соскобах с конъюнктивы, кожи, слизистой оболочки носа, ротоглотки.
Раздельное определение ДНК-вируса простого герпеса 1 типа (губного или лабиального) и 2 типа (генитального) в сыворотке крови методом полимеразной цепной реакции (ПЦР) с детекцией в режиме реального времени. Термин "герпес" (от древнегреч. – ползти, ползучи.
Цитомегаловирусная инфекция – инфекционное заболевание, обусловленное высокораспространенным вирусом герпеса 5-го типа, характеризующаяся политропностью поражений органов и систем, сложными иммунологическими реакциями со стороны макроорганизма, с формиров
Abstract. Cytomegalovirus infection is an infectious disease caused by the highly common herpes virus type 5, characterized by polytropic lesions of organs and systems, complex immunological reactions on the part of the macroorganism, with the formation of a long, often lifelong persistence of the virus in the body. Currently, there is an increase in the incidence of cytomegalovirus infection in all countries of the world. According to epidemiological data, most people become infected with cytomegalovirus during their lives. Thus, in Europe and the United States, 40-60% of the adult population is seropositive for cytomegalovirus; in developing countries, the prevalence of cytomegalovirus infection is even higher – 80% of children and almost the entire adult population. Among pregnant women, specific antibodies to cytomegalovirus are determined from 40% in developed to 100% in developing countries. The frequency of intrauterine transmission of cytomegalovirus ranges from 0,2-2,2%, averaging 1% in the population. The variety of clinical forms, from a subclinical course to the development of severe life-threatening forms in special, immunocompromised groups of patients, makes cytomegalovirus infection a complex and urgent problem of modern medicine. One of the main «target organs» for cytomegalovirus is the hepatobiliary system. A small number of observations, limited data on the pathogenesis of the development of liver damage in cytomegalovirus infection in children, as well as the lack of uniform regulatory documents for the diagnosis and treatment of these conditions in pediatric practice served as the basis for writing this article. The paper provides relevant data on the pathogenesis, clinical picture, diagnosis, as well as approaches to the treatment of cytomegalovirus hepatitis in children. For citation: Karpovich G. S., Shestakov A. E., Mihajlenko M. A., Serova Yu. S. Cytomegaloviral hepatitis in children: current state of the problem // Lechaschi Vrach. 2022; 1 (25): 25-29. DOI: 10.51793/OS.2022.25.1.004
Резюме. Цитомегаловирусная инфекция – инфекционное заболевание, обусловленное высокораспространенным вирусом герпеса 5-го типа, характеризующаяся политропностью поражений органов и систем, сложными иммунологическими реакциями со стороны макроорганизма, с формированием длительной, нередко пожизненной персистенции вируса в организме. В настоящее время отмечается рост заболеваемости цитомегаловирусной инфекцией во всех странах мира. Согласно эпидемиологическим данным, большинство людей в течение своей жизни инфицируются цитомегаловирусом. Так, в Европе и США серопозитивны по цитомегаловирусу 40-60% взрослого населения, в развивающихся странах распространенность цитомегаловирусой инфекции еще более высока – 80% детей и почти все взрослое население. Среди беременных специфические антитела к цитомегаловирусу определяются от 40% в развитых до 100% в развивающихся странах. Частота внутриутробной передачи цитомегаловируса колеблется в пределах 0,2-2,2%, в среднем составляя 1% в популяции. Многообразие клинических форм, от субклинического течения до развития тяжелых жизнеугрожающих форм у особых, иммунокомпроментированных групп пациентов, делает цитомегаловирусную инфекцию сложной и актуальной проблемой современной медицины. Одним из основных органов-мишеней для цитомегаловируса является гепатобилиарная система. Малое число наблюдений, ограниченные данные о патогенезе развития поражения печени при цитомегаловирусной инфекции у детей, а также отсутствие единых регламентирующих документов по диагностике и лечению указанных состояний в педиатрической практике послужили причиной для написания данной статьи. В работе приведены актуальные данные о патогенезе, клинической картине, диагностике, а также подходах к терапии цитомегаловирусного гепатита у детей.
Цитомегаловирусная инфекция (ЦМВИ) – инфекционное заболевание, вызванное герпесвирусом 5-го типа (Cytomegalovirus). Характеризуется полиморфной клинической симптоматикой и специфичной морфологической картиной с присутствием цитомегалических клеток на фоне лимфогистиоцитарных инфильтратов. В настоящее время ЦМВИ является одной из наиболее актуальных вирусных проблем инфекционной патологии, что обусловлено ее широким распространением, многообразием путей передачи, чрезвычайно большим спектром клинических проявлений, а также частым развитием тяжелых форм инфекции в определенных группах пациентов. Европейским регионарным бюро Всемирной организации здравоохранения (ВОЗ) ЦМВИ отнесена к числу болезней, которые определяют будущее инфекционной патологии. Многие эксперты считают необходимым принципиально изменить отношение к цитомегаловирусу (ЦМВ) и усилить борьбу с его распространением [2, 3].
Общие сведения
У людей с эффективным иммунитетом ЦМВИ в большинстве случаев характеризуется латентным течением. Клиническая манифестация заболевания с возможным развитием крайне тяжелых форм происходит относительно редко и зачастую у пациентов с приобретенными или врожденными иммунодефицитными состояниями (ИДС) [4]. В настоящее время, учитывая развитие биомедицинских технологий, в частности разработку и широкое использование цитостатических препаратов, а также высокоактивной биологической терапии, перманентный рост заболеваемости ВИЧ-инфекцией, рост онкопатологии и числа тяжелых аутоиммунных патологий, актуальность ЦМВИ не вызывает сомнений. Это одна из наиболее частых причин самопроизвольных выкидышей, преждевременных родов, врожденных пороков развития и фетопатий [4, 5].
Сегодня отмечается рост заболеваемости ЦМВИ во всех странах мира, что связано как с улучшением качества диагностики, так и с указанными выше причинами [5]. Согласно эпидемиологическим данным, большинство людей в течение жизни инфицируются ЦМВ. Так, в Европе и США 40-60% взрослого населения серопозитивны по ЦМВ, в развивающихся странах распространенность ЦМВИ еще выше – 80% детей и почти все взрослое население. Среди беременных специфические антитела к ЦМВ определяются от 40% в развитых до 100% в развивающихся странах. Частота внутриутробной передачи ЦМВ колеблется в пределах 0,2-2,2%, в среднем составляя 1% в популяции [2].
Учитывая, что ЦМВ характеризуется политропностью, клиническая картина может включать различные синдромы, однако одним из наиболее частых проявлений является синдром поражения печени. Наиболее распространенным заболеванием печени, связанным с ЦМВ, является острый гепатит, тяжесть которого варьирует от бессимптомного повышения аланиновой аминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ), а также самоограничивающегося гепатита до тяжелого поражения печени с развитием острой печеночной недостаточности (ОПчН). Кроме того, могут наблюдаться и нетипичные проявления, такие как холестатические формы острого гепатита, развитие хронического гепатита, а также вероятный дебют аутоиммунного гепатита [6, 7].
В зависимости от времени инфицирования ЦМВ выделяют врожденный и приобретенный гепатит. Поражение печени – характерный признак врожденной ЦМВ-инфекции – встречается у 40-63,3% больных [8, 9]. Врожденный ЦМВ-гепатит (ЦМВГ) всегда развивается как первично-хронический процесс. Поражение печени часто сочетается с другими пороками развития: атрезией желчевыводящих путей, поражением нервной системы, легких, почек и др. [10, 11]. В этиологической структуре неонатальных гепатитов ЦМВ-этиология составляет до 40% [12]. К концу первого года жизни поражение печени при врожденной ЦМВИ отмечается редко – примерно в 2% случаев [13]. Приобретенный ЦМВГ может протекать в форме острой инфекции в рамках мононуклеозоподобного синдрома, а также как самостоятельное заболевание, заканчиваясь выздоровлением с полным восстановлением функционального состояния печени или первично-хроническим процессом 14.
Эпидемиология
Патогенез
ЦМВИ может протекать в виде первичной инфекции у ранее неинфицированных (серонегативных) пациентов, реинфекции или реактивации у инфицированных (серопозитивных) людей; может вызывать острое, латентное и хроническое течение врожденных или приобретенных форм болезни. При острой ЦМВИ могут поражаться практически все типы клеток человеческого организма – эндотелиальные, эпителиальные, гладкомышечные, фибробласты, нейроны, гепатоциты, трофобласты, моноциты/макрофаги, дендритные клетки и многие другие, то есть вирус не имеет избирательной клеточной цели, что объясняет многообразие клинических форм поражения у различных групп пациентов [18].
Патогенез ЦМВГ до настоящего времени не до конца ясен. Традиционно считается, что ЦМВ поражает желчные протоки с развитием холестатического гепатита. Однако обнаружено, что вирус оказывает и прямое цитопатическое действие непосредственно на паренхиму печени, таким образом, ЦМВ является прямым гепатотропным агентом.
В формировании изолированного поражения гепатоцитов при ЦМВГ важную роль может играть непосредственное попадание возбудителя в кровь (парентеральный механизм инфицирования). Возбудитель сразу оказывается в системном кровотоке, откуда и попадает в паренхиму печени, где оказывает цитопатическое действие на клетки печени.
В патогенезе изолированного ЦМВГ нельзя исключить и роль различных генотипов ЦМВ, а также полиморфизма генов-кандидатов главного комплекса гистосовместимости (HLA-система) на хромосоме 6 восприимчивого индивидуума 19. В процессе формирования патологических изменений возникают интерстициальное воспаление, васкулиты, дистрофические изменения в окружающих тканях, сопровождающиеся лимфоидно-гистиоцитарной инфильтрацией. Изменения могут иметь локальный или диффузный характер и различную степень выраженности. Поражение клеток ретикулоэндотелиальной системы и развитие гепатолиенального синдрома может сопровождаться анемией, лимфопенией и тромбоцитопенией. Специфичность морфологической картины при ЦМВГ, в том числе и в паренхиме печени, определяют цитомегалические клетки типа «совиный глаз» и лимфогистиоцитарные инфильтраты [22].
Образующиеся по ходу инфекции специфические антитела соединяются с вирусными антигенами и формируют иммунные комплексы, вовлекающие в патологический процесс другие органы и системы [21, 22].
Особое свойство ЦМВИ – способность вызывать депрессию практически всех звеньев иммунитета, резко угнетать продукцию интерферонов (ИНФ), в первую очередь ИНФ-α. Внедрение ЦМВ приводит к иммунной перестройке в виде снижения реакции лимфоцитов на вирусы в связи с угнетением экспрессии антигена макрофагами, подавлением пролиферативной активности лимфоцитов (что коррелирует с тяжестью болезни), угнетением фагоцитарной активности и завершенности фагоцитоза [23]. Указанные изменения в иммунной системе приводят к формированию неэффективного иммунного ответа, что ухудшает течение основного патологического процесса, приводит к формированию предрасположенности к развитию вторичных вирусных и бактериальных инфекций.
Подходы к диагностике
Диагноз ЦМВГ устанавливают после тщательного анализа клинико-анамнестических данных, лабораторных и инструментальных методов обследования.
Ведущими методами этиологической диагностики являются определение антител (anti-CMV IgM, anti-CMV IgG + IEA IgG с определением авидности), а также качественная и количественная полимеразная цепная реакиця (ПЦР) для определения ДНК вируса в крови, слюне и моче и некоторых других средах [24].
Первым в сыворотке крови появляется IgM, сохраняющийся в среднем около 4 недель. В последующем возможно выявление IgG, для которых обязательно определение авидности. Данный показатель указывает на давность течения инфекционного процесса. Стоит отметить, что серодиагностика позволяет установить диагноз не во всех случаях [16]. При использовании серологических методик для диагностики острых ЦМВГ возможна перекрестная реакция с вирусом Эпштейна–Барр и гепатита Е [24].
У новорожденных серологические исследования редко информативны, особенно при манифестной клинике, так как врожденная иммунная система ко времени требуемого серологического ответа еще не эффективна. Отсутствие специфических фетальных IgM даже на фоне острой тяжелой ЦМВИ (серологическая ниша) – общая черта этого онтогенетического периода. Указанные маркеры начинают продуцироваться только через несколько месяцев [25].
На настоящем этапе золотым стандартом диагностики ЦМВИ, в том числе и ЦМВГ, является ПЦР-диагностика. Количественная ПЦР служит методом раннего выявления и способствует своевременному лечению ЦМВИ. Данная методика полностью заменила культуральный метод, который в настоящее время не используется из-за своей сложности и чрезмерной длительности. Положительная ПЦР на ДНК ЦМВ, наряду с наличием IgM или повышением IgG более чем в 4 раза, в большинстве случаев указывает на активную ЦМВИ 24. Диагностически значимой средой с точки зрения ПЦР-диагностики, безусловно, является кровь. Обнаружение ДНК ЦМВ в крови свидетельствует о виремии – активном течении инфекционного процесса, а наличие ДНК в слюне и моче при «положительной» крови в отсутствие количественного результата ПЦР косвенно свидетельствует о высокой вирусной нагрузке. В свою очередь наличие ДНК ЦМВ в слюне и моче при отсутствии генома в крови свидетельствует скорее о персистенции вируса без выраженной активности инфекционного процесса.
Если лабораторная диагностика не дала результата, методом выбора, как и при любом неуточненном гепатите, является биопсия печени. Гистологически ЦМВГ характеризуется классическим цитопатическим действием вируса на гепатоциты, эпителий билиарного тракта, эндотелиальные клетки и клетки Купфера. Инфицированные клетки имеют как цитоплазматическое, так и ядерное увеличение с цитоплазматическими и внутриядерными включениями. Другие неспецифические изменения предполагают умеренный лобулярный гепатит, гепатоцеллюлярный некроз, портальную мононуклеарную инфильтрацию и микроабсцессы [26]. Также в некоторых случаях возможно использование иммуногистохимического исследования. Следует отметить, что биопсия печени, как перкутанная, так и трансъюгулярная, на настоящем этапе считается малоинвазивной процедурой и не несет высоких рисков, что позволяет считать ее решающим методом обследования, особенно при неуточненных поражениях печени.
Подходы к лечению
Учитывая, что в основе патогенеза ЦМВГ лежит прямое вирусное поражение, ведущее значение принадлежит этиотропной терапии. Несмотря на токсичность противовирусных анти-ЦМВ-препаратов при развитии у ребенка угрожающей жизни манифестной ЦМВИ, в частности острого ЦМВГ, применение ганцикловира и валганцикловира показано и необходимо после обязательного предварительного анализа риска и пользы. Ганцикловир впервые применен у новорожденных в конце 1980-х гг., в последующем было многократно показано, что он хорошо переносится в том числе и детьми, а также эффективен при лечении манифестных форм ЦМВИ. Препарат назначают в дозе 5-6 мг/кг два раза в сутки в среднем в течение 6 недель. Стоит отметить, что препарат обладает выраженными токсическими свойствами, поэтому применяется при наличии строгих показаний. Ограничения применения ганцикловира также связаны с необходимостью реализации для его инфузии венозного доступа с массивным кровотоком, у детей зачастую – центрального венозного катетера.
Альтернативой к инвазивному использованию ганцикловира стало введение валганцикловира, рандомизированное исследование эффективности которого завершено в 2015 г. Препарат обладает менее выраженными токсическими свойствами. Согласно международному Консенсусу 2017 г., лечение валганцикловиром показано детям со среднетяжелой врожденной ЦМВИ – 16 мг/кг 2 раза в сутки до 6 месяцев.
С патогенетической точки зрения важна гепатопротективная терапия. Наиболее доказанным в этом отношении препаратом является урсодезоксихолевая кислота, которая назначается в дозе 10 мг/кг 1 раз в сутки, курс зависит от динамики холестатического и цитолитического синдрома, а также от течения основного заболевания в целом.
Учитывая иммунные нарушения, реализующиеся при ЦМВИ и проявляющиеся депрессией различных звеньев иммунитета, а особенно интерферонопродукции, рационально применение иммуномодулирующей терапии препаратами интерферона альфа-2 бета.
При реализации тяжелых форм ЦМВГ с развитием ОПчНв терапии рационально применять стероиды (2 мг/кг по преднизолону) для купирования мезенхимально-воспалительного синдрома в паренхиме печени. При развитии печеночной энцефалопатии показаны препараты лактулозы. При отсутствии эффекта от проводимой терапии, прогрессировании ОПчН, а также при формировании хронического гепатита с признаками развития цирроза печени показано проведение трансплантации органа при соответствии характеристик кандидата на трансплантацию. В свою очередь при лечении легких или бессимптомных форм ЦМВГ используется симптоматическая терапия [16, 28].
Заключение
ЦМВИ – это крайне сложное патологическое состояние, характеризующееся поражением многих органов и систем. Одним из основных проявлений ЦМВИ является способность ЦМВ поражать гепатоциты с развитием ЦМВГ. Сложность клинической и лабораторной диагностики ЦМВГ, отсутствие единого подхода к терапии и диагностике, отсутствие дальнейшего диспансерного наблюдения за указанными пациентами требуют особого внимания практикующих специалистов к этому заболеванию. Прежнее мнение о «мягкой» природе ЦМВИ подлежит пересмотру в свете новых научных и клинических данных. ЦМВИ является одной из актуальнейших проблем современной педиатрии и инфектологии, необходимо дальнейшее совершенствование методов диагностики и лечения как изолированного поражения гепатобилиарной системы, так и ЦМВИ в целом для оптимизации оказания медицинской помощи данной категории пациентов.
КОНФЛИКТ ИНТЕРЕСОВ. Авторы статьи подтвердили отсутствие конфликта интересов, о котором необходимо сообщить.
CONFLICT OF INTERESTS. Not declared.
Литература/References
1 ФГБОУ ВО НГМУ Минздрава России; 630091, Россия, Новосибирск, Красный проспект, 52
2 ГБУЗ НСО ДГКБ № 3; 630040, Россия, Новосибирск, ул. Охотская, 81
3 ООО «Главный пациент»; 630089, Россия, Новосибирск, ул. Бориса Богаткова, 217/1
Сведения об авторах:
Information about the authors:
Цитомегаловирусный гепатит у детей: современное состояние проблемы/ Г. С. Карпович, А. Е. Шестаков, М. А. Михайленко, Ю. С. Серова
Для цитирования: Карпович Г. С., Шестаков А. Е., Михайленко М. А., Серова Ю. С. Цитомегаловирусный гепатит у детей: современное состояние проблемы // Лечащий Врач. 2022; 1 (25): 25-29. DOI: 10.51793/OS.2022.25.1.004
Теги: дети, инфекция, гепатобилиарная система, гепатит
Герпес 5-го типа — это цитомегаловирусная инфекция (ЦМВ-инфекция), заболевание, вызываемое вирусом герпеса 5-го типа (цитомегаловирусом), поражающее преимущественно внутренние органы (печень, почки, легкие, сердце), с образованием в них специфических гигантских клеток (отсюда и название « цитомегаловирус»). Как и другие заболевания, вызванные вирусами герпеса, ЦМВ-инфекция относится к хроническим патологиям. Возбудитель, попав однажды в организм человека, сохраняется в нем на всю жизнь в латентной или спящей форме. Локализацию латентных форм определить невозможно. Даже находясь в латентной (« спящей») стадии, заболевание характеризуется периодическими выделениями возбудителя в окружающую среду.
Симптомы герпеса 5-го типа
- явления интоксикации (слабость, озноб, усталость, повышение температуры тела до 37,5 º С);
- в последующие дни температура тела увеличивается до 39 º С (температура может держаться до 4-х недель);
- может появиться незначительная боль в горле, но нередко клиническая картина может ограничиваться только симптомами интоксикации;
- при осмотре возможно выявление признаков фарингита (покраснение слизистой ротоглотки), увеличение подчелюстных лимфатических узлов.
- стреляющие боли в области слюнных желез — боль отдает в ухо;
- повышение температуры тела до 39º С;
- затрудненное глотание и даже дыхание;
- покраснение кожных покровов над слюнной железой;
- из-за понижения слюноотделения ощущается сухость во рту;
- отмечается снижение слуха.
- гранулематозный гепатит — воспаление печени с образованием гранулем — микроскопических округлых участков, отграниченных от окружающей ткани, с упорядоченным скоплениями клеток, не свойственных данной ткани. Заболевание сопровождается лихорадкой, тошнотой, рвотой, умеренной желтухой;
- на фоне поражения ЦНС развивается менингоэнцефалит (воспалительные процессы в оболочках, окружающих спинной и головной мозг, в веществе мозга);
- при поражении поджелудочной железы развивается панкреатит;
- при поражении легких — пневмония;
- при поражении мышечной оболочки сердца — миокардит.
- высокой температурой тела;
- мышечными, суставными болями;
- повышенным потоотделением;
- со стороны легких развивается двусторонняя « ползучая» пневмония: воспаление распространяется с нижних долей легких вверх; характеризуется тяжелым течением, развитием дыхательной недостаточности, одна из частых причин летального исхода;
- поражение центральной нервной системы (ЦНС) на ранних стадиях сопровождается развитием энцефалопатий (невоспалительное заболевание головного мозга), в дальнейшем развивается изменение поведения, восприятия реальности вплоть до деменции (приобретенное слабоумие, стойкое снижение умственной деятельности с утратой приобретенных в процессе жизни навыков);
- при поражении пищеварительного тракта развивается отек слизистой пищеварительного тракта от пищевода до толстого кишечника, появляются кровоточащие язвы. Больной жалуется на боли при прохождении пищи по пищеводу, состояние сопровождается рвотой, нередко с кровью, отказом от еды, болями в животе. Больной быстро теряет вес;
- поражается сердечно-сосудистая система с развитием миокардита и сердечной недостаточности;
- характерным для генерализованной формы является поражение сетчатой оболочки глаза с отеком и некрозом (омертвением) окружающих тканей. На фоне данных изменений снижается зрение, вплоть до слепоты, появляются кровоизлияния сосудов глазного дна.
Инкубационный период
Длительность инкубационного периода можно определить, если был установлен факт заражения. Чаще всего это возможно определить при переливании крови. Как правило, после переливания зараженной крови первые признаки заболевания появляются через 7-10 дней, в некоторых случаях инкубационный период возможен до 3-х месяцев.
Формы
- врожденную;
- приобретенную (в этом случае выделяют первичную латенцию: в крови больного определяются антитела, вирус выделяется из слюны, но клинические проявления заболевания отсутствуют. О первичной латенции говорят как при первичном « контакте» с ЦМВ, так и в случае после перенесенной ранее инфекции в субклинической форме; вторичная латенция ставится после достоверно перенесенного эпизода ЦМВ-инфекции в прошлом).
- генерализованная форма развивается при внутриутробном поражении и у лиц с тяжелыми иммунодуфицитами, характеризуется поражением целых систем органов (пищеварительной, сердечно-сосудистой, дыхательной);
- локализованная (ограничивается поражением определенного органа) часто может протекать бессимптомно (соотношение манифестных (с симптомами) форм и бессимптомных составляет 1:10). Выявляется по наличию антител и вирусов в крови, чаще изолированно поражаются слюнные железы (цитомегаловирусный сиалоадонит), но возможно и поражение других органов.
Причины
- Источником возбудителя является человек.
- Вирус может находиться в любых биологических жидкостях. Обнаруживается в слюне у трети здоровых женщин, сперме, слюне, семенной жидкости, крови, спинно-мозговой жидкости, вагинальном секрете.
- У носителей вирус сохраняется длительное время в слюне и моче.
- контактный механизм: при попадании вируса на поврежденную кожу, слизистые (например, при поцелуях);
- при половых контактах: если вирус содержится в цервикальном канале, сперме;
- также имеет место воздушно-капельный путь передачи, но вероятность заражения таким путем крайне низкая;
- при переливании крови, трансплантации органов. Цитомегаловирусная инфекция — одна из самых распространенных причин осложнений после пересадки органов (большинство реципиентов через три месяца после пересадки имеют признаки цитомегаловирусной инфекции).
LookMedBook напоминает: что данный материал размещен исключительно в ознакомительных целях и не заменяет консультацию врача!
Врач терапевт поможет при лечении заболевания
Диагностика
- метод полимеразной цепной реакции позволяет выделить ДНК возбудителя. Материалом для исследования могут являться кровь, моча, слюна, секрет простаты, выделения из мочеиспускательного канала, шейки матки, влагалища;
- методом иммунофлюоресцентного анализа определяется наличие антител к возбудителю в крови человека (при острых формах ЦМВ-инфекции определяются IgM, при обострениях — одновременно IgM и IgG, только IgG определяются после перенесенной ЦМВ-инфекции и остаются в крови пожизненно).
- температура тела, повышенное СОЭ, признаки интоксикации (слабость, озноб, усталость, повышение температуры тела);
- отсутствие эффекта от приема антибиотиков и появление сыпи на фоне приема ампицилина;
- у женщин в анамнезе отмечаются выкидыши, мертворождения, патологии развития плода (недоразвитость систем и органов).
- желтуха;
- гепатоспленомегалия (увеличение печени и селезенки);
- геморрагическая пурпура (высыпания в виде точечных кровоизлияний, кровоизлияния в органах).
Лечение герпеса 5-го типа
- иммунномоделирующую терапию (в виде приема препаратов, стимулирующих работу иммунной системы);
- противовирусную терапию. Прием противовирусных препаратов ускоряет наступление ремиссии и переход вируса в латентное (« спящее») состояние.
- прием жаропонижающих при высокой температуре тела;
- при тяжелых поражениях печени назначаются гепатопротекторы и т.д.;
- при нарушениях работы сердечно-сосудистой системы назначают сердечные гликозиды (препараты, поддерживающие работу сердца и обладающие антиаритмическим эффектом);
- общеукрепляющая терапия (прием витаминно-минеральных комплексов и т.д.).
Осложнения и последствия
- тромбоцитопении (состояние повышенной кровоточивости на фоне снижения количества тромбоцитов — элементов крови, обеспечивающих ее свертываемость);
- гемолитической анемии (патологическое состояние, характеризующееся разрушением эритроцитов);
- артритов (воспалительные заболевания суставов).
- пневмониями и плевритами (воспалением легких);
- кишечными кровотечениями;
- энцефалопатиями (поражением мозга невоспалительного характера).
Профилактика герпеса 5-го типа
- При планировании беременности необходимо сдать кровь на определение уровня антител к ЦМВ, чтобы выяснить, имела ли женщина контакт с этим вирусом, произошло ли инфицирование, и выработался ли у нее иммунитет к инфекции. Если определяются IgG, то можно не волноваться: ЦМВ не представляет опасности ни для течения беременности, ни для развития плода, поскольку опасно именно первичное инфицирование (заражение) ЦМВ-инфекцией во время беременности (на этом фоне определяется IgM). В случае, когда у женщины не определяются в крови антитела к ЦМВ (ни IgG, ни IgM), и он же не обнаруживается в цервикальном канале методом ПЦР, женщине рекомендуют быть осторожной и избегать мест с большим скоплением людей, детских учреждений и т.д., а также « берут» на вооружение, что у нее возможно первичное инфицирование ЦМВ.
- Грудное вскармливание, при наличии ЦМВ у матери не запрещается, так как с грудным молоком ребенок получает антитела к возбудителю.
- исключение случайных половых связей, использование барьерных методов контрацепции (презервативы) при половых контактах;
- при выборе донора для человека, в крови которого отсутствуют антитела к ЦМВ, необходимо по возможности искать такого же донора. В противном случае возникает высокий риск развития осложнений после трансплантации органов и тканей. Если не существует возможности подобрать серонегативного (не имеющего в крови антител к ЦМВ) донора, реципиентам (лицам, которым осуществляется пересадка) назначают противовирусную терапию с целью профилактики осложнений;
- профилактика рецидивов направлена на поддержание собственных защитных сил организма путем закаливания, употребление настоев из различных трав. Среди укрепляющих иммунитет растений следует назвать календулу, калину, шиповник, зверобой, мелиссу;
- группам риска (реципиентам костного мозга, почек, печени, сердца) назначаются препараты иммуноглобулинов (препараты из донорской крови, содержащие IgG к различным инфекциям).
Дополнительно
- Рецидивы заболевания (в результате повторной активации вируса) развиваются на фоне снижения иммунитета (при переохлаждениях, на фоне инфекционных болезней, стрессов, хронических заболеваний, онкологии).
- Тяжелое течение цитомегаловирусной инфекции отмечено у больных с иммунодефицитными состояниями: онкологических больных, ожоговых больных, больных туберкулезом, ВИЧ-инфицированных; у таких категорий пациентов происходит тяжелое поражение внутренних органов, часто с летальным исходом.
- ЦМВ-инфекция не имеет характерных симптомов, поэтому заболевание часто проходит под другими диагнозами. Соответственно назначается неадекватная терапия, которая может быть опасна. Особенно опасны случаи нераспознанной цитомегалии во время беременности (на всех ее этапах).
- Выделяется два пика заболеваемости цитомегаловирусной инфекцией:
- вскоре после рождения (в течение первых двух лет жизни);
- в период наибольшей сексуальной активности (среди подростков и лиц молодого возраста).
ИНФОРМАЦИЯ ДЛЯ ОЗНАКОМЛЕНИЯ
Необходима консультация с врачом
Певцова Анастасия Владимировна, врач-методист, акушер-гинеколог, медицинский редактор.
Ельчанинова Ольга Николаевна, редактор.
Что делать при герпесе 5-го типа?
- Выбрать подходящего врача терапевт
- Сдать анализы
- Получить от врача схему лечения
- Выполнить все рекомендации
В последние годы в инфекционной патологии все большее значение приобретают герпес-вирусы (от греч. herpes — ползучий). Внимание, которое вирусологи и клиницисты проявляют в последние 25 лет к герпес-вирусным заболеваниям человека, связано
В последние годы в инфекционной патологии все большее значение приобретают герпес-вирусы (от греч. herpes — ползучий). Внимание, которое вирусологи и клиницисты проявляют в последние 25 лет к герпес-вирусным заболеваниям человека, связано с их значительной эпидемиологической ролью и социальной значимостью в современном мире. Неуклонный рост числа герпетических заболеваний у взрослых и детей обусловливает необходимость всестороннего изучения герпетической инфекции и разработки эффективных методов профилактики и лечения разнообразных форм этой инфекции. Среди вирусных инфекций герпес занимает одно из ведущих мест в силу повсеместного распространения вирусов, многообразия клинических проявлений, как правило, хронического течения, а также различных путей передачи вирусов.
Он входит в число наиболее распространенных и плохо контролируемых инфекций человека. Герпес-вирусы могут циркулировать в организме с нормальной иммунной системой бессимптомно, но у людей с иммуносупрессией вызывают тяжелые заболевания со смертельным исходом. По данным ВОЗ, смертность от герпетической инфекции среди вирусных заболеваний находится на втором месте (15,8%) после гепатита (35,8%).
Герпес-вирусы объединены в обширное семейство Herpesviridae и в настоящее время наиболее четко классифицированы. Семейство Herpesviridae включает в себя более 80 представителей, 8 из которых для человека наиболее патогенны (human herpes virus-HHV). Герпес-вирусы — филогенетически древнее семейство крупных ДНК-вирусов — подразделяются на 3 подсемейства в зависимости от типа клеток, в которых протекает инфекционный процесс, характера репродукции вируса, структуры генома, молекулярно-биологических и иммунологических особенностей: α, β и γ (табл. 1, по данным Н. Г. Перминова, И. В. Тимофеева и др., Государственный научный центр вирусологии и биотехнологий).
α-герпес-вирусы, включающие HSV-1, HSV-2 и VZV, характеризуются быстрой репликацией вируса и цитопатическим действием на культуры инфицированных клеток. Репродукция α-герпес-вирусов протекает в различных типах клеток, вирусы могут сохраняться в латентной форме, преимущественно в ганглиях.
β-герпес-вирусы видоспецифичны, поражают различные виды клеток, которые при этом увеличиваются в размерах (цитомегалия), могут вызывать иммуносупрессивные состояния. Инфекция может принимать генерализованную или латентную форму, в культуре клеток легко возникает персистентная инфекция. К этой группе относятся CMV, HHV-6, HHV-7.
Герпес-вирусы ассоциированы с малигнизацией и способны (по крайней мере, EBV и HVS) трансформировать клетки in vitro. Все герпес-вирусы сходны по морфологическим признакам, размерам, типу нуклеиновой кислоты (двухцепочечная ДНК), икосадельтаэдрическому капсиду, сборка которого происходит в ядре инфицированной клетки, оболочке, типу репродукции, способности вызывать хроническую и латентную инфекцию у человека.
Клонирование герпес-вирусов происходит по следующей схеме: спонтанная случайная адсорбция исходного «материнского» вируса на поверхности клетки-мишени, «раздевание вириона» — расщепление оболочки и капсида, инфильтрация вирусной ДНК в ядро клетки-мишени, формирование и созревание «дочерних» вирионов путем почкования на ядерной мембране. После инфицирования клетки, например вирусом простого герпеса 1 или 2 типов, синтез новых вирусных белков начинается через 2 ч, а число их достигает максимума примерно через 8 ч. В процессе созревания «дочерних» вирионов их оболочки капсиды и ДНК формируются из имеющихся внутри инфицированной клетки аминокислот, белков, липопротеидов и нуклеозидов. Эти молекулы поступают в инфицированную клетку из межтканевых пространств по мере истощения внутриклеточных резервов. В этом отношении вирусы зависят от интенсивности внутриклеточного обмена, который, в свою очередь, определяется природой клетки-мишени. Наиболее высокий темп обмена веществ характерен для короткоживущих клеток эпителиоидного типа, поэтому герпес- вирусы особенно хорошо колонизируют клетки эпителия и слизистых оболочек, крови и лимфатических тканей. Полностью сформированные и готовые к последующей активной репродукции «дочерние» инфекционные вирионы появляются внутри инфицированной клетки через 10 ч, а их число становится максимальным примерно через 15 ч. Количество вирионов в определенной степени влияет на темп распространения инфекции и площадь поражения.
Первая генерация «дочерних» герпес-вирусов начинает поступать в окружающую среду (межклеточные пространства, кровь, лимфу и другие биологические среды) примерно через 18 ч. Это можно пронаблюдать в клинической практике при неконтролируемых процессах (например, при ветряной оспе, опоясывающем герпесе, генерализации цитомегаловирусной инфекции) — элементы герпетической сыпи возникают на коже или слизистых оболочках волнами. В свободном состоянии герпес-вирусы находятся в течение весьма непродолжительного периода (от 1 до 4 ч) — именно такая продолжительность характерна для периода острой интоксикации при герпес-вирусных инфекциях. Срок жизни каждой генерации образовавшихся и адсорбированных герпес-вирусов в среднем составляет 3 сут.
В эпидемиологическом плане наиболее интересны следующие сведения о герпес-вирусах: вирионы чрезвычайно термолабильны — инактивируются при температуре 50–52°С в течение 30 мин, при температуре 37,5°С — в течение 20 ч, устойчивы при температуре 70°С; хорошо переносят лиофилизацию, длительно сохраняются в тканях в 50-процентном растворе глицерина. На металлических поверхностях (монеты, дверные ручки, водопроводные краны) герпес-вирусы выживают в течение 2 ч, на пластике и дереве — до 3 ч, во влажных медицинских вате и марле — до их высыхания при комнатной температуре (до 6 ч).
Уникальными биологическими свойствами всех герпес-вирусов человека является тканевой тропизм, способность к персистенции и латенции в организме инфицированного человека. Персистенция представляет собой способность герпес-вирусов непрерывно или циклично размножаться (реплицироваться) в инфицированных клетках тропных тканей, что создает постоянную угрозу развития инфекционного процесса. Латенция герпес-вирусов — это пожизненное сохранение вирусов в морфологически и иммунохимически видоизмененной форме в нервных клетках регионарных (по отношению к месту внедрения герпес-вируса) ганглиев чувствительных нервов. Штаммы герпес-вирусов обладают неодинаковой способностью к персистенции и латенции и чувствительностью к противогерпетическим препаратам в связи с особенностями их ферментных систем. У каждого герпес-вируса свой темп персистенции и латенции. Среди изучаемых наиболее активны в этом отношении вирусы простого герпеса, наименее — вирус Эпштейна-Барр.
По данным многочисленных исследований, к 18 годам более 90% жителей городов инфицируются одним или несколькими штаммами по меньшей мере 7 клинически значимых герпес-вирусов (простого герпеса 1 и 2 типов, варицелла зостер, цитомегаловирусом, Эпштейна-Барр, герпеса человека 6 и 8 типов). В большинстве случаев первичное и повторное инфицирование происходит воздушно-капельным путем, при прямом контакте или через предметы обихода и гигиены (общие полотенца, носовые платки и т. п.). Доказаны также оральный, генитальный, орогенитальный, трансфузионный, трансплантационный и трансплацентарный пути передачи инфекции.
Герпес-вирусные инфекции широко распространены в мире и имеют тенденцию к неуклонному росту. Особенностью герпес-вирусной инфекции является возможность вовлечения в инфекционный процесс многих органов и систем, чем и обусловлено многообразие вызываемых герпес-вирусами заболеваний, варьирующих от простых кожно-слизистых до угрожающих жизни генерализованных инфекций. Важное свойство герпес-вирусов — это способность после первичного инфицирования в детском возрасте пожизненно персистировать в организме и реактивироваться под влиянием различных экзо- и эндогенных провоцирующих факторов.
Инфицирование человека указанными герпес-вирусами сопровождается клиническими симптомами соответствующего острого инфекционного заболевания в среднем не более чем у 50% людей, в основном у детей: внезапная эритема (вирус герпеса человека 6 типа), афтозный стоматит (вирусы простого герпеса 1 или 2 типов), ветряная оспа (вирус варицелла зостер), инфекционный мононуклеоз (вирус Эпштейна-Барр), мононуклеозоподобный синдром (цитомегаловирус). У остальных пациентов инфекция протекает бессимптомно, что особенно характерно для подростков и взрослых людей. Помимо биологических свойств штамма герпес-вируса, влияние на течение острых и рецидивирующих герпес-вирусных заболеваний оказывают индивидуальные (возрастные, половые, фило- и онкогенетические) особенности иммунного ответа инфицированного человека на многочисленные антигены вируса.
Часто, особенно при снижении иммунореактивности организма, герпес-вирусы выступают в качестве вирусов-оппортунистов, приводя к более тяжелому, с необычными клиническими проявлениями, течению основного заболевания. Вирусы простого герпеса 1 и 2 типов, а также ЦМВ входят в число возбудителей TORCH-инфекций. Они играют важную роль в нарушении репродуктивной функции человека, развитии серьезных заболеваний матери, плода, новорожденного и детей младшего возраста.
Вызываемые вирусами ВПГ, CMV, ВЭБ заболевания рассматриваются как СПИД-индикаторные в связи с их частым обнаружением при данной патологии. В 1988 г. они включены в расширенное определение случаев, подлежащих эпидемиологическому надзору по поводу СПИДа. Результаты исследований последних лет свидетельствуют о роли некоторых герпес-вирусов (ВГЧ-8, ЦМВ, ВЭБ и др.) в развитии ряда злокачественных новообразований: назофарингеальной карциномы, лимфомы Беркитта, В-клеточной лимфомы, рака груди, аденокарциномы кишечника и простаты, карциномы цервикального канала шейки матки, саркомы Капоши, нейробластомы и др.
Наибольшую угрозу для здоровья представляют герпетические нейроинфекции (летальность достигает 20%, а частота инвалидизации — 50%), офтальмогерпес (почти у половины больных приводит к развитию катаракты или глаукомы) и генитальный герпес.
По-видимому, все известные герпес-вирусные инфекции могут рецидивировать, однако порог и причины трансформации острой формы в рецидивирующую для каждого типа герпес-вируса свои. В целом герпес-вирусные инфекции принимают рецидивирующее течение не более чем у 8–20% больных. Рецидивирующие герпес-вирусные заболевания у некоторых людей могут восприниматься как «хронические», когда они развиваются в течение многих лет, не только разрушая физическое здоровье и функции жизненно важных систем, но и психологически крайне неблагоприятно влияя на больного. Поэтому для практических целей герпес–вирусные инфекции классифицируют с учетом одновременно локализации процесса, рецидивирования и этиологии (табл. 2).
Причины рецидивирующего течения герпес-вирусных инфекций многообразны. Одна из них заключается в том, что трансформация острого герпес-вирусного процесса в хронический происходит при явном «попустительстве» иммунной системы. Если приобретенный иммунодефицит в результате химиотерапии или ВИЧ-инфекции легко объясним, то все попытки выяснить, чем обусловлен основной дефект иммунного ответа у иммунологически полноценных людей с рецидивирующим течением герпес-вирусной инфекции, оказались безуспешными. Другая причина заключается, по-видимому, в количественной и качественной особенности персистенции и латенции конкретного штамма герпес-вируса в организме больного.
Диагностика герпетической инфекции
Все методы индикации и идентификации вирусов основаны на следующих принципах:
- выявление вируса per se (электронная микроскопия);
- выявление и идентификация вирусов посредством взаимодействующих с ними клеток (накопление вирусов в чувствительных к ним клетках);
- выявление и идентификация вирусов с помощью антител (МФА, ИФА, РАЛ, ИБ, РН, РСК);
- выявление и идентификация нуклеиновых кислот (ПЦР, МГ).
Электронная микроскопия: быстрая диагностика позволяет обнаружить ГВ или их компоненты непосредственно в пробах, взятых от больного, и дать быстрый ответ через несколько часов. Возбудитель выявляют с помощью электронной микроскопии клинического материала при негативном контрастировании.
Серологические методы уступают по информативности и чувствительности другим способам лабораторной диагностики и не позволяют с достаточной степенью достоверности установить этиологию той или иной формы заболевания. Нарастание титров антител происходит
в поздние сроки (через несколько недель) после заражения или реактивации вируса, и в то же время оно может и не наблюдаться у иммунодефицитных лиц. Для установления 4-кратного нарастания титра антител к герпес-вирусной инфекции (показатель первичной инфекции) необходимо исследование парных сывороток. Серологические реакции (РСК, РН) обладают высокой специфичностью, но относительно низкой чувствительностью, а кроме того, сложны в постановке.
Широкое практическое применение получили иммунофлюоресцентный метод, ИФА, РАЛ, ИБ.
Наиболее точным методом диагностики герпес-вирусной инфекции является выделение вируса из различных клеточных культур.
Для обнаружения вируса герпеса используют молекулярно-биологические методы: полимеразную цепную реакцию и реакцию молекулярной гибридизации, которые позволяют выявить наличие вирусной нуклеиновой кислоты в исследуемом материале. ПЦР может считаться самой чувствительной и быстрой реакцией. Чувствительность метода дает возможность определить одну молекулу искомой ДНК в образцах, содержащих 10 клеток.
Лечение герпетической инфекции
Лечение герпетической инфекции до настоящего времени остается сложной задачей. Хроническое течение процесса приводит к иммунной перестройке организма: развитию вторичной иммунной недостаточности, угнетению реакции клеточного иммунитета, снижению неспецифической защиты организма. Несмотря на разнообразие лекарственных препаратов, использующихся для лечения герпетической инфекции, лекарственных средств, обеспечивающих полное излечение от герпеса, не существует. Герпес-вирусная инфекция относится к трудно контролируемым заболеваниям. Это связано, в первую очередь, с разнообразием клинических поражений, развитием резистентности вируса к лекарственным средствам, наличием у герпес-вирусов молекулярной мимикрии. Поэтому для успешного лечения герпетической инфекции необходимо правильно подобрать противовирусный препарат, его дозу и длительность лечения, использовать комбинацию различных лекарств. В схемы терапии для повышения эффективности лечения необходимо также включать иммунобиологические препараты, способствующие коррекции иммунного статуса, а также патогенетические средства, облегчающие состояние пациента.
В настоящее время все антигерпетические средства подразделяются на 3 основные группы антивирусных препаратов (табл. 3).
Механизм действия химиопрепаратов (аномальных нуклеозидов: валтрекса, вектавира, фамвира, цимевена) связан с угнетением синтеза вирусной ДНК и репликации вирусов путем конкурентного ингибирования вирусной ДНК-полимеразы.
В препаратах-иммуномодуляторах (алпизарин, имунофан, ликопид, полиоксидоний) активно действующие вещества обладают иммуностимулирующими свойствами в отношении клеточного и гуморального иммунитетов, окислительно-восстановительных процессов, синтеза цитокинов.
Препараты-индукторы ИФН (амиксин, неовир, циклоферон) сочетают этиотропный и иммуномодулирующий эффекты действия. Препараты индуцируют образование эндогенных ИФН (α, β, γ) Т- и В-лимфоцитами, энтероцитами, гепатоцитами.
Особое место среди средств антигерпес-вирусной терапии занимает герпетическая вакцина для активации клеточного иммунитета, его иммунокоррекции в фазе ремиссии. Вакцинация преследует 2 цели: предупреждение первичной инфекции и возникновения состояния латентности, а также предупреждение или облегчение течения заболевания.
Однако, несмотря на наличие обширного списка антигерпетических препаратов, герпес остается до сих пор плохо контролируемой инфекцией. Это обусловлено и генотипическими особенностями возбудителя, и длительной персистенцией вируса в организме, и формированием штаммов, устойчивых к антивирусным препаратам. Максимальный клинический эффект может быть получен только при рациональной комплексной терапии лекарственных средств с различным механизмом действия.
Санкт-Петербургской группой ученых вирусологов и инфекционистов во главе с В. А. Исаковым предложена программа лечения и профилактики герпетической инфекции (табл. 4).
Преимущества комплексной терапии ГИ.
- Сочетанное применение противогерпетических химиопрепаратов и иммунобиологических средств обеспечивает синергидный эффект.
- Благодаря снижению дозы противовирусного ХПП уменьшается вероятность развития побочных эффектов, сокращается токсическое воздействие на организм больного.
- Снижается вероятность возникновения устойчивых штаммов герпес-вирусов к данному препарату.
- Достигается иммунокорригирующий эффект.
- Сокращается продолжительность острого периода болезни и сроков лечения.
Таким образом, терапия ГИ является сложной и многокомпонентной задачей.
По вопросам литературы обращайтесь в редакцию.
Т. К. Кускова, кандидат медицинских наук
Е. Г. Белова, кандидат медицинских наук
МГМСУ, Москва
Читайте также:

