Герпес на губах при пневмонии
Обновлено: 25.04.2024
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Вирус Эпштейна–Барр: причины появления, симптомы, диагностика и способы лечения.
Вирус Эпштейна–Барр может инфицировать различные типы клеток, включая B-клетки иммунной системы (разновидность лейкоцитов – белых кровяных телец) и эпителиальные клетки слизистых оболочек.
ВЭБ является представителем ДНК-содержащих вирусов из семейства Herpesviridae (герпесвирусы), подсемейства гамма-герпесвирусов и рода лимфокриптовирусов. В процессе репликации (самокопирования) вируса экспрессируется свыше 70 различных вирусспецифических белков. В настоящее время выделены группы иммуногенных белков, определение антител к которым дает возможность дифференцировать стадию инфекции (ЕА – ранний антиген, ЕВNА-1 — ядерный антиген, VCA — капсидный антиген, LMP — латентный мембранный белок).
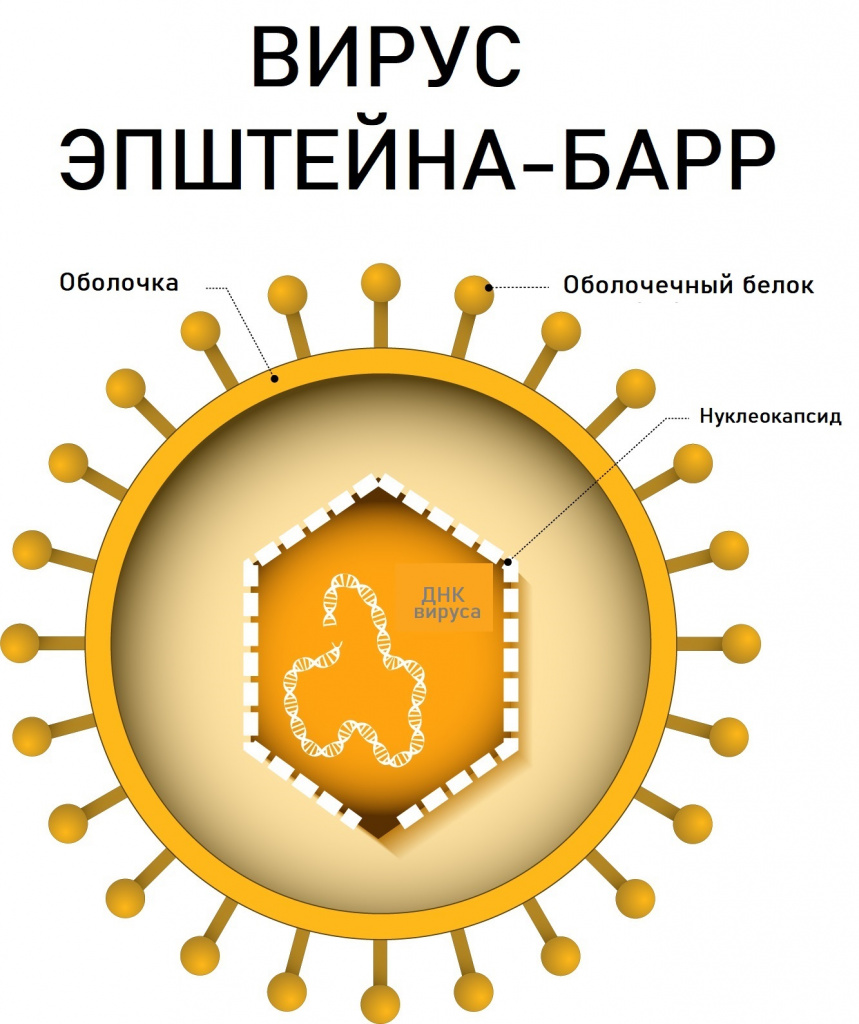
Причины появления заболеваний, вызванных вирусом Эпштейна-Барр
Вирус может распространяться от человека к человеку через биологические жидкости (воздушно-капельный путь передачи). Вот почему инфекционный мононуклеоз, одно из самых известных заболеваний, вызываемых ВЭБ, называют «болезнью поцелуев».
Другой способ заражения – контактно-бытовой (вирус передается через зубные щетки, столовые приборы, полотенца и т.д.). ВЭБ также может распространяться через кровь и сперму.
ВЭБ размножается в В-лимфоцитах и эпителиальных клетках, в связи с чем характерно многообразие клинических проявлений данной патологии. Важной отличительной чертой вируса является то, что он не тормозит и не нарушает размножение В-лимфоцитов, а, наоборот, стимулирует его. В этом заключается особенность возбудителя - он размножается в клетках иммунной системы, заставляя их клонировать свою, вирусную, ДНК.
Хронический воспалительный процесс, вызванный ВЭБ, приводит к структурным и метаболическим нарушениям пораженных тканей, что является причиной возникновения разнообразной соматической патологии.
Классификация вируса Эпштейна-Барр
Единой классификации вирусной инфекции Эпштейна-Барр (ВИЭБ) не существует, к использованию в практической медицине предлагается следующая:
- по времени инфицирования – врожденная и приобретенная;
- по форме заболевания – типичная (инфекционный мононуклеоз) и атипичная: стертая, асимптомная, с поражением внутренних органов;
- по тяжести течения – легкая, средней степени и тяжелая;
- по продолжительности течения – острая, затяжная, хроническая;
- по фазе активности – активная и неактивная;
- смешанная инфекция – чаще всего наблюдается в сочетании с цитомегаловирусом.
- Инфекционный мононуклеоз (железистая лихорадка, болезнь Филатова) – распространенное инфекционное заболевание, основными проявлениями которого является подъем температуры до высоких значений, увеличение лимфатических узлов, воспаление слизистой оболочки глотки, увеличение печени и селезенки. ВЭБ в данном случае проникает через эпителий слизистых оболочек верхних дыхательных путей.
- Лимфогранулематоз (болезнь Ходжкина) и некоторые виды неходжкинских лимфом – группа заболеваний, объединенных злокачественной моноклональной пролиферацией лимфоидных клеток в лимфоузлах, костном мозге, селезенке, печени и желудочно-кишечном тракте.
- Синдром хронической усталости – состояние, характеризующееся длительным чувством усталости, которое не проходит после продолжительного отдыха.
- Синдром Алисы в стране чудес – состояние, клиническим проявлением которого является нарушение ощущения своего тела и отдельных его частей. Человек ощущает себя или части своего тела очень большими или очень маленькими по сравнению с действительностью.
- Гепатит, спровоцированный ВЭБ, часто является осложнением инфекционного мононуклеоза. Появляется слабость, тошнота, желтушность кожи и слизистых, увеличивается печень.
- Герпетическая инфекция в виде генитального или лабиального (на губах) поражения. Также возможен стоматит, вызванный ВЭБ. При активации инфекции появляется чувство жжения и боль, а затем множество маленьких пузырьков.
- Посттрансплантационная лимфопролиферативная болезнь – вторичное злокачественное заболевание, развивающееся после трансплантации гемопоэтических стволовых клеток (метод лечения, применяемый при онкологии, заболеваниях крови и др.), ассоциированное с ВЭБ-инфекцией.
- Рассеянный склероз – хроническое аутоиммунное заболевание, при котором поражается миелиновая оболочка нервных волокон головного и спинного мозга. Характеризуется большим количеством симптомов и зависит от уровня поражения: часто снижается мышечная сила, угасают рефлексы, появляются параличи (обездвиженность) различных локализаций.
- Волосатая лейкоплакия – на слизистой оболочке языка по бокам, на спинке либо на его нижней части появляются белые участки с шероховатой поверхностью. Они безболезненны и не причиняют существенного дискомфорта. Основная опасность заключается в возможности озлокачествления измененных клеток слизистой.
- Назофарингеальная карцинома – злокачественное образование глотки. Среди его симптомов часто встречаются заложенность носа, потеря слуха, частые отиты, появление крови в слюне, кровянистые выделения из носа, увеличение лимфоузлов, головные боли.
- Аутоиммунный тиреоидит – хроническое заболевание щитовидной железы, при котором в организме образуются антитела к тканям щитовидной железы. При данном заболевании возможно появление зоба (увеличение щитовидной железы), развитие симптомов гипотиреоза: отеки, повышенная утомляемость, сонливость, запоры, сухость кожи, выпадение волос.
Лабораторное обследование включает:
-
вирус Эпштейна–Барр, определение ДНК в крови (Epstein Barr virus, DNA);
Определение ДНК вируса Эпштейна-Барр в крови методом полимеразной цепной реакции (ПЦР) с детекцией в режиме «реального времени». Вирус Эпштейна - Барр (ВЭБ) является причиной инфекционного мононуклеоза. С вирусом Эпштейна-Барр связывают также этиологию некоторых онкологических.
Клиника и диагностика поражений вирусом простого герпеса при иммунодефиците
Поражение лица и ротоглотки наиболее типично для реактивации герпесвирусной инфекции. Морфология герпетических высыпаний зависит от типа пораженной эпителиальной ткани. На красной кайме губ и коже лица первичными элементами являются мелкие везикулы, которые возникают последовательно, имеют тенденцию к быстрому слиянию и формированию крупного вялого пузыря. Эти элементы умеренно болезненны, типично ощущение жжения.
После отторжения некротизированного эпителия обнажаются эрозированные кровоточащие поверхности, по краям которых появляются новые мелкие везикулы, и элемент начинает расти от центральной части к периферии.
Суперинфицирование элементов часто приводит к возникновению глубоких некрозов, заживающих с формированием рубца. Поражение лица вирусом герпеса следует дифференцировать от поражения зигомицетами (Absidia, Rhisopus, Mucor) и Aspergillus, которые вызывают тяжелые некрозы тканей лица, расплавление хрящей и костей лицевого скелета с быстрым обезображиванием внешнего облика пациента.
На слизистой оболочке рта наиболее типичным является возникновение нескольких одинаковых поверхностных некротических элементов диаметром 1—3 мм, которые затем углубляются и увеличиваются в размерах, часто сливаются. В самых тяжелых случаях значительная площадь полости рта поражена крайне болезненными глубокими некрозами серого цвета с кровоточащими участками эрозий.
В прошлом, до введения всеобщей профилактики ацикловиром, у больных после ТКМ герпетические поражения ротоглотки нередко становились причиной обструкции верхних дыхательных путей, в связи с чем возникала необходимость в протективной интубации трахеи.
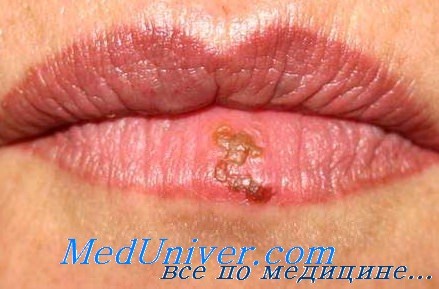
Герпетические элементы практически всегда суперинфицируются разнообразной оральной флорой: грибами рода Candida, стрептококками, фузобактериями и другими анаэробами, реже грамотрицательными бактериями, особенно стремительно в условиях нейтропении. Для практики полезно считать, что при нейтропении не бывает изолированных герпетических поражений полости рта, и стоматиты, объединяемые клиницистами под термином «герпетические», всегда являются результатом комбинированного вирусно-бактериально-грибкового поражения.
Стоматиты чаще всего возникают на фоне тяжелой нейтропении, обратное развитие претерпевают только по выходе из агранулоцитоза, полностью регрессируя через 5—12 дней после нормализации числа гранулоцитов. Заживление элементов всегда происходит от краев к центру — симптом «высыхающей лужи».
Процесс заживления глубоких некрозов часто проходит стадию отторжения фибриновых пленок с обнажением ригидных сосудов десен, что может быть чревато значительной кровопотерей, особенно у детей младшего возраста. Мы наблюдали кровотечения из язв на деснах в объеме до 400 мл в сутки. Кроме того, заживление язв нередко сопровождается обильной саливацией: потерей до 700—900 мл слюны в сутки, что может стать причиной обезвоживания у детей.
Знание закономерностей развития герпетического стоматита позволяет сделать вывод, что при нейтропении лечение его нельзя ограничивать ацикловиром: необходимо назначать препараты, активные в отношении стрептококков, анаэробов, грамотрицательной флоры и грибов. Монотерапии, отвечающей таким требованиям, не существует, поэтому при фебрильной нейтропении, сопровождающейся стоматитом, мы наряду с ацикловиром всегда используем бета-лактам с расширенным спектром антианаэробной активности (пиперациллин/тазобактам, имипенем, амоксициллин/клавуланат) либо к другим бета-лактамам добавляем метронидазол.
Часто драматического улучшения удается добиться при использовании клиндамицина или пенициллина. Кроме того, мы рекомендуем и сами всегда используем системную противогрибковую терапию.
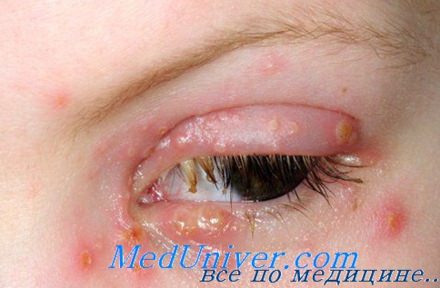
Поражение вирусом простого герпеса пищевода
При распространении инфекции из полости ротоглотки поражается верхний сегмент пищевода. Другой путь — контаминация инфицированной герпес-вирусом слюной эрозированного (в результате желудочно-пищеводного рефлюкса или рвоты) пищевода. В этом случае поражается нижний сегмент пищевода. Клиническая картина среднего и дистального эзофагита очень типична: больные жалуются на ощущение кома за грудиной, сильное жжение и боли, которые значительно усиливаются после глотания и рвоты.
Следует отметить, что последняя локализация — одно из самых опасных проявлений герпесвирусной инфекции, поскольку именно дистальный эзофагит служит воротами для развития инвазивных бактериальных и грибковых инфекций. По морфологической картине (язвенно-некротические элементы, захватывающие все слои пищевода) отличить герпетическое поражение от цитомегаловирусного, бактериального или грибкового не представляется возможным. Без проведения биопсии установить точный микробиологический диагноз невозможно.
Если принято решение выполнить эзофагоскопию и биопсию, то для диагностики герпес-вирусного поражения необходимо получить биоптат эпителия края язвы, а для диагностики ЦМВ-поражения — ее дна. Это связано с тем, что герпес-вирус поражает эпителий, а цитомегаловирус — строму.
При герпетическом эзофагите, как и при герпетическом стоматите, особенно больным с фебрильной нейтропенией, наряду с ацикловиром всегда следует назначать антимикотик системного действия (амфотерицин В внутривенно в дозе 0,3—0,5 мг/кг в сутки, флюконазол внутривенно или внутрь, возможно вориконазол и итраконазол) и системные антибиотики, обладающие антианаэробной активностью.
Важную роль играют антацидная и антирефлюксная (ранитидин или омепразол, дофаминовые антагонисты) терапия и адекватное обезболивание наркотиками.
Поражение бронхиального дерева и легких вирусом простого герпеса
Чаще всего герпетический трахеобронхит развивается у иммунокомпрометированных больных с герпетическим эзофагитом, которые интубированы и находятся на искусственной вентиляции легких. Наблюдаются также фокальные герпетические пневмонии. Диффузные пневмонии с развитием дыхательной недостаточности, напротив, являются следствием диссеминированной герпетической инфекции у больных с глубоким дефицитом клеточного или гуморального иммунитета.
Поражение вирусом простого герпеса центральной нервной системы
Герпетический энцефалит — очень редкое проявление реактивации герпесвирусной инфекции у онкогематологических больных. Он не отличается от энцефалита у иммунокомпетентного хозяина, т. е. характеризуется энцефалитическим синдромом и признаками воспаления и некроза на компьютерных и ядерно-магнитных томограммах. Поражение спинного мозга вирусом герпеса является казуистикой. Описаны случаи восходящего поперечного миелита.
Диагностика поражений вируса простого герпеса
Известно несколько методов быстрой и специфической диагностики герпесвирусной инфекции. Классическим методом является выделение вируса, основанное на его цитопатическом действии на чувствительные культуры клеток млекопитающих. Этот метод достаточно быстрый (90 % позитивных результатов в первые 3 дня, 100% —в первые 7 дней культивирования) и весьма специфичный.
Существует более быстрый метод (комбинация иммуноферментного и культурального методов), которым выявляют наличие вирусных антигенов в чувствительной клеточной культуре, зараженной исследуемым материалом. Этот метод аналогичен описанному ранее методу shell vial для ЦМВ и позволяет получить результаты в течение суток.
Следует отметить, что, как и при ЦМВ-инфекции, серологические данные (наличие специфического IgM или повышение титра IgG) и выделение вируса простого герпеса со слюной не несут полезной оперативной информации. Особенно важно это при диагностике герпесвирусного энцефалита. Нам доводилось наблюдать неадекватную интерпретацию серологических тестов у больных с энцефалитическим синдромом и необоснованное назначение ацикловира в высоких дозах. Единственным надежным методом диагностики является проведение биопсии ткани головного мозга и вирусологического исследования.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Каким образом можно повысить эффективность этиотропной терапии и одновременно добиться снижения побочных эффектов, проявляющихся в ходе ее применения? Как можно повысить функциональную активность собственной иммунной системы и ускорить восстановление
Каким образом можно повысить эффективность этиотропной терапии и одновременно добиться снижения побочных эффектов, проявляющихся в ходе ее применения?
Как можно повысить функциональную активность собственной иммунной системы и ускорить восстановление ее нарушенных звеньев?
Как обойти возможность аллергизации организма и развития иммунодефицита?
Роль иммунной системы в противоинфекционной защите организма доказана. Появляется все больше данных о прямой и обратной связи иммунной системы с системой интерферона. Состояние и активность этих систем во многом определяет исход заболевания, характер его течения.
В лечении инфекционно-воспалительных заболеваний традиционно применяют антибиотики и химиотерапевтические препараты. Тем не менее часто такая терапия не оправдывает возлагаемых на нее надежд. Это объясняется прежде всего резистентностью многих микроорганизмов к лекарственным средствам, имеющимся в арсенале практической медицины. Например, по статистике,
| Система интерферона направлена на распознавание и элиминацию чужеродной генетической информации. Основные эффекты интерферона можно разделить на противовирусный, противомикробный, антипролиферативный, иммуномодулирующий, осуществляемые во взаимодействии с другими цитокинами, и радиопротекторный. Многообразие обнаруженных и изученных к настоящему времени функций ИФН указывает на их контрольно-регуляторную роль в сохранении гомеостаза |
- ОРВИ — 1 курс, пневмония (бактериальная — 1-2 курса, вирусная — 1 курс, хламидийная — 1 курс)
- сепсис — 2-3 курса
- менингит — 1-2 курса
- герпетическая инфекция — 2 курса,
- энтеровирусная инфекция — 1-2 курса
- цитомегаловирусная инфекция — 2-3 курса
- микоплазмоз — 2-3 курса
Уместно заметить, что в последние годы отмечается рост аутоиммунных заболеваний (реактивные артриты, гломерулонефриты, рассеянный склероз и др.), одной из причин которых является вирусное инфицирование. Терапия данных заболеваний также требует коррекции иммунной и интерфероновой систем.
В настоящее время в арсенале практической медицины достойное место занимают препараты интерферонов. И это неудивительно. Интерфероны как естественные факторы неспецифической защиты организма и медиаторы иммунитета обладают самым широким спектром действия.
Сначала это были препараты лейкоцитарного интерферона (ИФН) человека, которые впоследствии вытеснились препаратами рекомбинантных ИФН.
Изначально препараты ИФН применялись для лечения только вирусных заболеваний (грипп, вирусные гепатиты, герпес, клещевой энцефалит и др.). Благодаря выраженному иммуномодулирующему действию ИФН была доказана их клиническая эффективность при лечении многих бактериальных и протозойных инфекций (бактериальные и грибковые менингиты, сепсис, хламидиоз, уреаплазмоз и др.), различных аллергозов, аутоиммунных заболеваний (ревматоидный артрит, гломерулонефриты и др.), онкологической патологии (лейкозы, лимфосаркомы, лимфомы и др.).
В настоящее время существует довольно много препаратов рекомбинантных ИФН: реаферон, реальдирон, интрон-А, роферон, велферон. Большинство из них обладает высокой эффективностью, но при их применении часто возникают значительные трудности. Данные препараты вводятся в организм больного, как правило, в высоких дозах (3-10 млн. МЕ в сутки) и парентеральным путем (внутривенно, внутримышечно, подкожно), что вызывает существенные побочные эффекты: повышение температуры, гриппоподобный синдром, артралгии, депрессивное состояние, диарею.
- Лекарственная форма препарата виферон и его компоненты
Выбранная лекарственная форма — суппозитории — обеспечивает простой, безопасный и безболезненный способ введения.
с 28 по 34 неделю гестации применяют виферон-1 по 2 свечи в сутки с 12-часовым интервалом через день (на курс 10 свечей).
С 35 по 40 неделю гестации применяют виферон-2 по 2 свечи в сутки с 12-часовым интервалом ежедневно.
Курс лечения составляет 5 дней.
Всего 7 курсов в течение 12 недель.
Перерыв между курсами 7 дней.
Продолжительность лечения определяется динамикой клинико-лабораторных показателей.
В качестве действующего начала был выбран человеческий рекомбинантный ИФН-a2b — один из наиболее распространенных в клинической практике ИФН.
В состав всех вариантов виферона, помимо рекомбинантного ИФН-а2b, вошли антиоксиданты — a-токоферола ацетат (витамин Е) и аскорбиновая кислота (витамин С) в терапевтически эффективных дозах.
Виферон выпускается в трех вариантах: виферон-1, виферон-2, виферон-3.
Виферон-1 содержит человеческий рекомбинантный интерферон-a2 в количестве 150 000 МЕ (международных единиц) в одной свече.
Виферон-2 содержит человеческий рекомбинантный интерферон-a2 в количестве 500 000 МЕ в одной свече.
Виферон-3 содержит человеческий рекомбинантный интерферон-a2 в количестве 1 000 000 МЕ в одной свече.
Виферон-3 назначается преимущественно для лечения вирусных гепатитов у детей и взрослых.
- Терапевтическое действие препарата виферон
Комплексным составом виферона обусловлен ряд его преимуществ: в сочетании с антиоксидантами противовирусная активность рекомбинантного интерферона возрастает в 10-14 раз, усиливается его иммуномодулирующее действие на Т- и В-лимфоциты, нормализуется содержание иммуноглобулина Е, отсутствуют побочные эффекты, возникающие при парентеральном введении препаратов интерферона. Установлено, что при длительном применении виферона в течение двух лет не образуются антитела, нейтрализующие антивирусную активность рекомбинантного интерферона-2.
Взаимодействие компонентов виферона позволяет значительно снизить курсовые дозы и продолжительность курсов антибиотико- и гормонотерапии.
Виферон положительно зарекомендовал себя при лечении вирусных и бактериальных инфекций у новорожденных: ОРВИ, сепсис, пневмония, менингит, специфическая внутриутробная инфекция (хламидиоз, герпес, цитомегалия, уреаплазмоз).
Базовое лечение + виферон  |
Базовое лечение  |
| Рисунок 1. Динамика и исчезновение хламидийного АГ из крови и верхних дыхательных путей (ВДП) у новорожденных детей |
Необходимо подчеркнуть, что препарат высоко эффективен при лечении пневмоний хламидийной этиологии (рис. 1).
Клиническая эффективность виферона заключается в уменьшении длительности инфекционного токсикоза, ускорении разрешения патологического очага (сокращение длительности кашля, одышки, более быстрая нормализация показателей КОС). Включение виферона способствовало сокращению антибактериальной терапии на 10 дней и снижению общей продолжительности заболевания в среднем на 8 дней (табл. 1).
При включении виферона в курс терапии менингитов различной этиологии у новорожденных детей цитоз в ликворе нормализовался на 2 недели раньше, чем в группе сравнения. Одновременно отмечалось значительно меньшее количество гнойных и неврологических осложнений.
Новорожденным детям (в том числе недоношенным с гестационным возрастом более 34 недель) показан виферон-1. Препарат применяют по 1 свече 2 раза в сутки через 12 часов. Курс лечения составляет 5 дней.
Недоношенным детям с гестационным возрастом менее 34 недель виферон-1 назначают по 1 свече 3 раза в сутки через 8 часов. Курс лечения составляет 5 дней.
Включение виферона в комплексную терапию хронических вирусных гепатитов В, С, D у детей способствовало уменьшению патологического процесса в печени, снижению активности АСТ и АЛТ, снижению титров HBsAg, исчезновению или сероконверсии HBeAg на анти-HBe. Происходило усиление функции макрофагов. Это
Таблица 1. Эффективность лечения вифероном новорожденных детей с пневмониями хламидийной этиологии (Кешищян Е. С., 1990)
выражалось в увеличении процента макрофагов, способных к хемосинтезу. При длительном 6-месячном курсе виферонотерапии у больных хроническим вирусным гепатитом минимальной степени активности ремиссия наблюдалась в 62% случаев, в то время как в группе больных, не получавших виферон, ремиссии не наступало. У 71% больных хроническим вирусным гепатитом выраженной степени активности и циррозом печени, находящихся на глюкокортикоидной терапии, включение виферона в схему лечения позволяло снизить дозу преднизолона в 3,5 раза (Рейзис А.Р., Дрондина А. Н., 1992), а у 28% больных — отменить гормоны полностью (Чистова Л. В. и др., 1995). Интересно отметить, что в группе детей с хроническим вирусным гепатитом С у 83% детей отмечено наступление ремиссии сразу после отмены виферонотерапии, а у остальных стойкое улучшение
Необходимо подчеркнуть, что антител, нейтрализующих антивирусную активность рекомбинантного интерферона-2, в крови больных, получавших длительный курс виферонотерапии, не обнаружено (Чистова Л. В. и др., 1995).
Отмечено успешное использование виферона вкупе с применением экстракорпоральных методов лечения: плазмафереза и гемосорбции в комплексном лечении детей, больных хроническим вирусным гепатитом выраженной степени активности и циррозом печени. Проведение 14-дневного курса виферонотерапии перед плазмаферезом и/или гемосорбцией предупреждало развитие ОРВИ и обострение герпетических заболеваний. В группе сравнения присоединение интеркуррентных заболеваний наблюдалось в 100% случаев (Кладова О. В., 1995).
В комплексной терапии острых и хронических вирусных гепатитов В, С, D детям до 7 лет назначается виферон-2, старше 7 лет — виферон-3. Препарат назначается по 2 свечи в сутки ежедневно с 12-часовым интервалом в течение 10 дней. Далее 3 раза в неделю через день по 2 свечи в сутки с 12-часовым интервалом в течение 1 месяца при остром гепатите и 6-12 месяцев при хроническом гепатите. Продолжительность лечения определяется динамикой клинико-лабораторных показателей.
Больным хроническим гепатитом выраженной степени активности и циррозом печени перед проведением плазмафереза и/или гемосорбции показано применение виферона-1 или виферона-2 (в зависимости от возраста) в течение 14 дней по 2 свечи ежедневно с 12-часовым интервалом.
В последние годы виферон успешно и эффективно применяется в акушерской практике. Виферон разрешен к применению у беременных женщин (начиная с 28 недели беременности) с вирусно-бактериальными урогенитальными инфекциями (вирус простого герпеса 1 и 2 типов, цитомегаловирус, хламидиоз, микоплазмоз, уреаплазмоз, токсоплазмоз). В процессе виферонотерапии отмечалось достоверное повышение уровня специфических противовирусных иммуноглобулинов класса G, а также нормализация относительных показателей субпопуляции лимфоцитов (CD3, CD4, CD4/CD8).
На фоне применения препарата у беременных выявлено снижение колонизации родовых путей условно патогенными микроорганизмами, уменьшение обсеменности эндоцервикса хламидиями, уреаплазмами, генитальным герпесом. Элиминация возбудителей происходила у каждой второй-третьей больной. У каждой шестой пациентки происходило восстановление микробиоциноза влагалища без дополнительного применения эубиотиков. Противовирусный характер действия препарата состоял в сокращении длительности рецидивов и увеличении межрецидивных промежутков. Включение в курс терапии беременных с аутоиммунными заболеваниями позволило отказаться от назначения глюкокортикоидов.
Высокая эффективность виферона состояла в выраженном снижении частоты генерализованных форм внутриутробной инфекции с 25,6% до 4,7% (Тареева Т. Г. и др., 1996).
Завершены клинические испытания виферона в комплексном лечении гломерулонефрита, ассоциированного с вирусом гепатита В, герпесвирусной и цитомегаловирусной инфекций.
Таблица 2. Эффективность поддерживающей терапии вифероном через 13-18 месяцев от начала лечения у детей с хроническим вирусным гепатитом В
Отмечено, что применение виферона способствует ускоренной ликвидации симптомов интоксикации, клинических признаков пиелонефрита и бактериурии. Катамнестическое наблюдение за детьми, получавшими лечение вифероном, свидетельствует о сохранении стойкой клинико-лабораторной ремиссии в течение 6-12 месяцев у большинства больных.
В последние годы у больных с инфекцией мочевой системы нередко выявляется хламидиоз, при котором течение болезни носит торпидный характер с частым рецидивированием. Это позволило включить в комплексную терапию наряду с антибактериальными препаратами, действующими на хламидии (макролиды, антибиотики тетрациклинового ряда), виферон в качестве иммунокорректора. При гломерулонефрите виферон назначался как в активную фазу, так и в периоде стихания процесса. У детей с нефротической формой гломерулонефрита выявлено более раннее наступление ремиссии. Более того, получена стойкая клинико-лабораторная ремиссия у отдельных детей с нефротической формой на фоне HВs-антигенемии, которой не удавалось добиться до назначения виферона. Доказана высокая эффективность виферона для профилактики гнойно-септических послеоперационных осложнений. Препарат назначается ежедневно по 2 свечи с 12-часовым интервалом в течение 5 дней.
Выявлен хороший эффект виферона при комплексном лечении дисбактериоза кишечника у детей. Виферон назначался ежедневно по 2 свечи в день с 12-часовым интервалом в течение 10 дней, затем поддерживающая доза — по 2 свечи в неделю до 1 месяца. После проведенного курса виферонотерапии отмечено восстановление или тенденция к нормализации микрофлоры кишечника. На рис. 2 приведена клиническая эффективность виферона при различных заболеваниях.
- Взаимодействие с другими лекарственными препаратами
Виферон совместим и хорошо сочетается со всеми лекарственными препаратами, традиционно применяемыми при лечении указанных ниже заболеваний (антибиотики, химиопрепараты, глюкокортикостероиды, иммуносупрессоры, индукторы интерферона).
Назначение виферона позволяет значительно снизить курсовые дозы и длительность применения антибиотиков, глюкокортикоидов, а также уменьшить токсический эффект при применении иммуносупрессивных препаратов. Виферон хорошо переносится больными, не дает побочных эффектов и аллергических реакций.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Герпес: причины появления, симптомы, диагностика и способы лечения.
Определение
Герпесом, или герпетической инфекцией, называют несколько заболеваний, вызываемых вирусами отряда Herpesvirales семейства Herpesviridae.
Все они характеризуются поражением кожи, слизистых оболочек с локализацией либо в области глаз, носа и губ, гениталий, а также нервных волокон.
У лиц с иммунодефицитом могут наблюдаться генерализованные формы инфекции с вовлечением в процесс других органов и тканей.

Среди известных науке восьми типов герпеса самым распространенным является вирус герпеса простого типа (Herpes simplex virus).
Простой вирус герпеса достаточно неустойчив во внешней среде. В условиях комнатной температуры сохраняется до 24 часов, на металле — до 2 часов. Под действием температуры выше 50°C погибает за 30 минут, под действием спирта и хлорсодержащих веществ - в течение нескольких минут, при замораживании сохраняется до пяти суток.
Причины герпетической инфекции
Источником инфицирования всегда служит человек. Он заразен в любую фазу болезни или носительства, но преимущественно при обострении.
Возбудитель может передаваться воздушно-капельным, контактно-бытовым или половым путем, а также от матери плоду через плаценту, во время родов или грудного вскармливания.
К вирусу восприимчивы все люди, хотя у многих отмечаются бессимптомные формы заболевания. Попадая через слизистую рта, половых органов или дыхательные пути в организм человека, герпесная инфекция остается в нем навсегда. Вирус, скрытый внутри клетки-хозяина, не доступен для иммунных клеток, уничтожающих возбудителей. Вирус активизируется при ослаблении иммунитета в результате переохлаждения, перегрева, простудного заболевания, недостатка витаминов, переутомления, стресса, нехватки сна. Рецидив инфекции могут вызвать травмы, оперативные вмешательства, а также половой контакт при условии повреждения слизистой оболочки. Использование лекарственных и косметических средств, содержащих стероидные гормоны, также способствует манифестации вируса герпеса.
Классификация герпеса
В МКБ-10 (Международной классификации болезней) выделяют две группы заболеваний, связанных с вирусом простого герпеса:
- Инфекционные герпетические заболевания:
- герпетическая экзема (экзема Капоши);
- герпетический везикулярный дерматит;
- герпетический гингивостоматит и фаринготонзиллит;
- герпетический менингит;
- герпетический энцефалит;
- офтальмогерпес;
- диссеминированная герпетическая болезнь (герпетический сепсис);
- другие формы герпетических инфекций;
- неуточненная герпетическая инфекция.
- Генитальные герпетические инфекции:
- герпетические инфекции перианальных кожных покровов и прямой кишки;
- неуточненная аногенитальная герпетическая инфекция.
По клинической картине и локализации высыпаний:
- Типичные формы:
- герпес кожи — с поражением губ, крыльев носа, лица, рук, ягодиц и других частей тела;
- герпес глаз — иридоциклит, кератит, конъюнктивит, неврит зрительного нерва;
- герпес слизистых оболочек желудочно-кишечного тракта — стоматит, гингивит, фарингит, эзофагит;
- герпес половых органов — поражение слизистой оболочки полового члена, влагалища, вульвы, цервикального канала;
- герпес внутренних органов — гепатит, пневмония, панкреатит, трахеобронхит;
- герпес нервной системы — неврит, менингит, менингоэнцефалит, поражения бульбарных нервов, энцефалит;
- генерализованный простой герпес — висцеральная форма (пневмония, гепатит, эзофагит) и диссеминированная форма (сепсис).
- Атипичные формы:
- герпетиформная экзема Капоши — обширные сливающиеся высыпания по всему телу;
- абортивный герпес — почти незаметные папулы на грубой коже или дискомфорт без высыпаний;
- язвенно-некротический герпес — с развитием некроза тканей;
- эрозивно-язвенный герпес — с образованием язв и эрозий;
- геморрагический герпес — с кровянистым пропитыванием высыпаний и тканей;
- отечный герпес — с отеком тканей и болью в области губ и век;
- зостериформный простой герпес — с локализацией по ходу нервного ствола;
- диссеминированный герпес — с тенденцией перехода в генерализованную форму при ВИЧ;
- рупиоидный герпес — возникает на лице с присоединением вторичной бактериальной флоры;
- мигрирующий герпес — с тенденцией к изменению локализации высыпаний.
- латентная стадия — носительство с отсутствием симптомов;
- локализованная стадия — наличие одного очага поражения;
- распространенная стадия — наличие не менее двух очагов поражения;
- генерализованная стадия — висцеральная, диссеминированная.
При заражении герпесом детей в возрасте от 6 месяцев до 3 лет чаще всего развивается герпетический стоматит, для которого характерно острое начало с симптомами интоксикации и подъемом температуры.
На слизистой оболочке полости рта появляются сгруппированные пузырьки с прозрачным содержимым, на месте которых после вскрытия образуются болезненные эрозии. У детей старшего возраста первичный герпес характеризуется появлением зудящих пузырьков на красной кайме губ и коже носогубного треугольника. После их вскрытия остаются неглубокие язвочки, которые покрываются корочками. Корочки, отпадая, не оставляют следов на коже.
При первичном заражении взрослых вирусом простого герпеса симптомы более выражены, чем при дальнейших рецидивах. Больной испытывает озноб, головные боли, повышенную утомляемость, у него отсутствует аппетит, может наблюдаться расстройство сна. Покраснение, а затем характерные пузырьки появляются на губах, возле крыльев носа. В некоторых случаях увеличиваются подчелюстные лимфоузлы.
Герпетические нейроинфекции сопровождаются наиболее тяжелым течением, особенно если вирус поражает оболочки или ткань головного мозга.
В этих случаях симптомы включают головные боли, подъем температуры тела, напряжение затылочных мышц, психомоторное возбуждение (болезненное состояние, при котором наблюдается беспокойство и двигательная активность различной степени выраженности, вплоть до судорог). При несвоевременной диагностике заболевания существует риск летального исхода.
Офтальмогерпес сопровождается покраснением глаза, развитием блефаро- или кератоконъюнктивита, эрозиями роговицы.
Диагностика герпеса
Типичные случаи герпетической инфекции выявляются на основании клинической картины и анамнеза заболевания. Характерно его волнообразное течение со сменой периодов обострения и ремиссии.
Косвенным признаком служит склонность к простудным заболеваниям, чувствительность к переохлаждению, периодически возникающие состояния, сопровождаемые подъемом температуры, усталостью, депрессией.

При атипичных формах герпетической инфекции необходимы дополнительные обследования: клинический анализ крови, биохимический анализ крови (общий белок, белковые фракции, С-реактивный белок, АЛТ, АСТ, ЛДГ, креатинин, электролиты: калий, натрий, хлор, кальций) и клинический анализ мочи - для выявления поражения внутренних органов и предупреждения осложнений.
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Сепсис: причины появления, симптомы, диагностика и способы лечения.
Определение
Сепсис – это патологический процесс, в основе которого лежит реакция организма в виде генерализованного воспаления на инфекцию различной природы. При сепсисе бактерии преодолевают иммунную защиту человека и распространяются из очага воспаления по всему организму. Местное воспаление, сепсис, тяжелый сепсис и септический шок – это различные формы выраженности воспалительной реакции организма на инфекционный процесс.

Истинная частота возникновения случаев сепсиса остается неизвестной, однако по оценкам исследователей, во всем мире сепсис является лидирующей причиной летальности у пациентов в критическом состоянии. Согласно результатам большого европейского исследования SOAP, включившего 3147 пациентов из 198 европейских медицинских центров, сепсис развился в 37,4% случаев, а госпитальная летальность от него колебалась от 14% случаев в Швейцарии до 41% в Португалии, в среднем составив 24,1%. Данные другого крупного исследования PROGRES (12 881 больной тяжелым сепсисом в 37 странах) показали, что госпитальная летальность в среднем составила 49,6%.
Причины возникновения сепсиса
Возбудителями сепсиса могут быть бактерии, вирусы или грибы. Но чаще сепсис имеет бактериальную природу - его причиной становятся стафилококки, стрептококки, пневмококки, менингококки, сальмонеллы, синегнойная палочка и др.
В большинстве случаев патологический процесс вызывают условно-патогенные микроорганизмы, которые присутствуют на коже, слизистых оболочках дыхательного и пищеварительного трактов, мочевыводящих путей и половых органов. Иногда при сепсисе выделяют сразу 2-3 микроорганизма.
Причиной сепсиса могут стать гнойно-воспалительные заболевания кожи (абсцессы, фурункулы, флегмоны), обширные травмы, ожоги, инфекционно-воспалительные заболевания мочевыводящей системы (пиелонефрит), живота (например, гнойно-некротический деструктивный панкреатит), тяжелая ангина, гнойный отит, пневмония, инфицирование во время родов или абортов и др.

Возможность возникновения сепсиса зависит не только от свойств возбудителя, но и от состояния иммунной системы человека - нарушения в ее работе предрасполагают к распространению инфекции. Причинами таких нарушений могут быть врожденные дефекты иммунитета, хронические инфекционные болезни (ВИЧ, гнойные процессы), эндокринные заболевания (сахарный диабет), онкологические болезни, хронические интоксикации (алкоголизм, наркомания), проникающая радиация, прием иммуносупрессоров (кортикостероидов, цитостатиков) и др.
Первичный гнойно-воспалительный очаг может возникать прямо у места входных ворот или во внутренних органах. В норме иммунные клетки организма быстро очищают кровь от чужеродных агентов. Но при ослабленном иммунитете инфекционный процесс распространяется и генерализуется, формируются вторичные септические очаги. Бактерии, «путешествуя» по крово- и лимфотоку, активно производят токсины, что приводит к интоксикации и может стать причиной инфекционно-токсического (септического) шока.
В ответ на внедрение возбудителя вырабатываются цитокины – особые белковые молекулы, которые выполняют защитные функции сначала на местном уровне, а затем, попадая в системный кровоток, продолжают работать уже на уровне всего организма. Цитокины бывают провоспалительными и противовоспалительными. В самом начале инфекционного процесса их количество находится в равновесии. Если регулирующие системы организма не способны поддерживать это равновесие, то цитокины накапливаются в кровотоке в сверхвысоких объемах, начинают доминировать их деструктивные, разрушающие эффекты, в результате повреждается сосудистая стенка, запускается синдром диссеминированного внутрисосудистого свертывания (ДВС-синдром) и полиорганная дисфункция. Вследствие полиорганной дисфункции печени, почек, кишечника появляются новые повреждающие факторы (лактат, мочевина, билирубин и др.), которые усиливают деструктивные процессы. При ДВС-синдроме в сосудах микроциркуляторного русла образуются множественные тромбы в сочетании с несвёртываемостью крови, приводящей к множественным кровоизлияниям.
Классификация заболевания
В зависимости от локализации входных ворот и первичного очага сепсис подразделяют на:
- перкутанный (чрескожный) – развивается при попадании возбудителя в организм через поврежденный кожный покров (ранки, царапины, фурункулы и др.);
- акушерско-гинекологический – развивается после родов и абортов;
- оральный (одонтогенный и тонзиллогенный) – развивается в результате первичной инфекции в полости рта;
- оториногенный – развивается в результате распространения инфекции из полости уха и/или носа;
- пневмогенный – при наличии инфекционного очага в нижних дыхательных путях;
- хирургический;
- урологический;
- пупочный – развивается у новорожденных вследствие проникновения инфекционных агентов в кровь через пупочную ранку;
- криптогенный (идиопатический, эссенциальный, генуинный) – сепсис неизвестного происхождения: первичный очаг гнойного воспаления неизвестен.
- молниеносный сепсис,
- острый сепсис,
- подострый сепсис,
- хронический сепсис (хрониосепсис).
По клиническим признакам:
1. Синдром системного воспалительного ответа (ССВО) – системная реакция организма на воздействие различных сильных раздражителей (инфекции, травмы, операции и др.) характеризуется двумя или более признаками:
- температура тела ≥ 38°С или ≤ 36°С;
- частота сердечных сокращений (ЧСС) ≥ 90 ударов в минуту;
- частота дыхания (ЧД) > 20 в минуту или гипервентиляция (РаСО2 ≤ 32 мм рт. ст.);
- лейкоциты крови > 12х109 /л или < 4х109 /л, или незрелых форм >10%.
По виду и характеру возбудителя:
- аэробный сепсис,
- анаэробный сепсис,
- смешанный сепсис,
- грибковый сепсис,
- вирусный сепсис.
Клинические проявления сепсиса могут варьировать от незначительных до критических. При молниеносном течении патологическое состояние развивается бурно - за несколько часов или суток. При остром сепсисе симптомы развиваются за несколько дней. Для хрониосепсиса характерно вялое течение и наличие малозаметных изменений, формирующихся месяцами. Рецидивирующий сепсис протекает с эпизодами обострений и затуханий.
Инкубационный период после выявления ворот инфекции или первичного очага составляет от 1 до 3-5 суток. Начало сепсиса, как правило, острое, хотя иногда может быть подострым или постепенным. Интоксикация проявляется резкой слабостью, адинамией, анорексией, нарушением сна, головной болью, расстройством сознания, менингеальным синдромом (поражением оболочек головного и спинного мозга), тахикардией, артериальной гипотензией. Температура тела держится высокой, со скачками утром и вечером. Признаки интоксикации особенно выражены на высоте лихорадки. На коже у трети больных появляется геморрагическая сыпь.
Со стороны дыхательной системы наблюдаются одышка и хрипы в легких. При нарушении функции почек снижается количество выделяемой мочи (олигурия) вплоть до полного прекращения мочеиспускания (анурия), в моче появляются следы крови, гноя. Наблюдается ухудшение функции печени с развитием желтухи и явлениями гепатита, увеличивается селезенка. Повреждение органов ЖКТ проявляется нарушением пищеварения, отсутствием аппетита, язык сухой, обложенный, нередко наблюдаются упорные септические поносы, тошнота и рвота. Метастазирование возбудителя из первичного очага с образованием вторичных очагов инфекции может приводить к инфаркту легкого, гангрене легкого, гнойному плевриту, эндокардиту (поражению внутренней оболочки сердца), воспалению сердечной мышцы (миокардиту), воспалению околосердечной сумки (перикардиту), гнойному циститу, абсцессам мозга и воспалению оболочек мозга (гнойному менингиту), гнойным артритам, флегмонам и абсцессам в мышцах.
Недостаточность функции одного органа длительностью более суток сопровождается летальностью до 35%, при недостаточности двух органов – 55%, при недостаточности функции трех и более органов летальность к четвертому дню возрастает до 85%.
Диагностика сепсиса
Для постановки диагноза «сепсис» необходимо наличие установленного или предполагаемого очага инфекционного процесса и два или более признака синдрома системной воспалительной реакции.
Производят посевы крови, мочи, ликвора, мокроты, гнойного экссудата из элементов сыпи, абсцессов, пунктатов плевры, суставов и других септических очагов. Посевы делают многократно, чтобы определить чувствительность к максимальному количеству антибиотиков. Используется также обнаружение антигенов в крови методом ИФА и определение генома возбудителя методом ПЦР.
Одним из наиболее специфичных и чувствительных маркеров бактериальной инфекции служит прокальцитониновый тест. Прокальцитонин – один из основных маркёров системного воспаления, вызванного бактериями.
Синонимы: Анализ крови на прокальцитонин; ПКТ. Procalcitonin; PCT. Краткая характеристика определяемого вещества Прокальцитонин Прокальцитонин является прогормоном кальцитонина, состоящим из 116 аминокислот с молекулярной массой 14,5 кDa. Биосинтез прокальцитонина в физиологических условиях прои.
Читайте также:

