Формирование иммунитета при герпетических инфекциях
Обновлено: 06.05.2024
Одной из нозологических форм, которую вирусы простого герпеса (ВПГ) вызывают у человека, является генитальный герпес. В настоящее время эта форма ВПГ-инфекции считается наиболее распространенной среди всех инфекций, передающихся половым путем.
Одной из нозологических форм, которую вирусы простого герпеса (ВПГ) вызывают у человека, является генитальный герпес. В настоящее время эта форма ВПГ-инфекции считается наиболее распространенной среди всех инфекций, передающихся половым путем. Генитальный герпес вызывают два серотипа вируса простого герпеса: ВПГ-1 и ВПГ-2; причем наиболее часто — ВПГ-2. Согласно данным сероэпидемиологических исследований, инфицирование ВПГ-1 выявляется у 20—40%, а ВПГ-2 — у 50—70% больных генитальным герпесом [2]. Заболевание передается преимущественно при сексуальных контактах от больного генитальным герпесом. Нередко генитальным герпесом заражаются от лиц, не имеющих симптомов заболевания на момент полового контакта или не знающих о том, что они инфицированы [5]. Эта особенность ВПГ, связанная с бессимптомным вирусоносительством, является сложной задачей, от решения которой зависит не только трудоспособность и здоровье, но и личная судьба миллионов потенциальных больных. Имеются сведения о том, что от 60 до 80% новорожденных, у которых развивается неонатальный герпес, рождаются от матерей с бессимптомным носительством [6].
ВПГ-инфекция также может быть причиной нарушения репродуктивной функции, невынашивания беременности, преждевременных родов и патологии плода. Возможно участие ВПГ в развитии онкологических заболеваний гениталий, иммунодефицитных состояний, что позволяет считать герпесвирусные инфекции важной медико-социальной проблемой практического здравоохранения [2].
Лечение хронических, часто рецидивирующих форм ВПГ-инфекции, до настоящего времени представляет определенные трудности, которые объясняются особенностями взаимодействия вируса с макроорганизмом. Жизнедеятельность вирусов герпеса основывается на следующих биологических особенностях:
- все вирусы герпеса являются внутриклеточными паразитами;
- герпесвирусы пожизненно персистируют в аксоноганглиальных структурах центральной и периферической нервной системы;
- в течение жизни человек многократно реинфицируется новыми штаммами вирусов герпеса, при этом возможно одновременное сосуществование нескольких видов и штаммов вирусов [12];
- при нарушении динамического равновесия между иммунным гомеостазом и вирусами последние переходят в активную форму [9].
Согласно данным проведенных исследований только 20% инфицированных ВПГ имеют диагностированный генитальный герпес, 60% — нераспознанный симптоматический генитальный герпес (атипичную форму) и 20% — бессимптомный герпес. В настоящее время только 27% пациентов с диагнозом генитальный герпес получают противовирусную терапию, из них треть — местное лечение [2]. По данным некоторых авторов, около 95% пациентов с клиническими проявлениями генитального герпеса вообще никак не лечатся [11].
Все разнообразие методов терапии и профилактики герпесвирусных инфекций в конечном счете сводится к трем главным подходам:
- химиотерапия;
- иммунотерапия;
- комбинация этих двух методов.
Каждый врач в своей практической работе так или иначе сталкивается с необходимостью решения этой сложной задачи, требующей тонкого индивидуального подхода к каждому пациенту, страдающему ВПГ.
Теоретически идеальным вариантом химиотерапии был и остается механизм прямой инактивации вирусной ДНК, но из-за неизбежного общего токсического, цитопатического и канцерогенного эффекта этот способ для клинического использования оказался неприемлемым [8]. Поэтому был разработан менее опасный способ инактивации вирусной ДНК — подавление активности вирусных ферментов, обеспечивающих жизнедеятельность ДНК. Наиболее безопасным вариантом оказалось создание синтетических аналогов нуклеозидов герпесвирусной ДНК, которые избирательно фосфорилируются не клеткой, а вирусспецифическим ферментом — тимидинкиназой. В процессе копирования вирусной ДНК эти псевдонуклеазиды встраиваются в дочерние вирусные ДНК, что приводит к генетическому дефекту или нежизнеспособности вирусной ДНК [1]. Первый лечебный синтетический нуклеозид — ацикловир (ациклический аналог гуанозина) — стал «золотым стандартом» противогерпетической химиотерапии. Ацикловир, будучи включен в какой-либо участок новой ДНК, никогда не заменяется естественным гуанином [13]. В последнее время синтезированы и широко используются новые противовирусные препараты этой группы — валтрекс и фамвир.
Различают два способа применения противовирусных химиопрепаратов: эпизодическое назначение (при обострениях герпесвирусной инфекции по мере необходимости) и супрессивная или превентивная терапия. В первом случае препарат назначается коротким курсом (5—10 дней), во втором — ежедневный прием препарата в течение нескольких месяцев, а то и лет призван помочь не столько купировать рецидив, сколько предотвратить развитие рецидивов как таковых.
Однако за последние 10 лет увеличилось число исследований, в ходе которых было показано, что изоляты вируса простого герпеса, полученные от пациенток с продолжающимися рецидивами генитального герпеса на фоне длительной супрессивной терапии (более 4 месяцев), обладают резистентностью по отношению к ацикловиру [10].
К тому же ни ацикловир, ни другие противовирусные агенты — фамцикловир, валацикловир — не предотвращают перехода вируса в латентное состояние, возникновения рецидивов после их отмены либо передачи инфекции, а также, к сожалению, не влияют на естественное течение этой инфекции, то есть не гарантируют полного излечения. Поэтому на протяжении последних двух десятилетий ученые изыскивают методы непосредственного воздействия на иммунную систему больных генитальным герпесом с целью стимуляции специфических и неспецифических ее факторов, тем самым способствуя блокаде репродукции вируса [1].
Главной мишенью применения иммуномодулирующих препаратов служат вторичные иммунодефициты, которые проявляются частыми, рецидивирующими, трудно поддающимися лечению инфекционно-воспалительными процессами разной локализации [7]. Именно к таким процессам, требующим иммунокоррекции, и относится хроническая рецидивирующая герпесвирусная инфекция (ХРГВИ), в частности ее генитальная форма. Иммуномодуляторы назначают в комплексной терапии одновременно с противовирусными средствами.
Полиоксидоний — отечественный иммуномодулятор с широким спектром фармакологического действия, не имеющий аналогов в мире [3]. Опыт применения полиоксидония начиная с 1996 года показал его высокую клиническую эффективность в комплексном лечении многих вторичных иммунодефицитных состояний, проявляющихся хроническими, рецидивирующими, вялотекущими инфекционно-воспалительными процессами различной локализации, в том числе в ходе терапии вирусных инфекций [4].
У нас также имеется определенный позитивный опыт применения полиоксидония у пациентов, резистентных к ацикловиру [9].
Мы проводили исследование открытым методом у 50 пациентов с ХРГВИ. В исследование включались пациенты (возрастной интервал от 18 до 65 лет) мужского и женского пола с достоверным диагнозом ХРГВИ. К исследованию не допускались пациенты с гиперчувствительностью к полиоксидонию и беременные женщины. Все пациенты, включенные в исследование, находились в периоде продрома или обострения не более 48 часов от момента появления высыпаний. Обязательным условием для женщин детородного возраста было соблюдение полноценной контрацепции.
На предварительном этапе были сформированы две равнозначные группы пациентов по 25 человек. Пациенты, вошедшие в изучаемые группы, отбирались методом произвольной выборки. Все пациенты предъявляли жалобы на пузырьковые или эрозивные высыпания в области гениталий, зуд, жжение. До лечения всем пациентам проводилась ПЦР-диагностика ВПГ-2 (мазок) — положительный результат получен в 98,3 %.
Возрастной состав пациентов, страдающих генитальной формой герпесвирусной инфекции, в обеих группах был приблизительно одинаковым (43,6 года в первой группе и 38,9 — во второй), в то время как в первой группе средний возраст женщин и мужчин был несколько выше по сравнению со второй группой.
Дозировка и схемы введения. Всем пациентам производилась в/м инъекция препарата утром, под контролем врача. 1-я схема: терапия проводилась в течение 45 дней: пациенты получали по 6 мг полиоксидония в день в/м в течение 5 дней и по 6 мг в/м через день в течение 10 дней. Поддерживающая терапия — по 6 мг в/м 2 раза в неделю в течение месяца. 2-я схема: 6 мг полиоксидония в/м через день в течение 10 дней (всего 5 инъекций на курс).
Обследование проводилось до приема препарата и на 12—14-й день от начала приема препарата, а также на 3—6-й день после окончания приема препарата. Обследование включало общее клиническое, иммунологическое исследования крови, исследование мочи (общее), объективное исследование. Накануне приема препарата собирался подробный анамнез пациента. В состав исследуемых включались совершеннолетние пациенты мужского и женского пола с достоверным диагнозом ХРГВИ.
Объем сопутствующей терапии: все пациенты получали стандартную сопутствующую терапию (ацикловир по 0,2 г 5 раз в день в течение 5 дней и антиоксиданты).
Критериями оценки эффективности являлись следующие параметры: первичные критерии — время достижения полного выздоровления (полная реэпитализация); вторичные критерии — длительность ремиссии и частота рецидивов в ближайшем и отдаленном периоде после терапии полиоксидонием. С целью оценки местных симптомов проводился наружный осмотр места поражения. Оценивалось состояние кожных покровов и слизистых: наличие пузырьков, язвочек, корочек, гиперемии; выяснялись жалобы пациента (зуд, жжение, общее состояние, температура, миалгия).
На фоне лечения полиоксидонием по первой схеме длительность течения рецидива и период реэпителизации сократились в среднем с 6,44 до 3,5 дня, в то время как на фоне стандартной терапии (ацикловир и антиоксиданты) те же показатели изменились с 6,44 до 5,16 дня соответственно. После курса терапии в ближайшем и отдаленном периоде длительность рецидива и быстрота наступления реэпителизации в среднем составляла 4 дня. В процессе лечения препаратом свежие высыпания ни у одного пациента не появились. 76% (19 человек) отметили уменьшение тяжести течения рецидива; остальные — 24% (6 человек) — не отметили разницы по сравнению с периодом до получения препарата. На фоне лечения полиоксидонием по второй схеме длительность течения рецидива и период реэпителизации сократились в среднем с 6,72 до 4,24 дня вместо 6,72 — 5,04 дня соответственно. После лечения полиоксидонием в ближайшем и отдаленном периоде длительность рецидива и быстрота наступления реэпителизации в среднем также составляли 4 дня. 64 % (16 человек) отметили уменьшение тяжести течения рецидива; остальные — 36% (9 человек) — не отметили никаких изменений по сравнению с периодом до получения препарата.
Частота рецидивов у пациентов, получавших полиоксидоний по первой схеме в течение 6 месяцев после лечения, уменьшилась в среднем с 6,5 до 3 раз по сравнению с показателями ближайших шести месяцев перед получением препарата. Длительность ремиссии возросла в среднем с 27 до 75 дней. Максимальная длительность ремиссии увеличилась в среднем с 45 до 180 дней (у отдельных пациентов максимальная ремиссия достигала 190–220 дней, что связано с неравномерностью возникновения рецидивов в исследуемом временном интервале). У 84% пациентов (21 человек) отмечалось ослабление клиники течения рецидива; у 16% (4 человека) после лечения клиника не изменилась. Ухудшения течения заболевания отмечено не было. Частота рецидивов у пациентов, получавших полиоксидоний по второй схеме, в течение 6 месяцев после лечения уменьшилась в среднем с 6 до 3,6 раза по сравнению с показателями ближайших шести месяцев перед получением препарата. Длительность ремиссии возросла в среднем с 33 до 62 дней. Показатель максимальной длительности ремиссии в обеих группах вырос в среднем примерно одинаково — с 45 до 180 дней. У 72% пациентов (18 человек) отмечалось ослабление клиники течения рецидива; у 28% (7 человек) после лечения клиника не изменилась. Как и в первой группе, ухудшений течения заболевания отмечено не было.
Максимальная длительность ремиссии за период наблюдения (2 года) составила 1,9 года в первой группе (у 9 пациентов — 36 %) и 1,1 года во второй группе (у 4 пациентов — 16 %).
До лечения полиоксидонием в обеих группах частота встречаемости и выраженность местных и общих клинических проявлений ХРГВИ была выше по сравнению с теми же показателями на фоне лечения полиоксидонием.
Парентеральное (в/м) введение полиоксидония в соответствии со схемами (см. выше) не вызывало аллергических реакций, не оказывало гепатонефротоксического действия и токсического действия на кроветворные органы; пациенты отмечали хорошую переносимость препарата.
По данным общеклинических и лабораторных методов исследования, побочных эффектов и осложнений при приеме полиоксидония не было.
Использование полиоксидония в комплексной терапии пациентов с генитальной формой хронической рецидивирующей герпесвирусной инфекции является эффективным способом уменьшения клинических проявлений в фазе обострения, сокращения длительности рецидивов и заметного уменьшения их частоты в отдаленном периоде.
Раннее назначение полиоксидония способствует более быстрой реэпителизации и более стойкой ремиссии.
Использование инъекционной формы полиоксидония не вызывает аллергических реакций, а также других побочных эффектов и осложнений.
При соблюдении указанного режима дозирования препарат не обладает нефро- и гепатотоксическим действием.
А. Е. Шульженко, кандидат медицинских наук ГНЦ — Институт иммунологии МЗ РФ, Москва
ГОУ ДПО Российская медицинская академия последипломного образования
ГОУ ДПО Российская медицинская академия последипломного образования, Москва
ФГБУ "Учебно-научный медицинский центр Управления делами Президента РФ"
Герпетическая инфекция: механизмы латентности и реактивации. Возможности управления
Журнал: Клиническая дерматология и венерология. 2014;12(1): 75‑80
Касихина Е.И., Глазко И.И., Чекмарев А.С. Герпетическая инфекция: механизмы латентности и реактивации. Возможности управления. Клиническая дерматология и венерология. 2014;12(1):75‑80.
Kasikhina EI, Glazko II, Chekmarev AS. Herpetic infection: mechanisms of latency and reactivation. Potential to control the infection. Klinicheskaya Dermatologiya i Venerologiya. 2014;12(1):75‑80. (In Russ.).
ГОУ ДПО Российская медицинская академия последипломного образования
Проанализированы возможные механизмы регуляции латентного состояния и ограничения реактивации герпес-вирусов. Описаны взаимоотношения между герпес-вирусами и иммунной системой хозяина. Факторы, способствующие поддержанию латентной инфекции и реактивации вирусной репликации, активно обсуждаются. Одной из стратегий контроля за вирусной репликацией является применение ациклических нуклеозидов, в том числе валацикловира. Под наблюдением находились 10 женщин с рецидивирующим генитальным герпесом с явлениями стойкого генитального зуда. При применении комплексной противовирусной терапии с включением препаратов Вирдел (валацикловир) и Лавомакс (тилорона гидрохлорид) в течение 12 нед клинический эффект (отсутствие зуда) достигнут у 8 пациенток.
ГОУ ДПО Российская медицинская академия последипломного образования
ГОУ ДПО Российская медицинская академия последипломного образования, Москва
ФГБУ "Учебно-научный медицинский центр Управления делами Президента РФ"
В настоящее время для специалистов, занимающихся проблемами терапии инфекционных заболеваний, актуальными являются проблемы, связанные с персистенцией герпес-вирусных инфекций (ГВИ). Объясняется это широким распространением этой группы вирусов в человеческой популяции, несовершенством диагностики и неоднозначностью интерпретации лабораторных данных, внутриклеточной персистенцией возбудителей и их участием в процессах иммуногенеза.
Существуют разные формы взаимодействия ГВИ с организмом хозяина - острого периода с развитием характерных проявлений и последующим развитием инаппарантной (латентной) формы, отражающей хрупкий баланс между репликацией вируса и иммунным ответом хозяина. Механизмы, определяющие переход из острой фазы инфекции, когда вирус (вирус простого герпеса 1-го и 2-го типов - ВПГ-1, ВПГ-2, ВВЗ) не удается обнаружить в гомогенатах ганглия, пока не выяснены. Становление латентной инфекции связано со структурными изменениями в вирусном геноме: в регионарных сенсорных ганглиях вирусная ДНК сохраняется в виде эписом и только один ген транскрибируется постоянно. Это принципиально важное положение было установлено методами рестрикционного анализа и блоттинг-гибридизации и меченными 32Р вирусными ДНК при сравнении вирионной ДНК эталонного ВПГ-1. Уровень реактивации зависит, скорее всего, от количества латентных форм вирусных ДНК, находящихся в ганглиях, а также типоспецифических последовательностей в геноме вируса, которые определяют частоту реактивации и рецидивов в конкретной анатомической области [1]. У инфицированных серопозитивных лиц контроль над вирусной реактивацией осуществляется с помощью пожизненно присутствующих противогерпетических гаплотипоспецифических антител IgG и цитотоксических Т-лимфоцитов 2. Считается, что уровень вируснейтрализующих антител у практически здоровых лиц - величина довольно устойчивая, однако при нарушении стабильности в иммунной системе и вирусной реактивации при серологических исследованиях определяется повышение титров IgG. Примером является возрастзависимое снижение клеточного иммунитета, ассоциируемое с повышением специфических антител к ВПГ, цитомегаловирусной инфекции (ЦМВИ) и вирусу Эпштейна-Барр (ВЭБ) [5, 6]. Кроме того, данные клинико-лабораторных исследований реактивации ГВИ у пожилых людей показали, что рост титра специфических антител сопровождался значительным усилением транскрипции вирусного гена и количественным увеличением вирусной ДНК. При аналогичном исследовании образцов, полученных от молодых пациентов, уровни показателей вирусной активности и специфических антител были значительно ниже, чем у пожилых лиц [7, 8]. Изменение функции цитотоксических CD8 + Т-лимфоцитов может происходить на фоне эмоционального стресса, следствием которого являются репликация вируса и повышение уровня специфических антител [9, 10]. При обследовании астронавтов выявлены повышенные показатели транскрипции вирусного гена, вирусной нагрузки и усиление синтеза противогерпетических антител как результат стресса на космический полет [11, 12]. Как физический, так и психический стресс оказывают влияние на активность CD8 + T-лимфоцитов через высвобождение нейроэндокринных пептидов, а данный механизм может быть связующим звеном, контролирующим реактивацию латентной ВПГ-инфекции в симпатической нервной системе [13].
В настоящее время неизвестно является ли дисрегуляция Т-клеточного иммунитета ключевым моментом взаимоотношения герпетической инфекции и хозяина или могут играть роль иные процессы. Например, любой воспалительный неспецифический процесс, являющийся результатом клеточного стресса - реактивация ЦМВ, инфекция бактериальной этиологии, травма (операция, гипоксия и др.), приводит к активизации гипоталамо-гипофизарно-надпочечниковой системы и, как следствие, репликации ВПГ и появлению симптомов жжения и зуда [14, 15].
Герпес-вирусы рассматриваются как пожизненная инфекция. Для реализации этой цели ими используются разные механизмы манипуляции иммунными механизмами хозяина. Один из типичных примеров - молекулярная мимикрия: кодировка вирусами соответствующих клеточных интерлейкинов, хемокинов или хемокиновых рецепторов [16]. Другая стратегия уклонения от иммунной защиты хозяина осуществляется путем встраивания вирусного антигена в главный комплекс гистосовместимости инфицированных клеток [17]. Герпес-вирусы супрессируют или полностью ингибируют активность молекул I и II классов HLA-системы. Так, кодирование ВЭБ гена BNLF2a ослабляет антигенную презентацию и, следовательно, узнавание CD8 + T-лимфоцитами новых инфицированных клеток [18].
Длительное бессимптомное течение характерно и для ЦМВИ, к которой в настоящее время проявляется живой научный интерес. Источником ЦМВИ является человек, который может инфицироваться в разные периоды жизни. Так, если в возрасте 9 лет приблизительно 36% лиц ЦМВ-серопозитивны, то к 40 годам их число приближается к 60% [19]. Согласно данным литературы [20], женщины наиболее подвержены заражению ЦМВ, при этом процент инфицированных может варьировать от 45 до 100% и зависит от региона, расовой принадлежности и социально-экономического статуса. Иммунопатологические реакции при ЦМВИ весьма разнообразны и во многом определяют течение и исход инфекции. ЦМВ влияет на спектр экспрессии клеточных белков и цитокинов, что позволяет ему оказывать общее иммуносупрессивное воздействие на весь организм. При активной репликации вируса в клетках экспрессия генов ЦМВ вызывает нарушение транспорта и быстрое разрушение HLA-1, тем самым затрудняя презентацию антигена. Снижение активности Т-клеточного пула, в первую очередь цитотоксических СD8 + Т-лимфоцитов, приводит к подавлению нормального иммунного ответа хозяина на антигенный вызов не только ЦМВ, но и других представителей герпес-группы 22. Так, N. Khan и соавт. [22] показано, что Т-клеточный ответ на ВЭБ был существенно хуже у субъектов, инфицированных ЦМВИ. Кроме того, антигенспецифические CD8 + Т-лимфоциты могут продуцировать фактор некроза опухоли-α (ФНО-α) и γ-интерферон (γ-ИФН), способствующие развитию персистенции ЦМВ в макрофагах [24]. Результаты проведенных в последние годы исследований свидетельствуют о том, что реактивация латентной ЦМВИ может ухудшать состояние здоровья в пожилом возрасте [8, 25]. В работах P. Trzonkowski и A. Wikby и соавт. 27 выявлено, что повышение титра антител у пожилых людей к ЦМВ может быть напрямую связано с увеличением продукции цитокинов интерлейкина-6 (ИЛ-6) и ФНО-α. Высокий уровень специфических антител к ЦМВ также был ассоциирован с повышением уровня С-реактивного белка и поражением коронарных артерий [25]. ЦМВ и в большей степени ВЭБ причастны к развитию нарушений коронарного кровотока [29]. В работах последних 10 лет выявлено, что ВПГ-1 и ЦМВ ассоциированы с болезнью Альцгеймера у пожилых людей с нарушениями коронарного кровотока, а также развитием цереброваскулярного атеросклероза и метаболических нарушений 32. A. Aiello и соавт. [33] подтверждена роль латентной ЦМВИ как предиктора когнитивных нарушений наряду с такими факторами, как возраст, образование и состояние здоровья.
Представители герпес-группы не только ухудшают качество жизни, но и серьезно вмешиваются в функционирование репродуктивной системы мужчин и женщин. Сочетанную инфекцию ВПГ-1, ВПГ-2 и ЦМВ рассматривают как один из этиологических факторов хронических вульвовагинитов, цервицитов, эндометритов 34. ГВИ способствуют формированию аутопроцессов в органах малого таза (эндометриоз, хронический эндометрит) [37]. В присутствии ВПГ-2 увеличивается вероятность развития диспластических процессов в многослойном плоском эпителии с формированием внутриэпителиальной цервикальной неоплазии [38].
Асимптоматическое течение чаще характерно для мужчин и людей, имеющих антитела к ВПГ-1. Это может указывать на тот факт, что предшествующее инфицирование ВПГ-1 может снижать вероятность развития симптоматических форм инфекции ВПГ-2. Считается, что в 70% случаев передачи ВПГ-2 связаны с заражением и реактивацией вируса при асимптоматических и субклинических формах заболевания [1]. Одним из вариантов течения генитальной герпетической инфекции у женщин является бессимптомное выделение вируса (ЦМВ, ВПГ-1, ВПГ-2), чередующееся с появлением минимальных клинических проявлений в виде симптомов упорного зуда и раздражения в области наружных половых органов. В настоящее время нет единых трактовки патогенеза и тактики терапии для купирования зуда и жжения, возникающего при вирусном микстинфицировании гениталий.
Лечение больных с рецидивирующим герпесом включает использование аналогов нуклеозидов, в том числе валацикловира в эпизодическом и превентивном (супрессивном) режиме. Эпизодическая терапия подразумевает пероральный прием препарата в момент обострения инфекции. Для большинства больных с частыми рецидивами превентивная профилактическая терапия более целесообразна, чем эпизодическое лечение. Ежедневный прием в непрерывном режиме иногда в течение нескольких лет предусматривает применение валацикловира в связи с самой удобной схемой дозирования. На фоне лечения валацикловиром предотвращаются рецидивы инфекции, вызываемой ВПГ, или задерживается их возникновение на 71-85% (анализ соотношения опасностей) по сравнению с плацебо 39. Валацикловир традиционно используется в мировой практике для лечения инфекций, вызванных ВПГ, ВВЗ и профилактики ЦМВИ, в том числе у иммуносупрессированных лиц [44, 45]. В 2013 г. на отечественном рынке появился новый препарат валацикловира - Вирдел таблетки 500 мг компании STADA. Анализ эффективности супрессивной терапии валацикловиром, проведенный О.И. Летяевой и соавт. [42], показал улучшение иммунологических показателей у 87,5% женщин с хронической рецидивирующей герпетической инфекцией.
Нами были обследованы 10 женщин 27-35 лет с жалобами на жжение и зуд в области гениталий. Большинство пациенток первоначально расценивали данную симптоматику как проявления аллергического контактного дерматита и безуспешно применяли топические глюкокортикостероидные средства. Кроме того, 80% женщин предъявляли жалобы на слабость, головную боль, быструю утомляемость. В анамнезе у 3 пациенток были привычное невынашивание беременности и циститы, у 50% - бактериальный вагиноз, у 1 - эндометриоз, у 2 - остроконечные кондиломы перианальной области.
В комплекс обследования, помимо клинических методов, входило выявление ДНК ВПГ-1 и ВПГ-2, ЦМВИ и вирус папилломы человека (ВПЧ) с помощью полимеразной цепной реакции. В начале исследования 2 раза с интервалом в 2-3 нед с помощью иммуноферментного анализа определяли титр специфических антител. Также проводили микробиологическое исследование на наличие гонореи и трихомонад, диагностику папилломавирусной, микоплазменной и хламидийной инфекций согласно методическим рекомендациям МЗ РФ «Стандартизация медицинской помощи больным гонококковой инфекцией (Приказ №176 от 28.02.05) и Положению МЗ РФ «О мерах по предупреждению распространения заболеваний, передающихся половым путем» (Приказ №291 от 30.07.01). При определении генома вирусов коинфекция ВПГ-1 и ЦМВИ была выявлена у половины обследованных женщин, ВПГ-2 и ВПЧ-16 - у 2 пациенток, моноинфекция ВПГ-2 - у 3. Антитела к ВПГ-2 не были обнаружены у 2 пациенток, при этом интенсивность зуда и тенденция к регрессу на фоне терапии были более выражены у серонегативных, чем у серопозитивных пациенток, что свидетельствует о протективной роли Ig, приводящих к частичной инактивации вирусов [9].
Лечение включало комбинированное использование химиопрепаратов с разыми механизмами противовирусного действия: валацикловир (Вирдел) по 500 мг ежедневно в течение 12 нед и тилорон (Лавомакс 125 мг), согласно рекомендуемой схеме по 1 таблетке первые 2 сут, затем через 1 сут, на курс 20 таблеток. Комплексная терапия также включала препараты магния, растительные адаптогены и интравагинальное применение вагинальных суппозиториев, содержащих фиксированную комбинацию хлоргексидина и декспантенола (Депантол) в течение 10 сут во II фазу менструального цикла в течение 3 циклов.
Применение Лавомакса в сочетании с аналогами нуклеозидов (валацикловиром) позволяет комплексно решать вопросы терапии вирусных микстинфекций, особенно при планировании беременности, невынашивании беременности и обнаружении в крови аутоиммунных маркеров (волчаночного антикоагулянта, антител к хорионическому гонадотропину, антикардиолипиновых и антифосфолипидных антител) [43]. Сочетанное применение противовирусных химиопрепаратов и тилорона обеспечивает аддитивный или синергидный эффект, позволяет воздействовать на патогенетическую основу рецидивирования герпетической инфекции (ВПГ-1, ВПГ-2, ЦМВИ) и обеспечить снижение дозы противовирусного химиопрепарата, уменьшает вероятность возникновения устойчивых к аномальным нуклеозидам штаммов вирусов [44, 45]. Терапевтическая активность тилорона (Лавомакса) достаточно хорошо изучена и связана не только с индукцией продукции ИФН 1-го и 2-го типа, но и с модуляцией выработки других цитокинов (ИЛ-6, ИЛ-12, ФНО-α), приводящих к смещению баланса в системе «повреждение/ответ» в благоприятную для организма зону, в которой выраженность защитных реакций организма обеспечивает контроль над инфекционным процессом, но при этом предотвращает значительное эндогенное повреждение организма [46, 47].
Выводы
Деликатный баланс между латентностью и реактивацией - уникальное достижение эволюции.
У хозяина с нормальным иммунным ответом на присутствие вируса в организме формируются продолжительные взаимоотношения без волнообразного течения процесса. Тем не менее средовые провоцирующие факторы, нарушающие этот баланс, или любая причина, приводящая к иммуносупрессии, обусловливают развитие обострения вирусного заболевания.
Учитывая иммуносупрессивные свойства герпес-вирусов, экспансию штаммов, резистентных к противовирусным препаратам и ускользающих от адаптивных иммунных механизмов хозяина, а также высокую частоту встречаемости вирусных микстинфекций, актуальным становится поиск новых направлений терапии и профилактики герпетических инфекций. В этом отношнии комбинация Вирдела (валацикловир) и Лавомакса (тилорон) представляется средством выбора для достижения и контроля латентной формы заболевания.
Что такое герпетический стоматит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Кожевниковой Светланы Николаевны, стоматолога со стажем в 28 лет.
Над статьей доктора Кожевниковой Светланы Николаевны работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина

Определение болезни. Причины заболевания
Герпетический стоматит — это инфекционное заболевание, которое вызывает вирус простого герпеса первого типа [6] . Сопровождается лихорадкой, слабостью, головной болью, появлением язв на слизистой полости рта и воспалением региональных лимфоузлов.
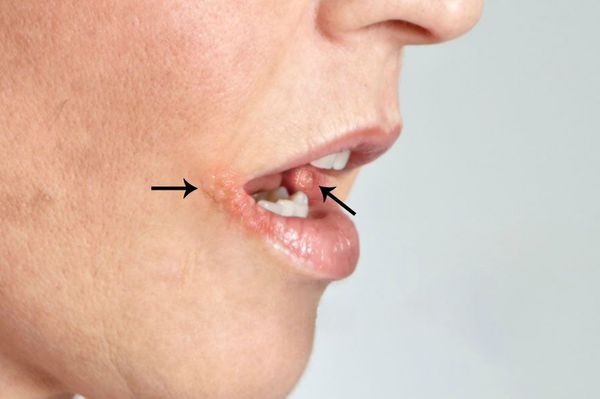
Этот вид стоматита составляет примерно 80 % всех инфекционных стоматитов полости рта. Он возникает чаще у детей, очень редко — у подростков и взрослых. Наиболее распространён в возрасте от 1 до 3 лет (до 70%) [7] . Это связано с расширением контактов у детей в этот период и особенностями местного иммунитета слизистой рта. В этом возрасте у ребёнка исчезают антитела, полученные от матери, которые защищали его в первые месяцы жизни. У каждого седьмого-десятого ребёнка заболевание переходит в рецидивирующую форму.
Вирус простого герпеса распространён по всему миру. Он содержит ДНК, в котором присутствует около 80 генов [6] . Развивается вирус внутри клеток. Во внешней среде при температуре 20-25 ℃ сохраняется в течение суток. При 50 ℃ разлагается через 30 минут. Устойчив к холодным температурам. На различных металлических предметах выживает до двух суток. Неустойчив к действию физических и химических факторов, разрушается под влиянием ультрафиолета и рентгеновских лучей, чувствителен к этиловому спирту и дезинфицирующим средствам [8] .
Герпетический стоматит — заразное заболевание. Источником является больной или бессимптомный носитель. Распространение идёт при непосредственном контакте. Никаких особых ситуаций и факторов для заражения не требуется, потому что вирус распространён повсеместно и контакт с ним происходит в детском возрасте. Большинство взрослых уже инфицированы.
Инкубационный период — скрытое течение болезни до появления его первых признаков — может длиться 2-26 дней, чаще 5-7 дней. Срок инкубации не влияет на тяжесть заболевания [9] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы герпетического стоматита
При лёгкой форме состояние ребёнка удовлетворительное. Инкубационный период не выражен, однако в процессе развития болезни (продромальном периоде) обязательно появляется субфебрильная лихорадка — до 38℃. Других симптомов в этот момент не возникает. Через 1-3 дня слизистая оболочка полости рта краснеет, усиливается слюнотечение. Далее покраснение становится ярче, появляется боль, ребёнок плохо ест и спит. Впоследствии возникают единичные или сгруппированные мелкие язвочки — афты (3-5 штук). Так начинается стадия разгара. Высыпания появляются однократно в течение 1-2 дней. После этого температура снижается, но боль ещё сохраняется, постепенно уменьшаясь. Общее состояние нормализуется, появляется аппетит, улучшается сон. Афты полностью заживают в течении 3-5 дней. Небольшое покраснение слизистой может сохраняться до 10 дней. Иногда увеличиваются шейные и подчелюстные лимфоузлы, но чаще при лёгкой форме этого не происходит. Изменения в крови не характерны.
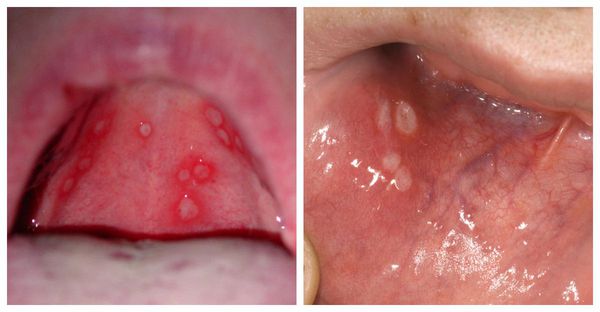
На пике лихорадки и интоксикации появляются изменения на слизистой и коже вокруг рта. На покрасневшей отёчной слизистой возникают афты. Обычно их количество достигает 25-30 штук, элементы могут сливаться. Усиливается слюноотделение, кровоточивость дёсен. После высыпания температура снижается, однако элементы могут появиться повторно вместе с новым подъёмом температуры. Воспаляются лимфоузлы.
Период разгара продолжается до 10 дней. В дальнейшем состояние постепенно улучшается: снижается температура, появляется аппетит, нормализуется сон. Элементы на слизистой и коже заживают. Дольше всего сохраняются покраснение и воспаление лимфоузлов. Появляются изменения в крови: снижается уровень лейкоцитов и увеличивается уровень лимфоцитов, может повыситься СОЭ (скорость оседания эритроцитов).
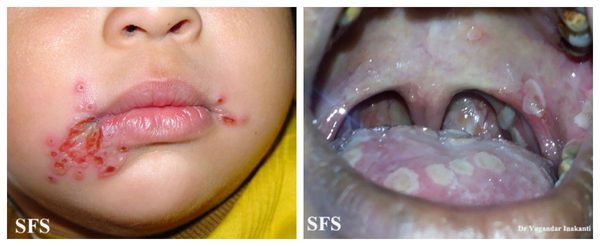
Тяжёлая форма встречается значительно реже. Уже в продромальном периоде у ребёнка выражены все признаки острого инфекционного процесса: вялость, слабость, головная боль, боль в мышцах и суставах. Температура повышается до 40℃. Сразу в первые сутки появляются изменения на слизистой и коже вокруг рта. Губы становятся сухими, слизистая отекает, приобретает ярко красный оттенок, сильно кровоточит, появляется много афт по всей слизистой рта и глотки, а также много пузырьков на коже вокруг рта, мочках ушей и век. Возможно развитие герпетических паронихиев на пальцах рук (гнойных воспалений). В местах слияния элементов имеются некротические (омертвевшие) участки. Высыпания неоднократно появляются снова и снова. Ярко выражено воспаление лимфоузлов. Выздоровление длительное. Наблюдаются изменения крови в виде понижения количества лейкоцитов со сдвигом формулы влево, может быть токсическая зернистость нейтрофилов, повышение СОЭ и С-реактивного белка.
У некоторых детей заболевание переходит в рецидивирующую форму. Последующие рецидивы уже могут протекать менее остро, без значимого нарушения самочувствия и лихорадки, т. к. в крови появляется некоторое количество антител. Но поражение слизистой полости рта будет возникать всегда [4] [5] [6] [7] [9] .
Патогенез герпетического стоматита
Механизм развития острого герпетического стоматита очень сложен и изучен не до конца [4] . Однако известны следующие звенья патогенеза.
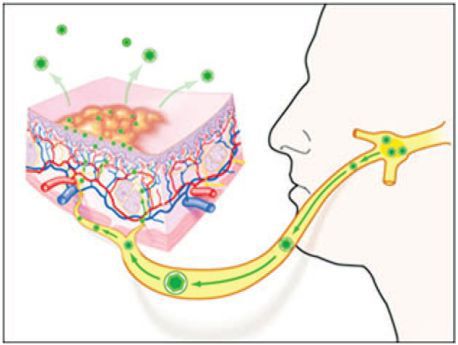
В момент заражения вирус простого герпеса прикрепляется к рецепторам мембраны клетки, которая чувствительна к вирусу. Происходит слияние клеточной мембраны и внешней оболочки вируса, при этом клеточная мембрана не повреждается, и вирус проникает внутрь. Затем клеточные ферменты растворяют внутреннюю оболочку вируса, и он проникает внутрь ДНК клетки. В таком состоянии вирус простого герпеса может находиться длительное время [6] .
Прикрепление и размножение вируса, как правило, происходит в клетках местных тканей и близлежащих лимфоузлов. Этим объясняется лимфаденит (воспаление лимфоузлов), который наблюдается ещё до появления афт в полости рта [11] .
В разгар болезни вирус нарушает баланс между свёртывающей и антисвёртывающей системами крови, из-за чего дёсны и слизистая рта могут кровоточить. Предполагается, что эта же причина приводит к образованию микротромбов в капиллярах, из-за чего возникают участки некроза слизистой [11] .
После выздоровления выделение вируса со слюной может продолжаться ещё несколько недель [4] . Он способен сохраняться в нервных ганглиях в течение всей жизни человека. В это период он практически не поддаётся противовирусному лечению. После активации вирус переносится по аксиону в первичный очаг проникновения, из-за чего возникает повторное поражение. Бессимптомное выделение вируса в слюне наблюдается у 5-10 % людей.
Классификация и стадии развития герпетического стоматита
Согласно Международной классификации болезней (МКБ-10), герпетический стоматит относится к инфекциям, вызванным вирусом герпеса и классифицируется как "В00.2 Герпетический гингивостоматит и фаринготонзиллит" [4] .
По течению бывает острым и хроническим рецидивирующим. При этом острый герпетический стоматит имеет три степени тяжести: лёгкую, среднетяжёлую и тяжёлую. Тяжесть течения болезни оценивается на основе совокупности общих и местных симптомов. К общим симптомам относятся рост температуры, слабость, чувство усталости; к местным — покраснение слизистой и появление афт.
Кроме этого выделяют пять периодов болезни: инкубационный, продромальный, начальный, разгар заболевания и реконвалесцентный — период выздоровления.
Осложнения герпетического стоматита
Как правило, герпетический стоматит не опасен, за исключением его развития у детей с первичным иммунодефицитом, проходящих химиотерапию, принимающих иммуносупрессивную терапию после пересадки органов и тканей, которая направлена на подавление нежелательной реакции иммунитета. У таких детей заболевание протекает в тяжёлой форме. Может сопровождаться кровотечением из слизистой рта и носа.
Наиболее частое осложнение — переход болезни в рецидивирующую форму. Рецидивы могут следовать один за другим, сильно изматывая пациента. Иногда возможны и другие, более серьёзные осложнения:
- герпетический миокардит — учащается пульс, снижается артериальное давление, возникает одышка, лихорадка;
- герпетический менингоэнцефалит — резко поднимается температура, отмечается головная боль, рвота, судороги;
- генерализованная герпетическая инфекция с поражением нескольких органов [4] .
Кроме этого может присоединяться вторичная бактериальная инфекция, бронхит, пневмония, отит, кератит, инфекционно-токсический шок — токсическое поражение мозга вирусом.
Диагностика герпетического стоматита
Диагноз острого герпетического стоматита ставится на основании совокупности данных: анамнеза (истории болезни), клинической картины, течения болезни и результатов лабораторных исследований.
При типичных формах заболевания диагностика трудностей не вызывает, поэтому дополнительные методы не используются. Лабораторная и инструментальная диагностика может помочь в выявлении осложнений либо при возникновении трудностей в диагностике: при нетипичном случае, затяжном течении, генерализованных формах болезни. Для этого могут использоваться следующие методы:
- микроскопический анализ — проводится не раньше второго дня болезни; под микроскопом исследуются мазки, взятые с поражённой слизистой, чтобы определить причину заболевания;
- иммунофлюоресцентный анализ (МФА) — проводится в период появления высыпаний; позволяет определить количество антигенов в крови;
- вирусологическое исследование — проводится в острый период болезни; используется для обнаружения клетки вируса и антигенов в крови;
- молекулярно-генетический метод (ПЦР) — проводится в острый период; помогает определить генотип вируса и верно подобрать способ лечения;
- иммуноцитохимия — проводится в острый период для выявления вируса;
- серологический тест— проводится на 7-10 день болезни, чтобы выяснить срок заболевания;
- исследование цереброспинальной жидкости — может потребоваться при осложнениях, чтобы подтвердить поражение центральной нервной системы;
- клинический анализ крови и мочи — проводится для определения осложнений;
- биохимический анализ крови — проводится в острый период для определения, поражены ли внутренние органы;
- инструментальная диагностика — УЗИ, КТ, МРТ, электроэнцефалография (ЭЭГ), рентгенография, электрокардиография (ЭКГ), офтальмоскопия.

Оценку всех исследований проводит только врач в комплексе с клиническими и анамнестическими данными [5] .
Лечение герпетического стоматита
Лечение пациентов с лёгкими и среднетяжёлыми формами заболевания проводится амбулаторно, т. е. дома, но с регулярным посещением врача. Госпитализации подлежат пациенты с тяжёлыми формами стоматита, осложнениями и генерализованными формами болезни — когда вирус поражает весь организм. Лечение включает в себя соблюдение режима, диеты, местной и общей терапии [5] .
Все пациенты нуждаются в щадящем режиме. Если ребёнок лежит, его нужно обеспечить свежим воздухом, регулярной сменой белья. Если он играет и отказывается от постели, не нужно его укладывать насильно — лучше занять спокойными играми, чтением и т. д. Не следует ходить с больным ребёнком в детский сад, школу, магазины, торговые центры, кинотеатры, детские площадки. Нужно помнить, что заболевание очень контагиозное, и другие дети могут заразиться. Но в период выздоровления прогулки на свежем воздухе отдельно от других детей возможны.
Помещение, где находится ребёнок, должно проветриваться 3-4 раза в день, необходима ежедневная влажная уборка. Также ребёнок нуждается в более продолжительном сне. Но если он спит почти весь день и с трудом просыпается или наоборот почти не спит, то требуется дополнительный осмотр врача.
А вот отказ от еды не так страшен. Приём пищи становиться для очень болезненным, поэтому не следует настаивать и тем более кормить ребёнка насильно. Стоит предлагать жидкую пищу, кашу, кисель, протёртые супы.
Важно заняться профилактикой обезвоживания. Маленькие лихорадящие дети очень быстро обезвоживаются, это усиливает интоксикацию и утяжеляет состояние. Поэтому необходимо обильно поить ребёнка. Стоит предлагать любые жидкости: воду, компот, чай, разведённые соки без сахара. Количество выпитой жидкости должно быть не меньше 1,5-2 литров. Если есть рвота или ребёнок отказывается от питья, нужно выпаивать его по чайной ложке каждые 5-7 минут.
Также немаловажную роль играет обезболивание. В разгар заболевания пациенты испытывают сильные головные боли и боли во рту. Для обезболивания чаще используют парацетамол и ибупрофен. Доза рассчитывается в зависимости от массы тела, препараты можно чередовать.
Лихорадку выше 38,5℃ у маленьких детей, у детей с фебрильными судорогами в анамнезе или при плохой переносимости следует сбить. Лихорадку выше 39,5℃ нужно снизить у всех пациентов. Если при приёме жаропонижающего средства температура снизилась хотя бы на градус — это хорошо, но если не снизилась или поднялась ещё выше, то требуется дополнительный осмотр врача.
При лёгкой степени тяжести вполне можно обойтись местным лечением. Для этого необходима тщательная гигиена полости рта, полоскание или обработка антисептическими растворами, которые не содержат спирт: фурацилин 1:5000, 2 % водный раствор хлоргексидина и т. д. Для обработки афт используется мазь ацикловир — 3 % для слизистых, 5 % для кожи. Примерно с третьего дня болезни добавляются заживляющие средства на основе масляного раствора витамина А, облепиховое масло, аекол, солкосерил. Местное лечение проводится 5-6 раз в день до полного заживления элементов поражения.
ВАЖНО: применение местных обезболивающих препаратов на основе лидокаина не рекомендуется детям до 12 лет [5] . Использование местных аэрозольных антисептиков при остром герпетическом стоматите также нежелательно.
При среднетяжёлых формах одного местного лечения недостаточно. Добавляется общее противовирусное лечение. Для этого у детей используют ацикловир и валацикловир (валтрекс). Первый препарат применяется в возрастной дозировке 5 раз в сутки — это важно. Валтрекс же применяется 2 раза в сутки, что удобнее.
ВАЖНО: препараты интерферонов (виферон, генферон, циклоферон), а также гомеопатические противовирусные средства (анаферон, афлубин) и иммуномодуляторы (имудон, тимоген, ликопид) не показаны, так как их эффективность и безопасность при лечении инфекций, вызванных вирусами герпеса, не доказана.
Рецидивирующие формы требуют дополнительного осмотра врача и назначения пролонгированного курса противовирусного лечения.
Тяжёлые и осложнённые формы болезни лечатся в профильном стационаре, так как амбулаторное лечение будет малоэффективным [1] [2] . Предполагает приём противовирусных средств в форме таблеток и инъекций, дезинтоксикационную терапию, восполнение потерянной жидкости и электролитов, внутривенную подачу необходимых растворов [11] .
Стоит помнить, что острый герпетический стоматит — это заболевание, вызванное вирусом. Поэтому в рутинных случаях не требует назначения антибиотиков, даже если лихорадка длится более трёх суток — это типичное состояние для болезни.
Прогноз. Профилактика
Прогноз заболевания в подавляющем большинстве случаев благоприятный. Герпетический стоматит заканчивается полным выздоровлением, но при этом вирус остаётся с человеком на всю жизнь. В 7-10 % случаев заболевание переходит в рецидивирующую форму. При герпетических менингоэнцефалитах и генерализованных формах прогноз крайне неблагоприятный, требуется обязательное лечение в стационаре [3] .
Профилактика герпетического стоматита заключается в соблюдении простых мер гигиены: мытье рук, проветривании помещений, соблюдении режима сна, закаливании, сбалансированном питании. Заболевшие дети должны быть изолированы. Взрослым с герпетическими высыпаниями на губах не рекомендуется целовать детей, пробовать пищу, облизывать ложку, соску. При контакте с ребёнком необходимо надевать маску. В детских учреждениях, где имеется вспышка или единичные случаи заболевания, необходимо провести дезинфицирующую уборку помещения и игрушек, организовать ежедневный осмотр детей [4] .
1 ГОУ ВПО «Красноярский государственный медицинский университет им. проф. В.Ф. Войно-Ясенецкого» Минздравсоцразвития России
Вирусы герпеса широко распространены в человеческой популяции, они способны поражать практически все органы и системы организма-хозяина, вызывая латентную, острую и хроническую формы инфекции. Вирусами герпеса инфицировано 65-90 % населения планеты. По данным ВОЗ, смертность, обусловленная герпесвирусами, занимает второе место после гриппа. Считается, что на территории России различными формами герпетической инфекции страдают около 20 млн человек. Особую актуальность герпетическая инфекция приобрела в связи с одновременной циркуляцией в организме человека нескольких серотипов вирусов одновременно. При герпесе, как и при других заболеваниях с персистенцией вируса, часто развиваются иммунодефицитные состояния, обусловленные недостаточностью различных звеньев иммунной системы и её неспособностью полностью элиминировать вирус из организма. По данным ряда исследователей, у больных с хронической герпесвирусной инфекцией в сравнении с контролем обнаружено достоверное повышение цито-токсических клеток (CD8), лейкоцитарного индекса интоксикации, снижение содержание Т-хелперов (CD4), T-клеток (CD3), иммуно-регуляторного индекса в периоде обострения заболевания. Изменения клеточного иммунитета зависело от периода заболевания и степени тяжести патологического процесса, то есть чем тяжелее протекало заболевание, тем выраженнее были иммунологические изменения. При наличии микст-инфекции (герпес 1, 2 типов в комплексе с цитомегаловирусом) авторы отмечали увеличение количества активированных T-лимфоцитов и клеток T-хелпера, тогда как смешанная инфекция (цитомегаловирусная инфекция и ВЭБ-инфекция) сопровождалась острым уменьшением в лимфоцитах CD3+/CD95+. Спектр клинических проявлений герпесвирусных инфекций отличается значительным разнообразием, однако все более характерным для данных инфекций становится атипичное течение с преобладанием первично-хронических и рецидивирующих форм. Все чаще хронические герпесвирусные инфекции ассоциируются с формированием у больных синдрома хронической усталости. В последние годы при изучении патогенеза герпесвирусных инфекций были получены доказательства ключевой роли иммунной системы и неспецифической резистентности организма в развитии особенностей течения заболевания. Это связано с тем, что нарушения иммунного реагирования являются немаловажным фактором, определяющим течение болезни и ее исход. Знание особенностей иммунопатогенеза хронической формы герпесвирусных инфекций позволит предупредить развитие активного непрерывно-рецидивирующего варианта заболевания и позволит наиболее эффективно определить тактику терапии, особенно у пациентов с часто рецедивирующими формами.

1. Воробьев А.А. Иммунология и аллергология. / А.А. Воробьев, А.С. Быков, А.В. Караулов. – 2006. – 287 с.
2. Герпесвирусные инфекции человека: руководство для врачей / В.А Исаков, Е.И. Архипова, Д.В. Исаков / под ред. В.А. Исакова – СПб.: СпецЛит, 2006. – 303 с.
4. Камбачокова З.А. Состояние клеточного и гуморального иммунитета у больных рецедивирующим генитальным герпесом // Медицинский вестник Башкорстана 2012. – № 1 (7). – С. 46–49.
5. Нагоев Б.С., Камбачокова З. А. Состояние клеточного иммунитета у больных герпесвирусными инфекциями // Вестник новых медицинских технологий. – 2011. – № 3 (18). – С. 325–327.
6. Синдром хронической усталости: диагностика и лечение / под ред. Ю.В. Лобзина. – СПб.: СпецЛит, 2005. – 79 с.
7. Соколова Т.Ф., Минакова Е.Ю., Долгих Т.И. Изучение иммунофенотипа лимфоцитов у пациентов с микст-инфекцией, вызванной вирусами семейства HERPESVIRIDAE // Медицинская иммунология. – 2010. – № 4–5 (12). – С. 433–436.
8. Черевко Н.А., Попова И.С., Климов В.В. и др. Особенности изменения популяционного иммунитета населения на фоне гепрес-инфицирования // Российский аллергологический журнал. – 2010. – № 1 (1). – С. 207–208.
9. Fatahzadeh M., Schwartz R.A. Human herpes simplex virus infections: epidemiology, pathogenesis, symptomatology, diagnosis, and management // J. Am. Acad. Dermatol. – 2007. – № 57 (5). – Р. 737–63; quiz 764–6.
10. Loutfy S.A., Alam El-Din H.M., Ibrahim M.F., Hafez M.M. Seroprevalence of herpes simplex virus types 1 and 2, Epstein-Barr virus, and cytomegalovirus in children with acute lymphoblastic leukemia in Egypt Kundi // Saudi Med J. – 2006. – № 27 (8). – Р. 1139–45.
11. Koelle D.M., Corey L. Herpes Simplex: Insights on Pathogenesis and Possible Vaccines // Annu Rev Med. – 2008. – № 59. – Р. 381–395.
12. Manchini, G. Immunochemical quantitation of antigens by single radical immunodiffusion / G. Manchini, A.O. Carbonara, J.F. Heremas // Immunochemistry. – 1965. – Vol. 2. – P. 235–254.
13. Wozniak M.A., Mee A.P., Itzhaki R.F. (January). Herpes simplex virus type 1 DNA is located within Alzheimer’s disease amyloid plaques // J Pathol. – 2009. – № 217 (1). – Р. 131–8.
Вирусы герпеса широко распространены в человеческой популяции, они способны поражать практически все органы и системы организма-хозяина, вызывая латентную, острую и хроническую формы инфекции [1, 2, 9]. Вирусами герпеса инфицировано 65–90 % населения планеты. По данным ВОЗ, смертность, обусловленная герпесвирусами, занимает второе место после гриппа. Считается, что на территории России различными формами герпетической инфекции страдают около 20 млн человек. Особую актуальность герпетическая инфекция приобрела в связи с одновременной циркуляцией в организме человека нескольких серотипов вирусов одновременно. При герпесе, как и при других заболеваниях с персистенцией вируса, часто развиваются иммунодефицитные состояния, обусловленные недостаточностью различных звеньев иммунной системы и её неспособностью полностью элиминировать вирус из организма [1, 9, 10]. По данным ряда исследователей, у больных с хронической герпесвирусной инфекцией в сравнении с контролем обнаружено достоверное повышение цито-токсических клеток (CD8), лейкоцитарного индекса интоксикации, снижение содержание Т-хелперов (CD4), T-клеток (CD3), иммуно-регуляторного индекса в периоде обострения заболевания. Изменения клеточного иммунитета зависело от периода заболевания и степени тяжести патологического процесса, то есть, чем тяжелее протекало заболевание, тем выраженнее были иммунологические изменения [3, 4, 11, 12]. При наличии микст-инфекции (герпес 1, 2 типов в комплексе с цитомегаловирусом) авторы отмечали увеличение количества активированных T-лимфоцитов и клеток T-хелпера, тогда как смешанная инфекция (цитомегаловирусная инфекция и ВЭБ-инфекция) сопровождалась острым уменьшением в лимфоцитах CD3+/CD95+ [5,10].
Спектр клинических проявлений герпесвирусных инфекций отличается значительным разнообразием, однако все более характерным для данных инфекций становится атипичное течение с преобладанием первично-хронических и рецидивирующих форм [1, 9]. Все чаще хронические герпесвирусные инфекции ассоциируются с формированием у больных синдрома хронической усталости [6, 13].
В последние годы при изучении патогенеза герпесвирусных инфекций были получены доказательства ключевой роли иммунной системы и неспецифической резистентности организма в развитии особенностей течения заболевания. Это связано с тем, что нарушения иммунного реагирования являются немаловажным фактором, определяющим течение болезни и ее исход. Знание особенностей иммунопатогенеза хронической формы герпесвирусных инфекций позволит предупредить развитие активного непрерывно-рецидивирующего варианта заболевания и позволит наиболее эффективно определить тактику терапии, особенно у пациентов с часто рецедивирующими формами.
Целью настоящей работы явилось изучение особенностей иммунного ответа при хронической герпетической инфекции и оценка эффективности сочетанной противовирусной и иммуномодулирующей терапии (Панавир и Глутоксим).
Материалы и методы исследования
Основную группу составили 30 пациентов обоего пола с хронической рецидивирующей инфекцией, вызванной вирусом простого герпеса (ВПГ), вирусом Эпштейна-Барр (ВЭБ), цитомегаловирусом (ЦМВ) или их сочетанием (микст-инфекция) возрастом от 20 до 50 лет. Отбор больных в группы осуществлялся методом сплошного наблюдения при обращении в консультативную поликлинику Красноярской краевой клинической больницы. Анализ результатов проводился при обострении заболевания.
Контрольную группу составили 36 практически здоровых на момент обследования человек, идентичных по полу и возрасту, без острых патологических процессов в течение 2-х месяцев, предшествующих обследованию, а также хронических заболеваний в анамнезе.
Для иммунологического исследования в утренние часы натощак согласно стандартной методике у всех пациентов проводилось взятие периферической крови из локтевой вены в вакуумные пробирки Green Vac-Tube (Южная Корея) с консервантом, содержащим раствор Li-гепарин и этилендитетрамин (ЭДТА).
Лимфоциты периферической крови выделяли в градиенте плотности фиколл-верографина по методу А. Boyum (1968). Определение в крови регуляторных субпопуляций лимфоцитов проводилось методом проточной цитофлуориметрии с помощью Epics XL («Beckman Coulter», США) с использованием панели сертифицированных моноклональных антител, меченных флуоресцеинизотиоционатом (FITC – Fluorescein Isothyocyanate, англ.), фикоэритрином (PE – Phycoerythrin, англ.), фикоэритрином-Техасским красным (ECD – Energy Coupled Dye или PE-TxR, англ.) линии IOTest («Beckman Coulter», США). Данным методом определялись соответственно кластеры клеточной дифференцировки (CD – Cluster of Differentiation, англ.) клеток человека: Т-лимфоциты, несущие CD3+, – маркер всех зрелых Т-клеток крови, CD4+ – маркер Т-хелперных клеток, CD8+ – цитотических Т-лимфоцитов. Рассчитывали соотношение CD4+/CD8+. Для удаления эритроцитов подготовку проб крови проводили по безотмывочной технологии с использованием следующих лизирующих растворов: OptiLyse C («Beckman Coulter», США). Для корректного исключения из зоны анализа всех частиц, которые не соответствовали по размерам и гранулярности живым лимфоцитам, вводили необходимые логические ограничения в гистограммы распределения частиц по малоугловому, боковому светорассеянию. Математическую обработку цитометрических данных проводили при помощи программ EXPO-32 и CXP v. 2.2 («Beckman Coulter», США). В каждой пробе анализировали не менее 104 клеток, используя трёхцветный цитометрический анализ.
Определение концентрации циркулирующих иммунных комплексов проводилось после инкубации сыворотки крови с раствором ПЭГ-6000 и последующим учетом результатов на фотоэлектроколориметре фильтр № 1 (длина волны 315 нм). Концентрация сывороточных иммуноглобулинов IgA, IgM, IgG измерялась методом Mancini [12]. Определение количественных показателей фагоцитарного звена производилась методом латексной агглютинации [7].
Иммуноферментным методом с использованием тест-систем фирмы «HUMAN» (Германия) определялись титры специфических антител (IgM и IgG) в сыворотке крови к указанным возбудителям и авидности специфических антител IgG к ВПГ, ЦМВ и IgG к VCA, EA, NA-антигенам ВЭБ.
Статистическая обработка результатов исследования проводилась с помощью непараметрического критерия Манна–Уитни (T) [8].
Результаты исследования и их обсуждение
Все пациенты с хронической формой герпесвирусной инфекции при осмотре предъявляли жалобы на наличие у них без видимых причин выраженной утомляемости, усталости и снижения работоспособности, которые отмечались в течение последних 1–3 лет. У 7 больных (23,33 %) на протяжении этого срока отмечалась постоянная температура до 37,2–37,5 °С с периодическими повышениями до 38 °С и ознобами. Значительная часть обследованных (21 человек; 70,00 %) предъявляли жалобы на эпизоды повышения температуры до 38°С, повторяющиеся 2–4 раза в год и продолжающиеся до 2–3 недель. Практически все пациенты (93,33 %) отмечали частые периодические боли в горле или повторные ОРВИ (5 и более раз в год). У большинства имели место разной степени выраженности головные боли, нарушения сна и ухудшение памяти (17 человек; 56,67 %), миалгия (66,67 %), артралгия (26,67 %) и мышечная слабость с быстрой утомляемостью (83,33 %). При осмотре у 22 больных (73,33 %) определялись увеличение и легкая болезненность лимфатических узлов, чаще – шейных, затылочных и нижнечелюстных, а у 7 человек (23,33 %) установлено наличие гепатоспленомегалии. Учитывая данную симптоматику, больным был выставлен диагноз СХУ (по МКБ 10 – G93.3).
В качестве стандартной терапии назначался Панавир – высокомолекулярный полисахарид, относящийся к классу гексозных гликозидов, обладающий противовирусным действием за счёт индукции интерферонов всех субклассов, а также Глутоксим, являющийся иммуномодулятором и системным цитопротектором за счёт влияния на внутриклеточные процессы тиолового обмена.
После лечения субфебрильная температура тела и боли в горле сохранялись лишь у 5 пациентов (16,7 %). Лимфаденопатия отмечалась всего у 8 пациентов (26,7 %), миалгии – у 7 (23,3 %), слабость, утомляемость – у 10 (33,3 %), а нарушения памяти и расстройства сна – у 9 (30 %).
Таким образом, после комбинированной противовирусной и иммуномодулирующей терапии отмечается значительная регрессия основных симптомов заболевания.
По сравнению с контрольной группой отмечалось уменьшение содержания IgА в сыворотке крови и увеличение уровня ЦИК, уровни же других классов иммуноглобулинов достоверно не различались. Также было отмечено уменьшение количества активно-фагоцитирующих клеток и подавление их поглотительной способности.
После лечения в группе больных с хронической герпесвирусной инфекцией наблюдалось стремление к нормализации иммунорегуляторного индекса за счёт роста процентного содержания CD4 и снижения уровня CD8, что связано с уменьшающейся вирусной нагрузкой. Отмечалась тенденция к увеличению уровня IgА в сыворотке крови и достоверное увеличение уровня IgG по сравнению с группой контроля, несколько уменьшался уровень ЦИК. По фагоцитарному звену отмечена нормализация показателей поглотительной активности (фагоцитарный индекс достоверно с контролем не различался).
По маркёрограмме герпесвирусных инфекций при сравнении групп между собой (табл. 2) значительно снижалось содержание Ig G EBNA к ВЭБ, практически не встречались маркёры активации ВЭБИ (Ig G EA к ВЭБ – у 3,33 %, Ig M VCA к ВЭБ – у 3,33 %), увеличивалась авидность Ig G VCA к ВЭБ. Отмечено снижение титра IgG к ВПГ и ЦМВ и увеличение авидности этих антител.
Показатели иммунного статуса больных хроническими герпесвирусными инфекциями до и после лечения (M ± m)
Читайте также:

