Если совсем не лечить системную красную волчанку хроническая форма
Обновлено: 24.04.2024
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Васкулиты: причины появления, симптомы, диагностика и способы лечения.
Определение
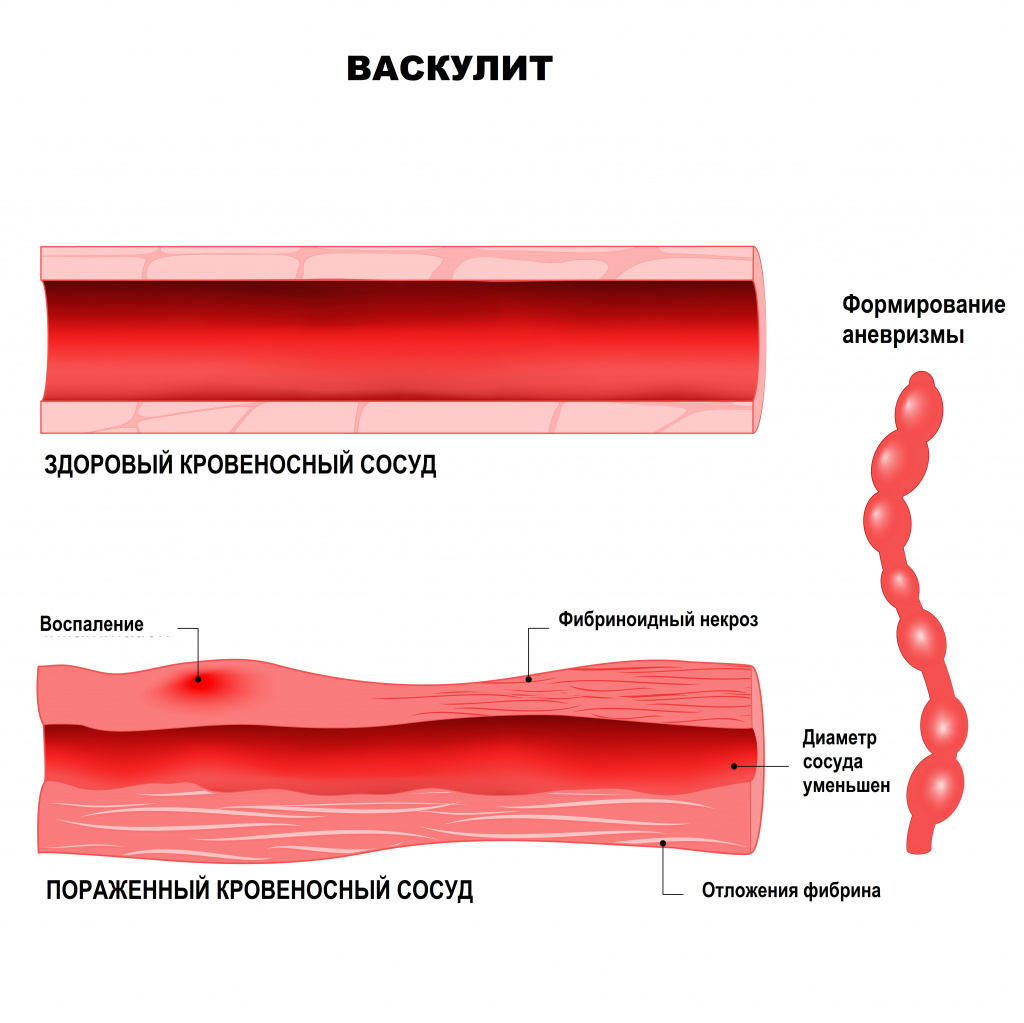
Системные васкулиты – это большая группа разнородных острых и хронических заболеваний, в основе которых лежит воспаление и некроз сосудистой стенки. Термин «системные» означает, что в патологический процесс вовлечено несколько органов и тканей. Системные васкулиты относятся к редким заболеваниям, распространенность их составляет от 0,4 до 14 случаев на 100 000 населения, однако во всем мире количество людей, больных васкулитами, ежегодно растет.
Причины возникновения васкулитов
Причины развития васкулитов точно пока не известны. Выделяют первичные системные васкулиты, являющиеся самостоятельными заболеваниями, и вторичные, которые развиваются на фоне других болезней.
В основе формирования первичных васкулитов лежат генетические дефекты, а пусковыми факторами становятся латентные (скрыто протекающие) инфекционные процессы (гепатит В, парвовирус, стафилококк, микобактериоз, ОРВИ), иммунная гиперчувствительность к некоторым лекарственным препаратам (антибактериальным, противовирусным, ингибиторам АПФ, аминазину и др.), гиперсенсибилизация к некоторым соединениям, входящим в состав табака, и пр.
Вторичные системные васкулиты возникают как синдром при различных заболеваниях, например, при инфекционном эндокардите, ревматоидном артрите, при некоторых опухолевых процессах, инфекционных поражениях, при лекарственной болезни.
В основе развития системных васкулитов лежат различные патологические механизмы, например, повреждающее действие циркулирующих иммунных комплексов (ЦИК). Иными словами, при попадании в организм антигена (им может быть любой микробный агент, лекарственное вещество, собственный измененный белок) к нему присоединяется соответствующий иммуноглобулин. Вместе они образуют иммунный комплекс. Эти комплексы начинают циркулировать по организму, осаждаются на внутренней стенке сосудов и вызывают воспаление. Чем больше этих комплексов и чем дольше они циркулируют в крови, тем сильнее повреждается сосудистая стенка. Способствует повреждению повышение внутрисосудистого давления, замедление тока крови, нарушения баланса в работе иммунной системы.
Другими патологическими механизмами, лежащими в основе васкулитов, является выработка тромбоцитами и клетками внутренней стенки сосудов (эндотелия) провоспалительных цитокинов и появление в крови аутоантител – белков, которые ведут себя агрессивно по отношению к собственным антигенам организма. Эти аутоантитела могут оказывать прямое повреждающее действие на эндотелий (антиэндотелиальные антитела), на цитоплазму нейтрофилов (АНЦА – антинейтрофильные цитоплазматические антитела), способствовать активации каскада свертывающей системы крови (антифосфолипидные аутоантитела).
Классификация васкулитов
Существует большое количество классификаций системных васкулитов, из которых основной на сегодняшний день является та, в основе которой лежит калибр пораженных сосудов и основные механизмы их поражения:
1. Васкулит с поражением сосудов крупного калибра:
- артериит Такаясу (неспецифический аортоартериит),
- гигантоклеточный артериит (болезнь Хортона) и ревматическая полимиалгия.
- узелковый полиартериит,
- болезнь Кавасаки.
3.1. Васкулиты, ассоциированные с антинейтрофильными цитоплазматическими антителами (АНЦА):
- микроскопический полиангиит,
- гранулематоз с полиангиитом (Вегенера),
- эозинофильный гранулематоз с полиангиитом (Черджа- Строс).
- заболевания, ассоциированные с антителами к базальной мембране клубочка почек (синдром Гудпасчера),
- криоглобулинемический васкулит
- IgA-ассоциированный васкулит (геморрагический васкулит, пурпура Шенлейна-Геноха),
- гипокомплементемический уртикарный васкулит (анти-C1q васкулит).
- кожный лейкоцитокластический ангиит,
- кожный артериит,
- первичный васкулит центральной нервной системы,
- изолированный аортит,
- другие.
- васкулит при системной красной волчанке,
- ревматоидный васкулит,
- саркоидный васкулит,
- другие.
- криоглобулинемический васкулит, ассоциированный с вирусом гепатита С,
- васкулит, ассоциированный с вирусом гепатита В,
- аортит, ассоциированный с сифилисом,
- лекарственный иммунокомплексный васкулит,
- лекарственный АНЦА-ассоциированный васкулит,
- паранеопластический васкулит,
- другие.
Симптомы системного васкулита зависят от того, какие сосуды поражены. При вовлечении сосудов кожи появляются симметричные высыпания (в первую очередь на голенях), склонные к отеку, кровоизлияниям, некрозу. Может развиться гангрена.
Характерным кожным симптомом является «сосудистая бабочка» – сыпь на щеках и переносице (наблюдается при системной красной волчанке).
На слизистых оболочках также могут появляться геморрагические высыпания, язвы и некрозы.
Ишемический синдром при васкулитах проявляется перемежающейся хромотой – болью в икроножных мышцах, возникающей при ходьбе и вынуждающей человека сделать остановку и подождать, пока боль утихнет (встречается также в других мышцах ног, сопровождается онемением и похолоданием конечностей, может наблюдаться и при поражении верхних конечностей). Кроме того, может развиваться ишемическая полинейропатия, ишемические поражения центральной нервной системы, асимметрия пульсации артерий.
Системные васкулиты характеризуются вовлечением в патологический процесс разных органов и систем. Поражения сосудов сердечно-сосудистой системы могут приводить к недостаточному кровоснабжению сердечной мышцы, миокардитам, поражению внутренней оболочки сердца – эндокарда, и околосердечной сумки – перикарда. Возникают различные нарушения ритма и проводимости, повышается риск развития острого инфаркта миокарда и сердечной недостаточности.
Поражение бронхолегочной системы включает появление в легких уплотнений (инфильтратов), развитие инфарктной пневмонии, бронхоспазма, плеврита.
Почечные васкулиты становятся следствием поражения почечных артерий. Например, при узелковом периартериите в почках возникают множественные безболевые инфаркты (гибель части почки в результате закупорки артерии), что приводит к почечной недостаточности. Поражение почечных артерий может закончиться стойкой злокачественной артериальной гипертензией. Некоторые васкулиты протекают с развитием тяжелого гломерулонефрита – воспалением почечных клубочков.
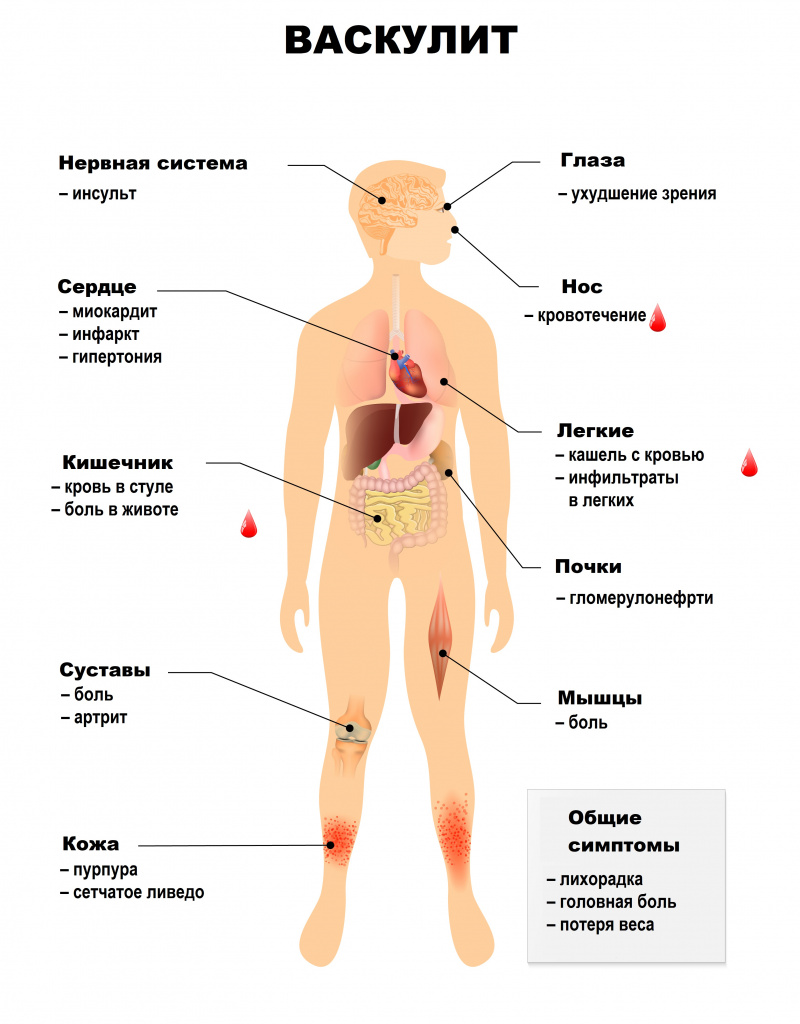
Абдоминальный синдром при васкулитах сопровождается болью в животе в сочетании с диспепсическими расстройствами (чувством распирания, вздутием), тошнотой, рвотой, язвами в желудке и кишечнике, может развиться опасное осложнение – тромбоз брыжеечных артерий, кровоснабжающих кишечник.
Поражение нервной системы проявляется множественными невритами, патологией центральной нервной системы с психозами, зрительными расстройствами, острыми нарушениями мозгового кровообращения.
Для геморрагического васкулита (пурпуры Шенлейна-Геноха) типично поражение кожи, кишечника, почек, суставов. Поражение кожи проявляется геморрагическим синдромом – множественными кровоизлияниями на стопах, голенях, бедрах, ягодицах, плечах, предплечьях, вокруг пораженных суставов. Но особенно они выражены на внутренней поверхности предплечий, бедер, голеней, в местах расположения ремня брюк, ремешка часов. О кровоизлияниях в кишечнике свидетельствуют колики, тошнота, рвота, стул с кровью.
Для криоглобулинемического васкулита характерно поражение кожи и клубочков почек. Появляется мелкоточечная или сливная геморрагическая пурпура чаще в области нижних конечностей, ягодиц, поясницы. Одновременно у больных возникают мигрирующие боли в мелких суставах кистей и в коленных суставах.
Гранулематоз Вегенера проходит с вовлечением дыхательных путей и тяжелым гломерулонефритом, приводящим к декомпенсированной почечной недостаточности и часто является причиной смерти больного.
Эозинофильный гранулематоз с полиангиитом (Черджа-Строс) протекает с поражением респираторного тракта, придаточных пазух носа, аллергией. Характерным признаком является развитие гиперэозинофильной бронхиальной астмы. Почки при этом васкулите, как правило, не страдают.
При узелковом периартериите поражаются в основном артерии среднего калибра – образуются аневризмы, тромбы, кровотечения из-за разрыва аневризм, велик риск инфаркта пораженных органов и тканей. Больные испытывают сильную боль в мышцах (чаще ног), мигрирующие боли в крупных суставах, наблюдается поражение кожи, желудочно-кишечного тракта и сердца.
При микроскопическом полиангиите страдают мелкие сосуды. Для заболевания характерны кожные проявления, полиневрит, воспалительные процессы в дыхательных путях, а также некротизирующий гломерулонефрит.
Болезнь/синдром Кавасаки часто встречается у детей и сопровождается лихорадкой, воспалением слизистых оболочек, кожи, лимфатических узлов и различных систем, прежде всего сердечно-сосудистой, что проявляется тахикардией, аритмией, могут возникать аневризмы и сужения коронарных артерий, миокардит, перикардит, поражение клапанного аппарата.
При болезни Такаясу, или неспецифическом аортоартериите страдают суставы (преимущественно верхних конечностей) и кожа с развитием язв. Характерным является синдром дуги аорты – он включает поражение подключичных артерий, которое проявляется болями, мышечной слабостью, зябкостью рук, резким уменьшением или полным отсутствием пульса на лучевых артериях, и стеноз сонных артерий. Кроме того, возникает симптоматическая артериальная гипертензия (из-за сужения почечных артерий), повышается давление в легочной артерии, сужаются артерии сердца вплоть до развития инфаркта, наблюдается перемежающаяся хромота.
При гигантоклеточном височном артериите страдает аорта и отходящие от нее крупные артерии. Характерным признаком является воспаление височной артерии, вызывающее постоянную, очень интенсивную головную боль, обычно с одной стороны головы.
Диагностика васкулита
Для большинства системных васкулитов нет специфических лабораторных тестов. Внимание уделяется клинической картине заболевания с выявлением характерных для того или иного васкулита симптомов.
Затем врач выясняет системность патологического процесса, на которую могут указывать такие симптомы как повышение температуры, снижение массы тела, боль в мышцах и суставах, анемия, увеличение СОЭ.
Потом определяется, первичный или вторичный характер носит заболевание, после чего требуется клиническое и инструментальное подтверждение поражения сосудов.
Для этой цели применяются методы инструментальной и рентген-диагностики:
Ультразвуковое сканирование артерий верхних конечностей в комплексной диагностике сердечно-сосудистых заболеваний.
За последние два десятилетия благодаря рациональному использованию кортикостероидных гормонов (КГ) и цитотоксических иммунодепрессантов (ЦИ) удалось значительно улучшить жизненный прогноз больных системной красной волчанкой (СКВ). Проведение пульс-терапи
За последние два десятилетия благодаря рациональному использованию кортикостероидных гормонов (КГ) и цитотоксических иммунодепрессантов (ЦИ) удалось значительно улучшить жизненный прогноз больных системной красной волчанкой (СКВ). Проведение пульс-терапии метилпреднизолоном (МП) и циклофосфаном (ЦФ) у больных с волчаночным нефритом, поражением центральной нервной системы (ЦНС) и цитопеническим кризом способствует ускорению сроков достижения клинического улучшения. Патофизиологическим обоснованием для применения ударных доз метилпреднизолона является его способность активно влиять на систему иммунитета и подавлять воспалительные реакции. Один из важнейших эффектов ударных доз КГ — подавление активности нейтрофилов и моноцитов и способность вызывать транзиторную перераспределительную лимфопению. Угнетающее воздействие мегадоз кортикостероидов на функцию В-лимфоцитов приводит к стойкому снижению продукции иммуноглобулинов, а следовательно, и аутоантител, а также к уменьшению образования патологических иммунных комплексов. Из других важных компонентов механизма действия ударных доз КГ заслуживают внимания воздействие на систему цитокинов-интерлейкинов-1,6, фактора некроза опухоли, металлопротеиназ и липокортина, ингибиция экспрессии и функциональной активности Fc и СЗ рецепторов мононуклеарных фагоцитов.
Однако далеко не во всех случаях классическая ПТ позволяет быстро и надежно решать сложнейшие вопросы лечения в критических ситуациях и прогностически неблагоприятных вариантах течения СКВ. В настоящее время достаточно четко выявляется особая группа риска. В эту группу в первую очередь включаются пациенты с развитием СКВ в подростковом возрасте, быстропрогрессирующим волчаночным нефритом с диффузным поражением клубочкового аппарата и «полулуниями», стойкой артериальной гипертензией и азотемией, быстрым развитием нефротического синдрома в молодом возрасте, церебропатией с судорожным синдромом и комой, поперечным миелитом, геморрагическим пневмонитом, тромбоцитопенией, генерализованным поражением кожи и слизистых оболочек с развитием некрозов, сопровождающихся криоглобулинемией, гипокомплементемией и высоким уровнем антиядерных антител. Огромное значение в оценке жизненного прогноза у этой группы пациентов имеет своевременное назначение патогенетической терапии.
Консервативная терапия с использованием подавляющих доз преднизолона и цитостатиков, назначаемых внутрь, у некоторых больных улучшает клиническую картину, но почти не влияет на жизненный прогноз, особенно в случаях прогрессирующего волчаночного нефрита, церебрального криза и геморрагического пневмонита. Однократное трехдневное применение ПТ МП может за сравнительно короткое время уменьшить клиническую и лабораторную активность при нефротическом синдроме. Однако 5-летняя выживаемость пациентов, как правило, не превышает 60%. Другими словами, ударные дозы МП прекрасно зарекомендовали себя в качестве фактически ургентной терапии, с успехом применяющейся в ситуациях, непосредственно угрожающих жизни пациента, при нарастании симптоматики и в случаях неэффективности или невозможности использования консервативной схемы лечения.
Практически при всех прогрессирующих хронических заболеваниях, в том числе и аутоиммунных, жизненный и социальный прогноз в огромной степени зависит от системного, программного подхода к терапии.
Различные схемы и программы интенсивной терапии у больных СКВ стали появляться уже с середины 80-х годов и сводились к назначению ПТ в ежемесячном режиме в течение полугода. Несколько позже появилась схема программного назначения ПТ в комбинации с циклофосфаном: 1 г циклофосфана может быть добавлен к стандартной пульс-терапии обычно на 2-3-й день лечения или дополнительно к метипреду при ежемесячном режиме. Показанием для комбинированного использования циклофосфана и метипреда является манифестная высокоактивная СКВ с выраженными иммунологическими нарушениями. Программное применение пульс-терапии ЦФ у больных быстро прогрессирующим люпус-нефритом впервые в стране предложила группа исследователей во главе с профессором И. Е. Тареевой. Согласно этой методике, ЦФ вводится внутривенно из расчета 1 г на 1 м 2 поверхности тела 1-2 раза в месяц в течение года. По сравнению с пероральным назначением ЦФ эта программа позволяет добиться хороших и стабильных результатов более чем у 70% больных с прогрессирующим нефритом. Особенно важным представляется то, что внутривенное введение мегадоз ЦФ оказывает значительно меньшее токсическое воздействие на эпителий мочевого пузыря и костный мозг, практически не вызывая геморрагических циститов и агранулоцитоза.
Другое направление интенсивной терапии ревматических заболеваний — экстракорпоральные методы лечения: плазмаферез (ПФ) и практически все сорбционные технологии, гемо- и плазмосорбция. В современном исполнении ПФ осуществляется с помощью центрифужной или мебранной технологии с удалением 40-60 мл плазмы на 1 кг веса больного. Для замещения потери белка используется альбумин или свежезамороженная плазма. Стандартные курсы ПФ состоят из 3-6 процедур, проводимых последовательно или с короткими интервалами, с суммарной эксфузией плазмы до 15 л.
Интерес к ПФ у ревматологов возник на рубеже 60-80-х годов после фундаментальных исследований, посвященных иммунокомплексной природе СКВ, изучению механизмов иммунокомплексного поражения органов и тканей и патогенетической роли антител к нативной ДНК. Представлялось вполне рациональным уменьшить степень тканевых повреждений за счет удаления из циркуляции иммунных комплексов (ЦИК), антител к ДНК (а-ДНК), криоглобулинов и цитокинов.
Первые попытки применения терапевтического ПФ у больных СКВ продемонстрировали возможности этого метода в первую очередь в ситуациях, когда кортикостероидная и иммуносупрессивная терапия оказывается неэффективной, при наличии высокого уровня ЦИК, а-ДНК, криоглобулинемии, цитопениях. Выявлена прямая зависимость между адекватным удалением из циркуляции патологических белковых структур и клиническим эффектом, изучены механизмы деблокирования РЭС и повышения естественного клиренса.
Эффективность плазмафереза (от нескольких процедур до многократно повторяемых серий при неблагоприятном течении СКВ) хорошо известна и доказана в ходе многочисленных, в основном зарубежных, исследований 80-90-х годов. Пока не получено убедительных данных об эффективности ПФ у больных люпус-нефритом. Результаты проведенных в США и Канаде открытых и контролируемых испытаний весьма противоречивы.
Изолированное применение ПФ при СКВ в большинстве случаев существенно ограничено развитием так называемого синдрома рикошета, возникающего непосредственно после удаления достаточно большого объема плазмы. Резкое повышение уровня аутоантител в ближайшие дни после процедуры — «рикошет» — связывается со стимуляцией лимфоцитов, продуцирующих аутоантитела по принципу обратной связи. Обычно лабораторный «рикошет» сопровождается обострением клинической картины, что в целом производит впечатление терапевтической неудачи. Логичными представляются два выхода из этой ситуации. Первый — сокращение времени между процедурами и проведение длительных серий ПФ в течение нескольких месяцев или даже лет. Второй, по-видимому, более рациональный и эффективный способ достижения стойкого клинического эффекта при назначении ПФ у больных СКВ — комбинирование экстракорпоральных методов и пульс-терапии МП и ЦФ в синхронном режиме.
Идея синхронной ИТ материализовалась уже в 80-х годах и является практически неотъемлемой частью лечения некоторых системных васкулитов, синдрома Гудпасчера, Вегенера, Хаммана-Ричи, криоглобулинемической пурпуры и поражения центральной и периферической нервной системы при болезни Шегрена. Первые успешные попытки применения синхронной ИТ у больных СКВ были предприняты в 1984 году в Японии, России и Германии: за рубежом — плазмаферез в комбинации с ЦФ, в России — ПФ в комбинации с пульс-терапией МП и ЦФ.
В Институте ревматологии начиная с середины 80-х изучалась эффективность синхронного применения ПФ и пульс-терапии МП и ЦФ у 56 больных СКВ с неблагоприятным жизненным прогнозом. Методика проведения синхронной интенсивной терапии (СИТ) заключалась в следующем: в течение первого месяца больным проводились три процедуры ПФ с удалением не менее 1500 мл плазмы за сеанс, интервалы между процедурами составляли 5-6 дней. После каждой процедуры назначался внутривенно 1 г метипреда, а после второй процедуры к МП добавлялся 1 г ЦФ. Далее в течение года через каждые 3 месяца проводилась одна процедура ПФ с последующим введением 1 г МП и 1 г ЦФ. Основу группы составляли молодые женщины, в подавляющем большинстве с небольшим сроком заболевания, с развернутой клиникой СКВ. Почти у каждого пациента наблюдался прогрессирующий волчаночный нефрит, более чем у половины — нефротический синдром, церебропатия, у трети больных на фоне криоглобулинемии наблюдался распространенный генерализованный васкулит кожи и слизистых оболочек. Высокая клиническая активность сопровождалась значительным повышением уровня антител к ДНК, ЦИК и гипокомплементемией.
Особо следует подчеркнуть, что у половины больных этой группы стандартная терапия, включавшая в себя массивные дозы кортикостероидов и иммунодепрессантов, была неэффективной, а почти трети пациентов адекватная терапия вообще не проводилась.
Многолетнее наблюдение за этой группой больных по окончании 12-месячной СИТ позволило сделать заключение о ее высокой эффективности. Среди этих пациентов 5-летняя выживаемость составила 81%. Наиболее показательными оказались результаты применения СИТ в группе из 12 подростков, у которых течение волчанки, как правило, приобретает фатальный характер. За весь период наблюдения состояние, близкое к клинико-лабораторной ремиссии, было отмечено у 8 из 12 больных, у 2 пациентов эпизодически наблюдались кратковременные обострения СКВ. Ежедневная доза преднизолона составляла от 2,5 до 15 мг, у одной пациентки кортикостероиды были полностью отменены. Большинству больных удалось вернуться к нормальной жизни, учебе, посильной работе, некоторые пациентки вышли замуж и имеют здоровых детей.
Таким образом, программа синхронной интенсивной многомесячной терапии оказывает значительное влияние на клинико-лабораторные проявления и существенно улучшает жизненный и социальный прогноз у больных СКВ с прогностически неблагоприятным вариантом течения. Синхронное назначение ПФ и внутривенное введение ударных доз МП и ЦФ могут использоваться по жизненным показаниям в случаях так называемого волчаночного криза — при тромбоцитопенической пурпуре, церебральной коме, развитии тромбозов, инфарктов и инсультов у больных с антифосфолипидным синдромом и геморрагическим пневмонитом. В этих ситуациях проведение СИТ обычно ограничивается 3-4 последовательными процедурами — вплоть до купирования ургентной ситуации. В случаях с заведомо неблагоприятным долгосрочным жизненным прогнозом — прогрессирующий гломерулонефрит или поражение ЦНС, язвенно-некротический васкулит, острое начало болезни у подростка — требуется проведение длительных программ СИТ.
Нам представляется, что возможности программной СИТ далеко не исчерпаны. Перспективным может оказаться добавление в схему внутривенного иммуноглобулина, моноклональных антител и интерферонов, применение которых способно блокировать образование аутоантител и патологических ЦИК. Весьма актуальным остается индивидуальный подбор программы с более частым (ежемесячным, еженедельным) назначением плазмафереза и ПТ. Особенно важным аспектом, обеспечивающим возможность проведения более длительных и полноценных курсов экстракорпоральных процедур, является внедрение новых технологий обработки плазмы, таких, как каскадная фильтрация и иммуносорбция, применение которых позволяет сводить к минимуму потерю альбумина и селективно удалять из циркуляции патологические аутоантитела и иммунные комплексы.
Системная красная волчанка (СКВ) – аутоиммунное заболевание, этиология которого остается неизвестной. Кожный синдром при СКВ зачастую имеет первостепенное диагностическое значение – поражение кожи в 20-30% случаев является самым ранним симптомом, а у 60-
Systemic lupus erythematosus: alertness in the practice of a dermatologist / M. M. Tlish, Zh. Yu. Naatyzh1, T. G. Kuznetsova, E. A. Chernenko /State Budgetary educational institution of higher professional education Kuban State Medical University of the Ministry of Healthcare of the Russian Federation, Krasnodar, Russia
Abstract. Systemic lupus erythematosus (SLE) is an autoimmune disease, the etiology of which remains unknown. Skin syndrome in SLE is often of paramount diagnostic value – skin lesion is the earliest symptom in 20-30% of cases, and in 60-70% it manifests itself at various stages of the course of the disease, which leads to the patient's primary referral to a dermatologist. Frequent diagnostic errors are due to the absence of clinical symptoms of systemic lesions in the presence of cutaneous manifestations of lupus erythematosus (LE). In this case, laboratory tests are an integral part of the algorithm for managing patients with LE at the stage of contacting a dermatologist. The most specific laboratory test is the determination of antinuclear antibodies by an indirect immunofluorescence reaction, referred to as antinuclear factor (ANF). An elevated ANF titer is included in the list of diagnostic criteria for SLE, its detection allows one to suggest a diagnosis of SLE and determine a further algorithm for the provision of medical care. The article presents two clinical cases illustrating that against the background of an isolated skin lesion and the absence of visible somatic pathology, abnormalities in immunological tests were identified. This made it possible to suspect the systemic course of the process at an early stage and refer patients to a rheumatologist's consultation, where the diagnosis of SLE was confirmed. For citation: Tlish M. M., Naatyzh Zh. Yu., Kuznetsova T. G., Chernenko E. A. Systemic lupus erythematosus: alertness in the practice of a dermatologist // Lechaschy Vrach. 2020; vol. 23 (11): 23-26. DOI: 110.26295/OS.2020.35.78.005
Согласно современным представлениям, системная красная волчанка (СКВ) – аутоиммунное заболевание неустановленной этиологии, характеризующееся гиперпродукцией органонеспецифических аутоантител с развитием иммуновоспалительного повреждения тканей внутренних органов [1]. Широкий ряд вырабатываемых аутоантител и их прямое или опосредованное воздействие на клеточные мишени обуславливают многообразие клинических проявлений при красной волчанке (КВ) [2]. СКВ может проявляться изолированным или сочетанным поражением систем и органов, включающим поражение кожи и слизистых оболочек (волчаночная бабочка, дискоидная эритема, фотосенсибилизация, алопеция, телеангиэктазии, сетчатое ливедо, язвы в полости рта), сердечно-сосудистой системы (перикардит, миокардит, эндокардит, коронарит), почек (волчаночный нефрит), центральной нервной системы (судороги, психоз), опорно-двигательного аппарата (артралгии, артриты), легких (плеврит, волчаночный пневмонит), гематологическими нарушениями (гемолитическая анемия, лейкопения, тромбоцитопения) и т. д. [3].
Ключевую роль в диагностике СКВ играет обнаружение клинических проявлений заболевания и данные лабораторной диагностики [3]. Кожный синдром при СКВ зачастую имеет первостепенное диагностическое значение – поражение кожи в 20-30% случаев является самым ранним симптомом, а у 60-70% проявляется на различных этапах течения болезни, что приводит к первичному обращению больного именно к дерматологу [4]. Поражения кожи при СКВ полиморфны и представлены различными изменениями – от незначительных телеангиэктазий до буллезных поражений [2]. Выделяют волчаночно-специфичные и волчаночно-неспецифичные поражения кожи, последние встречаются в несколько раз чаще. К волчаночно-специ-фичным относят различные проявления хронической, подострой и острой КВ [5]. Группа неспецифических поражений включает: фотосенсибилизацию, лейкоцитокластический и уртикарный васкулит, телеангиэктазии, сетчатое ливедо, злокачественный атрофический папулез и синдром Рейно [5]. Широкая вариабельность клинических проявлений кожного синдрома обуславливает необходимость проведения тщательного дифференциального диагноза [1].
Важным инструментом ранней диагностики системных заболеваний является обнаружение аутоантител с помощью лабораторных тестов [3]. Наиболее специ-фичными для СКВ являются антинуклеарные антитела (АНА) – это гетерогенная группа аутоантител к компонентам клеточного ядра, среди которых выделяют антитела к двуспиральной дезоксирибонуклеиновой кислоте (ДНК), гистонам, нуклеосомам, экстрагируемым ядерным антигенам, ядрышковым антигенам и другим клеточным структурам [6]. Стандартным методом обнаружения группы АНА является непрямая реакция иммунофлюоресценции (НРИФ) с использованием линии эпителиальных клеток аденокарциномы гортани человека (HЕp-2) [7]. Определение АНА методом НРИФ принято обозначать как антинуклеарный фактор (АНФ), содержание которого оценивается по максимальному выявленному титру в сыворотке крови, с указанием интенсивности и типа флюоресценции [8]. Количественное увеличение титра свыше 1:160 входит в перечень диагностических критериев СКВ согласно рекомендациям Американской коллегии ревматологов (American College of Rheumatology, ACR) и Европейской лиги борьбы с ревматизмом (European League Against Rheumatism, ULAR) и используется для оценки активности процесса, прогноза, так как является предиктором развития СКВ на доклинической стадии [8].
Длительное формирование патогномоничного клинического симптомокомплекса СКВ, отсутствие проведения необходимых лабораторных исследований и междисциплинарного взаимодействия являются причиной частых диагностических ошибок, приводящих к отсутствию своевременной противовоспалительной и иммуносупрессивной терапии у врача-ревматолога. Учитывая вышесказанное, считаем целесообразным привести собственные клинические наблюдения.
Клиническое наблюдение № 1
Больная М., 27 лет, считает себя больной с июля 2019 г., когда после длительного отдыха на побережье появились высыпания на коже лица. Обратилась к дерматологу по месту жительства, где был выставлен диагноз: «Розацеа, папулопустулезный подтип, среднетяжелое течение». Получала курсовое лечение (доксициклин, метронидазол гель). Видимого улучшения пациентка не отмечала, процесс на коже продолжал прогрессировать, в связи с чем обратилась на кафедру дерматовенерологии ФГБОУ ВО КубГМУ Минздрава России.
Данные со стороны других органов и систем: предъявляет жалобы на ноющие боли в мелких суставах кистей и коленных суставах, чувство утренней скованности. Соматически не обследована.
Объективно: кожный патологический процесс носит ограниченный симметричный характер, локализуется на коже крыльев носа, щек, подбородка. Представлен: эритематозные пятна, чешуйки, телеангиэктазии.
На коже лица (в области крыльев носа, щек, подбородка) расположены ярко-розовые эритематозные очаги, с четкими границами, слегка инфильтрированные, правильной округлой формы, диаметром 3-4 см, покрытые небольшим шелушением в центре очагов; в периферической зоне очагов визуализируются телеангиэктазии (рис. 1). Удаление чешуек сопровождается болезненностью (симптом Бенье–Мещерского).
.jpg)
Определена биодоза 20 секунд.
С предположительным диагнозом «Дискоидная красная волчанка?» больная была направлена на гистоморфологическое исследование кожи.
Результаты гистоморфологического исследования кожи из патологического очага на правой щеке: фолликулярный гиперкератоз; эпидермис с тенденцией к атрофии; вакуольная дистрофия клеток базального слоя. Под эпидермисом сосуды расширены. Во всех отделах дермы – густые диффузные и периваскулярные лимфогистиоцитарные инфильтраты с примесью нейтрофилов и плазмоцитов. Вокруг сально-волосяных фолликулов – густой лимфогистиоцитарный инфильтрат с примесью нейтрофилов, тучных клеток и фибробластов, проникающий в наружное эпителиальное влагалище. В дерме – участки мукоидного набухания коллагеновых волокон. Заключение: морфологическая картина может соответствовать красной волчанке.
Данные общеклинических исследований: общий и биохимический анализ крови – показатели в пределах нормы; общий анализ мочи – показатели в пределах нормы.
Настораживающими факторами в плане трансформации кожной формы в системный процесс у пациентки М. явились: дебют заболевания в молодом возрасте, длительная инсоляция в анамнезе, II фототип кожи, биодоза 20 секунд, наличие выраженного суставного синдрома.
Для исключения диагноза СКВ было проведено иммунологическое исследование:
- Антинуклеарный фактор на НЕр-2 клетках: 1:320 титр (норма менее 160); мелкогранулярный тип свечения.
- Антитела к двуспиральной ДНК (a-dsDNA) – 53 МЕ/мл (норма – менее 25 МЕ/мл).
- Анализ крови на антитела к фосфолипидам класса IgG (скрининг) – 10,13 МЕ/мл (референсные значения: до 10 МЕ/мл – не обнаружено).
- Анализ крови на антитела к фосфолипидам класса IgM (скрининг) – 12,68 МЕ/мл (референсные значения: до 10 МЕ/мл – не обнаружено).
С полученными данными больная направлена к ревматологу в Краевую клиническую больницу № 2, где был подтвержден диагноз СКВ. Больная взята на диспансерный учет ревматологом для определения дальнейшей тактики ведения и лечения.
Клиническое наблюдение № 2
Пациентка В., 66 лет, считает себя больной с апреля 2018 г., когда впервые появились высыпания на коже щек и подбородка. При сборе анамнеза установлено, что больная длительное время проживала в северном регионе и после переезда в Краснодарский край начала отмечать появление высыпаний. Самостоятельно использовала бетаметазон и декспантенол. Отмечала временное улучшение, но в весенне-летний период заболевание обострялось. Обратилась к дерматологу по месту жительства, где был выставлен диагноз «стероидпровоцированная розацеа» и назначено лечение (наружные и системные антибактериальные препараты, ангиопротекторы). Видимого улучшения не наблюдала, в связи с чем обратилась на кафедру дерматовенерологии ФГБОУ ВО КубГМУ МЗ РФ.
Объективно: кожный патологический процесс носит распространенный характер, локализован на коже лица, шеи. Представлен: пятна, телеангиэктазии, чешуйки.
На коже лица в области щек, левой околоушной области и шеи расположены отечные эритематозные очаги розовато-красного цвета, диаметром 2–3 см, преимущественно правильно-округлой формы с небольшим шелушением, визуализируются единичные телеангиэктазии. Удаление чешуек сопровождается болезненностью (симптом Бенье–Мещерского) (рис. 2).
.jpg)
С предварительным диагнозом «Дискоидная красная волчанка?» пациентка направлена на гистоморфологическое исследование.
Результаты гистоморфологического исследования кожи из патологического очага: на коже левой щеки – фолликулярный гиперкератоз; участки паракератоза; эпидермис местами атрофичен; вакуольная дистрофия клеток базального слоя эпидермиса; подэпидермальные пузыри. В сосочковом слое – отек, стенки сосудов утолщены. В дерме – густые очаговые и периваскулярные лимфогистиоцитарные инфильтраты с примесью нейтрофилов. Вокруг сально-волосяных фолликулов – густой лимфогистиоцитарный инфильтрат с примесью нейтрофилов, тучных клеток и фибробластов, проникающий в наружное эпителиальное влагалище. В дерме – участки мукоидного набухания коллагеновых волокон. Заключение: морфологическая картина больше соответствует красной волчанке.
Данные общеклинических исследований: в общем и биохимическом анализах крови выявлены следующие отклонения – лейкоциты 3,7 × 10 9 /л; холестерин 8,7 ммоль/л.
Учитывая длительность течения кожного патологического процесса, отсутствие результатов обследования смежных специалистов, для исключения диагноза СКВ было проведено иммунологическое исследование:
- Антинуклеарный фактор на НЕр-2 клетках: 12 560 титр (норма менее 160); крупногранулярный тип свечения.
- Антитела к двуспиральной ДНК (a-dsDNA) – 0,5 МЕ/мл (норма – менее 25 МЕ/мл).
- Анализ крови на антитела к фосфолипидам класса IgG (скрининг) 16,65 МЕ/мл (референсные значения: до 10 МЕ/мл – не обнаружено).
- Анализ крови на антитела к фосфолипидам класса IgM (скрининг) – 14,68 МЕ/мл (референсные значения до 10 МЕ/мл – не обнаружено).
С полученными результатами лабораторных исследований больная была направленна на консультацию к ревматологу в Краевую клиническую больницу № 2, где был установлен диагноз: «СКВ, хроническое течение, 1-й степени активности, с поражением кожи (эритема по типу «бабочки»), иммунологическими нарушениями (антинуклеарный фактор на НЕр-2 клетках, положительный анализ крови на антитела к фосфолипидам IgG, IgM)». Больную госпитализировали в ревматологическое отделение на стационарное лечение.
Таким образом, иммунологические исследования и их комплексный анализ являются неотъемлемой составляющей алгоритма ведения больных с КВ уже на этапе обращения к врачу-дерматологу и способствуют высокому качеству оказания медицинской помощи данному контингенту больных.
Литература/References
- Тлиш М. М., Наатыж Ж. Ю., Сычева Н. Л., Кузнецова Т. Г., Иризелян Г. А., Псавок Ф. А. Системная красная волчанка: междисциплинарный подход к диагностике // Российский журнал кожных и венерических болезней. 2016; 19 (3): 141-147. [Tlish M. M., Naatyzh Zh. Yu., Sycheva N. L., Kuznetsova T. G., Irizelyan G. A., Psavok F. A. Sistemnaya krasnaya volchanka: mezhdistsiplinarnyy podkhod k diagnostike [Systemic lupus erythematosus: an interdisciplinary approach to diagnosis] Rossiyskiy zhurnal kozhnykh i venericheskikh bolezney. 2016; 19 (3): pp. 141-147.]
- Мазуров В. И., ред. Диффузные болезни соединительной ткани: руководство для врачей. СПб: СпецЛит, 2009. 192 с. [Mazurov V. I., red. Diffuznyye bolezni soyedinitel'noy tkani: rukovodstvo dlya vrachey. [Diffuse connective tissue diseases: a guide for physicians.] SPb: SpetsLit, 2009. P. 192.]
- Насонов Е. Л., ред. Клинические рекомендации по ревматологии. 2-е изд., испр. и доп. М.: ГЭОТАРМедиа, 2010. 429 с. [Nasonov Ye. L., red. Klinicheskiye rekomendatsii po revmatologii. [Clinical practice guidelines to rheumatology.] 2-ye izd., ispr. i dop. M.: GEOTARMedia, 2010. P. 429.]
- Романова Н. В., Шилкина Н. П. Клинико-иммуноло-гическая характеристика кожного синдрома у больных красной волчанкой // Российский журнал кожных и венерических болезней. 2005; (4): 45-48. [Romanova N. V., Shilkina N. P. Kliniko-immuno-logicheskaya kharakteristika kozhnogo sindroma u bol'nykh krasnoy volchankoy [Clinical and immunological characteristics of skin syndrome in patients with lupus erythematosus] Rossiyskiy zhurnal kozhnykh i venericheskikh bolezney. 2005; (4): pp. 45-48.]
- Тлиш М. М., Наатыж Ж. Ю., Сычева Н. Л., Кузнецова Т. Г. Системная красная волчанка в практике дерматолога // Клиническая медицина. 2018; 96 (3): 277-281. [Tlish M. M., Naatyzh Zh. Yu., Sycheva N. L., Kuznetsova T. G. Sistemnaya krasnaya volchanka v praktike dermatologa [Systemic lupus erythematosus in the practice of a dermatologist] Klinicheskaya meditsina. 2018; 96 (3): pp. 277-281.]
- Клюквина Н. Г. Клиническое значение лабораторных нарушений при системной красной волчанке // Современная ревматология. 2014; (2): 41-47. [Klyukvina N. G. Klinicheskoye znacheniye laboratornykh narusheniy pri sistemnoy krasnoy volchanke [Clinical significance of laboratory disorders in systemic lupus erythematosus] Sovremennaya revmatologiya. 2014; (2): pp. 41-47.]
- Александрова Е. Н., Новиков А. А., Насонов Е. Л. Рекомендации по лабораторной диагностике ревматических заболеваний Общероссийской общественной организации «Ассоциация ревматологов России» – 2015 // Современная ревматология. 2015; 9 (4): 25-36. [Aleksandrova Ye. N., Novikov A. A., Nasonov Ye. L. Rekomendatsii po laboratornoy diagnostike revmaticheskikh zabolevaniy Obshcherossiyskoy obshchestvennoy organizatsii «Assotsiatsiya revmatologov Rossii» – 2015 [Recommendations for laboratory diagnostics of rheumatic diseases of the All-Russian public organization «Association of rheumatologists of Russia» – 2015] Sovremennaya revmatologiya. 2015; 9 (4): pp. 25-36.]
- Александрова Е. Н., Новиков А. А., Верижникова Ж. Г., Лукина Г. В. Современный взгляд на проблемы исследования антинуклеарных антител при системной красной волчанке (обзор литературы) // Клиническая лабораторная диагностика. 2018; 63 (6): 340-348. [Aleksandrova Ye. N., Novikov A. A., Verizhnikova Zh. G., Lukina G. V. Sovremennyy vzglyad na problemy issledovaniya antinuklearnykh antitel pri sistemnoy krasnoy volchanke (obzor literatury) [Modern view on the problems of studying antinuclear antibodies in systemic lupus erythematosus (literature review)] Klinicheskaya laboratornaya diagnostika. 2018; 63 (6): pp. 340-348.]
М. М. Тлиш, доктор медицинских наук, профессор
Ж. Ю. Наатыж 1 , кандидат медицинских наук
Т. Г. Кузнецова, кандидат медицинских наук
Е. А. Черненко
ФГБОУ ВО КубГМУ Минздрава России, Краснодар, Россия
Системная красная волчанка: настороженность в практике дерматолога/ М. М. Тлиш, Ж. Ю. Наатыж, Т. Г. Кузнецова, Е. А. Черненко
Для цитирования: Тлиш М. М., Наатыж Ж. Ю., Кузнецова Т. Г., Черненко Е. А. Системная красная волчанка: настороженность в практике дерматолога // Лечащий Врач. 2020; т. 23 (11), 23-26. DOI: 110.26295/OS.2020.35.78.005
Теги: аутоиммунное заболевание, кожный синдром, алгоритм лечения

Фото: АстраЗенека
Главный герой одного из популярных «медицинских» сериалов при дифференциальном диагнозе именно системную красную волчанку (СКВ) подозревал у каждого трудного пациента. И хотя у кинематографических сценариев свои законы, авторы этого сценария четко уловили важную особенность СКВ — невероятную многоликость заболевания.

О многогранности проявлений сложной хронической патологии, при которой иммунная система организма атакует свои собственные клетки как чужеродные, о потенциальных причинах ее развития и о возможностях современных терапевтических стратегий корреспондент МВ узнал у Татьяны Решетняк, докт.мед.наук, врача высшей квалификационной категории, заведующей лабораторией тромбовоспаления ФГБНУ «Научно-исследовательского института ревматологии им. В.А. Насоновой».
— На самом деле, история этого заболевания значительно глубже. Первым, кто описал кожные язвы herpes esthiomenos, был еще Гиппократ (460-375 до н. э.). Название «красная волчанка» (Lupus erythematosus — лат.), происходит от латинских слов lupus — «волк» (из-за характерной, похожей по форме на бабочку сыпи на лице, напоминающей белые отметины на морде волка), и erythematosus — «красная», что указывает на цвет кожных высыпаний.
Выделяют несколько периодов изучения СКВ: классический, при котором описаны кожные проявления заболевания и их отличие от туберкулеза кожи; неоклассический — выделение диссеминированных или системных проявлений заболевания; современный, начало которого относится к описанию LE-клеточного феномена при СКВ, а продолжение характеризуется дальнейшими успехами в диагностике и терапии заболевания.
По определению ВОЗ и акад. В.А. Насоновой, «Системная красная волчанка (СКВ) — хроническое полисиндромное заболевание преимущественно молодых женщин и девушек, развивающееся на фоне генетически обусловленного несовершенства иммунорегуляторных процессов и приводящего к неконтролируемой продукции антител к собственным клеткам и их компонентам, с развитием аутоиммуного и иммунокомплексного хронического воспаления». Как следует из определения, контингент больных — в основном, молодые женщины трудоспособного и репродуктивного возраста, в связи с чем это заболевание остается актуальным как в мире, так и в России.
Теперь о распространенности. В учете истинной частоты и степени преобладания заболевания в различных этнических группах есть трудности. Связаны они с методологическими различиями в проведенных исследованиях.
Результаты исследования 2007 года, суммирующего данные 1950-2004 годов, приводят частоту заболевания от одного до 241 случая на 100 тыс. населения. При этом отмечается, что частота встречаемости СКВ возрастает с каждым десятилетием (с 1950 по 1979 год она составляла 1,51 на 100 тыс. населения, а с 1980 по 1992 год — 5,56 на 100 тыс.).
По данным российских исследований, распространенность данного заболевания колеблется в диапазоне от 4 до 250 случаев на 100 тыс. населения 1 .
К сожалению, в нашей стране отсутствует регистр по СКВ, но число новых случаев такое же, как и по Европе (например, по данным регистра Швеции — это 39-45 случаев на 100) 2 .
— Системная красная волчанка — сложное заболевание, этиология которого до конца не изучена. Расскажите, пожалуйста, что известно современной медицине о его патогенезе?
— Патогенез СКВ сложен и действительно до конца не изучен. Системная красная волчанка — заболевание с наследственной предрасположенностью, но не в полной мере наследственное заболевание. Выявлено достаточно много генов, которые вовлечены в механизм его развития (более 40). Однако сам ген волчанки до настоящего времени не найден, поэтому говорить о том, что это наследственное заболевание, мы пока не можем.
СКВ — аутоиммунная болезнь, возникающая в случае, когда иммунная система человека теряет способность отличать чужеродные агенты от собственных тканей и клеток. Иммунная система вырабатывает наряду с другими активными молекулами аутоантитела, которые расценивают собственные нормальные клетки организма как чужеродные и атакуют их.
Отмечается гиперактивность В-лимфоцитов и дефицит Т-супрессорной функции лимфоцитов, при этом отмечается продукция большого количества аутоантител (антиядерных, антител к двуспиральной, нативной ДНК, микросомам, лизосомам, митохондриям, форменным элементам крови и др.). Наибольшее патогенетическое значение имеют антитела к нативной ДНК (нДНК), которые, соединяясь с ней, образуют иммунные комплексы и активируют комплемент.
В патогенезе СКВ задействован как врожденный, так и приобретенный иммунитет, и важную роль в их дисрегуляции играет интерферон I типа (ИФН I типа). Недавние исследования обнаружили тесную взаимосвязь между ИФН I типа, особенно ИФН-α. С этим заболеванием более чем у половины пациентов с СКВ экспрессия генов «сигнатуры ИФН типа I» была выявлена в мононуклеарах периферической крови. ИФН-α может активировать лимфоциты, дендритные клетки и естественные киллерные клетки (NK), нарушая аутоиммунную толерантность. Результатом является аутоиммунная реакция, вызывающая воспаление определенных органов (суставов, почек, кожи и т. д.).
Также известно, что СКВ может быть спровоцирована гормональным дисбалансом в период полового созревания, стрессом, факторами окружающей среды (например, воздействием ультрафиолета), вирусной инфекцией, приемом лекарственных средств (таких, как изониазид, гидралазин, прокаины или противосудорожные препараты).
— Для волчанки характерно многообразие симптомов и проявлений. Врачам каких специальностей нужно иметь настороженность в отношении этого заболевания?
— Симптомы СКВ действительно многообразны и могут быть связаны с поражением любых систем и органов. Именно поэтому СКВ определяют как мультидисциплинарную проблему.
Врач любой специальности на практике имеет возможность «встретиться» с больным системной красной волчанкой. В первую очередь, это может быть терапевт, дерматолог, нефролог, невролог, гематолог, кардиолог, акушер-гинеколог, а также аллерголог и инфекционист.
— Татьяна Магомедалиевна, на что врачу следует обратить внимание, чтобы не пропустить такого пациента? Какие органы и системы поражаются при этом заболевании? Каковы наиболее часто встречающиеся симптомы при СКВ?
— Как правило, у пациента можно выделить какой-либо один пораженный орган-мишень, определяющий тяжесть состояния. При легкой степени активности СКВ наиболее часто вовлечены кожно-слизистая и костно-мышечная системы. Для тяжелой степени активности характерно поражение жизненно-важных органов.
Одинаковых случаев СКВ нет. У разных пациентов заболевание может проявляться по-разному. Это может быть, к примеру, лихорадка неясного генеза, боли в суставах, кратковременные, мигрирующие боли в области грудной клетки, которые могут быть связаны с дыханием или с переменой положения тела, адгезивный полисерозит. С такими проявлениями пациенты обращаются к терапевтам.
К неврологам попадают пациенты с эпилептическим статусом, хореиформными гиперкинезами, нарушением чувствительности, проблемами с мочеиспусканием или недержанием мочи у молодых пациентов. Встречаются также энцефаломиелопатии и радикулополинейропатии, которые обычно сочетаются с лихорадкой и другими проявлениями.
При поражении почек у больных СКВ болевых ощущений чаще всего нет. И врачи ориентируются на лабораторные анализы — появление белка в моче. Это в первую очередь требует исключения гломерулонефрита после ангины или простудного заболевания, на фоне приема лекарственных препаратов. О вовлечении почек зачастую говорит и появление отеков, преимущественно в области стоп, голеней, а также появление одутловатости лица и параорбитальных отеков.
При волчанке может наблюдаться феномен Рейно (изменение окраски кончиков пальцев или пальцев целиком в связи со стрессом или холодом). Поражения кожи при СКВ в 25-50% довольно типичны, поэтому дерматологи и терапевты сразу их замечают — высыпания эритематозного характера на скулах, спинке носа, подбородка, надбровных дуг. К проявлениям волчанки относятся и язвы во рту и носу — с такими жалобами пациент может попасть к отоларингологу или опять же к терапевту.
Системная красная волчанка иногда сопровождается так называемым сухим синдромом, или синдромом Шегрена, при котором отмечается сухость во рту, трудности с проглатыванием твердой пищи, снижение количества слез.
Кроме того, существует субтип волчанки с антифосфолипидным синдромом. Он вызывает рецидивирующие тромбозы любой локализации и акушерскую патологию, проявляющуюся рецидивирующими потерями беременности. Бывает, что первая беременность заканчивается самопроизвольным абортом, и при обследовании выявляется позитивная реакция Вассермана (реакция на сифилис), а при проверке эта реакция оказывается ложно-позитивной — это еще один признак волчанки.
— Очевидно, что и при СКВ важно как можно раньше поставить диагноз. Каким будет прогноз при запоздалой диагностике заболевания?
— Поздняя диагностика приводит к плохому прогнозу, как и запоздалое выявление повышения активности СКВ — это ведет к неконтролируемой выработке аутоантител и нарастанию функциональной недостаточности органов.
Самые серьезные из возможных поражений — поражения почек и центральной нервной системы. При волчаночном нефрите быстро наступает хроническая болезнь почек и уремия, что вызывает необходимость диализа, в перспективе трансплантации почек.
При поражении центральной нервной системы возможен поперечный миелит, приводящий пациентов с энцефаломиелопатией или радикулополинейропатией без своевременного лечения к инвалидизации. Наличие антифосфолипидного синдрома при СКВ ведет к возрастанию риска инсульта и нарушений когнитивных функций.
Как говорилось выше, антифосфолипидный синдром может также проявляться акушерской патологией с рецидивирующими случаями потери плода на разных сроках беременности. При этом фертильность у пациенток с СКВ не страдает, беременность наступает довольно легко. Поэтому при активной волчанке и при приеме иммуносупрессивных препаратов обязательно пользоваться средствами контрацепции.
Все перечисленные специалисты наблюдают пациента совместно с ревматологом.
— Какие современные терапевтические стратегии предлагает медицина для пациентов с этим сложным и мало предсказуемым заболеванием?
— Длительно существующее аутоиммунное воспаление, как это бывает при системной красной волчанке, может вызвать повреждение тканей и нарушить их нормальное функционирование, поэтому лечение СКВ направлено прежде всего на подавление аутоиммунных реакций.
В настоящее время выявлен ряд мишеней для создания лекарственных препаратов для лечения СКВ. Несмотря на большое число клинических исследований сегодня ревматологи располагают ограниченным набором высокотехнологичных лекарственных средств.
Генно-инженерная биологическая терапия — многообещающая опция в лечении СКВ. Она подразумевает разработку моноклональных антител, оказывающих селективное воздействие на основные звенья иммунопатогенеза СКВ. К сожалению, пока таких препаратов одобрено мало. Биологические препараты, рекомендуемые для терапии СКВ, влияют только на В-клеточное звено иммунитета.
Согласно последним научным данным, считается, что ведущий механизм развития СКВ связан с семейством интерферонов (ИФН) типа I, поэтому антитела к ИФН-α имеют большое будущее в лечении волчанки. В ближайшее время ожидается появление нового препарата — ингибитора ИФН типа I.
— Излечить волчанку пока нельзя, но этот диагноз уже не звучит фатально. Какова выживаемость пациентов с СКВ в наше время? Благодаря чему она достигнута?
— Да, сегодня 10-летняя выживаемость достигла 95%. Это результат и своевременной диагностики, и адекватного лечения. Появление новых биологических таргетных препаратов ведет к снижению дозы глюкокортикоидов и цитостатиков, что, в свою очередь, снижает нежелательные явления стандартной терапии, уменьшается повреждение органов, что способствует не только контролю активности заболевания, но и достижению еще одной важной цели в терапии СКВ — улучшению качества жизни пациентов.
Читайте также:

