Эпителий желез атрофичен что это
Обновлено: 23.04.2024

Врач акушер-гинеколог. Эксперт по патологиям вульвы и шейки матки, ведущий консультирующий врач в Центре патологии шейки матки в Санкт-Петербурге. Стаж 12+ лет. Принимает в Университетской клинике. Стоимость приема 1400 руб.
- Запись опубликована: 26.03.2020
- Reading time: 4 минут чтения
В ходе атрофических изменений влагалища его эпителий становится чрезвычайно тонким. Причина атрофии – низкий уровень эстрогена, что наблюдается в период наступления менопаузы, кормления грудью и при дефиците гормонов в организме.
К симптомам заболевания относятся: сухость влагалища, зуд и жжение в области половых органов, болевые ощущения в течение полового акта. Для лечения применяют эстрогены и увлажняющие средства (вагинальные суппозитории, гели или кремы).
Что такое атрофический вагинит
Атрофический вагинит – это процесс, заключающийся в уменьшении толщины эпителия. Эти изменения происходят в результате уменьшения концентрации стероидных гормонов – эстрогенов в крови. Чаще всего атрофические изменения влагалища возникают после прихода менопаузы, но могут развиваться и в период грудного вскармливания или при гормональных нарушениях, связанных со снижением секреции эстрогенов.
Причины заболевания
Основная причина развития атрофических изменений влагалища – дефицит выработки эстрогенов. Снижение содержания женских половых гормонов в организме приводит к тому, что ткани влагалища истончаются, становятся более хрупкими, сухими, нежными и чувствительными к механическим повреждениям.
Уменьшение концентрации эстрогенов происходит в следующих случаях:
- пременопауза;
- постменопауза;
- грудное вскармливание;
- удаление обоих яичников;
- состояние после лучевой и химиотерапии органов малого таза;
- как побочные эффекты гормональной терапии рака молочной железы.
Как правило, изменения эндометрия влагалища начинаются за несколько лет до начала менопаузы, но иногда появляются после наступления этого периода. Атрофия вульвы также развивается непосредственно в период самой менопаузы.
Другая причина атрофии слизистой оболочки влагалища – отсутствие детей. Установлено, что женщины, которые никогда не рожали, более склонны к развитию атрофического воспаления влагалища, по сравнению с теми, которые хотя бы раз в жизни проходили через роды.
Существуют факторы, повышающие риск развития атрофии влагалища. К ним относится курение. Никотин нарушает кровообращение, к тканям влагалища и других органов поступает меньше кислорода. Снижение циркуляции крови и доставки питательных веществ приводит к атрофическим изменениям.
Никотин уменьшает воздействие естественных эстрогенов на ткани. Кроме того, у курящих женщин менопауза начинается раньше и наблюдается пониженная реакция организма на терапию эстрогенами.
Симптомы атрофического вагинита
Атрофический вагинит может иметь серьезные последствия, связанные не только с дискомфортом в области влагалища. Хрупкость и повышенная чувствительность эстрогензависимых тканей может привести к нарушениям статики репродуктивного органа и осложнениям со стороны мочевыводящей системы.

Симптомы вагинита
В зависимости от степени тяжести заболевания наблюдаются следующие симптомы атрофического вагинита:
- сухость влагалища;
- жжение в области уретры во время мочеиспускания;
- внезапные позывы к мочеиспусканию;
- недержание мочи;
- небольшое кровотечение после полового акта;
- дискомфорт и боль во время секса;
- зуд половых органов;
- укорочение и сужение канала, влагалища.
Диагностика атрофического вагинита
Для диагностики атрофического вагинита проводятся: гинекологический осмотр, УЗИ, цитологическое исследование, клинический анализ мочи, анализ крови на гормоны.
- Гинекологический осмотр. Во время гинекологического осмотра врач проводит визуальную оценку состояния наружных половых органов, влагалища и шейки матки. При атрофическом вагините видны измененные участки, отек и покраснение слизистой оболочки влагалища.
- Ультразвуковая диагностика. При проведении УЗИ врач изучает состояние органов малого таза, матки, яичников. Во время этого исследования гинеколог также проверяет наличие признаков пролапса органов малого таза и растяжения тканей, поддерживающих матку.
- Цитологическое исследование. Гинеколог берет мазок из влагалища и шейки матки, затем проводится микроскопический анализ. Изучается строение и функции клеток. При атрофическом вагините обнаруживают большое количество отмерших клеток эпителия. Также цитология необходима для исключения злокачественных новообразований шейки матки и влгалища.
- Бактериологическое исследование . Проводится анализ мазка уретры, влагалища и шейки матки для определения флоры и наличия патогенных микроорганизмов. Определяется кислотность среды. При дефиците эстрогенов происходит сдвиг pH в щелочную сторону.
- Клинический анализ мочи. При наличии симптомов со стороны мочевыделительной системы проводится общий анализ мочи для оценки физико-химического состава и наличия микроорганизмов в моче.
- Определение уровня гормонов в крови. При атрофическом вагините наблюдается снижение уровня эстрогенов в крови. Определение содержания гормонов необходимо для подбора препаратов для заместительной гормональной терапии.
Лечение атрофического вагинита
Для терапии атрофического вагинита применяется заместительная гормональная терапия, местное лечение эстрогенсодержащими препаратами, гинекологические пробиотики, фитоэстрогены.
Заместительная гормональная терапия (ЗГТ). Признаки и симптомы дефицита эстрогенов можно вылечить, при помощи ЗГТ. ЗГТ заключается в приеме препаратов эстрогенов для восполнения их дефицита. Врач принимает решение о применении гормонотерапии совместно с пациенткой. Важно применять эстроген вместе с прогестероном одновременно, что защищает от развития гиперплазии тканей, например, эндометрия.
Гиперплазия эндометрия может привести к возникновению рака. Первые результаты лечения эстрогенами могут быть заметны через несколько недель после начала терапии. Некоторые симптомы атрофии влагалища при обширной форме поражения могут сохраняться в течение длительного времени. Рекомендуется длительное применение ЗГТ, в течение нескольких лет.
Местное лечение эстрогенсодержащими препаратами. В том случае, когда симптомы, беспокоящие женщину, причиняют выраженный дискомфорт, назначается местное применение препаратов, которые содержат эстрогены. Они устраняют сухость и зуда влагалища, а также повышают эластичность тканей.
Используются кремы, мази, гели, вагинальные кольца. Доказана высокая эффективность местных эстрогенсодержащих препаратов. Такая терапия позволяет ограничить влияние организма на действие гормона и наоборот. Эстрогены при местном применении могут попадать в кровь, но в минимальном количестве. Такая форма гормонов оказывает прямое действие на слизистую влагалища и приводит к ослаблению симптомов атрофического вагинита.
Гормональная терапия атрофического вагинита при раке молочной железы . При наличии рака молочной железы, в том числе перенесенном, пероральная терапия эстрогенами не рекомендуется, поскольку эти гормоны могут стимулировать повторный рост раковых клеток, особенно при гормонозависимом раке молочной железы.
Применение эстрогенов вагинально у женщин, которые в прошлом болели раком молочной железы, вызывает много споров среди врачей. Не до конца известно, может ли даже небольшое повышение уровня эстрогена в крови увеличить риск рецидива рака. Чтобы свести эту угрозу к минимуму, препараты, содержащие синтетические и естественные эстрогены не применяются.
Вместо них рекомендуется применение средств, способствующих увлажнению влагалища (смазки, гели), препаратов, улучшающих трофику тканей, суппозиториев, которые улучшают регенерацию поврежденных тканей влагалища.
Применение гинекологических пробиотиков. При атрофическом вагините гинеколог назначает местные эубиотики. К ним относятся препараты (суппозитории, вагинальные капсулы) которые содержат молочнокислые или ацидофильные бактерии. Гинекологические пробиотики восстанавливают естественную полезную микрофлору влагалища и стимулируют местный иммунитет.
Фитоэстрогены. Для лечения атрофического вагинита используются препараты, содержащие растительные фитоэстрогены. Фитоэстрогены – это растительные нестероидные вещества, сходные по строению и химической структуре с эстрогенами.
Назначаются не только в период пре- и менопаузы, но и в период позднего репродуктивного возраста. Используются в качестве вспомогательного лечения для нормализации гормонального фона женщины. Препараты также назначаются гинекологом, поскольку имеют противопоказания, например, хронические заболевания печени и опухоли.
Атрофический вагинит и интимные отношения
Атрофический вагинит – это не просто недомогание с неприятными симптомами. Наибольшее беспокойство он причиняет женщинам, которые ведут активную половую жизнь. Зуд в области половых органов причиняет дискомфорт. Истончение влагалища при атрофическом вагините способствует механическим повреждениям и микротравмам слизистой оболочки. Сухость влагалища вызывает болевые ощущения, которые усиливаются во время полового акта. Дефицит гормонов, физический и психологический дискомфорт вызывает не только нежелание сексуальных отношений, но и отсутствие естественной разрядки в конце полового акта.
Кроме препаратов, которые назначает гинеколог для нормализации гормонального фона и восстановления слизистой оболочки половых органов при атрофическом вагините, женщина самостоятельно может использовать увлажняющие гели и смазки на водной основе. Они уменьшают дискомфорт во время полового акта и оказывают стимулирующее, возбуждающее действие.
Необходимо избегать применения вазелина и косметических кремов, поскольку они могут привести к повреждению презерватива, если партнеры используют этот метод контрацепции.
Как уменьшить симптомы атрофического вагинита
Чтобы уменьшить симптомы атрофического вагинита, можно использовать:
- Увлажняющие средства, кремы, которые при постоянном применении помогают восстановить увлажнение влагалища. Такие средства следует применять 2-3 раза в день. Эффекты развиваются при длительном постоянном применении.
- Специальную смазку именно для женщин на водной основе. Она снижает чувство дискомфорта во время полового акта. Такие лубриканты имеют pH близкий к естественному. Есть интимные смазки, содержащие лактобактерии.
- Специальные увлажняющие вагинальные суппозитории с гиалуроновой кислотой. Эти средства восстанавливают эпителий, увлажняют влагалище и помогают поддерживать ее естественный pH. Они рекомендованы к применению в период менопаузы, в случае боли во время полового акта, отеках, при таких симптомах как: зуд, покраснение, ощущение дискомфорта во влагалище при атрофическом вагините.
Способы местного лечения атрофического воспаления влагалища
Лечение эстрогеном, используемым непосредственно во влагалище возможно при использовании различных видов препаратов.
- Крем с эстрогеном для влагалища. Крем используется непосредственно во влагалище с помощью специального аппликатора, как правило, перед сном. В течение первых нескольких недель лечения рекомендуется применять крем каждый день, а затем 2 или 3 раза в неделю. По сравнению с другими продуктами, крем обеспечивает более быстрое облегчение симптомов атрофического вагинита.
- Вагинальное кольцо с эстрогеном . Это мягкое, гибкое кольцо, которое вставляется в верхнюю часть вагины. Кольцо выпускает постоянную дозу эстрогена. Его необходимо менять каждые 3 месяца. Такая форма лечения наиболее удобна для женщины.
- Вагинальные таблетки с эстрогеном. С помощью одноразового аппликатора таблетка с эстрогеном помещается внутри влагалища. Как правило, в течение первых 2 недель вагинальные таблетки применяются каждый день, а потом 2 раза в неделю.
- Комбинированные препараты. Если симптомы атрофического вагинита возникают совместно с другими симптомами менопаузы, такими как умеренные и нарастающие приливы, врач назначает терапию с применением таблеток, пластырей, геля или введения во влагалище кольца с более высокой дозой эстрогена и синтетического прогестерона.
Осложнения атрофического вагинита
В случае атрофического воспаления влагалища риск развития других инфекций во влагалище увеличивается. Происходят изменения кислотно-щелочного баланса во влагалище, а, следовательно, оно становится более уязвимым к инфекции бактериями, грибами или другими организмами.
Атрофические изменения во влагалище связаны с изменениями, происходящими в мочевыделительных путях. Мочеиспускание учащается и сопровождается жжением.
У некоторых женщин могут возникнуть инфекции мочевыводящих путей или недержание мочи. Несмотря на то что недержание мочи, вызванное стрессом, довольно часто развивается среди женщин во время менопаузы, эта проблема непосредственно не вызывается атрофическим вагинитом. Связь между дефицитом эстрогенов и заболеваниями мочевыводящих путей еще до конца изучена. Однако, однозначно доказано, что правильное функционирование половых органов тесно связано со здоровьем мочевыводящих путей.
Приблизительно половина женщин после наступления менопаузы страдает от атрофического вагинита, но только небольшой процент из их числа обращается за помощью к гинекологу, чтобы устранить эту патологию. Многие женщины стесняются рассказать о проблеме во время визита к доктору и не получают лечение.
В результате заболевание прогрессирует, у женщины развивается сильная боль во время полового акта (диспареуния). Она не исчезает после применения специальных увлажняющих средств или других смазок на водной основе.
При отсутствии лечения атрофического вагинита развиваются кровотечения не только во время полового акта. Появляется периодическое или постоянное подкравливание. Это может привести к развитию анемии.
В настоящее время существуют методы эффективного лечения атрофического вагинита. Поэтому женщине не нужно терпеть физический и психологический дискомфорт, который возникает при развитии атрофического вагинита. Не откладывайте визит к врачу!
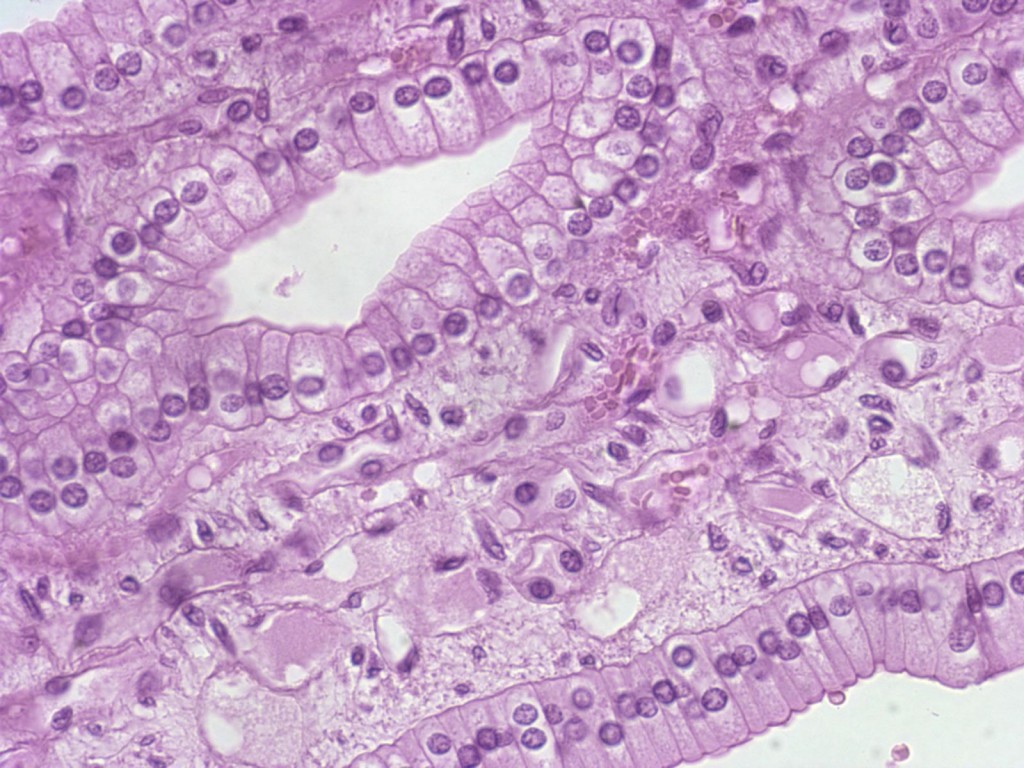
Хронический атрофический гастрит – это заболевание, характеризующееся атрофией желудочных желез, перерождением эпителия желудка в кишечный, умеренно выраженным воспалительным процессом. Проявления зависят от локализации и этиологии атрофических процессов: в основном, это тяжесть в желудке после еды, быстрая насыщаемость, отрыжка, тошнота, неприятный вкус во рту, анемия. Золотой стандарт диагностики - ЭГДС с биопсией слизистой, внутрижелудочная рН-метрия, выявление H.pylori; остальные методы являются вспомогательными. Лечение заключается во введении глюкокортикоидных гормонов, натурального желудочного сока, витамина В12, применении антихеликобактерной схемы терапии.
МКБ-10
Общие сведения
Хронический атрофический гастрит – диагноз морфологический, для верификации которого обязательны результаты ЭГДС. Клинические проявления данной патологии не всегда соответствуют выявляемым при проведении биопсии изменениям. Хронический атрофический гастрит может развиться как на поздних стадиях хеликобактерного гастрита (из-за длительной персистенции инфекции происходит постепенная гибель значительного количества желудочных желез), так и в результате аутоиммунных нарушений в организме (антитела к эпителиальным клеткам желудка вызывают их гибель, постепенно развивается ахлоргидрия).
H.pylori выявляется более чем у 80% населения России, при этом хроническое воспаление слизистой желудка обнаруживается примерно у 50%. Аутоиммунный гастрит у женщин диагностируется в три раза чаще, чем у мужчин, однако является достаточно редким заболеванием. Исследования в области гастроэнтерологии подтверждают, что заболеваемость хроническим гастритом повышается на 1,5% ежегодно.
Причины
Наиболее значимыми причинами хронического атрофического гастрита являются инфекция H.pylori и аутоиммунные процессы. Атрофия эпителия желудка развивается на поздних стадиях хронического хеликобактер-ассоциированного гастрита. Бактерии сначала колонизируют слизистую антрального отдела, вызывая хронический воспалительный ответ. По мере прогрессирования инфекции процесс распространяется сначала на тело желудка, а затем и на остальные его отделы, инициируя пангастрит. На этой стадии уже четко визуализируются атрофические изменения слизистой, формируется хронический атрофический гастрит. Обычно на данном этапе хеликобактерии перестают выявляться, так как желудочные железы атрофируются, происходит замена желудочного эпителия на кишечный, к которому H.pylori не имеет тропности.
При аутоиммунном гастрите поражение основных желез желудка наблюдается в начале заболевания. Диффузная атрофия эпителия желудка очень быстро прогрессирует, что связано с выработкой аутоантител к микросомальным антигенам париетальных клеток, гастринсвязывающим белкам, внутреннему фактору. Антитела принимают непосредственное участие в деструкции эпителиальных клеток желудка.
Причина образования аутоантител на сегодняшний день не определена, но гастроэнтерологи не исключают наследственной предрасположенности к хроническому атрофическому гастриту. Известно, что для запуска аутоиммунного процесса в эпителии желудка титр антител должен достичь некой критической цифры, индивидуальной для каждого человека. Повлиять на скорость этого процесса могут различные эндогенные и экзогенные провоцирующие факторы:
- Эндогенные факторы: генетические особенности, дуодено-гастральный рефлюкс, эндоинтоксикация, кислородное голодание, хронические инфекции, обменные и эндокринные нарушения, недостаток витаминов (гиповитаминоз), висцеральные рефлекторные реакции при патологии других органов.
- Экзогенные факторы: нарушения питания, вредные привычки (алкоголь, курение), прием некоторых медикаментов, воздействие ионизирующего излучения, инфекционные агенты (бактерии, грибы, паразиты).
Симптомы
Для хронического атрофического гастрита характерны как местные, так и общие проявления. Некоторые симптомы зависят от этиологии заболевания (HP-ассоциированный или аутоиммунный тип) и локализации воспалительного процесса.
При бактериальном генезе хронического атрофического гастрита с локализацией в антральном отделе пациенты предъявляют жалобы на тяжесть в желудке во время или сразу после еды. Если хронический гастрит длительно протекал как гиперацидный, больного могут беспокоить диспепсические нарушения: диарея или запоры, повышенный метеоризм, урчание в животе.
Аутоиммунный гастрит характеризуется тетрадой признаков: аутоиммунный процесс, наличие в крови антител к обкладочным клеткам желудка, В12-фолиеводефицитная анемия, ахлоргидрия. При любом виде хронического атрофического гастрита беспокоят боли в эпигастрии во время или после еды, тошнота, неприятный запах и привкус во рту, отрыжка и срыгивания, жжение в подложечной области или изжога.
Общие проявления выражаются слабостью, раздражительностью, склонностью к артериальной гипотонии, колющими болями в сердце. Для хронического атрофического гастрита характерен демпинг-синдром: после еды возникает резкая слабость, бледность кожи, потливость, сонливость, икота, неустойчивый стул.
Осложнения
При аутоиммунном гастрите антитела поражают не только клетки желудка, но и внутренний фактор Касла, участвующий в метаболизме витамина В12. В результате этого развивается пернициозная анемия, проявляющаяся жжением в языке, симметричными парестезиями в руках и ногах, утомляемостью, сонливостью, депрессией. Помимо В12-дефицитной анемии, хронический аутоиммунный гастрит может осложняться язвенной болезнью желудка и ДПК, ахлоргидрией, раком желудка.
Диагностика
При подозрении на хронический гастрит пациент в обязательном порядке нуждается в консультации гастроэнтеролога и врача-эндоскописта. На первичном приеме назначается ряд анализов и исследований. После получения результатов проводится повторная консультация, на которой обычно и выставляется диагноз хронического атрофического гастрита.
- Лабораторые исследования. Анализ кала на скрытую кровь может быть положительным при наличии изъязвлений в слизистой желудка. В обязательном порядке проводятся исследования с целью обнаружения H.pylori: определение хеликобактер в кале методом ИФА, ПЦР-диагностика, определение антител к хеликобактер в крови, уреазный дыхательный тест.
- Эндоскопия желудка.Эзофагогастродуоденоскопия позволяет выявить атрофию слизистой оболочки желудка. Для подтверждения визуальных изменений проводится эндоскопическая биопсия с морфологическим исследованием биоптатов.
- Дополнительные методы диагностики. Чтобы определить уровень секреции желудочного сока, осуществляется внутрижелудочная pH-метрия. УЗИ органов брюшной полости используется только для дифференциальной диагностики и выявления сопутствующей патологии.
Лечение хронического атрофического гастрита
Перед началом лечения рекомендуется отказаться от вредных привычек (курения, приема алкоголя). Диета не является основным методом терапии хронического атрофического гастрита. Медикаментозное лечение планируется в зависимости от этиологии заболевания (хеликобактерный или аутоиммунный гастрит).
При хроническом атрофическом гастрите, сопровождающемся тяжелыми аутоиммунными нарушениями, показано назначение коротких курсов глюкокортикоидных гормонов в невысоких дозах. После стабилизации процесса и регресса клинических проявлений лечение прекращается. Если секреторная функция желудка не восстановилась, назначают натуральный желудочный сок, прокинетики, ферменты поджелудочной железы. Проводится коррекция В12-дефицитной анемии.
Лечение хеликобактер-ассоциированного хронического атрофического гастрита стандартное: ингибиторы протонной помпы в сочетании с антибактериальными препаратами (кларитромицин, амоксициллин, фуразолидон, метронидазол, тетрациклин), препаратами висмута. Использование препаратов висмута вместо ИПП показано пациентам с пониженной секреторной функцией желудка.
После 1,5-2 месяцев антихеликобактерной терапии необходимо провести повторное исследование на H.pylori. Если эрадикации возбудителя не произошло, то определяется его чувствительность к антибиотикам, и дальнейшее лечение проводится согласно полученным результатам. Симптоматическая терапия включает в себя препараты, препятствующие дуодено-гастральному рефлюксу (уродезоксихолевая кислота), метеоризму, замещающую ферментную терапию.
Прогноз и профилактика
Прогноз при хроническом атрофическом гастрите зависит от многих факторов: степени обсеменения H.pylori и атрофии слизистой и др. Хеликобактерная инфекция является начальным звеном патологического процесса, который в будущем может привести к раку желудка. На начальных этапах атрофию слизистой можно предотвратить или остановить, именно на этой стадии большинство пациентов обращается за медицинской помощью.
Значительно улучшить прогноз позволяет эрадикация H.pylori до наступления атрофии слизистой желудка, а также своевременное начало лечения пернициозной анемии. На стадии кишечной метаплазии риск малигнизации крайне высокий. Профилактика хронического атрофического гастрита заключается в своевременном выявлении и лечении инфекции H.pylori, устранении других факторов риска этого заболевания.
Железистая гиперплазия эндометрия – избыточное разрастание железистой ткани эндометрия, характеризующееся его утолщением и увеличением объема. Железистая гиперплазия эндометрия проявляется обильными менструациями, дисфункциональными ановуляторными кровотечениями, анемией, бесплодием. Для определения гиперпластической трансформации эндометрия проводится УЗИ, гистероскопия, Эхо-ГСГ, биопсия эндометрия, гормональные исследования. Лечение железистой гиперплазии эндометрия включает выскабливание полости матки, гормонотерапию, при необходимости – резекцию или абляцию эндометрия.
МКБ-10
Общие сведения
В основе железистой гиперплазии эндометрия лежат чрезмерно активные пролиферативные процессы в железистой ткани матки. Основной опасностью гиперпластических изменений эндометрия служит возможность их прогрессирования и злокачественной трансформации. Поэтому важность диагностики и лечения железистой гиперплазии эндометрия диктуется актуальностью сохранения репродуктивного потенциала женщины и профилактики рака эндометрия. Диагноз железистой гиперплазии может быть поставлен только по результатам гистологического исследования образцов эндометрия.
Причины развития железистой гиперплазии эндометрия
Гиперпластическая трансформация эндометрия может возникать у женщин любого возраста при наличии факторов риска, но чаще встречается в переходные периоды, связанные с гормональными изменениями в организме (у подростков и пациенток пременопаузального возраста).
Фоновыми генитальными процессами, сопутствующими развитию железистой гиперплазии эндометрия, являются миома матки, синдром поликистозных яичников, эндометриоз, эндометриты. Развитию железистой гиперплазии эндометрия нередко предшествуют гинекологические операции, диагностические выскабливания эндометрия, аборты. Факторами риска гиперпластических процессов матки служит отсутствие в анамнезе у женщины родов, отказ от использования гормональной контрацепции, искусственное прерывание беременности, поздняя менопауза.
К экстрагенитальным сопутствующим заболеваниям относятся сахарный диабет, мастопатия, гипертония, ожирение, заболевания щитовидной железы, печени и надпочечников. Ведущим моментом возникновения железистой гиперплазии эндометрия служит гиперэстрогения или длительное воздействие эстрогенов при снижении сдерживающего влияния прогестерона.
Классификация гиперплазии эндометрия
По гистологическому варианту выделяют несколько видов гиперплазии эндометрия: железистую, железисто-кистозную, атипическую (аденоматоз) и очаговую (полипы эндометрия). Железистая гиперплазия эндометрия характеризуется исчезновением разделения эндометрия на функциональный и базальный слои. Граница между миометрием и эндометрием выражена четко, отмечается увеличенное количество желез, но их расположение неравномерно, а форма неодинакова. При железисто-кистозной форме гиперплазии часть желез приобретает кистозно-измененный вид.
Для аденоматоза (атипической гиперплазии) свойственны структурная перестройка и более интенсивная пролиферация элементов по сравнению с железистой гиперплазией эндометрия, полиморфизм ядер, уменьшение числа стромальных элементов. При локальной гиперплазии отмечается разрастание железистого и покровного эпителия вместе с подлежащими тканями, ведущее к образованию эндометриальных полипов (железистых, фиброзных, железисто-фиброзных).
Наибольшую онконастороженность в гинекологии вызывают атипическая и полипозная гиперплазия, которые расцениваются как предраковое состояние. Угроза перехода аденоматоза в рак эндометрия составляет около 10%. Железистая и железисто-кистозная гиперплазия эндометрия менее склонны к озлокачествлению. Такая вероятность возрастает при их рецидивирующем течении после выскабливания эндометрия и неадекватности гормонотерапии.
Симптомы железистой гиперплазии эндометрия
Характерным симптомом железистой гиперплазии эндометрия является расстройство менструальной функции, выражающееся патологическими маточными кровотечениями. Среди форм менструальной дисфункции встречаются меноррагии (циклические кровотечения, превышающие обычные месячные по кровопотере и длительности) и метроррагии (ациклические кровотечения различной продолжительности и обильности).
Кровотечения при железистой гиперплазии эндометрия возникают после незначительной задержки менструации или в межменструальный период. Для ювенильных кровотечений, возникающих при железистой гиперплазии эндометрия у подростков, характерен прорывной характер с выделением сгустков. Длительные и обильные кровотечения со временем способствуют развитию анемии, слабости, недомогания, головокружения. Ановуляторный цикл, отмечающийся при железистой гиперплазии эндометрия, сопровождается бесплодием.
Диагностика железистой гиперплазии эндометрия
Поскольку проявления железистой гиперплазии эндометрия не являются специфичными только для данной патологии, вопросы полноценной и точной диагностики приобретают особую важность. При изучении анамнеза гинеколог расспрашивает о наследственности, особенностях течения менструального цикла, состоянии детородной функции, используемых методах контрацепции, перенесенных общих и гинекологических заболеваниях.
Кроме общего гинекологического осмотра, диагностика железистой гиперплазии эндометрия включает трансвагинальное УЗИ, в процессе которого определяется толщина эндометрия, наличие полипозных разрастаний. При помощи УЗИ-скрининга выявляется контингент женщин, нуждающихся в гистологическом подтверждении диагноза железистой гиперплазии эндометрия с помощью проведения аспирационной биопсии эндометрия либо раздельного диагностического выскабливания.
Диагностическое выскабливание выполняется накануне ожидаемой менструации или сразу после ее начала под контролем гистероскопии. Гистероскопия обеспечивает проведение адекватного кюретажа и полное удаление патологически измененного эндометрия. Соскобы эндометрия подвергаются гистологическому исследованию, позволяющему определить тип гиперплазии и установить морфологический диагноз. При железистой гиперплазии эндометрия информативность диагностической гистероскопии составляет 94,5%, тогда как трансвагинального УЗИ - 68,6%.
При железистой гиперплазии эндометрия у пациентки исследуются уровень прогестерона и эстрогенов, при необходимости – гормоны надпочечников и щитовидной железы. Вспомогательную диагностическую роль играют гистерография или радиоизотопное сканирование. Дифференциальную диагностику при кровотечениях, вызванных железистой гиперплазией эндометрия, проводят с внематочной беременностью, трофобластической болезнью, полипами или эрозией шейки матки, раком тела матки, миомой матки.
Лечение железистой гиперплазии эндометрия
Процедура раздельного диагностического выскабливания полости матки служит первым этапом лечения железистой гиперплазии эндометрия. В дальнейшем с учетом результатов гистологии подбирается схема гормонотерапии, направленная на подавление дальнейшей пролиферации эндометрия и устранение гормонального дисбаланса.
При железистой форме гиперплазии эндометрия могут назначаться КОК (Ярина, Жанин, Регулон), гестагены (Утрожестан, Дюфастон) на 3-6 месяцев. С успехом в лечении железистой гиперплазии эндометрия применяется гестагенсодержащая внутриматочная система «Мирена», оказывающая местное лечебное воздействие на эндометрий. Использование агонистов гонадотропин рилизинг-гормона (аГнРГ) эффективно у женщин старше 35 лет и перименопаузального периода. Данные препараты вызывают временное обратимое состояние искусственного климакса и аменореи.
Параллельно с гормональным лечением проводится витаминотерапия, коррекция анемии, иглорефлексотерапия, физиотерапия (электрофорез). Контрольное УЗИ в процессе терапии выполняется через три и шесть месяцев лечения; повторная биопсия эндометрия – по окончании курса. В целях стимуляции овуляторного цикла в дальнейшем применяются стимуляторы овуляции.
В случае рецидива железистой гиперплазии эндометрия на фоне гормонотерапии у пациенток, заинтересованных в деторождении, могут выполняться абляция или резекция эндометрия с помощью лазерных и электрохирургических методики под гистероскопическим контролем. При железистой гиперплазии эндометрии, осложненной эндометриозом, миомой матки, а также в период климакса методом выбора может являться удаление матки: надвлагалищная ампутация, гистерэктомия или пангистерэктомия.
Профилактика железистой гиперплазии эндометрия
После завершения курса лечения железистой гиперплазии эндометрия особую значимость приобретает вопрос предупреждения ее рецидива и рака эндометрия. В этих целях рекомендуется регулярные осмотры гинеколога, консультация гинеколога-эндокринолога и подбор контрацепции, профессиональная подготовка и ведение беременности у пациенток. От самой женщины, своевременности ее обращения к специалисту и выполнения предписаний врача, в значительной мере зависит прогноз железистой гиперплазии эндометрия.
Что такое гипотиреоз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Курашова О. Н., эндокринолога со стажем в 28 лет.
Над статьей доктора Курашова О. Н. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Гипотиреоз — это заболевание эндокринной системы, возникающее из-за длительно низкого уровня тиреоидных гормонов, вырабатываемых щитовидной железой, и проблем с их воздействием на организм преимущественно на тканевом уровне.
Ежегодно на каждую тысячу человек приходится 0,6-3,5% заболевших гипотиреозом. [3] [6] [8] Данное нарушение может возникнуть в любом возрасте, но обычно оно возникает у пожилых людей старше 60 лет. [14] Среди новорождённых гипотиреоз встречается в одном случае из 4-5 тысяч.
К факторам риска относятся:
-
; ;
- подострый и послеродовой тиреоидит;
- аутоиммунные заболевания (B1-дефицитная анемия, болезнь Аддисона, сахарный диабет I типа);
- рак тканей головы и шеи (леченый);
- курение;
- болезни щитовидной железы у родственников;
- применение радиоактивного йода при лечении рака щитовидной железы ;
- приём некоторых препаратов (амиодарон, α-интерферон, карбонат лития, йод-, бромсодержащие и другие лекартсва). [15]
В 80% случаев гипотиреоз связан с поражением защитных сил организма, т. е. аутоиммунным тиреоидитом. Он является ведущей причиной первичного гипотиреоза у взрослых людей. [3]
Риск возникновения аутоиммунного тиреоидита зависит от возраста и пола пациента: у женщин в возрасте 40-50 лет он возникает в 10-15 раз чаще, чем у мужчин. [6] [9]
При аутоиммунном тиреоидите даже на фоне длительной ремиссии функциональное состояние щитовидной железы в разное время может значительно различаться. Так, с возрастом деструктивные изменения в щитовидной железе постепенно нарастают. Этот фактор, а также наличие тиреоидных аутоантител могут спровоцировать переход субклинического (скрытого) гипотиреоза, протекающего на фоне аутоиммунного тиреоидита, в явный. Частота таких случаев составляет около 5 % в год.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы гипотиреоза
Симптомы гипотиреоза крайне обманчивы, разнообразны и не всегда заметны. Их проявление зависит от степени выраженности заболевания.
К основным клиническим проявлениям относятся: [9] [11] [14]
- Обменно-гипотермический синдром. Характерно постоянное чувства холода, снижение температуры тела, увеличение веса.
- Нарушение нервной системы и органов чувств. Человек становится заторможенным, вялым, появляется сонливость, ухудшается память, нарушается носовое дыхание и слух, голос становится низким и грубым, а речь замедленной. На лице и конечностях может возникнуть плотный отёк. Кожа утолщается, становится сухой и холодной, приобретает бледный окрас с желтоватым оттенком, волосы становятся тусклыми и ломкими, подверженными выпадению.
- Нарушение сердечно-сосудистой системы. Наблюдается пониженное или нормальное артериальное давление. У части пациентов возникает мягкая диастолическая гипертензия.
- Изменения со стороны ЖКТ. Замедляется перистальтика кишечника, возникают запоры, изменения желчного пузыря и его протоков, снижается аппетит, вплоть до развития анорексии.
- Анемический синдром. Из-за недостатка гормонов щитовидной железы возникает депрессия костно-мозгового кроветворения, нередко развивается В12-дефицитная и постгеморрагическая анемия, время кровотечения увеличивается.
- Дисфункция почек. Почечный кровоток и скорость клубочковой фильтрации снижаются, как и эффективность почечного плазмотока, уровень глюкозы и натрия в крови становится ниже нормы.
- Сбои репродуктивной системы. У женщин происходит нарушение овуляции, менструальные циклы становятся короткими и редкими, возникает бесплодие. В большинстве случаев развивается вторичная гиперпролактинемия, которая сопровождается самопроизвольным вытеканием молока из молочной железы и отсутствием месячных. На фоне декомпенсированного гипотиреоза беременность наступает крайне редко. Снижение либидо наблюдается у лиц обоего пола. У мужчин может развиваться эректильная дисфункция, нарушение сперматогенеза.
- Нарушение опорно-двигательной системы. Как правило, замедляется костное ремоделирование, снижается интенсивность резорбции (рассасывания) кости и костеобразования. Часто возникает снижение плотности костной ткани и рабдомиопатия, причём как с гипертрофией (увеличением) мышц, так и с их атрофией.
Патогенез гипотиреоза
Тиреоидные гормоны, которые вырабатывает щитовидная железа, называются "трийодтиронин" (Т3) и "тироксин" (Т4). Они влияют практически на все процессы, протекающие в организме. Стимулирующее влияние на них оказывает тиреотропный гормон гипофиза (ТТГ).
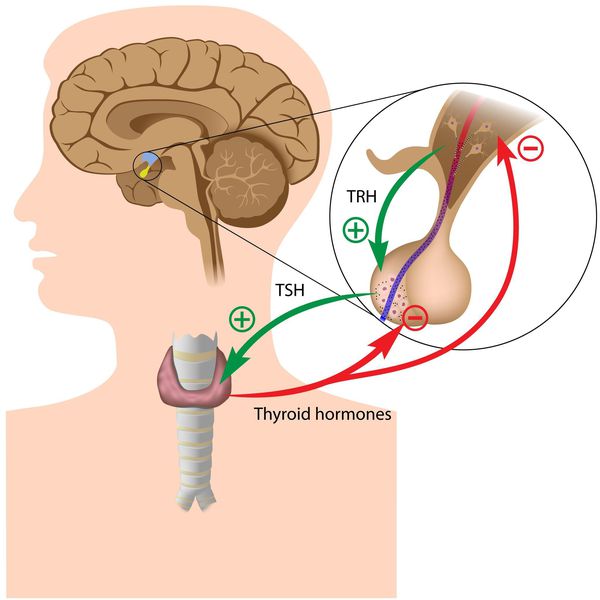
Синтез тиреоидных гормонов начинается после того, как щитовидная железа захватывает йод. Он является регулятором гормоногенеза и размножения тиреоцитов — клеток эпителия щитовидной железы. Попав в тиреоциты, йодид окисляется до активной формы при помощи тиреопероксидазы — микросомального антигена, к которому образуются антитела, в частности при аутоиммунном тиреоидите. [4] [6] [7] Уровень поступления йода изменяет чувствительность тиреоцитов к воздействию ТТГ, которая усиливается при дефиците йода. [3] [6]
Исходя из этого механизма возникновения гормонов щитовидной железы, патогенетически гипотиреоз делится на три типа:
- первичный (тиреогенный);
- вторичный (гипофизарный);
- третичный (гипоталамический);
- периферический (тканевой).
Первичный гипотиреоз возникает в 80-95% случаев и чаще всего обусловлен нарушениями общей структуры щитовидной железы, которые являются врождёнными или приобретёнными, а также сбоем секреторной функции её клеток.
Вторичный и третичный гипотиреоз возникают в 3-4% случаев. Они связаны с заболеваниями таких участков головного мозга, как аденогипофиз или гипоталамус в результате которых наблюдается стойкая нехватка гормонов щитовидной железы и нарушение секреции ТТГ гипофиза. [4] [6]
Периферический гипотиреоз развивается крайне редко — в 0-1% случаев. Основным фактором его возникновения является резистентность (сопротивляемость) тканей-мишеней (например, мозга, гипофиза, сердца, костей, печени) гормонам Т4 и Т3. [5] [6] [7]
В патогенезе аутоиммунных заболеваний щитовидной железы взаимодействуют генетические и средовые факторы. Однако точная роль тех и других не определена. Ведущее значение в гибели тиреоцитов при этих заболеваниях придают клеточным механизмам, т.е. цитотоксическим эффектам аутореактивных Т- лимфоцитов. [3] [5] Отсутствие при аутоиммунных поражениях щитовидной железы классических признаков гнойного воспаления (боли, отёка и других), обычно сопровождающих массивный некроз ткани, указывает в таких случаях на иной механизм гибели тиреоцитов. В последние годы установлено, что Т-лимфоциты способны вызывать гибель клеток-мишеней не только путём некроза, но в основном путём индукции их разрушения. [3] [5] [7] [9]
Классификация и стадии развития гипотиреоза
В Международной классификации болезней десятого пересмотра выделены две формы гипотиреоза:
- Субклинический (скрытый) гипотиреоз, развившийся в результате йодной недостаточности.
- Иные формы гипотиреоза:
- врожденный гипотиреоз с диффузным зобом;
- врождённый гипотиреоз без зоба;
- гипотиреоз, возникший по причине приёма лекарств и других экзогенных веществ;
- постинфекционный гипотиреоз;
- атрофия щитовидной железы (приобретённая);
- другие уточнённые гипотиреозы;
- неуточнённый гипотиреоз.
Первичный гипотиреоз подразделят на три большие группы:
- Врождённый гипотиреоз.
- Гипотиреоз, связанный с уменьшением количества функционирующей ткани щитовидной железы:
- возникающий после операции
- развивающийся после облучения
- вызванный аутоиммунным нарушением щитовидной железы
- связанный с вирусным заболеванием щитовидной железы
- возникающий на фоне новообразований щитовидной железы.
- Гипотиреоз, связанный с нарушением выработки тиреоидных гормонов:
- эндемический зоб — возникает в районах с йододефицитом;
- спорадический зоб с гипотиреозом — развивается в случае дефектов биосинтеза гормонов;
- медикаментозный гипотиреоз — появляется в результате приёма тиреостатиков и других препаратов;
- зоб и гипотиреоз, развившиеся в связи с употреблением продуктов, содержащих вредные вещества. [3][5][7][9]
В последнее время разработана классификация первичного гипотиреоза, которая основывается на выраженности симптомов и результатах гормональных исследований (определяющий показатель — уровень ТТГ). В неё включают:
- Субклинический (скрытый) гипотиреоз — симптомы размыты или отсутствуют, уровень ТТГ повышен, содержание Т4 в норме.
- Манифестный — возникает типичная клиническая картина гипотиреоза, уровень ТТГ повышен, концентрация Т4 снижена:
- компенсированный.
- декомпенсированный.
- Осложнённый — развивается кретинизм, сердечная недостаточность, выпот в серозные полости, вторичная аденома гипофиза. [2]
Осложнения гипотиреоза
Гипотиреоидная кома ("спячка") — это угрожающее жизни состояние, которое чаще развивается у пожилых людей, которые долгое время не лечили тяжёлый гипотиреоз, который был у них довольно долгое время. [3] [5] [7] [9]
К основным провоцирующим факторам такого осложнения относят:
- охолаждение;
- сердечно-сосудистые заболевания;
- острые инфекции;
- травмы;
- кровопотерю;
- хирургические вмешательства;
- приём алкоголя или лекарств, угнетающих функцию центральной нервной системы;
- стрессовые ситуации. [6][7][8]
При гипотиреоидной коме температура тела, как правило, снижается до 24-32,2°С, возникают судороги и угнетение дыхания. Лечение такого состояния нужно начинать незамедлительно. [14] Но даже при своевременном обнаружении осложнения и незамедлительном лечении смерть может наступить в 25-60% случаев. [15]
Но появление осложнений может вызвать не только отсутствие лечения, но и неграмотная медикаментозная терапия. Например, передозировка лекарствами может привести к избыточному синтезу гормонов щитовидной железы и патологиям со стороны сердечно-сосудистой системы. В связи с этим крайне важно соблюдать все рекомендации врача по лечению заболевания и ни в коем случае не лечиться самостоятельно.
Диагностика гипотиреоза
Диагностика гипотиреоза включает в себя подробный опрос пациента, осмотр и лабораторные исследования.
Так как симптомы гипотиреоза неспецифичны, он может скрываться под масками других заболеваний. Поэтому по проявлениям его иногда можно спутать с железодефицитной анемией, депрессией, аменореей, невритом и другими нарушениями. [15] [16] В связи с этим важную роль в определении гипотиреоза играют лабораторные исследования. Они показаны всем пациентам с нарушениями щитовидной железы и предполагают оценку уровня ТТГ и свободного Т4. [2] [12] Определение уровня Т3 в крови, как правило, не является информативным, так как при первичном гипотиреозе этот показатель находится в норме. [14]
На явное наличие гипотиреоза будет указывать высокий уровень ТТГ и низкий уровень свободного Т4 в крови. При субклиническом гипотиреозе уровень ТТГ также будет повышен, а уровень свободного Т4 будет находиться в пределах нормы.
После того как наличие гипотиреоза подтверждено, при помощи показателя ТТГ также определяется характер заболевания и наличие возможных осложнений. Уровень ТТГ также позволяет в значительном большинстве случаев оценить адекватность проводимой терапии: об этом будет свидетельствовать стойкий уровень ТТГ в крови в пределах нормы. [6] [7] [8]
В достаточно редких случаях проводят пробу с тиреолиберином для оценки аутоиммунных заболеваний щитовидной железы. [6] [9] [15]
Дополнительные методы диагностики, такие как УЗИ щитовидной железы, сцинтиграфия или пункционная биопсия, используются для уточнения характера и степени выраженности заболевания. [6] [11] [12] [16]
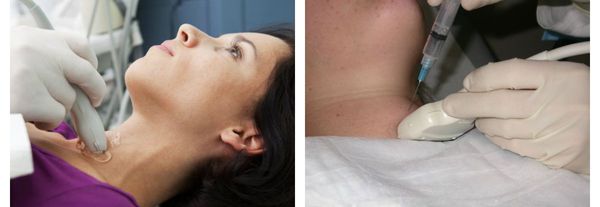
Так как с возрастом учащаются случаи узлового зоба, выраженный шейный кифоз может смещать трахею кзади и вниз, что затрудняет пальпаторную оценку состояния щитовидной железы, в результате чего своевременная диагностика заболевания не проводится. [4] [5] [6] [7] [8]
В связи с тем, что гипотиреоз не всегда проявляет себя, среди населения принято проводить массовую диагностику данного заболевания — скрининг. Так, определение уровня ТТГ позволяет обнаружить первичный гипотиреоз у людей без каких-либо других его проявлений, а также у новорождённых (исследование проводится на 4-5 сутки жизни). При планировании беременности и на ранних её сроках также важно пройти исследование на гипотиреоз. [3] [5] [7] [9]
Лечение гипотиреоза
Цель лечения гипотиреоза — это поддержание уровня ТТГ в пределах 0,5-1,5 мМЕ/л.
Единственным методом лечения является пожизненная заместительная терапия. Начинать её стоит при уровне ТТГ более 10 мЕД/л, высоких титрах антител к ТПО и других показателях. Для этого предпочтительны препараты левотироксина натрия. Его применение противопоказано лишь в случае нелеченого тиреотоксикоза и недостаточности коры надпочечников, остром инфаркте миокарда, аллергии и индивидуальной непереносимости препарата. [16]
Обычно лечение проводится в условиях стационара. Показаниями к госпитализации пациентов с гипотиреозом служат:
- тяжёлая степень заболевания;
- наличие выраженной сердечной патологии;
- гипотиреоидная кома.
Заместительная терапия первичного (манифестного) гипотиреоза показана пожизненно с назначением тироксина в средней дозе 1,6-1,8 мкг/кг. Пациентам с кардиальной патологией доза рассчитывается, исходят из расчёта 0,9 мкг/кг. Стоит отметить, что в связи с уменьшением метаболизма тиреоидных гормонов потребность в них с возрастом снижается. [5] [7] [9]
Дозы тироксина зависят от причин и патогенеза заболевания. Потребность в препарате у людей со спонтанным гипотиреозом выше, чем у пациентов с гипотиреозом, возникшим после хирургического лечения и применения радиоактивного йода.
Уровень ТТГ при диагностике гипотиреоза напрямую связан с оптимальной заместительной дозой тироксина: у большинства женщин она составляет 75-100 мкг, а у мужчин — до 150 мкг в день приёма.
Первый контроль уровня ТТГ после начатого лечения проводят через 2-3 месяца, затем один раз в шесть месяцев (при обязательном условии соблюдения пациентом схемы лечения). [6] [9] [13]
При субклиническом гипотиреозе существует риск развития манифестной формы заболевания со всеми характерными проявлениями. Так, явный гипотиреоз возникает у 20-50% пациентов в течение 4-8 лет, а присутствие антитиреоидных антител увеличивает риск до 80%. [8] [9] [10] Потому людям со скрытым гипотиреозом следует длительно наблюдаться у специалистов.
Проблемы при лечении гипотиреоза
Лечение тироксином безопасно, просто и сравнительно дешево. Но, несмотря на многолетний опыт его использования, при нём всё же могут возникать многие проблемы. Основная из них связана с несоблюдением пациента схемы лечения. Так, одновременное повышение уровней Т4 и ТТГ, по всей вероятности, будет указывать на то, что за несколько дней до визита к врачу пациент не выполнял его назначений.
Снижение эффективности установленной дозы тироксина часто связано с меньшим содержанием гормона в таблетках (например, в непатентованных препаратах) или взаимодействием лекарств при одновременном приёме других препаратов. [9] [13]
Недостаточность дозы также может быть связана с уменьшением всасывания тироксина, нарушением энтеропечёночного кровотока, ускорением кругооборота или выделением гормона с мочой, медленным снижением тиреоидной функции после лечения гипертиреоза.
Существуют и другие особенности и проблемы при лечении гипотиреоза. [6]
Лучшим критерием подбора дозы тироксина при аутоиммунном тиреоидите является исследование ТТГ и свободного Т4. При этом лечение нацелено на компенсацию гипотиреоза благодаря той же заместительной терапии и редукция зоба при помощи супрессивной терапии. [6] [9] Критериями эффективности лечения при этом будут служить:
- уменьшение зоба в объёме;
- снижение плотности щитовидной железы;
- уменьшение титра антител до нормы;
- поддержание уровня ТТГ в пределах нормы.
Назначение препаратов тиреогормонов при аутоиммунном тиреоидите без нарушения функции щитовидной железы нецелесообразно, а операция может привести к состоянию, способному значительно ухудшить качество жизни пациента с возможностью развития тяжёлого гипотиреоза и инвалидизации. [9] [13]
Прогноз. Профилактика
Прогноз заболевания при своевременной диагностике и лечении благоприятный. [10] Осложнить его, особенно в отношении трудоспособности и состояния здоровья в целом, могут фибрилляция предсердий и выраженная сердечная недостаточность, развивающиеся на фоне тиреотоксикоза. [5]
Специфической профилактики заболевания не существует. Снизить риск развития гипотиреоза можно только при помощи сбалансированного правильного питания , употребления достаточного количества йода с пищей (включения в рацион морепродуктов) и контроля гормонального баланса. Крайне важно проходить профилактические осмотры и являться на контрольные приёмы к лечащему врачу. [5] [11] [12]
В качестве неспецифической профилактики патологий щитовидной железы стоит проходить санаторно-курортное лечение по показаниям врача.
Доказано, что медикаментозная терапия при гипотиреозе становится более эффективной в сочетании с радоновыми процедурами, а азотные ванны, не содержащие радон, оказывают профилактическое воздействие. [1] [5] Благодаря этому удаётся добиться стойкости ремиссии заболевания.

Рекомендуется проведение до трёх курсов таких процедур с интервалом от 8 до 12 месяцев. Подбор схем лечения в санатории (в т.ч. медикаментозных), рациональное использование природных и климатических факторов определяют ближайший и отдалённый результат оздоровления.
Многие женщины время от времени сдают ПАП-мазок или тест Папаниколау.
Это исследование, при котором из влагалища и шейки матки берут мазок на онкоцитологию.
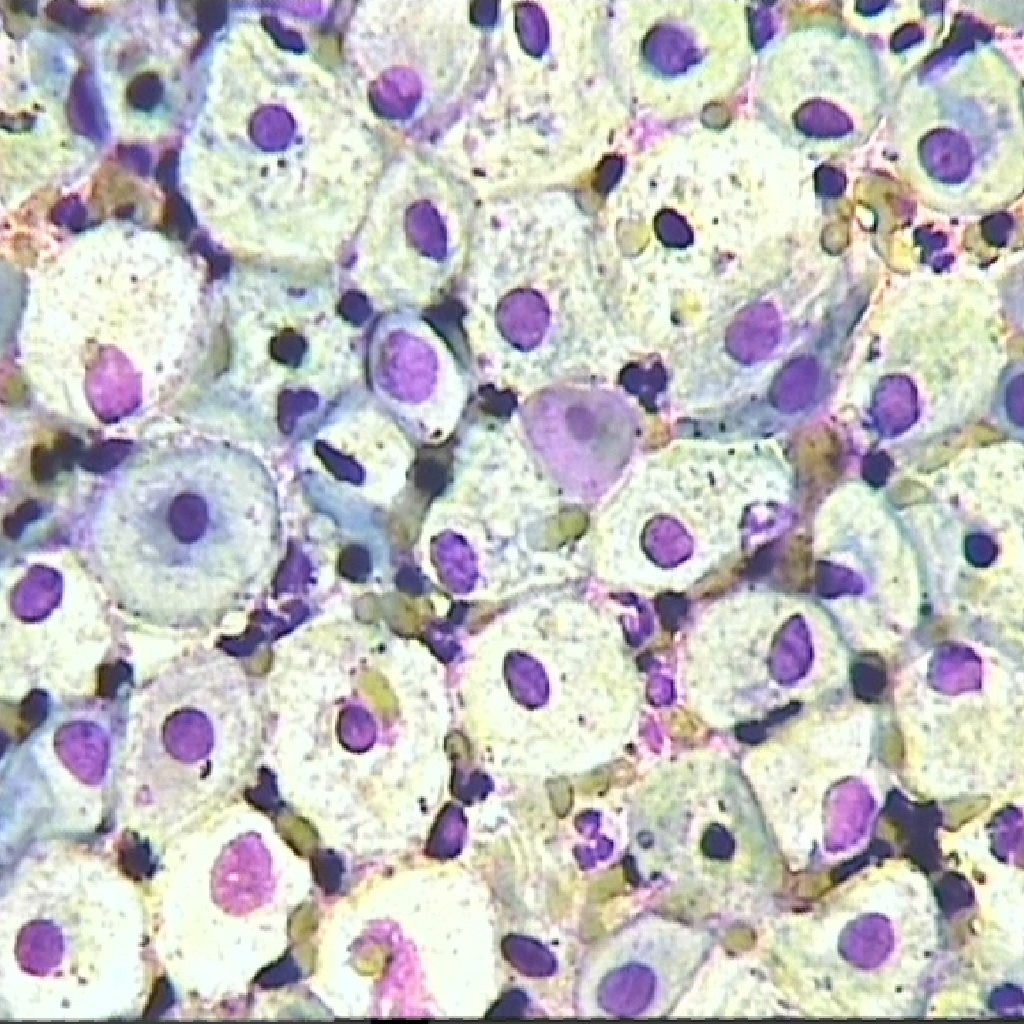
Метод диагностики используется для скринингового выявления онкологических заболеваний, а также предраковых состояний.
В процессе микроскопического исследования полученного клинического материала специалист изучает клеточный состав мазка.
Из него он делает выводы о том, присутствуют ли атипичные клетки, имеются ли признаки воспаления или атрофии эпителия половых органов.
Иногда женщины, особенно в пожилом возрасте, получают заключение атрофический тип мазка.

Что это значит, и насколько опасно данное состояние?
Поговорим о том, что такое атрофический тип мазка в гинекологии.
Что такое атрофия?
Чтобы разобраться в том, что значит атрофический тип мазка, нужно понять, что значит само слово «атрофия».
В основе его лежит слово «трофика», что означает «питание».
Ткани, которые получают достаточное количество питательных веществ с кровью, нормально развиваются.
Если же питания недостаточно, они деградируют.
Приставка «а» в любом медицинском термине означает отсутствие чего-либо.
В нашем случае атрофия – это отсутствие трофики, то есть, питания.
Кровоснабжение тканей в области половых органов нарушается.
Это приводит к их деградации.
Фактически, организм сам это делает.
Он экономит свои ресурсы и уменьшает кровенаполнение тех органов, которым в данный момент «не пользуется».
Чаще всего атрофические процессы во влагалище происходят в пожилом возрасте, когда половые органы становятся «ненужными».
Ведь их основное назначение – это зачатие, вынашивание и рождение ребенка.
Большинство женщин в период постменопаузы не ведут половую жизнь.
Уровень эстрогенов у них низкий.
Поэтому слизистая оболочка половых органов постепенно атрофируется – она истончается и больше не способна в полной мере выполнять свои функции.
Это состояние считается нормальным, если наступает в пожилом возрасте, и не требует лечения.
За исключением ситуаций, когда женщина испытывает дискомфорт вследствие атрофических процессов, или они становятся причиной повторяющихся воспалительных заболеваний влагалища и шейки матки.
Атрофический тип мазка – что это значит?
Если вы сдали мазок на онкоцитологию, атрофический тип мазка может быть указан в заключении.
Поговорим о том, что это означает.
Слизистая оболочка половых путей состоит из различных клеток.
Все они имеют разную степень зрелости.
То есть, один вид клеток постепенно переходит в другой.
Все клетки делят на четыре типа:
- поверхностные – большого размера, с маленьким ядром, раздельно расположенные, определяются в большом количестве в середине менструального цикла;
- промежуточные – чуть меньшего размера, имеют крупное круглое ядро, располагаются в основном пластами;
- парабазальные – маленькие круглые клетки с большим ядром, в норме встречаются только во время менструации, да и то в небольшом количестве (возрастания их числа говорит об атрофии);
- базальные – еще меньше парабазальных, ядро занимает треть цитоплазмы, появляются только после менопаузы, а также после родов.
Поверхностные расположены на самом верху, в то время как базальные – в глубине слизистой оболочки.
Поверхностные имеют наибольшую степень зрелости, а базальные – наименьшую.
Таким образом, если в мазок попадает большое количество зрелых клеток, это означает, что они развиваются нормально, и трофика тканей сохранена.
Если же в мазке присутствует множество незрелых клеток, это говорит об атрофических процессах.
Атрофия – понятие относительное, а не абсолютное.
То есть, она не относятся к тем процессам, которые либо есть, либо нет.
Нет четкой границы между нормальным и промежуточным типом мазка, промежуточным и атрофическим.
Эти изменения происходят постепенно.
Незрелых клеток становится все больше, а зрелых – все меньше.
Чем сильнее выражена атрофия, тем больше в эпителии шейки матки содержится парабазальных клеток.
По мере развития атрофии также увеличивается размер ядер в них.
Причины атрофического типа мазка шейки матки
Если у вас обнаружен атрофический тип мазка на цитологию, причины том могут быть разные.

Основные из них:
- возрастное угасание репродуктивной функции;
- часто наблюдается атрофический тип мазка после родов;
- эстрогенная недостаточность в молодом возрасте;
- длительно протекающие хронические воспалительные процессы (кольпит).
У женщин репродуктивного возраста тоже может наблюдаться атрофический тип мазка.
Это происходит при:
- нарушении функции яичников;
- нарушении регуляции функции яичников со снижением выработки эстрогенов (к этому приводит патология других эндокринных желез, например, гипоталамогипофизарной системы).
Возможен атрофический тип мазка после удаления матки с придатками, например, в случае злокачественных новообразований.
Яичники могут также повреждаться при лучевой терапии.
У молодых женщин иногда развивается синдром истощенных яичников, характеризующийся ановуляцией и гипоэстрогенемией.
Возможен синдром резистентных яичников, обусловленный нарушением работы их рецепторного аппарата.

В этом случае невозможна их полноценная работа из-за того, что яичники не воспринимают «сигналы», поступающие от других желез внутренней секреции.
То есть, они не реагируют на изменение уровня других гормонов, которые должны стимулировать образование эстрогенов.
Цитограмма соответствует возрасту, атрофический тип мазка
С возрастом становится нормой атрофический тип мазка на цитологию.
В климаксе снижается уровень эстрогенов.
Это неизбежно приводит к ухудшению трофики половых органов.
Постепенно происходят атрофические процессы, если женщина не получает заместительную терапию.
Они прогрессируют с годами.
При этом важен не столько возраст, сколько количество лет, которое прошло с момента менопаузы.
Менопаузой считается дата последних менструаций.
Она определяется ретроспективно (то есть, в прошлом).
Потому что во время менструальных кровотечений женщина не может знать, что они последние.

Но если с момента последних месячных прошло 12 месяцев, это говорит о том, что их больше не будет.
Тогда женщина вспоминает, когда у неё были последние менструации, и эта дата считается датой менопаузы.
Через 5 лет после прекращения месячных уже обнаруживается атрофический тип мазка.
Возрастные изменения ещё слабо выражены.
В мазке обычно наблюдается около 50% промежуточных клеток.
Это уже атрофический тип мазка матки, но атрофия ещё слабо выражена.
О глубокой атрофии говорит появления парабазальных клеток.
До климактерического периода в норме их вообще не должно быть в мазке.
Даже через 5 лет после наступления менопаузы только у 17% женщин они присутствуют.
Их наличие указывает на ярко выраженные атрофические процессы при резком дефиците эстрогенов.
Читайте также:

