Эпидермальный регенерат что это
Обновлено: 26.04.2024
К сожалению, до сих пор есть заболевания, которые за считанные часы доводят, казалось бы, совершенно здорового человека до критического состояния и имеют крайне неблагоприятный прогноз.Одним из таких заболеваний является синдром Лайелла (L51.2 по МКБ-10).
В СМИ широко обсуждался скандальный случай смерти от данной патологии — гибель в июле 2003 года журналиста, депутата Государственной Думы третьего созыва Юрия Щекочихина.
Свидетели отмечали необъяснимое резкое ухудшение его состояния: «за две недели превратился в глубокого старика, волосы выпадали клоками, с тела сошла кожа, практически вся, один за другим отказывали внутренние органы» («Новая газета», выпуск № 20 от 24 марта 2008 г.).
По факту смерти депутата было заведено уголовное дело по статье 105 УК РФ ч. 1 — «Убийство». Родственники и подхватившая ажиотаж пресса твердили об отравлении, в частности таллием. Семь месяцев проводились соответствующие экспертизы, эксгумировали тело депутата. Лишь к марту 2004 года были установлены обстоятельства стремительного ухудшения состояния Щекочихина. Диагноз и причина смерти — синдром Лайелла, острая сердечно-сосудистая недостаточность.
Из истории синдрома
Лайелл заменил принятое ранее обозначение «острый пемфигус» на «токсический эпидермальный некролиз» (ТЭН).Дело в том, что у всех пациентов отмечалась сыпь, «имеющая сходство с ошпариванием кожи объективно и субъективно». Сыпь и послужила основным диагностическим признаком для выделения новой нозологической единицы. Термин «токсический» Лайелл ввел, полагая, что заболевание вызывается токсемией — циркулирующим в организме определенным токсином. «Некролиз» — медицинский неологизм, придуманный самим Лайеллом, скомбинировавшим в нем основной клинический признак — «эпидермолиз» и гистопатологический признак — «некроз».
Также Лайелл отметил тяжесть поражения слизистых оболочек и необычную слабость воспалительных процессов в дерме — «дермальное безмолвие».
В научном мире заболевание получило имя своего первооткрывателя еще при жизни Лайелла — в 60‑е годы. Однако сам дерматолог всегда использовал обозначение ТЭН.
В 1967 году, проведя целевой опрос коллег по всей Великобритании, Лайелл представил самое обширное на сегодняшний день обобщение по ТЭН — 128 случаев заболевания. В том же году он описал 4 формы ТЭН, соответствующие определенной этиологии: стафилококковая, лекарственная, смешанная и идиопатическая.
«Некролиз» — медицинский неологизм, придуманный самим Лайеллом, скомбинировавшим в нем основной клинический признак — «эпидермолиз» и гистопатологический признак — «некроз».
В настоящее время стафилококковая форма синдрома Лайелла выделена в отдельную нозологическую единицу: стафилококковый синдром ошпаренной кожи (staphylococcal scalded skin syndrome, SSSS, L00 по МКБ-10).
Эпидемиология
С 70‑х годов в медицине ведется ежегодный учет распространенности синдрома Лайелла. По данным разных авторов, показатели колеблются в пределах 0,4–1,3 случая на 1 млн населения в год. Показатели смертности составляют 20–60 % от числа заболевших, в зависимости от состояния системы здравоохранения региона. Таким образом число смертей от данной патологии по всему миру за год исчисляется тысячами. Среди аллергических реакций немедленного типа по показателю смертности синдром Лайелла уступает лишь анафилактическому шоку. В общей структуре лекарственных аллергий доля синдрома Лайелла составляет 0,3 %. Чаще болеют женщины: соотношение с пациентами-мужчинами 1,5:1. Прямой зависимости риска заболевания от возраста не выявлено. Группой риска считаются пациенты, ранее перенесшие синдром Лайелла, особенно в детском возрасте.
Самая распространенная форма синдрома — лекарственная, до 80 % всех случаев.После лекарственной, второй по частоте причиной выступают злокачественные новообразования (особенно лимфомы). Частота идиопатических случаев синдрома составляет 5–10 %.
У детей Лайелла синдром чаще — до 60 % случаев — имеет инфекционную этиологию. Особая группа риска проявления болезни среди детей — это перенесшие в раннем возрасте ОРВИ и прошедшие в связи с этим курс лечения НПВП.
Этиология
Дискуссии об этиологии и патогенезе синдрома Лайелла продолжаются. Наиболее изучена лекарственная форма заболевания, которая развивается из‑за нарушения способности организма к обезвреживанию реактивных промежуточных лекарственных метаболитов. Данные метаболиты взаимодействуют с тканями, в результате формируется антигенный комплекс, иммунный ответ на который и инициирует развитие болезни.
Фактически доказана и генетическая предрасположенность к данной патологии, в частности у лиц с рядом антигенов комплекса гистологической совместимости HLA: A2, А29, В12, В27, DR7. Наличие в организме хронических очагов инфекции (синусит, тонзиллит, холецистит и т. п.), приводящих к снижению иммунитета, — увеличивает риск заболевания. Особую группу риска составляют ВИЧ-инфицированные пациенты: у них риск развития синдрома Лайелла в 1000 раз выше, чем в общей популяции.
Диагностика
Для дифференциальной и лабораторной диагностики провокационные пробы не проводятся, поскольку высок риск неконтролируемых осложнений. Наиболее распространены внеорганизменные диагностические пробы, основанные на реакциях клеток крови пациента на сенсибилизировавшее организм вещество. К ним относятся: тест дегрануляции базофилов по Шелли, реакция агломерации лейкоцитов по Флеку, реакция бластной трансформации лимфоцитов, гемолитические тесты.
У ВИЧ-инфицированных пациентов риск развития синдрома Лайелла в 1000 раз выше, чем в общей популяции.
Апоптоз кератиноцитов — один из первых тканевых морфологических признаков синдрома Лайелла. Всё большее распространение приобретает пункционная биопсия с использованием замороженных срезов кожи. При этом выявляются отсутствие типичных акантолитических клеток, тотальный эпидермальный некролиз, под- и внутриэпидермальные пузыри.
Течение
По характеру течения выделяют три варианта клиники синдрома Лайелла:
- Молниеносная форма — до 10 % всех случаев. Развивается в течение нескольких часов. Этиология: идиопатическая или лекарственная. Кожные поражения за сутки охватывают до 90 % поверхности тела. Нарушение сознания вплоть до коматозного. Острая почечная недостаточность — анурия. Ввиду того, что эти пациенты в большинстве своем не доживают до госпитализации или поступают уже в терминальном состоянии, летальный исход составляет 95% в течение 2–3 суток. На вскрытии внутренние органы обычно интактны.
- Острая форма — 50–60 % случаев. Поражение кожи и слизистых проходит весь спектр созревания: от высыпаний до некролиза. Площадь некролизированных поверхностей может достигать 70 % поверхности тела. Заболевание длится от 7 до 20 суток. Начиная с 3–4 суток появляются симптомы почечной, печеночной, сердечно-сосудистой, легочной недостаточности, инфекционные осложнения — прежде всего пульмональные и инфекции мочеполовой системы, а при прогрессировании заболевания — сепсис. Летальность достигает 60 %.
- Благоприятное течение (сглаженная форма) — частота до 30 % случаев. Поражение кожных покровов и слизистых оболочек не превышает 50 % поверхности тела. Клинические проявления достигают пика на 5–6 сутки заболевания. Затем, в течение 3–6 недель, наблюдается улучшение состояния пациента до полного восстановления здоровья.
У подавляющего числа пациентов — более 90 % — присутствуют эрозивные изменения слизистых оболочек. Типичны жалобы на болезненность по ходу уретры при мочеиспускании и светобоязнь.
Характерен положительный симптом Никольского: отслойка эпидермиса на внешне неизмененной коже при скользящем надавливании и отслойка околопузырного эпидермиса при потягивании за обрывок пузырной покрышки. При особо тяжелых формах наблюдается тотальная отслойка эпидермиса при трении по всей поверхности тела пациента.
Синдром Стивена — Джонсона или синдром Лайелла?
Один из главных прогностических факторов при синдроме Лайелла — площадь некролизированной поверхности. Поэтому очень важна правильная оценка ее протяженности. Для этого используются те же правила, что и в комбустиологии: правило «девятки» — когда руки, грудь и живот считаются по 9 % поверхности тела, а спина и ноги — по 18 %; и правило «однопроцентной ладони». Для более точной оценки рекомендуется измерять площадь отделенного и отделяемого эпидермиса не только на участках с выраженными эритематозными изменениями, но и на отдаленных от «эпицентра» участках тела.В зависимости от площади пораженной некролизом поверхности выделяют клинические отличия синдрома Лайелла от синдрома Стивена — Джонсона.
На протяжении 30 лет — с конца 70‑х — кортикостероиды считались обязательным звеном в терапии синдрома Лайелла. В последние годы появились критические замечания по поводу их эффективности: в частности, указывается, что при их использовании возрастает риск септических осложнений.
В последние годы набирает популярность теория, что эти синдромы являются двумя вариантами тяжелого исхода эпидермолитической кожной реакции на медикаменты и отличаются лишь степенью отслойки кожного покрова.
Системная терапия
К сожалению, единых клинических рекомендаций при диагностированном синдроме Лайелла не существует. Это связано прежде всего с полиорганностью поражений, что предполагает в первую очередь разнонаправленную посимптомную терапию.Для лечения синдрома Лайелла правило «отмены последнего» назначенного медикамента чаще всего неэффективно, так как время проявления заболевания варьирует от нескольких часов до нескольких суток. Поэтому рекомендуется отмена всех ранее назначенных медикаментов и экстренная симптоматическая терапия. Подтверждено, что быстрая и тотальная отмена всех медикаментов при невозможности четкого выявления определенного аллергена — улучшает прогноз заболевания на 30 %. В рамках специфического лечения аллергического синдрома Лайелла большинством исследователей однозначно рекомендованы:
- экстренная, желательно в первые же часы заболевания, каскадная плазмофильтрация (плазмаферез), позволяющая удалить до 80 % плазмы пациента. При технической невозможности плазмафереза рекомендована гемосорбция;
- массивная системная кортикостероидная терапия. Рекомендуемые схемы кортикостероидов варьируют от 3–4 мг/кг массы тела в первые сутки заболевания до полного запрета при ухудшении состояния пациента;
- внутривенные иммуноглобулины. Ежесуточная доза начиная с первого дня заболевания варьируется от 0,2 до 0,75 г/кг массы тела пациента. Длительность цикла — от 4 до 12 дней. Эффективность иммуноглобулинов обусловлена содержанием в них естественных анти-Fas-антител, регулирующих апоптоз и пролиферацию в интактных и трансформированных лимфоидных клетках. Они снижают частоту бактериальных осложнений и предотвращают прогрессирование синдрома;
- гипербарическая оксигенация при отсутствии в легких пациента абсцессов, каверн и свободной проходимости дыхательных путей.
Лечение поражений кожного покрова и слизистых проводят по принципам терапии ожогов. Соблюдается режим парентерального питания. Коррекция инфузий осуществляется в зависимости от состояния пациента.
В период нахождения в стационаре обязательны регулярные — не реже одного раза каждые 72 часа — осмотры урологом, окулистом, стоматологом, отоларингологом, чтобы вовремя выявить и назначить соответствующую терапию при поражении слизистых оболочек.
Прогноз
С 2011 года на Западе распространена SCORTEN шкала оценки тяжести синдрома Лайелла. В ней учитываются следующие прогностические факторы:
- возраст пациента > 40 лет;
- ЧСС > 120 уд. в мин.;
- наличие сопутствующего злокачественного онкологического заболевания;
- площадь пораженной поверхности тела > 10 %;
- уровень мочевины крови > 10 ммоль/л;
- уровень бикарбонатов плазмы 14 ммоль/л.
Наличие каждого фактора увеличивает риск летального исхода. Так, примерный риск смерти составляет: при наличии 1 фактора — до 3,2 %; 2‑х факторов — 12,1 %; 3‑х факторов — 35,3 %; 4‑х факторов — 58,3 %; 5 и более факторов — 90 %.
Клинический случай
В 2009 году в Донецке я стал свидетелем редчайшего для Донбасса (всего 6 случаев в Донецкой области за период с 1991 по 2013 годы!) случая синдрома Лайелла. Пациентка: 37 лет. Аллергический и инфекционный анамнезы — не отягощены. За трое суток до поступления заболела простудным заболеванием. Лечилась «знакомыми» лекарствами: таблетки от кашля, глазные, носовые капли, витамины. С вечера второго дня появились зуд, высыпания. Самостоятельно принимала супрастин. После кратковременного облегчения — состояние ухудшилось. Вечером на третьи сутки, после обморока доставлена БСМП в городскую больницу, в течение нескольких часов переведена в областную клинику.
Поступила женщина с гиперемированной кожей на грудной клетке, плечах, внутренних поверхностях бедер. На третий день появились наполненные мутноватым содержимым пузыри. Объем иных достигал 100 мл. На протяжении всего периода сохранялась гиперемия век, склер, слизистых оболочек ротовой полости, перианальной области.
С третьих суток комбустиологом неоднократно предпринимались попытки закрыть раневую поверхность ксенокожей. Однако кратковременные периоды спокойствия сменялись у пациентки психомоторным возбуждением, что приводило к смещению повязок и ксенокожи. Ни один лоскут не прижился. На протяжении двух недель в реанимационном отделении пациентка более половины времени провела в вынужденном медикаментозном сне. А с шестых суток, когда состояние пациентки стало критическим, ее перевели на постоянную ИВЛ.
В данном случае синдром Лайелла диагностирован в течение двух суток после поступления пациентки в стационар; течение заболевания было не молниеносным, а скорее острым; проводилась посимптомная терапия, но спасти женщину не удалось.
Гидролипидная мантия кожи – одна из составляющих эпидермального барьера кожи.
Здоровье кожи в широком смысле этого слова – её качество, цвет, тонус, увлажненность и т.п. – напрямую зависит от состояния эпидермального барьера. Многие дерматологические проблемы возникают именно из-за «брешей» в его работе.
Нарушения функции и дефекты в этом барьере неизбежно провоцируют проникновение чужеродных микробов и аллергенов в кожу, активируют дегидратацию эпидермиса и вызывают сухость кожи, повышают её чувствительность к различным воздействиям окружающей среды.
Что же такое эпидермальный барьер
Кожа – самый большой орган человеческого тела. Она составляет почти 18% общего веса человека.
В составе кожи три основных слоя:
- 1. Самый глубокий - гиподерма или подкожно-жировая клетчатка;
- 2. Средний – дерма. В ней расположены основные каркасные белки – коллаген и эластин;
- 3. Верхний слой кожи - эпидермис состоит из четырёх слоёв и постоянно обновляется.
Кожа выполняет несколько очень важных для организма и самой кожи функций. При этом, основную - защитную функцию обеспечивает эпидермис.
Именно самый верхний слой кожи - эпидермис является своего рода барьером, защищающим ее от агрессивных атак множества микроорганизмов и аллергенов, внешних механических и химических воздействий, потери влаги – сохраняет коже увлажнение.
Эпидермальный барьер состоит из:
- Гидролипидной мантии, укрывающей поверхность кожи;
- Липидо-эпидермального барьера.
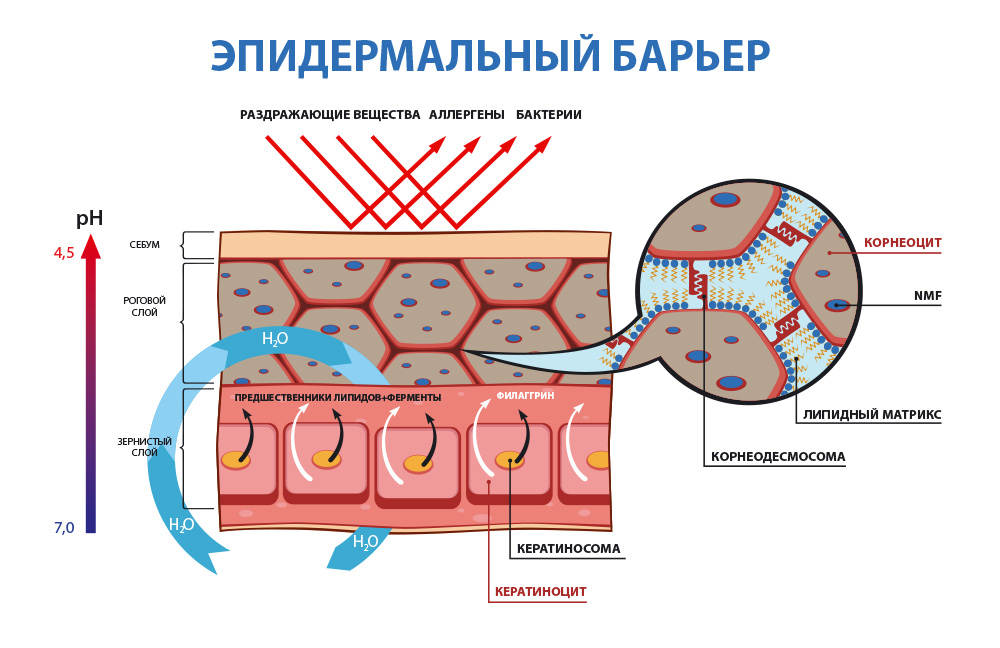
1. Гидролипидная или водно-жировая мантия
- это, некая, невидимая глазу пленка на поверхности кожи, которая образуется из смеси отслоившихся роговых чешуек, пота, кожного сала, а также органических кислот и микрофлоры.
Главная функциональная особенность гидролипидной мантии здоровой кожи человека - её кислая среда - pH от 4,7 до 5,7. (Для справки: кислотная среда pH 0 - 6,9; нейтральный pH – 7; щелочная среда pH 7,1 – 14).
Благодаря наличию кислой среды, в которой перестают размножаться и погибают вредоносные бактериии, гидролипидная мантия является самым первым звеном защиты кожи от большинства чужеродных микроорганизмов и агентов.
Свой вклад в формирование кислой среды на поверхности кожи вносят с одной стороны, органические кислоты - молочная, лимонная и другие, которые образуются в результате биохимических и метаболических процессов, протекающих в эпидермисе. С другой стороны, кислый pH гидролипидной мантии помогает поддерживать жизнедеятельность полезных бактерий - Staphylococcus epidermidis и лактобактерий, которые постоянно живут на коже и составляют её микробиоту.
Кислотность гидролипидной мантии может нарушаться в ту или иную сторону по разным причинам (будет описано ниже). Например, при грибковых заболеваниях рН возрастает до 6, при экземе до 6,5; при угревой болезни защелачивается до 7.
Повреждённая гидро-липидная мантия кожи восстанавливается самостоятельно при правильном очищении, грамотном уходе и защите.
2. Липидо-эпидермальный барьер
– основной защитный барьер кожи. Находясь непосредственно в эпидермисе, он защищает организм и кожу от обезвоживания путем механизма транс-эпидермальной потери влаги (ТЭПВ), а также является вторым звеном защиты после гидролипидной мантии от проникновения в кожу патологических бактерий и аллергенов, различных химических соединений.
Основу липидо-эпидермального барьера составляют три вида липидов — церамиды, свободные жирные кислоты и холестерин.
Механизм ТЭПВ. По большому счету кожа увлажняется изнутри – то есть из глубоких слоёв гиподермы и дермы вода поступает к эпидермису, липиды удерживают воду в эпидермисе, обеспечивая его увлажненность. Повреждённый липидо-эпидермальный барьер является главной причиной неадекватной трансэпидермальной потери влаги и в результате сухости кожи. Поэтому, чтобы обеспечить хорошую увлажненность кожи, необходимо в первую очередь восстановить липидный барьер.
Кроме того, бреши в липидо-эпидермальном барьере приводят не только к обезвоженности кожи, но и к её повышенной чувствительности, аллергическим реакциям, раздражениям и кожным заболеваниям.
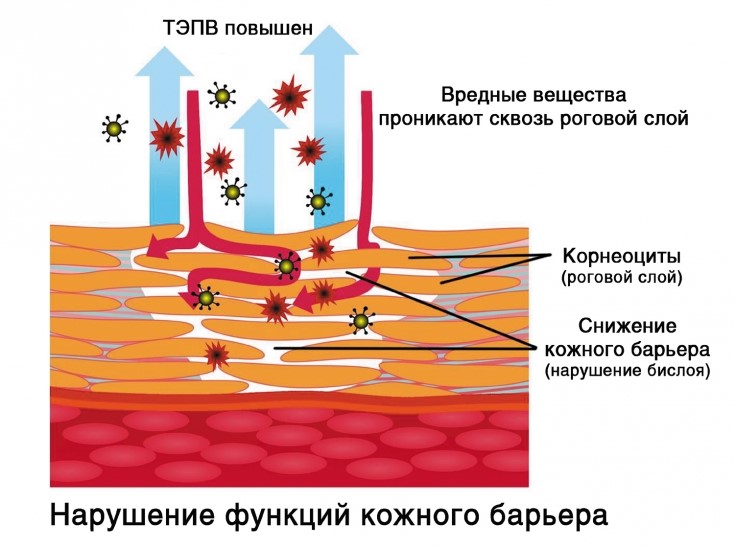
Незначительные повреждения липидо-эпидермального барьера клетки кожи восстанавливают сами. В случае выраженных нарушений – им необходимо помочь. В первую очередь это процедуры регулярного увлажнения, правильного ухода за поверхностью кожи и дермы, здоровый образ жизни и сбалансированное питание.
Внешние проявления, связанные с повреждением гидролипидной мантии
- Периодические или постоянные ощущения стянутости кожи, вызывающие дискомфорт; сухость и шелушение кожи даже в условиях привычного ухода;
- Выраженная гиперчувствительность и реакция кожи различные атмосферные явления: на ветер, солнце, мороз,
- Повышенная чувствительность кожи при применении очищающих и уходовых средств;
- Периодическое появление раздражений и покраснений, зудящих красных пятен; перманентные дерматиты.
Наличие вышеперечисленных проблем – повод обратиться к дерматологу.
Факторы, повреждающие кожные барьеры
Применение при очищении кожи мыла, умывалок и др., содержащих ПАВы и щелочи; частое использование обезжиривающих и спиртовых тоников.
Щелочи и ПАВы, присутствующие в большинстве очищающих средств нарушают кислый pН гидролипидной мантии. В результате водно-жировая мантия разрушается. Открываются входные ворота для чужеродных бактерий. Повреждается липидный барьер, вода активно начинает испаряться с поверхности кожи, вызывая её сухость.
Здоровый эпидермальный барьер — залог красивого вида любого типа кожи — жирной, проблемной, сухой, чувствительной и даже увядающей.
Сохранение и восстановление эпидермального барьера один их самых ключевых принципов в профессиональных программах по уходу за любым типом кожи и омолаживающих врачебных процедурах, а также домашнего хода за кожей.
Методы восстановления и сохранения барьеров кожи
Адекватное очищение кожи.
Домашний уход. Важно правильно определить с профессиональным дерматологом свой тип кожи и использовать ежедневно очищающие средства, которые соответствуют вашему типу кожи, не нарушая при этом эпидермальный барьер.
Профессиональный уход. В условиях клиники – проведение грамотно подобранных процедур очищения и эксфолиации кожи и соблюдения режима их выполнения: химического пилинга, и лазерного пилинга,ручной чистки лица с учётом вашего типа кожи и решаемых проблем.
Регулярное увлажнение.
Домашний уход. Ежедневно наносите на кожу увлажняющие кремы и периодически маски, содержащие компоненты, удерживающие влагу: аминокислоты, гиалуроновую кислоту, коллаген, эластин, алое вера и др. Плюс, как это ни банально, пейте адекватное количество чистой воды.
Профессиональный уход в условиях клиники. Регулярно (курсами 2 раза в год) проводите процедуры биоревитализации, биорепарации, мезотерапии
Профессиональный уход в условиях клиники. При повреждении кожи и развитии патологической флоры, например при угревой болезни – применение различных медикаментозных препаратов, назначенных врачом, а также лечение акне на лазерной установке Fotona с целью инактивации патологической флоры, уменьшения воспалительного процесса и улучшения трофики тканей.
Сбалансированное питание и уход.
Домашний уход. Ежедневно используйте питательные крема, соответствующие вашему типу кожи, возрасту и времени сезона года, чередуйте их с увлажняющими средствами. Отдавайте предпочтение средствам, содержащим церамиды, липосомы и жирные кислоты – они защищают и восстанавливают повреждённый липидный слой.
Употребляйте в пищу продукты, богатые омега 3 и омега 6 жирными кислотами. Не исключайте из рациона масла и жиры.
Постоянная защита.
Не используйте скрабы и избегайте сильного механического воздействия. Применяйте средства, содержащие в своём составе плёнкообразующие компоненты — коллаген, эластин, воска, силиконы, ланолин, парафин - руки. Регулярно наносите на кожу солнцезащитные крема при выходе на улицу, особенно летом.
Подводим итоги
Здоровье кожи напрямую зависит от целостности и нормального функционирования эпидермального барьера, основу которого составляет гидро-липидная мантия и липидо-эпидермальный барьер.
Сверху эпидермальный барьер «окутан» в гидролипидную мантию. Важно бережно относиться к ней и не повреждать её. Она первая «встречает» патогенные микробы и агенты, препятствуя их проникновению вглубь кожи.
Повреждение липидо-эпидермального барьера и гидролипидной мантии является серьёзной проблемой для кожи. Как правило, это приводит к обезвоживанию эпидермиса, появлению сухости, повышенной чувствительности, раздражениям, может спровоцировать и поддерживать кожные заболевания и др.
Нарушенный эпидермальный барьер можно восстановить, если правильно подобрать домашний уход, а также проводить профессиональные процедуры у косметолога. Сбалансированный уход за кожей и правильный образ жизни обеспечат защиту, увлажнение и восстановление кожи.
Поделитесь со знакомыми и друзьями:
Кератоз или гиперкератоз - это невоспалительная форма дерматоза, которая сопровождается избыточным ороговением кожи.
Для здоровой кожи любого человека процесс ороговения – это обычное физиологическое состояние. Процесс ороговения обеспечивает одну из самых основных функций кожи - защитную.
МЕХАНИЗМ ОРОГОВЕНИЯ В НОРМЕ И ПРИ ГИПЕРКЕРАТОЗЕ
В норме в результате своей жизнедеятельности клетки кожи постепенно перемещаются из нижнего слоя в верхний, при этом постепенно накапливая кератин – белок, который делает их более прочными и устойчивыми к внешним воздействиям. Верхний слой кожи представляет собой не что иное, как полностью ороговевшие клетки или роговые чешуйки, которые в процессе жизнедеятельности человека слущиваются и заменяются на новые. Такие клетки лишены жизнеспособности, но при этом, благодаря кератину, обеспечивают защиту живым клеткам, расположенным под ними, от негативных факторов окружающей среды.
При развитии гиперкератоза , как патологического состояния кожи
- с одной стороны, происходит активное ускоренное деление клеток эпидермиса, вырабатывающих кератин;
- с другой - задержка процесса нормального физиологического слущивания роговых чешуек с поверхностного слоя кожи.
КАК ВЫГЛЯДИТ
В местах гиперкератоза кожа утолщается и покрывается сухими чешуйками, бугорками или корочками от бежевого до коричневого оттенка до 4-5 см в диаметре. Как правило, гиперкератоз сопровождается снижением функции сальных желёз, нарушением работы водно-липидного барьера кожи и потерей чувствительности в зонах его локализации.
ВИДЫ КЕРАТОЗА
Чаще всего явления гиперкератоза локализуются на ногах (пятки, стопы, колени) и руках (ладони, локти), реже – на волосистой части головы, лице в области носа, щек, лба. В основном эта патология формируется в областях раздражения любыми внешними механическими факторами или факторами окружающей среды. Однако, гормональные сбои, наследственность и неправильный уход за кожей тоже могут провоцировать гиперкератоз.
Наиболее часто встречаются следующие типы проявлений гиперкератоза:
- Актинический (солнечный) кератоз на лице и теле (кератомы). Развивается из-за чрезмерного воздействия на кожу ультрафиолетовых лучей и её фотоповреждения. Выглядит как плоские, шероховатые пятна желтого или коричневого оттенка;
- Ладонная и подошвенная кератодермия - мозоли, натоптыши на подошвах ног и ладонях, пяточные трещины. Образуются в областях, подвергающихся длительному трению или давлению, при инфекционных и грибковых заболеваниях;
- Фолликулярный или волосяной кератоз («гусиная кожа»). Дерматоз возникает в результате как ускоренного ороговения, так и нарушения физиологического слущивания роговых чешуек. На этом фоне нарушается нормальное отделение кожного сала и присоединяется локальное воспаление волосяных фолликулов на теле. Выглядит это как сыпь из мелких множественных узелков ярко-розового и серого цвета на лице, плечах, ногах, ягодицах;
- Себорейный кератоз - наиболее распространенная форма гиперкератоза. Представляет собой гиперпигментированую "бляшку" с четкими границами от светлого до тёмно-коричевого оттенка, покрытую ороговевшей кожей. Может быть как единичной, так и множественной.
- Старческий кератоз - развивается в пожилом возрасте в виде пятен бежево-коричневого цвета и локализуется на лице, плечах, спине, тыльной поверхности кистей рук.
ПРИЧИНЫ РАЗВИТИЯ КЕРАТОЗА
Факторы, обуславливающие развитие гиперкератоза, делятся на внешние и внутренние .
К внешним факторам , провоцирующим гиперкератоз, относятся хронические воспалительные процессы на коже, инфекции, ультрафиолетовое излучение, воздействие агрессивных химических веществ, а также сильное давление, например, тесная обувь, тугая шапка, заколки, ободки, неправильный уход за кожей и неправильно подобранная косметика, которая вызывает сухость кожи, а также недостаток витаминов А, С, D и др.
Если патология сформировалась без предварительного раздражения или травмирования, то вероятно, гиперкератоз кожи вызван внутренними факторами . В этом случае это могут быть наследственные заболевания, сухость кожи из-за нарушения обмена веществ, болезни печени, желчного пузыря, щитовидной железы, сахарный диабет, врожденные патологии. Кроме того, проявления гиперкератоза возникают и сопровождают некоторые хронические заболевания кожи – экзему, псориаз, красный плоский лишай, себорею, эритродермию, кератодермию.
К КАКОМУ ВРАЧУ ОБРАТИТЬСЯ
Диагностикой и лечением гиперкератоза кожи в основном занимается дерматолог или подолог, если утолщения кожи присутствуют на стопе. Врач проводит осмотр, собирает тщательнй анамнез, узнает особенности образа жизни. Эта информация помогает ему узнать причину появления огрубевших участков. Иногда для определения вида гиперкератоза делают цитологию, микроскопическое исследование кусочка гиперкератоза.
КАК ЛЕЧИТЬ ГИПЕРКЕРАТОЗ
Симптомы гиперкератоза, как правило, не вызывают боли, и рассматриваются как косметический дефект. Исключением являются мозоли, натоптыши на стопах, которые доставляют неудобства при ходьбе. В этом случае нужно незамедлительно обратиться за квалифицированной помощью, тем более если проявления гиперкератоза вызывают боль, дискомфорт, присутствуют симптомы инфицирования (покраснение, отек, скопление гноя) или если у вас сахарный диабет.
Сам по себе гиперкератоз не пройдет, в любом случае необходимо начать лечение.
Метод лечения гиперкератоза выбирает врач с учетом причины, локализации, распространенности и формы утолщений, а также компенсации основного хронического заболевания в результате которого сформировался патологический процесс.
Для лечения гиперкератоза чаще всего применяют:
- мази, кремы со смягчающим действием; кремы, богатые жиром;
- приём ацитретина;
- мазь дайвонекс (кальципотриол);
- медицинский аппаратный маникюр (при локализации процесса на ладонях, стопах, руках и ногах);
- кремы с мочевиной;
- пилинг, в том числе химический и лазерный пилинг (лицо и тело); (кератомы);
- срезание хирургическим путем (мозоли, натоптыши).
Самостоятельно удалять мозоли, натоптыши или бородавки нельзя, так как есть риск занесения инфекции и других осложнений.
В ДОМАШНИХ УСЛОВИЯХ
В домашних условиях важно соблюдать гигиену, обеспечить правильный уход за кожей. Как вспомогательное средство помогают сбалансированному отшелушиванию и размягчению содовые ванночки.
Очень важно правильно питаться, следует употреблять в пищу морковь, шпинат, сливы, персики, цветную капусту, ягоды и все продукты, богатые витамином А, В, С и D. Избегать воздействия прямых солнечных лучей, а также резкого переохлаждения или перегрева.
Поделитесь со знакомыми и друзьями:
Ссадины, царапины, порезы, ожоги — с наступлением лета люди значительно чаще обращаются в аптеку из‑за разного рода травм. Даже самая незначительная ссадина может доставлять массу неудобств, поэтому процесс заживления всегда хочется максимально ускорить. Принципы лечения механических, термических и химических повреждений кожи существенно различаются. Поэтому подбор препаратов для заживления ран в аптеке рекомендуется только при механических травмах с небольшой раневой поверхностью и глубиной, не сопровождающихся сильным кровотечением. Во всех остальных случаях необходимо рекомендовать покупателю обратиться к врачу или в отделение неотложной помощи. Рассмотрим основные принципы подбора заживляющих средств из аптечного ассортимента.
Прежде чем приступить к разбору, давайте вспомним, как протекает сам раневой процесс. Независимо от типа раны и степени повреждения тканей, раневой процесс проходит три физиологические стадии заживления.
Стадия 1. Экссудация (сосудистая реакция и воспаление)
Рана характеризуется отеком, незначительной гиперемией и специфическим отделяемым. Воспалительный процесс на стадии экссудации способствует удалению мертвых тканей и очищению раны. Раневое отделяемое, как правило, серозное, серозно-фибринозное, со сгустками крови. Затем отделяемое становится гнойным, содержит лейкоциты и клетки некротизированных тканей.
Стадия 2. Пролиферация (регенерация)
В идеальных условиях при заживлении раны первичным натяжением синтез клетками коллагена начинается уже на второй день. В этом случае происходит сокращение краев раны грануляционной тканью, которая прочно соединяет стенки раны.
При заживлении раны вторичным натяжением, на стадии регенерации на наиболее очистившихся участках начинают появляться очаги деления клеток — грануляционная ткань. По мере роста грануляций начинается параллельное уменьшение размеров раны. Отделяемое из раны на стадии регенерации минимальное, серозно-геморрагическое.
Стадия 3. Эпителизация (окончательное заживление)
Отделяемое в ране отсутствует, рана сухая. Отделяемое может возникнуть, если рану травмировать, а также при присоединении инфекции. Чаще всего эпителизация начинается по краям раны или с зоны так называемых островков эпителизации. При этом остальная часть раны может находиться в стадии пролиферации.
Если на любой из стадий раневого процесса происходит присоединение инфекции, отделяемого становится больше, и оно приобретает вид, цвет и запах, характерные для определенного вида микроорганизмов.
Не стоит также забывать, что время заживления ран во многом зависит от общего состояния организма, возраста, иммунитета, хронических заболеваний и многого другого. Состояния, которые могут существенно замедлять регенерацию кожи:
- сахарный диабет;
- анемия;
- ожирение;
- дерматит, экзема, псориаз;
- печеночная и почечная недостаточность;
- истощение организма (включая истощение, вызванное диетами);
- гиповитаминозы;
- иммунодефицит;
- курение;
- онкологические заболевания.
Также на скорость ранозаживления влияют:
- Регулярность перевязок. Достаточная для своевременного очищения раны от некротизированных тканей и экссудата и в то же время не излишняя, чтобы не повредить образующиеся нежные очаги грануляции, для неосложненных ран — 1 раз в сутки
- Регулярность обработки кожи вокруг раны (для предупреждения инфицирования).
- Стерильность материалов для перевязки.
Подбор
Ранозаживляющие средства подбирают, учитывая степень повреждения тканей и вид раны.
Если рана чистая и не обширная, то ускорять процесс регенерации имеет смысл только на третьей стадии — стадии эпителизации, а первый и второй этапы требуют только первичного очищения и регулярной смены асептических повязок.
При нагноившихся ранах, более обширных и/или глубоких повреждениях потребуется консультация специалиста, так как подбор средств будет зависеть от тяжести процесса и может потребовать назначения местных антибактериальных препаратов.
Итак, рассмотрим популярные среди покупателей и фармацевтов препараты для ускорения заживления ран.
Декспантенол
Противовоспалительное, дерматопротективное средство, стимулирует процессы регенерации. Выпускается в форме мазей, кремов и спреев, в комбинациях с хлоргексидином биглюконатом и бензилдиметил-миристоиламино-пропиламмонием.
Декспантенол быстро абсорбируется и превращается в пантотеновую кислоту, связывается с белками плазмы и стимулирует регенерацию кожи. Пантотеновая кислота является незаменимым компонентом и стимулятором синтеза кофермента A. Кофермент А, в свою очередь, участвует практически во всех метаболических процессах: цикле трикарбоновых кислот, а также в обмене углеводов, жиров и жирных кислот, фосфолипидов и белков.
Декспантенол широко применяется для лечения сухости кожи, ожогов (в том числе солнечных), царапин, ссадин, фурункулов, пролежней, трещин и воспалений сосков молочной железы у кормящих матерей. Также препарат применяют для профилактики и лечения опрелостей у детей.
Как правило, хорошо переносится, может использоваться в период беременности и лактации, а также у детей с раннего возраста. Возможны аллергические реакции (крапивница, зуд) при индивидуальной непереносимости. Препараты на основе декспантенола изучены лучше остальных. Это и не удивительно, ведь пантотеновая кислота была выделена еще в начале ХХ века и активно исследовалась.
Депротеинизированный гемодериват крови телят
Препарат, улучшающий трофику и регенерацию тканей. Выпускается в виде крема, геля, мази. Также существует форма выпуска в виде растворов для инъекций и таблеток (используются как антигипоксанты и антиоксиданты для коррекции метаболических нарушений при хронических заболеваниях сердечно-сосудистой и нервной систем).
Ускоряет репаративные и регенеративные процессы в поврежденных тканях. Повышает поглощение и утилизацию кислорода, ускоряет транспорт и утилизацию глюкозы. Всё это приводит к улучшению энергетического метаболизма клеток и снижению образования лактата в условиях ишемии (избыточное количество лактата в тканях приводит к изменению рН, что мешает адекватной регенерации). Усиливает синтез коллагена, стимулирует пролиферацию клеток.
Депротеинизированный гемодериват крови телят наружно в виде мази и геля применяют при ранах и воспалительных заболеваниях кожи и слизистых, ожогах (в том числе солнечных), порезах кожи, ссадинах, царапинах, язвах, а также для профилактики и лечения пролежней. Применение у детей, беременных и кормящих женщин возможно.
Наружное применение переносится хорошо. У пациентов, имеющих в анамнезе реакции гиперчувствительности, в редких случаях могут развиваться аллергические реакции.
Гиалуронат цинка
Ранозаживляющее, регенерирующее, противомикробное средство. Выпускается в форме геля и раствора для наружного применения.
При взаимодействии гиалуроновой кислоты с молекулами воды возникает дисперсионный матрикс, который образует естественный поддерживающий каркас для клеток, участвующих в заживлении раны, повышает активность гранулоцитов и макрофагов, усиливает пролиферацию фибробластов и ангиогенез, ускоряет образование коллагена. Спектр антимикробной активности цинка включает штаммы золотистого стафилококка, стрептококка, кишечной и синегнойной палочек.
При местном применении системная резорбция крайне низкая. Воздействует на все 3 фазы раневого процесса. Снижает болезненность при перевязках (препятствует присыханию повязки). Раствор применяют при всех видах плохо заживающих инфицированных ран, трофических язвах, пролежнях, свищах; гель чаще используют в комплексной терапии угревой болезни. Нет данных о применении препарата при беременности или в период лактации. Противопоказан при индивидуальной непереносимости компонентов.
Таблица 1.
Применение ранозаживляющих препаратов для лечения неинфицированных ран
| Лекарственное соединение | Стадии раненого процесса | Форма выпуска | Удобство применения | Особенности |
| Гемодериват крови молочных телят | 1, 2, 3 | Гель, мазь, крем | + | Универсальность |
| Гиалуронат цинка | 1, 2, 3 | Раствор | - | Универсальность |
| Гель | + | |||
| Декспантенол | 1, 3 | Мазь, крем, аэрозоль | + | Применение ограничено стадией раневого процесса |
| Декспантенол + бензилдиметил-миристоиламино-пропиламмоний | 2 | Гель | + | Применение ограничено стадией раневого процесса |
| Декспантенол + хлоргексидина биглюконат | 2 | Крем | + | Применение ограничено стадией раны |
Правильная форма
Подбор формы заживляющего средства не менее важен, чем выбор действующего вещества. Повторим основные правила.
- Мази на жировой основе противопоказаны в первую стадию раневого процесса — они создают пленку, препятствуют адекватному оттоку экссудата и очищению раны.
- Препарат, используемый на ранних стадиях, должен иметь гидрофильную основу и длительно удерживать влагу. К лекарственным формам, отвечающим таким требованиям, относятся растворы, гели, аэрозоли и кремы на гидрофильной основе.
- Аэрозоли удобны для лечения ожогов, когда любые прикосновения к ране крайне болезненны.
- По мере роста грануляций во время второй фазы раневого процесса всё большая и большая часть поверхности раны должна обрабатываться с применением мази. А когда рана станет сухой и значительно уменьшится в размерах, необходимо полностью перейти к мазевым формам. Благодаря созданию жировой пленки на поверхности участков эпителизации, мазь будет защищать молодые чувствительные клетки кожи от пересыхания и обеспечит им большую устойчивость к факторам внешней среды.
Домашняя аптечка
Однако если речь идет об универсальном средстве, которое лучше иметь в домашней аптечке и которое подойдет всем членам семьи, то предпочтение стоит отдать препаратам декспантенола, которые разрешены к применению у детей с первых дней жизни, у беременных женщин и женщин в период лактации. Поскольку на каждом этапе раневого процесса рекомендованы разные формы выпуска этого препарата, оптимальным будет наличие в аптечке мази и комбинированного с антисептиком крема или геля.
В этой статье поговорим о функции дермальных фибробластов в коже, процессе их старения, а также о методе обновления и стимуляции регенерации кожи путём введения аутологичных фибробластов.
Введение
Роль дермальных фибробластов (ДФ) в обновлении кожи трудно переоценить, поскольку они являются основным клеточным компонентом соединительнотканной основы кожи, обеспечивающим её гомеостаз и морфофункциональную организацию. Очевидна актуальность этой темы для регенеративной (репаративной) косметологии, задача которой — омоложение кожи путём активации естественных процессов её восстановления.
Функции дермальных фибробластов
Из всех функций ДФ наибольшее внимание специалистов в области эстетической медицины и дерматологии сосредоточено на продуцировании этими клетками компонентов внеклеточного матрикса (ВКМ) дермы: коллагена, эластина, протеогликанов, особенно гиалуроновой кислоты (ГК), и структурных гликопротеинов.
Повышенный интерес именно к этой функции ДФ понятен: названные компоненты ВКМ формируют и поддерживают структуру кожи, обеспечивая её упругость и прочность. Причём ДФ не только синтезируют эти вещества, но и обеспечивают их катаболизм путём прямого фагоцитоза «отработанных» фрагментов фибрилл коллагена и эластина, секреции коллагеназы, гиалуронидазы и прочих ферментов.
Резидентные клетки ткани — образующиеся и постоянно пребывающие в этой ткани.
Другая, и не менее значимая для кожи, активность ДФ оставалась до недавнего времени несколько на обочине поля зрения врачей-практиков, однако сегодня она тоже становится объектом пристального внимания клиницистов. Речь идёт о целом ряде важнейших функций фибробластов. Так, продуцируя коллаген IV типа и ламинин, они влияют на формирование базальной мембраны. Фибробласты формируют строму, которая не только служит каркасом (опорой) для эпителия, но и регулирует структурную организацию и функционирование эпителиальных клеток. Они вырабатывают и выделяют факторы клеточного роста (KGF-1 — фактор роста кератиноцитов, GM–CSF — гранулоцитарно-макрафагальный колониестимулирующий фактор роста), иммунорегуляторные интерлейкины IL-6, IL-8. За счёт секреции факторов роста и интерлейкинов и непосредственного взаимодействия с эпителиальными клетками ДФ играют ключевую роль в регуляции эпидермального морфогенеза. Их паракринная активность служит основой для поддержания гомеостаза стволовых кератиноцитов.
Дермальные фибробласты секретируют факторы, влияющие на дифференцировку лимфоцитов, и факторы, регулирующие численность, миграцию и функции гранулоцитов и макрофагов, обеспечивая тем самым поддержание иммунитета кожи. Вырабатывая множество проангиогенных факторов, которые индуцируют дифференцировку и миграцию эндотелиальных клеток, ДФ способствуют образованию и стабилизации сосудов.
Они принимают участие в процессах нейроэндокринной регуляции кожи. Синтезируют биологически активные пептиды: гормоны, биогенные амины, нейропептиды и нейротрансмиттеры, идентичные таковым в центральной нервной и эндокринной системах, экспрессируют рецепторы андрогенов и эстрогенов, посредством которых осуществляется влияние этих гормонов на кожу человека.
Фибробласты, взаимодействуя с различными резидентными клетками: эпидермальными, эндотелиальными, нервными, жировыми, гемопоэтическими, участвуют практически во всех кожных процессах, в том числе — физиопатологических. Таким образом, ДФ представляют собой центральное звено в биологии кожи: они поддерживают не только гомеостаз ВКМ дермы, обеспечивая её ремоделирование и обновление, но и физиологическое состояние других слоёв и структур кожи.
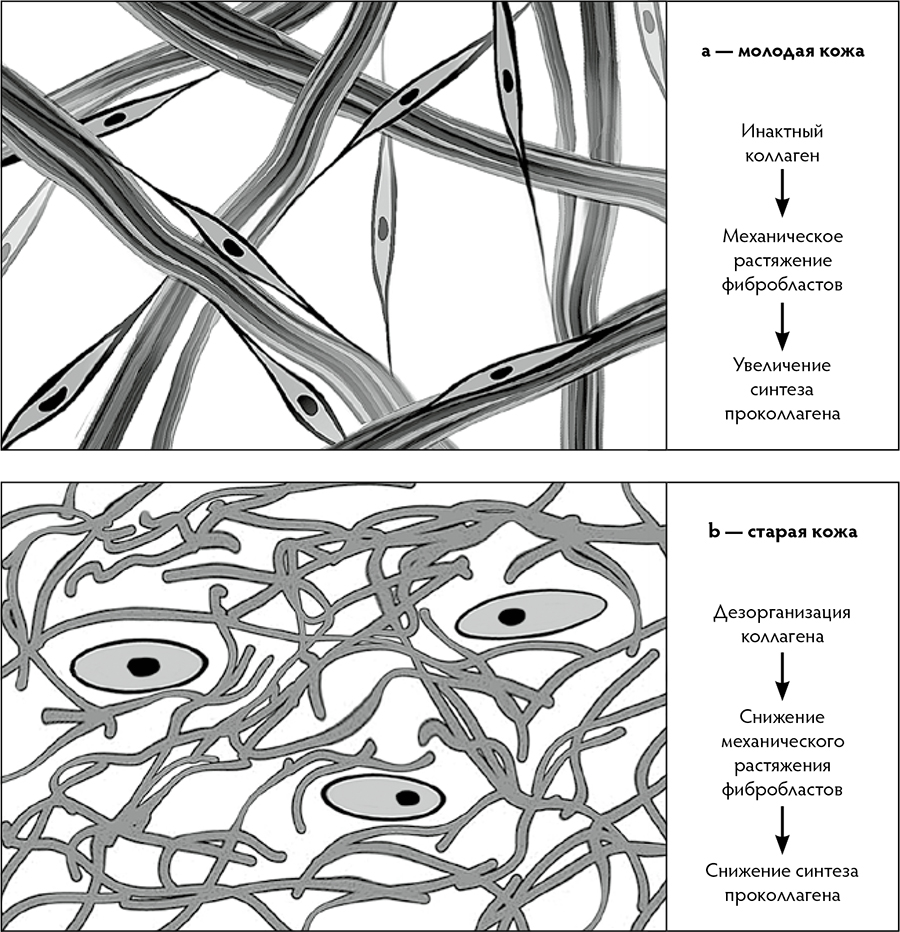
Рис. 1. Взаиморасположение фибробластов и коллагеновых волокон: a — в коже молодых людей (18–29 лет); b — в коже людей старшего возраста (старше 80 лет) (Varani J., et al. 2006, с изм.)
Инволюция дермальных фибробластов
По мере старения организма растёт число ДФ, в которых происходят возрастзависимые изменения, связанные преимущественно с непрерывным накоплением повреждений. Такие ДФ обозначают как «стареющие», или сенесцентные фибробласты (ДФст). Снижается их способность к ремоделированию и организации ВКМ, так как уменьшается синтез и секреция ими основных компонентов ВКМ. Нарушается эпидермальный гомеостаз из‑за негативных изменений в паракринных механизмах, связывающих эпидермис и папиллярный слой дермы. В популяции ДФст происходит увеличение секреции богатого цистеином ангиогенного индуктора — белка 61 (CYR61, или CCN1), стимулирующего продукцию провоспалительных цитокинов и матриксных металлопротеиназ (MMPs). CCN1 и MMPs поддерживают старение клетки путём негативной регуляции гомеостаза коллагена и увеличения его деградации.
Постепенно баланс между синтезом и деградацией коллагена нарушается в пользу последней. Повреждённый коллагеновый каркас ВКМ уже не может удерживать фибробласты в растянутом состоянии, свойственном молодым клеткам. Происходит своего рода коллапс фибробластов, что приводит к нарушению их функций. В процессе инволюции уменьшается численность фибробластов. Снижается и биосинтетическая активность этих клеток, нарушается баланс между синтезом и деградацией ВКМ дермы. В среднем, у пожилых / старых людей, по сравнению с молодыми, общее количество ДФ меньше на 35 %, продукция коллагена в коже снижена на 75 %, причём содержание коллагена уменьшается приблизительно на 1 % в год.
Все сенесцентные изменения в популяции ДФ приводят к постепенному и значительному снижению способности кожи к регенерации и обновлению. Как при этом меняется статус кожи? Уменьшается её толщина, снижается упругость и эластичность, появляются морщины, заломы, птоз тканей — кожа стареет.
Очевидно, что именно ДФ должны быть основной «мишенью» омолаживающих кожу косметологических методов. Так оно и есть: все современные терапевтические воздействия в целях коррекции возрастных изменений кожи — инъекционные, включая PRP-терапию, аппаратные (лазерные, радиочастотные, ультразвуковые) — направлены прежде всего на стимуляцию функциональной активности ДФ, как пролиферативной, так и биосинтетической. Особое место в этом ряду занимает применение аутологичных (собственных) дермальных фибробластов, или SPRS-терапия.
SPRS-терапия как метод оздоровления и обновления кожи
SPRS-терапия (SPRS — от англ. Service for Personal Regeneration of Skin — персонифицированный комплекс лечебно-диагностических процедур для восстановления кожи) — метод регенеративной медицины (РУ ФС №2009 / 308 от 21.07.2010). Его применение позволяет восполнить уменьшившуюся с возрастом популяцию ДФ за счёт введенных в кожу специализированных молодых и функционально активных клеток. Трансплантируются собственные фибробласты кожи пациента, поэтому они полноценно приживаются, интегрируют с резидентной клеточной популяцией и живут «по законам» дермы.
После трансплантации их биосинтетическая активность сохраняется не менее года, причём без какой‑либо дополнительной стимуляции. Как результат, увеличивается синтез коллагена и других компонентов ВКМ, благодаря чему происходит ремоделирование микроструктуры дермы, увеличение её толщины, уменьшение количества и глубины морщин.
Сенесценция — это состояние, при котором клетки с накопленными повреждениями ДНК и истощением механизмов её восстановления перестают делиться, теряют способность к ремоделированию и организации ВКМ.
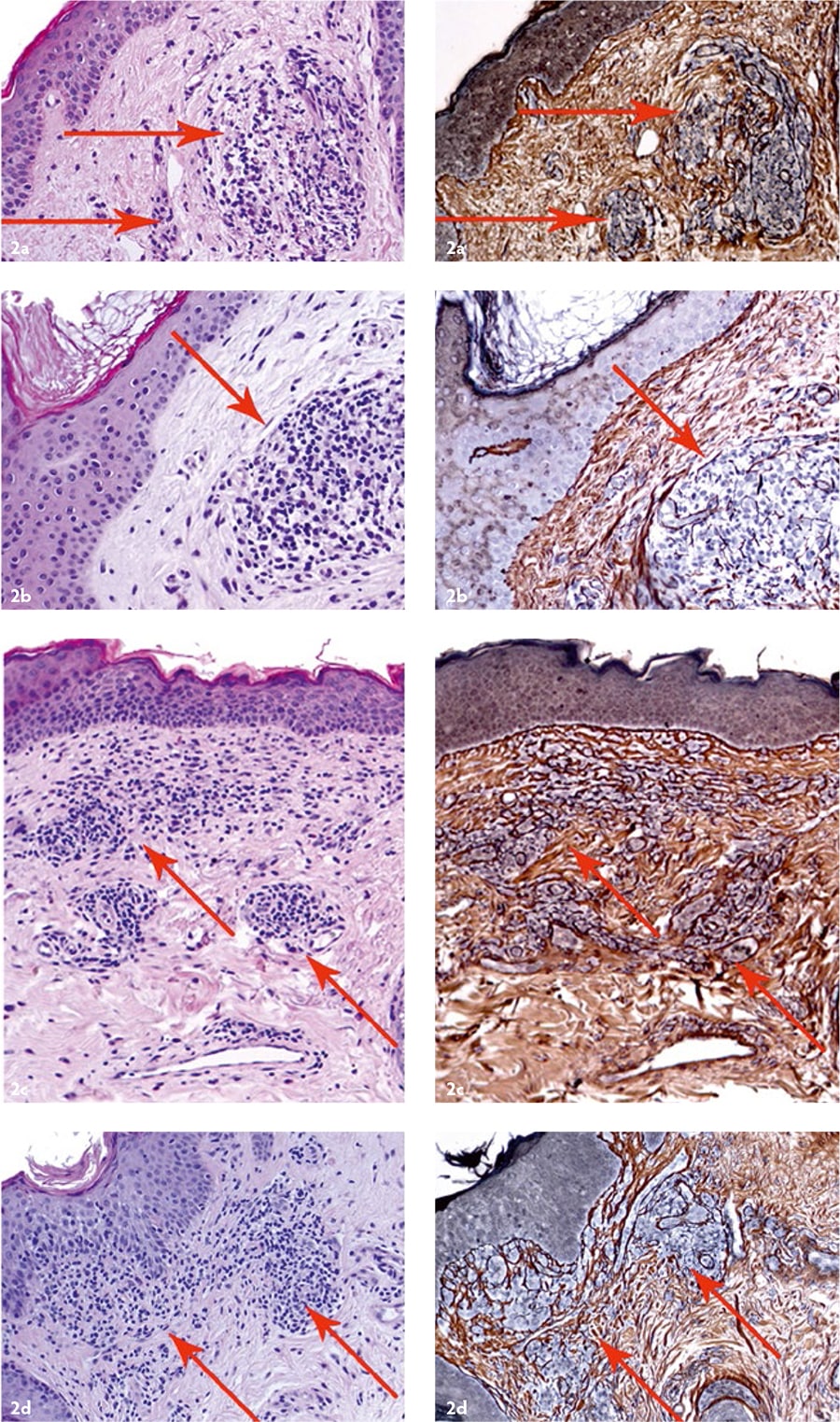
Рис. 2. Кожа после применения аутоДФ: a — через 1 месяц, b — через 3 месяца, c — через 6 месяцев, d — через 12 месяцев. Стрелками указаны группы введённых культивированных аутоДФ. Левая колонка — окраска гематоксилином и эозином, правая колонка — импрегнация нитратом серебра. Ув. ×200. Препараты и микрофотографии Р. В. Деева.
Описание технологии
В специализированной лаборатории Института стволовых клеток человека, соответствующей международным стандартам GMP*, из 4 мм биоптата кожи пациента получают клеточный препарат, содержащий культивированные аутологичные ДФ (аутоДФ). На этапах клеточного процессинга происходит отбор и стимуляция только функционально активных ДФ, которые, несмотря на старение организма, сохраняют высокую способность к делению и синтезу важных для кожи компонентов. Дело в том, что пролиферативный потенциал всей популяции дермальных фибробластов взрослого человека в течение всей его жизни остаётся на довольно высоком уровне — благодаря наличию в фибробластическом диффероне стволовых / прогениторных клеток. Это клетки-предшественницы, которые отвечают за обновление клеточной популяции дермы. Как показали исследования in vitro, первичные культуры, полученные даже от очень пожилых людей (95 лет), содержат до 14 % митотически активных фибробластов.
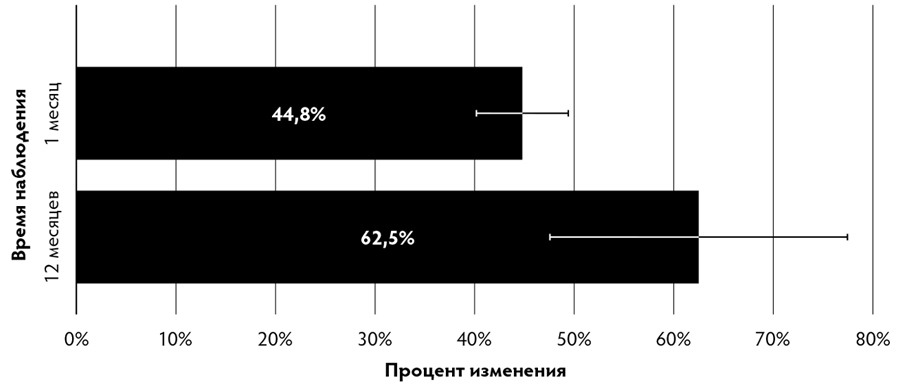
Рис. 3. Относительное изменение толщины кожи после применения аутоДФ (по результатам гистологических исследований).
Данный факт подтверждается и нашими экспериментами: культуры фибробластов дермы, полученные от пациентов 18–82 лет, характеризуются довольно высокой эффективностью колониеобразования (45.0±9.5 %), независимо от возраста донора. Это даёт возможность из небольшого биоптата кожи любого взрослого человека получить необходимое для проведения терапии количество функционально активных клеток.
После трансплантации культивированных ауто ДФ в дерму их биосинтетическая активность сохраняется. В своей работе мы вводили полученный клеточный материал одновременно и в кожу лица, и в кожу за ушной раковиной, откуда затем проводили забор биоптата для гистологического изучения. Наши исследования показали:
- трансплантированные аутоДФ синтезировали компоненты ВКМ дермы на протяжении как минимум 12 месяцев [Рис. 2];
- трансплантированные аутоДФ присутствовали в дерме небольшими группами, без признаков митотической активности, то есть без признаков деления клеток (следовательно, риск развития каких‑либо гиперпластических процессов при их использовании отсутствует);
- образовались новые коллагеновые волокна;
- толщина дермы увеличилась в среднем на 62,5±13,6 % (р=0,028) в течение первых 12 месяцев после применения аутоДФ [Рис. 3].
Через 24 месяца после применения аутоДФ в дерме также регистрировали отдельные группы фибробластоподобных клеток [Рис. 4], продуцирующих коллагеновые волокна. Однако признаков созревания (утолщения) коллагена не наблюдали, из чего следует, что через два года после трансплантации аутоДФ интенсивность их синтетической активности (по сравнению с таковой в течение первого года после трансплантации) была снижена.
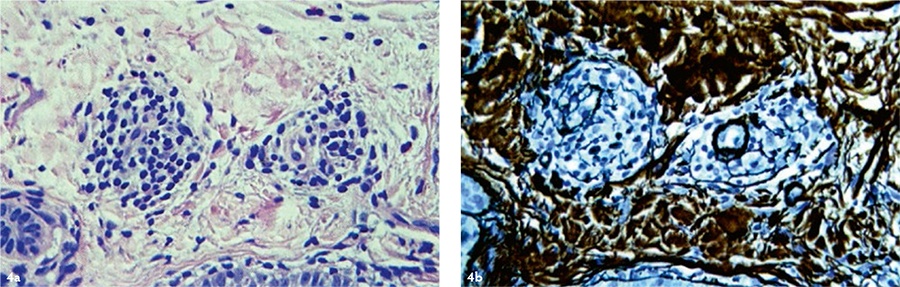
Рис. 4. Кожа пациента М. (54 г.) после применения аутоДФ через 24 месяца. Левая колонка — окраска гематоксилином и эозином, правая колонка — импрегнация нитратом серебра. Ув. ×200. Препараты и микрофотографии Р. В. Деева.
Скорее всего, это связано с уровнем физиологических потребностей дермы (известно, что для обеспечения её физиологического состояния достаточно незначительной функциональной активности фибробластов). По всей видимости, трансплантированные аутоДФ полноценно интегрировались с дермой, стали естественной составляющей её основной клеточной популяции — фибробластического дифферона — и находятся под контролем микроокружения.
Выводы гистологического исследования:
- введенные аутоДФ сохраняют свою жизнеспособность в дерме;
- они располагаются в дерме преимущественно группами;
- их функционирование не приводит к неблагоприятным последствиям, клетки пролиферативно не активны;
- на всех сроках наблюдения в дерме регистрируются признаки увеличения её объёма и процесс синтеза молодых коллагеновых волокон.
Выявленная на гистологическом уровне положительная динамика изменений кожи после применения аутоДФ полностью соответствует клинической картине. Уже через 10–14 дней после окончания курса SPRS-терапии отмечается повышение упругости кожи, уменьшение её рельефности (уменьшение выраженности морщин), улучшение цвета и контуров лица. Эффект имеет нарастающий характер. Так, если через месяц после инъекции на «хорошо» и «отлично» клинический результат оценили 88 % пациентов, то уже через три месяца и позже — 100 %. Врачи-исследователи через месяц определили результат как «хороший» и «отличный» у 86 % пациентов, через три месяца и позже — у 100 % пациентов. Положительные, прогрессирующие со временем (на протяжении как минимум 12 месяцев) изменения состояния кожи подтверждены нами и с помощью инструментальных методов исследования.
Заключение
Инновационная технология — SPRS-терапия, основанная на принципах регенеративной медицины, — позволяет восстанавливать утраченные с возрастом структуру и функции дермы за счёт уникального биологического механизма собственных коллагенобразующих клеток кожи пациента.
SPRS-терапия используется в отечественной эстетической медицине более восьми лет, зафиксировано более 1000 клинических наблюдений пациентов, из которых более 80 % повторно (два и более раз), пролечив одну область кожи, обращались в клиники для лечения этим методом кожи других областей.
Для врачебной практики важно, что SPRS-терапия является не только самостоятельным эффективным методом ремоделирования дермы, но и хорошей базовой основой для применения других косметологических вмешательств, направленных на стимуляцию синтетической активности фибробластов, что позволяет в течение длительного времени поддерживать кожу пациента в хорошем состоянии.
Авторы:
Алла Зорина, к. м. н., врач-биохимик, Москва.
Вадим Зорин, к. б. н., врач-биофизик, Москва.
Читайте также:

