Эозинофилия при эксфолиативном дерматите
Обновлено: 27.04.2024
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Иммуноглобулин Е (IgE) - класс иммуноглобулинов, обнаруживаемый в норме в незначительных количествах в сыворотке крови и секретах. Впервые IgE был изолирован в 1960-х годах из сывороток больных атопией и множественной миеломой. В 1968 г. ВОЗ выделила IgE как самостоятельный класс иммуноглобулинов. Согласно ВОЗ 1 МЕ/мл (МЕ - международная единица) соответствует 2,4 нг. Обычно концентрация IgE выражается в МЕ/мл или кЕ/л (кЕ - килоединица).
В норме IgE составляет менее 0,001% от всех иммуноглобулинов сыворотки крови (см. табл.1).
Таблица 1: Содержание IgE в сыворотке крови здоровых людей
| Возрастные группы | IgE (кЕ/л) |
|---|---|
| До 1 года | 0 - 15 |
| 1 год-6 лет | 0 - 60 |
| 6 -10 лет | 0 - 90 |
| 10 -16 лет | 0 - 200 |
| Взрослые | 0 - 100 |
Структура IgE подобна структуре других иммуноглобулинов и состоит из двух тяжёлых и двух лёгких полипептидных цепей. Они сгруппированы в комплексы, называемые доменами. Каждый домен содержит приблизительно 110 аминокислот. IgE имеет пять таких доменов в отличие от IgG, который имеет только четыре домена. По физико-химическим свойствам IgE - гликопротеин с молекулярной массой примерно 190000 дальтон, состоящий на 12% из углеводов. IgE имеет самую короткую продолжительность существования (время полувыведения из сыворотки крови 2 - 3 суток), самую высокую скорость катаболизма и наименьшую скорость синтеза из всех иммуноглобулинов (2,3 мкг/кг в сутки). IgE синтезируется главным образом плазматическими клетками, локализующимися в слизистых оболочках. Основная биологическая роль IgE - уникальная способность связываться с поверхностью тучных клеток и базофилов человека. На поверхности одного базофила присутствует примерно 40000 - 100000 рецепторов, которые связывают от 5000 до 40000 молекул IgE.
Дегрануляция тучных клеток и базофилов происходит, когда две связанные с мембраной клеток молекулы IgE соединяются с антигеном, что, в свою очередь, «включает» последовательные события, ведущие к выбросу медиаторов воспаления.
Помимо участия в аллергических реакциях I (немедленного) типа, IgE принимает участие в защитном противогельминтном иммунитете, что обусловлено существованием перекрёстного связывания между IgE и антигеном гельминтов. Последний проникает через мембрану слизистой и садится на тучные клетки, вызывая их дегрануляцию. Медиаторы воспаления повышают проницаемость капилляров и слизистой, в результате чего IgG и лейкоциты выходят из кровотока. К гельминтам покрытым IgG присоединяются эозинофилы, которые выбрасывают содержимое своих гранул и таким образом убивают гельминтов.
IgE можно обнаружить в организме человека уже на 11-й неделе внутриутробного развития. Содержание IgE в сыворотке крови возрастает постепенно с момента рождения человека до подросткового возраста. В пожилом возрасте уровень IgE может снижаться.
В практике клинико-диагностических лабораторий определение общего и специфического IgE проводится с целью их использования в качестве самостоятельных диагностических показателей. В табл. 2 перечислены основные болезни и состояния, сопровождающиеся изменением содержания общего IgE сыворотки крови.
Таблица 2: Болезни и состояния, сопровождающиеся изменением содержания общего IgE сыворотки крови
| Болезни и состояния | Возможные причины |
| I. Повышенное содержание IgE | |
|---|---|
| Аллергические болезни, обусловленные IgE антителами: а) Атопические болезни · Аллергический ринит · Атопическая бронхиальная астма · Атопический дерматит · Аллергическая гастроэнтеропатия б) Анафилактические болезни · Системная анафилаксия · Крапивница - ангионевротический отек | Множественные аллергены: · пыльцевые · пылевые · эпидермальные · пищевые · лекарственные препараты · химические вещества · металлы · чужеродный белок |
| Аллергический бронхопульмональный аспергиллез | Неизвестны |
| Гельминтозы | IgE антитела, связанные с защитным иммунитетом |
| Гипер-IgE синдром (синдром Джоба) | Дефект Т-супрессоров |
| Селективный IgA дефицит | Дефект Т-супрессоров |
| Синдром Вискотт-Олдриджа | Неизвестны |
| Тимусная аплазия (синдром Ди-Джорджи) | Неизвестны |
| IgE - миелома | Неоплазия IgE-продуцирующих плазматических клеток |
| Реакция "трансплантат против хозяина" | Дефект Т-супрессоров |
| II. Сниженное содержание общего IgE | |
| Атаксия - телеангиэктазия | Дефекты Т-клеток |
Ниже приведены в качестве примеров диапазоны содержания общего IgE сыворотки крови (у взрослых) при некоторых патологических состояниях (табл. 3). Однако, несмотря на первоначально кажущуюся простоту использования определения общего и специфического IgE для диагностики, существуют некоторые сложности в интерпретации результатов. Их перечень приведён ниже.
Таблица 3: Значения общего IgE при некоторых патологических состояниях
| Патологические состояния | Содержание IgE (кЕ/л) |
|---|---|
| Аллергический ринит | 120 - 1000 кЕ/л |
| Атопическая бронхиальная астма | 120 - 1200 кЕ/л |
| Атопический дерматит | 80 - 14000 кЕ/л |
| Аллергический бронхолегочный аспергиллез: - ремиссия - обострение | 80 - 1000 кЕ/л 1000 - 8000 кЕ/л |
| Гипер - IgE синдром | 1000 - 14000 кЕ/л |
| IgE - миелома | 15000 кЕ/л и выше |
Особенности интерпретации и диагностические ограничения общего IgE
- Примерно 30% больных атопическими заболеваниями имеют уровень общего IgE в пределах значений нормы.
- Некоторые больные бронхиальной астмой могут иметь повышенную чувствительность только к одному аллергену (антигену), в результате чего общий IgE может быть в пределах нормы, в то время как кожная проба и специфический IgE будут положительными.
- Концентрация общего IgE в сыворотке крови также повышается при неатопических состояниях (особенно при глистной инвазии, некоторых формах иммунодефицитов и бронхопульмональном аспергиллезе) с последующей нормализацией после соответствующего лечения.
- Хроническая рецидивирующая крапивница и ангионевротический отёк не являются обязательными показаниями для определения общего IgE, так как обычно имеют неиммунную природу.
- Границы нормы, определённые для европейцев, не могут быть применены для представителей зон, эндемичных по гельминтозам.
Особенности интерпретации и диагностические ограничения специфического IgE
- Доступность определения специфического IgE не должна преувеличивать его диагностическую роль в обследовании больных с аллергией.
- Обнаружение аллергенспецифического IgE (к какому-либо аллергену или антигену) не доказывает, что именно этот аллерген ответственен за клиническую симптоматику; окончательное заключение и интерпретация лабораторных данных должны быть сделаны только после сопоставления с клинической картиной и данными развёрнутого аллергологического анамнеза.
- Отсутствие специфического IgE в сыворотке периферической крови не исключает возможности участия IgE-зависимого механизма, так как местный синтез IgE и сенсибилизация тучных клеток может происходить и в отсутствие специфического IgE в кровотоке (например, аллергический ринит).
- Антитела других классов, специфичные для данного аллергена, особенно класса IgG (IgG4), могут быть причиной ложноотрицательных результатов.
- Исключительно высокие концентрации общего IgE, например, у отдельных больных атопическим дерматитом, могут за счёт неспецифического связывания с аллергеном давать ложноположительные результаты.
- Идентичные результаты для разных аллергенов не означают их одинакового клинического значения, так как способность к связыванию с IgE у разных аллергенов может быть различной.
В заключении, учитывая всё выше изложенное, а также существующие сложности в постановке и интерпретации кожных проб, перечислим основные показания и противопоказания к назначению специфического аллергологического обследования in vitro - определения специфического IgE (табл. 4).
Таблица 4: Показания и противопоказания к определению специфического IgE
| Показания | |
|---|---|
| 1 | Дифференциальная диагностика между IgE-зависимым и не-IgE-зависимым механизмами аллергических реакций |
| 2 | Больные, у которых невозможно выявить аллерген анамнестически, при помощи дневника и т. д. |
| 3 | Больные с недостаточным эффектом специфической гипосенсибилизации, назначенной по результатам кожных проб |
| 4 | Дермографизм и распространённый дерматит |
| 5 | Больные детского и пожилого возраста с гипореактивностью кожи |
| 6 | Гиперреактивность кожи |
| 7 | Больные, которым невозможно отменить симптоматическую терапию препаратами, влияющими на результаты кожных проб |
| 8 | Отрицательное отношение больного к кожным пробам |
| 9 | В анамнезе системные аллергические реакции на кожные пробы |
| 10 | Несоответствие результатов кожных проб данным анамнеза и клинической картине |
| 11 | IgE-зависимая пищевая аллергия |
| 12 | Необходимость количественной оценки чувствительности и специфичности аллергена |
| 13 | Общий IgE сыворотки крови более 100 кЕ/л |
| Обследование нецелесообразно: | |
| 1 | При атопических заболеваниях в случаях удовлетворительных результатов специфической терапии по данным кожных проб |
| 2 | У больных с не-IgE-зависимым механизмом аллергических реакции |
- Мачарадзе Д.Ш. Современные клинические аспекты оценки уровней общего и специфических IgE // Педиатрия. 2017; 96 (2): 121-127.
- Рыбникова Е.А., Продеус А.П., Федоскова Т.Г. Современные подходы к лабораторной диагностике аллергии — в помощь практикующему врачу // РМЖ. Медицинское обозрение. – №1 от 26.04.2021. – С. 43-49. DOI: 10.32364/2587-6821-2021-5-1-43-49
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Эозинофилия (эозинофильный лейкоцитоз) – это увеличение в крови уровня эозинофилов больше 500 в 1 мкл крови или больше 5%. Чаще всего встречается при аллергических реакциях, паразитарных инвазиях, может свидетельствовать о тяжелых заболеваниях легких, онкологических гематологических патологиях. Специфических проявлений нет. Клиническая картина зависит от заболевания, при котором наблюдается повышенное содержание эозинофилов. Уровень эозинофилов исследуется в венозной или капиллярной крови путем подсчета лейкоцитарной формулы в общем анализе крови. Для коррекции эозинофилии необходимо лечение заболевания, которое ее вызвало.
Классификация
На сегодняшний день существуют две основные классификации эозинофилии – по уровню повышения эозинофилов и по этиопатогенетическому фактору. По количеству клеток различают следующие эозинофилии:
- Легкие. Уровень эозинофилов от 500 до 1500.
- Умеренные. Концентрация эозинофилов от 1500 до 5000.
- Выраженные. Содержание эозинофилов составляет более 5000. Наиболее характерны для гельминтозов, гематологических болезней.
Умеренные и выраженные эозинофилии объединяют термином гиперэозинофилии. По патофизиологическому механизму эозинофилии разделяют на:
- Клональные. Эозинофилы являются частью злокачественного клона. Встречаются при миелопролиферативных гемобластозах (лейкозах), системных заболеваниях тучных клеток (мастоцитозе).
- Реактивные. Общий механизм возникновения – гиперпродукция Т-хелперами интерлейкина-5, который стимулирует костномозговую выработку эозинофилов. Развиваются как ответная реакция на различные внешние воздействия на макроорганизм – аллергены, паразитарные инвазии и т.д. Составляют около 90% всех эозинофилий.
Отдельно выделяют транзиторную (кратковременную) эозинофилию, не связанную напрямую с конкретными заболеваниями. Количество эозинофилов может увеличиться при употреблении некоторых лекарственных препаратов (антибиотиков, противотуберкулезных средств), введении вакцины против гепатита А, при проведении гемодиализа, воздействии локальной радиационной терапии. Точный патофизиологических механизм повышения эозинофилов при этих обстоятельствах неизвестен.
Причины эозинофилии
Аллергии
Это наиболее частая причина эозинофилии. Любые реакции гиперчувствительности сопровождаются увеличением продукции эозинофилов костным мозгом. Патогенез эозинофилий при аллергиях хорошо изучен. При попадании в организм аллергена (ингаляционно, через кожу или слизистые) он взаимодействует с IgE на мембране базофилов. Это приводит к их дегрануляции последних и высвобождению гистамина, лейкотриенов и других медиаторов, в результате чего в тканях развивается аллергическое воспаление, что и обусловливает симптоматику со стороны кожи (атопический дерматит, крапивница), слизистых оболочек (аллергический ринит, конъюнктивит), а также дыхательной системы (бронхиальная астма).
Параллельно с этим базофилами выделяется эозинофильный хемотаксический фактор анафилаксии, который стимулирует миграцию эозинофилов из периферической крови к очагу воспаления. Эозинофилы, в свою очередь, подавляют выработку медиаторов аллергии. Во время разгара аллергической реакции (обострения) уровень эозинофилии максимальный; по мере разрешения симптомов он постепенно снижается и нормализуется в стадию ремиссии.
При выраженном обострении содержание эозинофилов, наоборот, может быть снижено (эозинопения) или даже равно нулю (анэозинофилия). Такое случается, когда произошла массивная миграция эозинофилов к очагу аллергического воспаления, а новые эозинофилы еще не успели синтезироваться в костном мозге. Также, если во время рецидива бронхиальной астмы присоединится вторичная бактериальная инфекция (бронхит), то показатели эозинофилов могут оставаться в пределах нормы.
В основном при аллергиях встречается легкая степень эозинофилии. Для бронхиальной астмы, особенно атопической и аспириновой формы, характерна умеренная эозинофилия. При аллергических патологиях повышенное содержание эозинофилов наблюдается не только в крови, но и в других биологических жидкостях (в мокроте и бронхоальвеолярной жидкости – при бронхиальной астме, в носовой слизи – при рините, в соскобе с конъюнктивы – при конъюнктивите).
Гельминтозы
Другой частой причиной эозинофилий (особенно среди детей) является заражение гельминтами. Эозинофилия в данном случае обусловлена двумя патогенетическими механизмами. Во-первых, эозинофилы обладают противопаразитарной активностью – они выделяют эозинофильный катионный белок и активные формы кислорода, которые губительны для гельминтов. Во-вторых, продукты метаболизма гельминтов способны индуцировать реакции гиперчувствительности. Именно поэтому глистные инвазии часто сопровождаются аллергической симптоматикой.
Самые частые гельминтозы, сопряженные с высокой эозинофилией среди детей – аскаридоз, токсокароз, среди взрослых ‒ анкилостомидоз, описторхоз. При стронгилоидозе эозинофильный лейкоцитоз долгое время может быть единственным проявлением. Эозинофилия выявляется уже на 4-5 день инфицирования. Затем она очень быстро нарастает и достигает максимума примерно к 30-40 дню, а потом медленно начинает уменьшаться, но продолжает оставаться на высоких цифрах длительное время. Уровень эозинофилов очень большой (может составлять от 20% до 70-80%). Резкое нарастание эозинофилии происходит во время стадии миграции личинок по организму и проникновения в ткани.
Заболевания легких
Существует группа болезней легких, называемых легочными эозинофилиями, которые объединяет большое содержание эозинофилов в крови, в бронхоальвеолярной жидкости и образование эозинофильных инфильтратов в легочной ткани. Точный патогенез эозинофилии периферической крови и инфильтрации эозинофилами легочной ткани при большинстве этих заболеваний неизвестен. Различают следующие легочные эозинофилии:
- Эозинофильные пневмонии. К ним относятся синдром Леффлера (простая легочная эозинофилия), острые, хронические эозинофильные пневмонии (ОЭП, ХЭП). При синдроме Леффлера наблюдается легкая эозинофилия, которая быстро и самостоятельно разрешается. Для ХЭП характерен постоянный умеренный эозинофильный лейкоцитоз. При ОЭП отмечается эозинофилия, резко нарастающая до высоких цифр (до 25%) и столь же стремительно регрессирующая на фоне терапии глюкокортикостероидами.
- Аллергический бронхолегочный аспергиллез. Обусловлен гиперчувствительностью больных к грибкам рода аспергилл. Патогенез сходен с аллергическими патологиями (IgE-опосредованная реакция). Эозинофилия умеренная, возникает только в фазу обострения. В период ремиссии уровень эозинофилов находится пределах нормальных значений.
- Синдром Черджа-Стросса. Эозинофильный гранулематоз с полиангиитом ‒ тяжелое заболевание неизвестной этиологии из ряда системных васкулитов, поражающее несколько внутренних органов. Эозинофильный лейкоцитоз наиболее высокий среди всех легочных эозинофилий, в период рецидива может доходить до 50%.

Болезни крови
Во время некоторых злокачественных гематологических заболеваний в крови наблюдается повышенный уровень эозинофилов с разным патогенетическим механизмом. При миелопролиферативных патологиях (остром и хроническом эозинофильном лейкозе, хроническом миелолейкозе), агрессивном системном мастоцитозе эозинофилия обусловлена опухолевой (клональной) пролиферацией эозинофильного ростка кроветворения.
Эозинофилия нарастает медленно, в течение нескольких лет. При мастоцитозе достигает умеренных значений, при лейкозах – выраженных (до 60-70%). Уменьшается очень медленно, под действием химиотерапии. Кроме периферической крови, эозинофилия наблюдается также в миелограмме (мазке пунктата костного мозга). Для лейкозов существует специфичный лабораторный признак ‒ одновременное увеличение эозинофилов и базофилов (базофильно-эозинофильная ассоциация).
При лимфогранулематозе и неходжкинских лимфомах эозинофилия возникает вследствие продуцирования лимфатическими клетками цитокинов (в том числе интерлейкин-5), которые стимулируют пролиферацию нормальных эозинофилов. Эозинофильный лейкоцитоз умеренный, медленно нарастающий.
Заболевания ЖКТ
Эозинофилия сопровождает некоторые болезни органов пищеварения. К ним относят эозинофильный эзофагит, гастрит и энтероколит. Морфологическим субстратом является инфильтрация эозинофилами стенок пищевода, желудка, кишечника. Патогенез до сих пор остается предметом дискуссий.
Предполагается, что у наследственно предрасположенных лиц воздействие пищевых аллергенов на слизистую оболочку вызывает активацию антиген-презентирующих клеток (Т-лимфоцитов), вырабатывающих интерлейкины и эотаксин-3. В результате этого происходит миграция эозинофилов и инфильтрация ими слизистой оболочки органов ЖКТ. Эозинофильный лейкоцитоз обычно легкий и наблюдается только во время выраженного обострения заболевания. Высокая концентрация эозинофилов в биоптате слизистых, напротив, встречается постоянно.
Эндокринопатии
Некоторые гормоны, например, глюкокортикостероиды (гормоны коры надпочечников), стимулируют апоптоз (запрограммированную клеточную гибель) эозинофилов. Поэтому заболеваниям, сопровождающимся снижением уровня глюкокортикостероидов, сопутствует эозинофилия. К таким патологиям относятся первичная надпочечниковая недостаточность (болезнь Аддисона), врожденная дисфункция коры надпочечников, а также множественные эндокринопатии, такие как синдром Шмидта, пангипопитуитаризм. Степень эозинофилии легкая. Количество эозинофилов быстро нормализуется после введения глюкокортикоидов.
Иммунодефицитные состояния
Эозинофилия встречается при, так называемых, первичных иммунодефицитах – тяжелых болезнях с высокой летальностью, обусловленных генетическим дефектом одного или нескольких компонентов иммунной системы (клеточных, гуморальных реакций, фагоцитоза и пр.). Такими заболеваниями являются синдром Вискотта-Олдрича и синдром Джоба (гипер-IgE-синдром). Эозинофилия, вероятно, связана с аномальной гиперпродукцией иммуноглобулина Е. Уровень эозинофилов в тканях и крови очень высокий (до 60%), не поддается коррекции.
Злокачественные новообразования
Некоторые опухоли, особенно аденокарциномы легких, органов пищеварительной и мочеполовой системы, имеют способность к выработке эозинофильного хемотаксического фактора, стимулирующего костномозговую продукцию эозинофилов. При таких заболеваниях эозинофильный лейкоцитоз нарастает медленно, достигает высоких значений (до 20-40%). Концентрация эозинофилов периферической крови возвращается к норме после долгой химиотерапии или хирургического удаления злокачественного образования.
Диагностика
Эозинофилия выявляется при подсчете лейкоцитарной формулы клинического анализа крови. Так как спектр патологий, сопровождающихся эозинофилией, довольно широк, при впервые выявленных изменениях в анализах необходимо обратиться к врачу-терапевту. Для подтверждения заболевания, вызвавшего эозинофилию, с учетом клинических и анамнестических данных назначается обследование, которое может включать:
- Анализы крови. Определяется уровень эритроцитов, лейкоцитов, тромбоцитов. Проверяется наличие специфических антител к гельминтам, грибкам, антицитоплазматических антител (ANCA), концентрация некоторых гормонов (кортизола, паратгормона, эстрогенов, андрогенов). Проводится генетическое исследование на первичные иммунодефициты, а также иммунофенотипирование, иммуногистохимический анализ клеток крови для обнаружения специфических опухолевых антигенов (CD-маркеров).
- Аллергодиагностика. Для выявления аллергена выполняются различные аллергопробы – кожные (скарификационные, аппликационные, прик-тесты), провокационные (назальные, ингаляционные, конъюнктивальные), прямой и непрямой базофильный тесты. Методом ИФА измеряется уровень иммуноглобулина E (IgE).
- Исследование мокроты. Осуществляется микроскопическое исследование мокроты для изучения клеточного состава (количества эозинофилов, наличия кристаллов Шарко-Лейдена, спиралей Куршмана), выявления личинок гельминтов. Проводится бактериологический, микологический посев мокроты с определением чувствительности к антибактериальным и противогрибковым препаратам.
- Рентгенологические исследования. Одним из наиболее информативных методов диагностики легочных эозинофилий считается рентгенография грудной клетки. На снимках обнаруживаются летучие (мигрирующие) эозинофильные инфильтраты в виде участков затемнения. При аллергическом бронхолегочном аспергиллезе могут быть видны бронхоэктазы, фиброз верхних отделов легких.
- Эндоскопия. При подозрении на эозинофильное поражение органов желудочно-кишечного тракта проводятся фиброгастродуоденоскопия и фиброколоноскопия со взятием биопсийного материала. Для морфологической картины, помимо эозинофильной инфильтрации, характерен фиброз собственной пластинки слизистой оболочки.
- Спирометрия. При поражении дыхательной системы выполняется оценка функции внешнего дыхания. Измеряется степень проходимости бронхов мелкого и среднего калибра, растяжимость легочной ткани. Для пациентов с бронхиальной астмой типично уменьшение объема выдыхаемого воздуха (индекс Тиффно) и улучшение дыхательной функции после фармакологической пробы с сальбутамолом. При легочных эозинофилиях наблюдается снижение жизненной емкости легких.
- Гистология. С целью подтверждения синдрома Черджа-Стросса берется биопсия легкого. Отмечаются периваскулярные эозинофильные инфильтраты. Для изучения морфологической картины костного мозга (в случае подозрения на лейкоз) прибегают к стернальной пункции и трепанобиопсии. Обнаруживаются гиперплазия гранулоцитарного ростка кроветворения, гиперклеточность за счет эозинофильных миелобластов.

Коррекция
Самостоятельная коррекция эозинофилии невозможна. Для нормализации уровня эозинофилов необходимо бороться с причиной. Если эозинофилия легкая, связана с приемом ЛС или вакцинацией либо приходится на период реконвалесценции – беспокоиться не стоит. Нужно понаблюдать кровь в динамике через 7-10 дней. При обнаружении стойкой или высокой эозинофилии в анализе крови следует обратиться к специалисту, чтобы тот на основании осмотра, жалоб, анамнеза провел диагностический поиск этиологического фактора и назначил соответствующее лечение. Для терапии большинства болезней, сопровождающихся эозинофилией, используются лекарственные препараты из группы антигистаминных средств или глюкокортикостероидов.
Прогноз
Только по одному лишь эозинофильному лейкоцитозу в крови невозможно предсказать риск возникновения тех или иных последствий для здоровья и жизни человека. Прогноз всегда определяется основным заболеванием и своевременностью его диагностирования – он может варьироваться от благоприятного при аллергическом конъюнктивите до высокой вероятности летального исхода при злокачественных новообразованиях или миелопролиферативных патологиях. Поэтому любое превышение референсных значений эозинофилов в клиническом анализе крови требует тщательного обследования для установления причины.
2. Дифференциальный диагноз внутренних болезней: Алгоритмический подход/ Хили П.М., Джекобсон Э.Дж. - 2014.
4. Синдромная диагностика и базисная фармакология заболеваний внутренних органов. В 2 томах, т. 2/ под ред. Г.Б. Федосеева, Ю.Д. Игнатова. – 2004.
Эозинофилия - лечение в Москве


Комментарии к статье
Да, интересно пришли к адекватному результату. У нас врачи даже особо не заинтересовались этой патологией-я поняла, что найти истинную причину очень сложно-почти что пальцем в небо. Или лечить одновременно все возможные причинные направления.
Герпетиформный дерматит Дюринга — хроническое рецидивирующее поражение кожи, проявляющееся полиморфной сыпью в виде эритематозных пятен, пузырей, папул, волдырей и сопровождающиеся выраженным зудом и жжением. Заболевание получило свое название благодаря тому, что элементы сыпи при дерматите Дюринга группируются таким же образом, как высыпания при герпесе. Диагностика проводится при помощи гистологического исследования, анализа содержимого пузырей и реакции прямой иммунофлуоресценции. В лечении герпетиформного дерматита Дюринга эффективна сульфоновая группа препаратов и кортикостероиды.
Общие сведения
Герпетиформный дерматит Дюринга встречается в любом возрасте, но наиболее часто он развивается в 30-40 лет. Мужчины более подвержены этому заболеванию, чем женщины. В некоторых случаях герпетиформный дерматит Дюринга является кожной реакцией на имеющуюся в организме злокачественную опухоль внутренних органов, то есть выступает в качестве параонкологического дерматоза.

Причины возникновения
Причины и механизм развития герпетиформного дерматита Дюринга неизвестны. У многих пациентов выявляется непереносимость белка глютеина, содержащегося в злаковых растениях. В пользу аутоиммунного компонента в развитии заболевания говорит обнаружение IgA-антител на границе дермы и эпидермиса — в области базальной мембраны. Предполагают, что определенную роль в возникновении герпетиформного дерматита Дюринга играют повышенная йодная чувствительность, наследственность, аскаридоз, воспалительные процессы желудочно-кишечного тракта (гастрит, язвенная болезнь), вирусные заболевания (ОРВИ, герпетическая инфекция и др.).
Симптомы
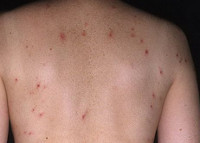
Обычно герпетиформный дерматит Дюринга имеет острое начало с появлением очагов полиморфной сыпи. Высыпаниям могут предшествовать умеренный подъем температуры тела, общая слабость, зуд и чувство покалывания. Элементы сыпи могут возникать на любом участке кожного покрова, кроме подошв и ладоней. Но наиболее частое их расположение — это разгибательные поверхности рук и ног, область лопаток, плечи, поясница и ягодицы. На ладонях могут возникать петехии и экхимозы — крупные (больше 3мм) пятна внутрикожных кровоизлияний. Высыпания сопровождаются выраженным дискомфортом: ощущением жжения, интенсивным зудом и парестезиями. Поражение слизистых оболочек при герпетиформном дерматите Дюринга, как правило, отсутствует. В редких случаях в полости рта могут возникать пузыри, быстро переходящие в эрозии.
Истинный полиморфизм сыпи при герпетиформном дерматите Дюринга связан с одновременным появлением на коже различного размера эритематозных пятен, волдырей, папул и пузырей. Со временем к истинному полиморфизму присоединяется ложный: образуются связанные с трансформацией высыпаний эрозии и корочки, а также вызванные сильным расчесыванием кожи экскориации. При заживлении элементов сыпи на коже остаются очаги гипо- и гиперпигментации, иногда рубцы.
Эритематозные пятна при герпетиформном дерматите Дюринга имеют четкий контур и округлую форму. Их гладкая поверхность часто покрыта расчесами, кровянистыми и серозными корочками. Со временем они пропитываются выпотом из расширенных сосудов и превращаются в похожие на волдыри (уртикароподобные) образования. Последние растут по периферии и сливаются, трансформируясь в розово-синюшные очаги, покрытые корочками, расчесами и пузырьками. Наряду с этим эритематозные пятна могут переходить в сочные розово-красные папулы. Кроме того, возникновение папул и уртикароподобных высыпаний может происходить без стадии эритематозного пятна.
Пузырные элементы сыпи при герпетиформном дерматите Дюринга могут быть небольшого размера — везикулы и диаметром более 2 см — буллезные высыпания. Они заполнены прозрачной жидкостью, помутнение которой говорит о присоединении инфекции. Пузыри вскрываются и подсыхают с образованием корки. Из-за расчесывания происходит снятие корки и на месте пузыря остается эрозия.
В зависимости от преобладания того или иного вида сыпи над остальными выделяют следующие виды герпетиформного дерматита Дюринга: папулезную, везикулезную, буллезную и уртикароподобную. Возможны атипичные варианты заболевания: трихофитоидные, экзематоидные, строфулоидные и др.
Острые периоды герпетиформного дерматита Дюринга сочетаются с довольно продолжительными ремиссиями (от нескольких месяцев до года и более). Обострения часто протекают с ухудшением общего состояния больного, подъемом температуры, нарушениями сна.
Диагностика
При подозрении на герпетиформный дерматит Дюринга проводят йодную пробу Ядассона. На здоровый участок кожи накладывают компресс с мазью, содержащей 50% йодида калия. Через 24 ч компресс снимают. Выявление на его месте покраснения, везикул или папул говорит в пользу герпетиформного дерматита Дюринга. Если проба отрицательна, то ее повторяют. Для этого через 48 ч накладывают такой же компресс на область пигментации, оставшейся после бывших высыпаний. Пробу Ядассона можно проводить с приемом препарата йода внутрь. Но такое исследование чревато резким обострением заболевания.
При герпетиформном дерматите Дюринга в клиническом анализе крови обнаруживается повышенное содержание эозинофилов. При цитологическом исследовании содержимого пузырей также выявляется большое количество эозинофилов. Однако эти данные, как и проба Ядассона, не являются обязательными или строго специфичными для заболевания.
Наиболее надежным способом диагностики герпетиформного дерматита Дюринга считается гистологическое исследование участков пораженной кожи. Оно выявляет расположенные под эпидермисом полости, скопления эозинофилов, нейтрофилов и остатков их разрушенных ядер. Реакция прямой иммунофлуоресценции (РИФ) обнаруживает на верхушках дермальных сосочков отложения IgA.
В диагностике буллезной формы герпетиформного дерматита Дюринга необходима дифференциация с другими буллезными дерматитами: буллезным пемфигоидом, вульгарной пузырчаткой и другими видами пузырчатки.
Поскольку герпетиформный дерматит Дюринга является параонкологическим заболеванием, для пациентов пожилого возраста желательно проведение дополнительных обследовании для исключения онкологической патологии внутренних органов: УЗИ органов брюшной полости и моче-половой системы, рентгенограмму легких, КТ почек и т. п.
Лечение герпетиформного дерматита Дюринга
Больным герпетиформным дерматитом Дюринга показано лечение у дерматолога. Назначают диету, исключающую злаки и йодосодержащие продукты (морская рыба, морепродукты, салат и др.). Медикаментозная терапия проводится препаратами сульфоновой группы: диафенилсульфон, сульфасалазин, солюсульфон и другие. Эти препараты обычно назначают внутрь циклами по 5-6 дней с перерывами в 1-3 дня. В случаях неэффективности сульфоновой терапии лечение проводят средними дозами кортикостероидов (преднизолон, дексаметазон и др.) Для купирования зуда применяют антигистаминные препараты: лоратадин, цетиризин, дезлоратадин.
Местное лечение герпетиформного дерматита Дюринга включает теплые ванны с раствором марганцовки, вскрытие пузырей и их обработку зеленкой или фукарцином, наложение кортикостероидных мазей или аэрозолей, применение 5% дерматоловой мази.
В статье приводятся данные об эксфолиативном дерматите, характеризующемся диффузной эритемой и шелушением кожи, поражающими более 90% общей поверхности тела. Наиболее частыми предшествующими эксфолиативному дерматиту заболеваниями являются псориаз, атопич
The article presents data on exfoliative dermatitis, characterized by diffuse erythema and skin peeling, affecting more than 90% of the total body surface. The most common diseases, previous to exfoliative dermatitis, are psoriasis, atopic dermatitis and other spongiotic dermatitis, drug hypersensitivity reaction (drug toxicodermia) and cutaneous T-cell lymphoma. The treatment is directed at the primary disease, symptomatic relief and prevention of potential systemic complications.
Эксфолиативный дерматит — это диффузная эритема и шелушение кожи, поражающие более 90% общей поверхности тела [1, 2]. Частота встречаемости эксфолиативного дерматита варьирует от 0,9 до 71,0 на 100 000 пациентов. Мужчины болеют значительно чаще женщин в соотношении от 2:1 до 4:1. Средний возраст начала заболевания составляет от 41 до 61 года с учетом того факта, что в большинство исследований не включены случаи заболевания у детей. Эксфолиативный дерматит может возникать на фоне многих кожных и системных заболеваний. В половине случаев эксфолиативного дерматита у пациентов выявляются предшествующие кожные заболевания. По данным ряда авторов, наличие предшествующего кожного заболевания является провоцирующим фактором в 52% всех случаев эксфолиативного дерматита. Наиболее часто эксфолиативный дерматит возникает на фоне псориаза (23%), спонгиотических дерматитов (20%), лекарственной гиперчувствительности (15%), кожной Т-клеточной лимфомы или синдрома Сезари (5%). Идиопатический эксфолиативный дерматит, когда причину установить не удается, встречается в 20% случаев. Реже эксфолиативный дерматит возникает на фоне иммунобуллезных заболеваний, красного волосяного лишая, системных заболеваний соединительной ткани, дерматофитии [3–7]. У маленьких детей и новорожденных эксфолиативный дерматит следует дифференцировать с такими дерматозами, как псориаз, атопический и себорейный дерматиты, действием лекарств и синдромом стафилококковой обожженной кожи, следует исключить врожденные состояния, в том числе буллезную и небуллезную формы врожденной ихтиозиформной эритродермии, синдром Нетертона, а также иммунодефицитные состояния.
При эксфолиативном дерматите кожа эритематозная и повсеместно утолщена. Поражение с островками нормальной кожи указывает на красный волосяной лишай, выпадение волос — на Т-клеточную лимфому, заболевания ногтей могут быть типичными для экземы или псориаза. Практически всегда присутствует генерализованная лимфаденопатия. Так как Т- и В-лимфоциты сильно активированы, гистологическая дифференцировка реактивных лимфоузлов и лимфомы может быть затруднена. Эритродермия может протекать в тяжелой форме с повышением температуры, болями в суставах, выраженным недомоганием, потерей белка, жидкости и массы тела вплоть до кахексии [8].
В патогенезе эксфолиативного дерматита молекулы адгезии и их лиганды играют существенную роль в эндотелиально-лейкоцитарных взаимодействиях, которые влияют на связывание, переселение и инфильтрацию лимфоцитами и мононуклеарными клетками при воспалении, травме или иммунологической стимуляции. Рост экспрессии молекул адгезии (VCAM-1 (васкулярные молекулы межклеточной адгезии 1), ICAM-1 (молекулы межклеточной адгезии, присутствующие в низких концентрациях на мембранах лейкоцитов и эндотелиальных клетках), Е-селектина и Р-селектина) у пациентов с эксфолиативным дерматитом стимулирует кожное воспаление, которое может привести к эпидермальной пролиферации и повышенной продукции медиаторов воспаления. Сложные взаимодействия цитокинов и молекул клеточной адгезии, такие как интерлейкин-1 (ИЛ-1), ИЛ-2 и ИЛ-8; межклеточная адгезия молекулы ICAM-1 и фактора некроза опухоли (ФНО), приводят к значимо повышенной эпидермальной пролиферации. Количество герминативных клеток увеличивается, а время прохождения через кератиноциты эпидермиса уменьшается, вызывая потерю клеточного материала с поверхности. Ряд авторов обратили внимание на то, что дермальный инфильтрат у больных синдромом Сезари при иммуногистохимическом исследовании проявляется в основном цитокиновым профилем Т-хелперов 2-го типа (Th2), в отличие от цитокинового профиля Т-хелперов 1-го типа (Тh1) при доброкачественной реактивной эритродермии с другими патомеханизмами и этиологическими факторами [9].
Эритродермия может возникать спонтанно или развиться в течение нескольких месяцев. Быстрое наступление эксфолиативного дерматита в качестве более вероятной причины может быть диагностировано в пользу приема лекарственных препаратов. Клинически у пациентов появляется генерализованная эритема, часто с шелушением. Признаки включают озноб, в том числе из-за терморегуляторной дисфункции. Часто наблюдается отек, особенно в нижних конечностях. При осмотре может отмечаться тахикардия, возможны нарушения ритма сердца, иногда диспепсия, зуд. Диффузная алопеция, кератодермия, дистрофия ногтей и потеря веса являются более распространенными при хроническом состоянии. Пожилые пациенты часто гемодинамически нестабильны и подвержены высокому риску сердечной недостаточности, дыхательной недостаточности, повышенной проницаемости капилляров, почечных дисрегуляций и отрицательному азотистому балансу [10].
Лекарственно-индуцированные случаи эксфолиативного дерматита могут быть представлены сенсибилизацией к неомицину, этилендиамину. Как правило, эксфолиативный дерматит может возникать после приема таких препаратов, как фенитоин, пенициллины, изониазид, триметоприм, сульфаниламиды, противомалярийные препараты, тиазидные диуретики, золото, Аминазин, цианамид, нифедипин, роксатидин, эсциталопрам, иматиниб, аллопуринол. Ряд авторов отмечают случаи эксфолиативной эритродермии после применения некоторых нестероидных противовоспалительных препаратов, таких как сулиндак, меклофенамат натрия, фенилбутазон, бета-блокаторы, глазные капли (тимолола малеат), мазь Гиперикум (экстракт зверобоя). Терапия с использованием рекомбинантных цитокинов также может привести к развитию эксфолиативной эритродермии. Клиническая симптоматика эксфолиативного дерматита, связанная с лекарственными препаратами, как правило, имеет быстрое начало и относительно быстрое разрешение в течение 2-6 недель, в отличие от более длительного курса идиопатической эритродермии и лимфомы кожи [11].
Клинические признаки, относящиеся к эксфолиативному дерматиту различной этиологии, могут включать:
Псориатическая эритродермия возникает остро с появлением эритемы на участках кожи, не покрытых псориатическими очагами, затем распространяется на весь кожный покров, включая и кожу лица. У пациентов на фоне эритемы очень быстро появляется обильное шелушение, псориатические папулы становятся неразличимыми. Может наблюдаться сильное выпадение волос, ногтевые пластинки утолщаются и легко отходят от поверхности ногтевого ложа. Кожный процесс сопровождается длительным повышением температуры. Через несколько недель (иногда месяцев) эритродермия, как правило, проходит, и восстанавливается клиническая картина псориаза. Наиболее частой причиной развития вторичной эритродермии является нерациональное, слишком энергичное лечение псориаза в остром периоде. Гистопатологические изменения характеризуются явлениями акантоза, выражающегося в резком удлинении межсосочковых эпителиальных отростков, и паракератозом. Зернистый слой полностью отсутствует. В остром периоде болезни в шиповатом слое нередки разлитой межклеточный отек и скопления лейкоцитов в форме микроабсцессов. В дерме наблюдаются отек и резкое удлинение сосочков, поднимающихся почти до самого паракератозно измененного рогового слоя и отделяющихся от него лишь двумя-тремя рядами клеток шиповатого слоя. Капилляры сосочков и сосуды подсосочкового слоя резко расширены. Вокруг них визуализируется значительная, преимущественно лимфоцитарная, инфильтрация, усиливающаяся по мере перехода процесса в стационарное состояние [12, 13].
При постановке диагноза эксфолиативного дерматита собирают анамнез о предшествующих кожных заболеваниях, таких как псориаз или атопический дерматит. У пациентов с эксфолиативным дерматитом должно быть проведено тщательное обследование и выявление триггеров для исключения инфекции, аллергии, контактной гиперчувствительности. Выполняют биопсию для уточнения диагноза и исключения лимфомы, биопсию легче провести на коже, чем в лимфоузлах. По показаниям проводят ультразвуковое исследование и биопсию лимфоузлов. Собирают подробный личный и семейный анамнез (атопия, псориаз, красный плоский лишай) и подробную информацию о приеме всех лекарств (следует выяснить, принимает ли пациент аллопуринол, антидиабетические и противосудорожные препараты). Важна оценка питания, особенно при хронической эритродермической картине, так как многие пациенты имеют низкий альбумин и отрицательный азотистый баланс. У пациентов с эксфолиативным дерматитом проводят общий анализ крови с формулой, биохимический анализ крови. При подозрении на лимфому проводят исследование на клетки Сезари; > 20% активированных Т-лимфоцитов [14].
При эксфолиативном дерматите требуется стационарное лечение, постельный режим и постоянная температура воздуха в помещении (22-24 °C). Пациенты с эксфолиативным дерматитом нуждаются в тщательном мониторинге за функциями организма, достаточном введении белка и жидкостей, преимущественно внутривенном, контроле баланса электролитов. Первоначально проводится простая наружная терапия кортикостероидами IV класса без консервантов и ароматизаторов. Рекомендуется обильное применение увлажняющих препаратов с мочевиной и масляных ванн. Часто помогает короткий ударный курс системных кортикостероидов, однако он не показан при псориазе, ввиду риска развития эффекта отмены препарата или эффекта «рикошета». Следует воздерживаться от продолжительной стероидной терапии. Как можно быстрее рекомендуется назначение специфической терапии в зависимости от заболевания. Также важна оценка и лечение сопутствующих заболеваний, особенно сердечно-сосудистой системы и почек. При псориазе и кожной Т-клеточной лимфоме рекомендуется фотохимиотерапия и в некоторых случаях метотрексат. Если у пациента с эксфолиативной эритродермией наблюдается базовый патогенез псориаза, может быть инициирована терапия с пероральными ретиноидами, циклоспорином или агентом анти-ФНО в зависимости от сопутствующих заболеваний пациента. В случае, если основой эритродермии является атопический дерматит, лечение топическими стероидами может быть достаточно, при торпидности процесса могут быть рекомендованы системные стероиды и щадящие средства. У пациентов с эксфолиативным дерматитом должны тщательно контролироваться жидкости и электролитный баланс. Следует компенсировать любой дефицит в питании, особенно белка [15].
Профилактике эксфолиативного дерматита способствует отмена приема лекарственных препаратов, которые изначально могли провоцировать это заболевание. Пациент должен тщательно регистрировать все возникающие у него аллергические реакции, в том числе от лекарственных препаратов, потенциально способных к перекрестным реакциям. Отказ от использования системных кортикостероидов у пациентов с псориазом будет способствовать профилактике эффекта отмены.
Таким образом, каждый случай эксфолиативного дерматита должен быть адекватно оценен, а целью терапии должен быть не только контроль обострения заболевания, но и контроль достижения прочной ремиссии с улучшением качества жизни пациентов.
Литература
Л. А. Юсупова, доктор медицинских наук, профессор
ГБОУ ДПО КГМА Минздрава России, Казань
Современное состояние проблемы эксфолиативного дерматита/ Л. А. Юсупова
Для цитирования: Лечащий врач № 11/2019; Номера страниц в выпуске: 6-8
Теги: кожа, воспаление, эритема, шелушение
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Эозинофилия: причины появления, при каких заболеваниях возникает, диагностика и способы лечения.
Определение
Эозинофилия – это состояние, при котором отмечается повышение уровня эозинофилов в крови. Эозинофилы представляют собой один из видов белых клеток крови – лейкоцитов, образуются в костном мозге, откуда попадают в кровоток. Повышение их количества отмечается при паразитарных и аллергических заболеваниях, туберкулезе, инфекционных процессах и некоторых других состояниях и заболеваниях, требующих полноценного обследования и специфической терапии.
Разновидности эозинофилии
По количеству клеток в единице крови различают следующие эозинофилии:
- легкая, когда содержание эозинофилов составляет от 500 до 1500 в микролитре крови;
- умеренная, когда содержание эозинофилов составляет от 1500 до 5000 в микролитре крови;
- выраженная, когда содержание эозинофилов составляет более 5000 в микролитре крови.
- первичную, или клональную эозинофилию, которая наблюдается при патологиях крови;
- вторичную, или реактивную эозинофилию, которая развивается как ответная реакция на аллергены, паразитарные инвазии и т.д.
- идиопатическую, или транзиторную эозинофилию, причины которой выяснить не удается.
В наибольшей степени эозинофилы задействованы в иммунном ответе с выраженным аллергическим компонентом.
Аллергическая реакция является одной из форм ответа организма на проникновение извне чужеродных агентов (аллергенов).
Аллергеном может стать практически любое вещество, однако чаще в роли аллергена выступают белки. При первом попадании аллергена в организм клетки лимфоциты начинают вырабатывать особый вид антител IgE, играющих ключевую роль в развитии аллергической реакции при повторном контакте организма с данным аллергеном. Антитела активируют эозинофилы, приводя к их повышенному содержанию в крови.
Заболевания, при которых повышаются эозинофилы крови
Эозинофилия является характерным проявлением аллергических заболеваний и состояний, таких как:
- аллергический ринит и конъюнктивит;
- атопический дерматит;
- бронхиальная астма;
- пищевая аллергия и др.
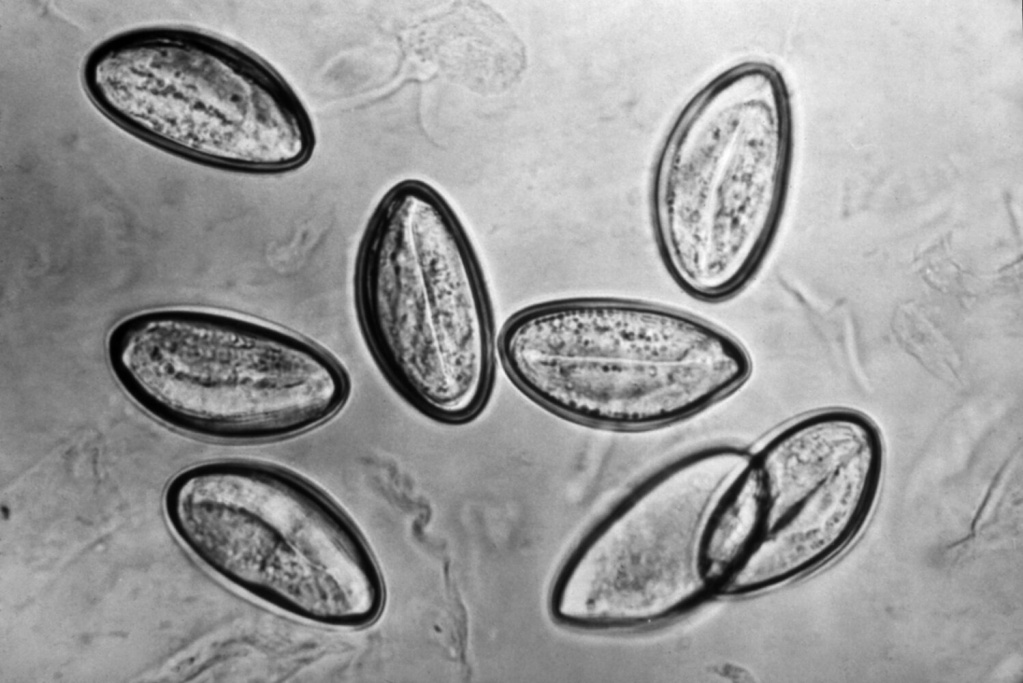
С одной стороны, эозинофилы обладают противопаразитарной активностью, за счет способности выделять эозинофильный катионный белок и активные формы кислорода, которые губительны для гельминтов. С другой стороны, продукты метаболизма гельминтов вызывают реакцию гиперчувствительности, для которой свойственны симптомы аллергии.
Следующая группа заболеваний, протекающих с повышением количества эозинофилов, - ревматологические патологии, или системные воспалительные заболевания соединительной ткани. Данные заболевания в абсолютном большинстве случаев являются аутоиммунными.
В основе аутоиммунных процессов лежит нарушение распознавания клетками иммунной системы собственных тканей, в результате чего они воспринимаются как чужеродные. Против них начинают вырабатываться антитела, и запускается воспалительный процесс.
Одним из аутоиммунных заболеваний, для которого характерна эозинофилия, является разновидность васкулита (воспаления сосудов) – эозинофильный гранулематоз с полиангиитом, или синдром Черджа–Стросса (воспаление мелких и средних кровеносных сосудов).
Эозинофилия может свидетельствовать о наличии в организме злокачественного процесса. Это связано с тем, что клетки злокачественных опухолей вырабатывают, среди прочего, вещества, стимулирующие образование эозинофилов. Так, эозинофилия является частым симптомом хронического миелолейкоза.
К каким врачам обращаться при эозинофилии
Эозинофилия не является самостоятельным заболеванием, но может быть признаком аллергических, аутоиммунных, инфекционных патологий.
Поэтому сначала можно обратиться к терапевту (врачу общей практики) или педиатру , если пациентом является ребенок. Зачастую данных, собранных в процессе опроса и клинического осмотра пациента, может оказаться достаточно для направления на прием к узкопрофильному специалисту. Так, при впервые выявленном аллергическом заболевании требуется консультация аллерголога-иммунолога, при гельминтозе - врача-инфекциониста, а при подозрении на аутоиммунный процесс – ревматолога.
Диагностика и обследование при эозинофилии
После тщательного сбора анамнеза и выявления ключевых фактов развития заболевания назначают лабораторные обследования.
Клинический анализ крови с определением лейкоцитарной формулы необходим для определения количества эозинофилов. В данном исследовании важно провести микроскопию мазка, которая позволяет не только достоверно подсчитать количество эозинофилов, но и выявить наличие в крови специфических клеток, характерных, например, для лейкоза и некоторых аутоиммунных заболеваний.
Синонимы: Общий анализ крови (ОАК); Гемограмма; КАК; Развернутый анализ крови. Full blood count; FBC; Complete Blood Count (CBC); Hemogram; CBC with White Blood Cell Differential Count; Peripheral Blood Smear; Blood Film Examination; Complete blood count (CBC) with differential white blood cell coun.
Читайте также:

