Энтеролизация эпителия что это такое
Обновлено: 25.04.2024
Актуальность проблемы. Язвенная болезнь (ЯБ) относится к числу наиболее распространенных заболеваний и является важнейшей медико-социальной проблемой. Болезнь поражает людей в активном, творческом возрасте, часто становясь причиной временной и стойкой утраты трудоспособности 1. Установление связи инфекции Helicobacter pylori (H.pylori) с гастродуоденальными заболеваниями (ГДЗ) позволила по-новому подойти к лечению ЯБ [9].
Уже почти 30 лет продолжается интенсивное изучение микроорганизма H. pylori. В 1997 г. были разработаны первые рекомендации Маастрихт-1, касающиеся диагностики инфекции, показаний для антихеликобактерной терапии [4, 30]. В дальнейшем в связи с получением новых данных о свойствах возбудителя, расширением спектра заболеваний были разработаны рекомендации Маастрихт-2 (2000) и Маастрихт-3 (2005) 5. Последний пересмотр основного документа произошел в 2010 г. (Маастрихт-4) [1].
Для лечения хеликобактериоза рекомендованы следующие схемы лечения 7:
-тройная стандартная терапия;
-квадротерапия без препаратов висмута;
-квадротерапия на основе препаратов висмута.
Современная фармакотерапия ЯБ включает различные группы лекарственных средств, действие которых направлено на основные звенья патогенеза ульцерогенеза. Однако эрадикационная терапия не предупреждает развития на месте язвенного дефекта рубцовой ткани, которая приводит к деформации стенки и стенозу 13. Поэтому, патогенетическое лечение должно включать мероприятия, направленные на ускорение репаративных процессов слизистой оболочки двенадцатиперстной кишки (СОДПК). Применяемые в настоящее время методы эндоскопического лечения направлены в основном на защиту поверхности язвы от воздействия агрессивных факторов пищеварительных соков и стимуляции процесса регенерации [15], но они технически сложны в выполнении, обременительны для пациентов и, также не исключают развития рубцовой деформации слизистой оболочки (СО).
Хеликобактерная теория ульцерогенеза не решила в полной мере вопросы профилактического и противорецидивного лечения ЯБ. Высокая частота рецидивов и осложнений предопределяет необходимость поиска препаратов, направленных на сокращение сроков рубцевания, улучшение качества регенерации, повышение защитных свойств СО гастродуоденальной зоны, не обладающих побочными эффектами, не вызывающих привыкания и экономически доступных для пациентов 16.
В течение многих лет в медицине успешно применяются протеолитические ферментные препараты (ПФП) [19,20]. В качестве альтернативы традиционным подходам энзимотерапия находит широкое применение при лечении заболеваний различной этиологии. Клиническими и экспериментальными исследованиями установлен широкий спектр их фармакологической активности. ПФП обладают противовоспалительным, дегидратационным, антикоагуляционным, репаративным и опосредованным антибактериальным свойствами 24. Среди них наибольшее распространение получили ферменты протеолитические, которые составляя систему протеолиза, играют существенную роль в таких важнейших биологических процессах, как обмен белков, свертывание крови, фибринолиз, иммунные реакции, регуляция артериального давления, процессы дифференциации и метаболизма соединительной ткани [25]. Ферменты выполняют важные защитные функции, обезвреживая как экзогенные, так и эндогенные токсические вещества [26].
Цель исследования - изучение процессов регенерации СО гастродуоденальной зоны при применении в комплексной терапии больных язвенной болезнью двенадцатиперстной кишки (ЯБДПК) препарата инзимол, полученного в результате иммобилизации бактериальных протеиназ на полиэтиленоксиде (ПЭО).
Материалы и методы исследования. В исследование были включены 105 больных с не осложненным течением ЯБДПК в стадии обострения. Среди них было 76 (72,4%) мужчин и 29 (27,6%) женщин в возрасте от 21 до 54 лет (средний возраст составил 32,2±2,8 года).
У больных ЯБДПК проводилось сравнительное изучение терапевтической эффективности эрадикационной и комбинированной терапии с применением ПФП инзимол. В зависимости от тактики лечения все больные были распределены с учетом таких факторов, как характер сопутствующей патологии, стадия заболевания, локализация язвы, что позволило провести сравнительную оценку сравниваемых параметров.
Дана оценка эффективности различных методов лечения. Все обследованные 105 больных ЯБДПК в соответствии с задачами исследования были рандомизированы на три группы.
I группа (n=50) больных - которым проводилась тройная стандартная терапия + дополнительно инзимол pеr os по 1 таблетке, содержащей 150ПЕ х 3 раза/день (курс лечения 10 дней);
II группа (n=26) больных, которым проводилась тройная стандартная терапия + дополнительно эндоскопические вливания инзимола по 150 ПЕ (в 10 мл дистиллированной воды) через день. Курс лечения составил в среднем 5 вливаний;
III группа - контрольная (n=29 больных), пролеченные только по тройной стандартной схеме эрадикации.
Для оценки структуры СО ДПК больных использовали морфологические методы исследования. Морфологические признаки оценивали по визуально-аналоговой шкале, предложенной Л.И. Аруиным.
На рис. 1-4 представлены морфологические изменения, обнаруженные в гистологических препаратах СОДПК обследованных больных:
1) отечность собственной пластинки, инфильтрация лимфоцитами, плазматическими клетками, единичными нейтрофилами; сгруппированные железы характеризуются расширенными протоками и плохой дифференцировкой клеток (рис. 1);
2) неравномерное утолщение ворсинок с булавовидными изменениями их дистальных отделов; дистрофия энтероцитов, полиморфно-клеточная инфильтрация стромы; деформация кишечных крипт; некрозы и местное слущивание покровного эпителия (рис. 2);
3) участки атрофии с кистозными расширениями крипт; инфильтрация лимфогистиоцитарными элементами; разрастание коллагеновых и мышечных волокон; деструкции базальных мембран эпителиальной выстилки (рис. 3);
4) изменения пилорических желез, местами окаймленные узкими темными полосками полулунной формы с расширенными протоками (рис. 4).
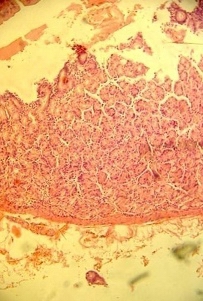
Рис. 1. Инфильтрация собственной пластинки СО. Окраска гематоксилин эозином. Увеличение х200
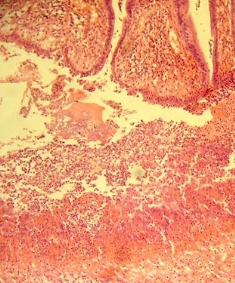
Рис. 2. Дистрофия энтероцитов, деформация кишечных крипт. Окраска гематоксилин эозин. Увеличение х200
Результаты проведенных эндоскопических исследований показали, что во всех 3-х изучаемых группах пациентов ЯБДПК выявлялись язвенный дефект различных размеров, изменения периульцерозной зоны с гиперемией, отеком, т.е. наблюдалось выраженное обострение заболевания. Визуальная картина воспалительного процесса была подтверждена морфологическим изучением биоптатов СОДПК. У всех обследованных выявлена различной степени активность дуоденита с характерными для ульцерозного процесса изменениями СОДПК и обсемененность инфекцией Н.рylori.
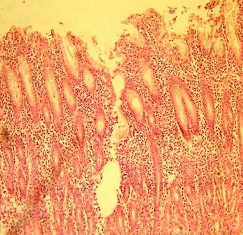
Рис. 3. Разрастание коллагеновых волокон, деструкция базальных мембран. Окраска гематоксилин эозином. Увеличение х200
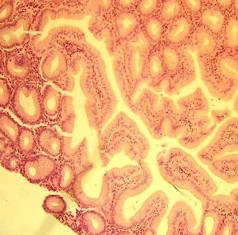
Рис. 4. Изменения пилорических желез. Расширение протоков желез. Окраска гематоксилин эозином. Увеличение х400
Результаты исследований. Динамика регенераторных процессов СО гастродуоденальной зоны при различных способах лечения: морфологический анализ прицельно взятых биоптатов показал, что после проведенного лечения, у больных I и II групп (у 92,7% и у 98,8% соответственно) отмечалась положительная динамика. Сравнительная характеристика структурных изменений СОДПК у исследуемых больных с разными методами лечения представлена в табл. 1.
Во II группе пациентов наблюдались более отчетливые изменения, характеризующие эффективность данного метода лечения. Признаки активного воспаления, фиброзирования, дистрофические, дисрегенераторные и атрофические изменения в СОДПК отсутствовали. Все показатели с высокой степенью достоверности отличались от начальных изменений. Ворсинки были покрыты энтероцитами со светлой цитоплазмой, хорошо выраженной щеточной каймой, в криптах обнаруживалось большое количество бокаловидных клеток.
Таблица 1. Морфологические изменения (%) у больных ЯБДПК с разными методами лечения (M±m)

Примечание: статистические различия с исходными данными (до начала лечения): *р
На микрофото представлены характерные морфологические изменения после лечения больных ЯБДПК ПФП инзимол, в сравнении с результатами больных, получавших только базисную эрадикационную схему терапии (рис. 5-8).
1) умеренная полиморфно-ядерная инфильтрация; энтеролизация в зоне язвенного дефекта с формированием эпителиального слоя (рис. 5);
2) формированием грануляционной ткани к центру язвенного дефекта (рис. 6);
3) лейкоцитарная инфильтрация в очагах энтеролизации; покровный эпителий некротизирован и слущен, изъязвление СО (рис. 7);
4) диффузный воспалительный инфильтрат; отек, диапедезные кровоизлияния; кишечные крипты деформированы, кистозно расширены (рис. 8).
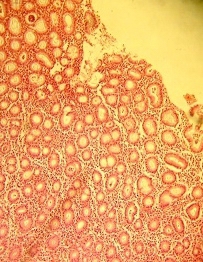
Рис. 5. Стадия заживления язвы. Окраска гематоксилин эозином. Увеличение х200
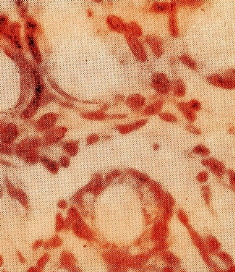
Рис. 6. Грануляционная ткань у края язвы. Окраска гематоксилин эозином. Увеличение х400
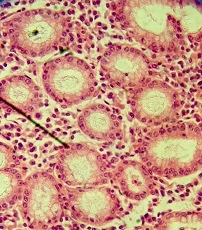
Рис. 7. Лейкоцитарная инфильтрация в очагах энтеролизации. Окраска гематоксилин-эозином. Увеличение х200
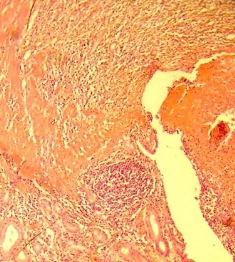
Рис. 8. Эпителий СО некротизирован и слущен, изъязвление. Окраска гематоксилин эозином. Увеличение х200
Проведенные в 3-х группах больных морфологические исследования подтвердили данные, полученные при эндоскопии. При применении инзимола исчезают или существенно уменьшаются признаки воспаления, дисрегенерации и дистрофии, происходит замещение дефекта грануляционной тканью.
Морфологические изменения СО в I и II группах больных приведены на рис. 5, 6. Морфологические изменения СО в III группе больных приведены на рис. 7, 8.
При проведении морфометрических исследований в гистологических препаратах биоптатов больных ЯБДПК до и после лечения разными методами, мы обращали внимание на толщину СО, как показателей дистрофии и дисрегенерации, на толщину подслизистого слоя ДПК (показатель выраженности инфильтративного процесса), а проводили подсчет слизистых клеток, отражающих восстановление процессов регенерации и защитных свойств СОДПК.
Морфометрические исследования показали, что у всех больных до лечения наблюдались выраженное уменьшение толщины СО до 876,2±37,1 мкм, и утолщение подслизистого слоя - до 274,5±14,7 мкм, которые с высокой степенью достоверности отличались от аналогичных показателей значений нормы (р
Таблица 2. Морфометрические показатели (M±m) СО

В стадии обострения у больных, по сравнению со значениями нормы, наблюдалось достоверное уменьшение размеров железистых трубочек (р<0,001) и уменьшение относительного количества слизистых клеток (р<0,01).
Сравнительный анализ морфометрических данных позволил установить, что у пациентов, пролеченных методом комплексной терапии с применением инзимола, наблюдается выраженная положительная динамика, проявляющаяся уменьшением воспалительных, дистрофических процессов, восстановлением регенерации и защитных свойств СО.
Заключение. Проведенные нами исследования морфологических и морфометрических параметров СО у больных в динамике позволили установить характер и распространенность воспалительно-дистрофических изменений, степень регенераторных нарушений, оценить состояние слизеобразования, провести сравнительную оценку эффективности проводимой терапии. Эти данные подтверждают противовоспалительные, противоотечные, регенераторные и цитопротекторные свойства ПФП инзимол. Эффективность инзимола в комплексной терапии больных ЯБДПК значительно выше, чем базисные эрадикационные схемы лечения.
Свойства ПФП очищать поверхность ран от фибрина и денатурированных белков являются перспективным при эндоскопическом лечении больных ЯБДПК. Скорость заживления язвенного дефекта при комплексном лечении обусловлены снятием фибринового налета и доступности к пораженной слизистой других препаратов. Препарат освобождает поверхность язвы от некротизированных клеток, фибрина, стимулирует процесс заживления.
Список использованных источников:
1. Циммерман Я.С. Гастроэнтерология. Руководство. 2012. 800 с.
2. Шептулин А.А. Современный алгоритм лечения язвенной болезни// Клин.мед. – 2004. - №1. – С.57-60.
3. Васильев Ю.В. Язвенная болезнь. Избранные главы клинической гастроэнтерологии/ Под ред.Л.Б.Лазебника.- М.:Анахарсис. – 2005. – С.82–112.
4. Лазебник Л.Б., Гусейнзаде М.Г., Ли И.А., Ефремов Л.И. Эпидемиология язвенной болезни желудка и двенадцатиперстной кишки// Тер.архив. – 2007. - №2. - С.12-15.
5. Щербинина М.Б. Континуум хеликобактерной инфекции как научное обоснование принятия клинических решений// Эксперимент. и клин. гастроэнтерол. 2005. №4. – С.20-26.
6. Chira C., Rovinaru I., Raducan L. Et al. Terapia de durata scurta in ulcerul duodenal// Rom.J. Gastroenterol. – 2001. - № 9. – Р. 81.
7. Ильченко А.А. Язвенная болезнь и Нelicobacter pylori - проблемы диагностики и лечения// Росс.гастроэнтерол журнал – 2000. - №3. – С.34-39.
9. Васильев Ю.В. Современная терапия язвенной болезни, ассоциируемой с Helicobacter pilori// Трудный пациент. – 2007. - №6. С.7-10.
10. Минушкин О.Н., Володин Д.В., Зверков И.В. Возраст и эрадикационное лечение язвенной болезни двенадцатиперстной кишки// Тер.архив, 2007. - №2. – С.23-26.
11. Калинин А.В. Язвенная болезнь: от патогенеза к лечению// Педиатрия, 2002. - №9(60). – С.14-18.
12. Ивашкин В.Т., Шептулин А.А., Баранская Е.К. и др. Рекомендации по диагностике и лечению язвенной болезни: метод.пособие для врачей. - М. – 2002. – 43с.
13. Грифанов И.Ф. Эндоскопическое применение натриевой соли ДНК в комплексном лечении гастродуоденальных язв: Автореф. … канд. мед. наук. - Уфа, 2008. - 24 с.
14. Малиновская Н.К. Мелатонин и язвенная болезнь: автореф. докт. мед.наук. – М., 1998. - 48с.
15. Буторов И.В., Николенко И.А., Бутуров С.И. Эффективность галавита у больных язвенной болезнью двенадцатиперстной кишки// Клин.мед. – 2005. - №8. – С.72-75.
16. Соколова Г.Н., Потапова В.Б., Комаров Б.Д.. Трубицына И.Е. и др. Роль местных факторов в хронизации язвенного процесса в желудке// Эксперимен. и клин. гастроэнтерол. - 2003. - №1. – С.109-110.
17. Kv S., Devi G.S., Mathew S.T. Liposomal formulations of serratiopeptidase: in vitro studies using PAMPA and Caco-2 models// Mol. Pharm.2008. - №5(1). – Р.92–97.
18. Maheshwari M., Miglani G., Mali A., Paradkar A., Yamamura S., Kadam S. Development of tetracycline-serratiopeptidase-containing periodontal gel: formulation and preliminary clinical study// AAPS PharmSciTech. - 2006. - №7(3). - Р.76.
19. Pant K.K., Das V., Grawal S.P., Singh A., Khattri S., Nath R., Nischal A., Dabholkar P. PARFLEX — a very useful drug for management of surgical pain// J. Indian Med. Assoc.. – 2008. - №106(6). – Р. 409–411.
20. Rawat M., Saraf S. Formulation optimization of double emulsification method for preparation of enzymeloaded Eudragit S100 microspheres// J.Microencapsul. – 2008. - №4. – Р.1–9.
21. Веремеенко К.Н., Коваленко В.Н. Системная энзимотерапия. Теоретические основы, опыт клинического применения. - Киев: Морион, 2000. - 320 с.
22. Березов Т.Т. Применение ферментов в медицине// Соросовский образоват. журн. - 1996. - №3. – С.23–27.
23. Selan L., Berlutti F., Passariello C.et al. Proteolytic enzymes: a new treatment strategy for prosthetic infections? // Antimicrob. Agents Chemother.- 1993. - №37(12). - Р.2618–2621.
24. Васильев Ю.В. Язвенная болезнь: патологические аспекты и медикаментозное лечение больных. // Consilium medicum. - 2002. - №2(прил). – С.4-10.
25. Modlin I.M., Sachs G. Acid related diseases. Biology and treatment. Schnetztor – Verlag GmbH D – Konstanz, 1998.- 368 p.
26. Steer H.W. Ultrastructure of cell migration through the gastric epithelium and its relationship to bacteria. // Clin. Pathol.- 1975.-№ 28.- Р. 39–46.
27. Marshall B.J., Warren J.R. Unidentified curved bacilli on gastric epithelium in active chronic gastritis (letter). // Lancet.-1983.-№2.- Р.1273–1273.
28. Goodwin C.S., Armstrong J.A., Chilvers T. Et al. Transfer of Campylobacter pylori and Campylobacter mustelae to Helicobacter gen.nov. as Helicobacter pylori comb.nov., respectively. // Int.J.Syst. Bacteriol.-1989.-№39.- Р.397-405.
29. Аруин Л.И., Капуллер Л.Л., Исаков В.А. Морфологическая диагностика болезней желудка и кишечника. -М.,1998. - 268 с.
30. Предварительный патент на изобретение № 13975. Способ лечения больных язвенной болезнью желудка и двенадцатиперстной кишки/ Сейдахметова А.А., Искаков Б.С.; опубл.15.12.2003. – 6 с.
Подписано в печать: 02.07.2013
Что такое дисплазия шейки матки? Причины возникновения, диагностику и методы лечения разберем в статье доктора Игнатенко Татьяны Алексеевны, гинеколога со стажем в 14 лет.
Над статьей доктора Игнатенко Татьяны Алексеевны работали литературный редактор Елена Бережная , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
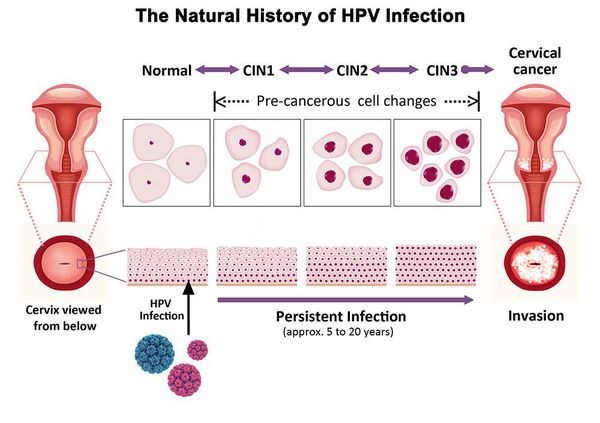
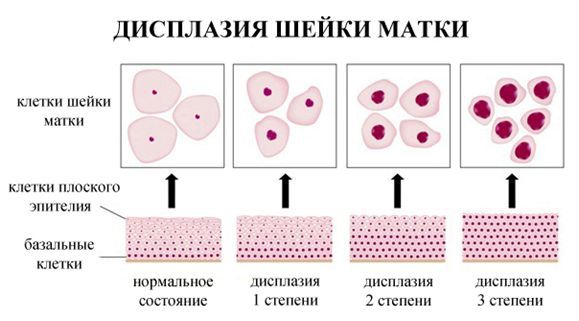
Дисплазия шейки матки, или цервикальная интраэпителиальная неоплазия (ЦИН), или Cervical Intraepithelial neoplasia (CIN) — это патологический процесс, при котором в толще клеток, покрывающих шейку матки, появляются клетки с различной степенью атипии (неправильного строения, размера, формы).
Причины дисплазии шейки матки
Папилломавирусная инфекция (ВПЧ) — основная причина дисплазии и рака шейки матки. К болезни приводит длительное персистирование именно ВПЧ высокого канцерогенного риска. У женщин с риском развития цервикальной неоплазии распространенность онкогенных типов ВПЧ чрезвычайно велика. ВПЧ становится причиной CIN 2-3 и рака шейки матки в 91,8% и 94,5% случаев соответственно. [1]
К факторам риска дисплазии шейки матки относится длительный приём контрацептивов и курение. Выявлена связь между пассивным курением среди некурящих и повышенным риском возникновения CIN 1. [3]
Другие факторы риска — раннее начало половой жизни, большое число и частая смена половых партнеров, употребление алкоголя, сопутствующие половые инфекции, много беременностей и родов. Риск цервикальной CIN 2 особенно высок у женщин, которые до этого имели опыт пересадки органов, у них выявлена ВИЧ-инфекция или они принимают иммунодепрессанты. [2]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы дисплазии шейки матки
Дисплазия шейки матки, как правило, имеет бессимптомное течение, поэтому пациентки не предъявляют никаких специфических жалоб.
Патогенез дисплазии шейки матки
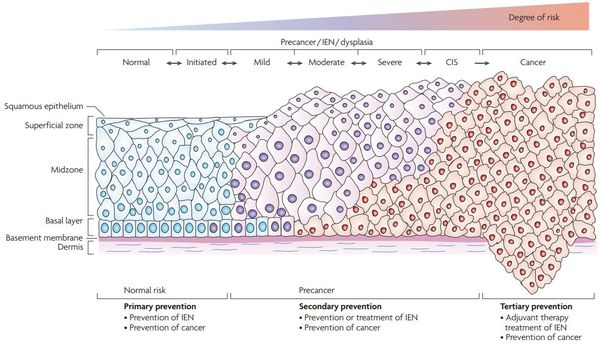
Критический фактор развития цервикальной интраэпителиальной неоплазии — инфицирование вирусом папилломы человека. Во многих случаях цервикальная интраэпителиальная неоплазия легкой степени отражает временную реакцию организма на папиломавирусную инфекцию и без лечения исчезает в течение полугода-года наблюдения. При цервикальной интраэпителиальной неоплазии умеренной и тяжелой степени высока вероятность встраивания вируса папилломы человека в клеточный геном. Инфицированные клетки начинают продуцировать вирусные белки E6 и Е7, которые продлевают жизнь клетки, сохраняя ее способность к неограниченному делению. Неизбежно формирующиеся на этом фоне мутации клеток ведут к формированию предрака (дисплазии) и рака шейки матки, влагалища и вульвы.
Онкогенные белки ВПЧ (Е6, Е7) взаимодействуют с регуляторными белками клеток шейки матки, приводя к повышению активности онкомаркера p16INK4A, что свидетельствует о неконтролируемом размножении клеток шейки матки. Таким образом, сверхэкспрессия p16INK4A, определяемая в материале шейки матки, который получают при биопсии, является биомаркером интеграции вируса папилломы человека высокого риска в геном и трансформации эпителиальных клеток под действием вируса, что делает эту информацию полезной при оценке прогноза развития предраковых и злокачественных поражений, связанных с инфицированием генитального тракта вирусом папилломы человека. [5]
Классификация и стадии развития дисплазии шейки матки
Для постановки цитологического диагноза (по результатам цитологического исследования соскобов шейки матки и цервикального канала с окрашиванием по Папаниколау (Рар-тест) или жидкостной цитологии) используется классификация Бетесда (The Bethesda System, 2014), основанная на термине SIL (Squamous Intraepithelial Lesion) – плоскоклеточное интраэпителиальное поражение. [10]
Выделяют три вида результатов соскобов с поверхности шейки матки (экзоцервикса):
- нормальные мазки, без изменений клеток шейки матки (NILM, Negative for intraepithelial lesion or malignancy);
- «непонятные» мазки без определенного значения, по которым нельзя определить характер поражения, однако они при этом не являются нормой (ASC-US, Atypical Squamous Cells of Undetermined Significance) или, что хуже, ASC-H, Atypical squamous cells cannot exclude HSIL, обнаружение атипичных клеток плоского эпителия, не исключающее SIL высокой степени);
- предраки низкой (LSIL, Low Grade Squamous Intraepithelial Lesion) и высокой (HSIL, High Grade Squamous Intraepithelial Lesion) степени.
Классификация Папаниколау
- 1-й класс — нормальная цитологическая картина (отрицательный результат);
- 2-й класс — изменение морфологии клеток, которое обусловлено воспалением во влагалище и (или) шейке матки;
- 3-й класс — единичные клетки с аномалией ядер и цитоплазмы (подозрение на злокачественное новообразование);
- 4-й класс — отдельные клетки с явными признаками озлокачествления;
- 5-й класс — много типично раковых клеток (злокачественное новообразование).
Существуют также гистологические классификации для оценки материала, полученного при биопсии.
По классификации R. M. Richart (1968) в зависимости от глубины поражения поверхностного клеточного слоя выделяют три степени дисплазии шейки матки:
- ЦИН 1 (дисплазия слабой степени) — признаки папилломавирусной инфекции (койлоцитоз и дискератоз). Поражение до 1/3 толщины клеточного пласта;
- ЦИН 2 (дисплазия средней степени) — поражена 1/2 толщины клеточного слоя;
- ЦИН 3 (дисплазия тяжелой степени) — поражение более 2/3 клеточного слоя. [8]
В приведенной ниже таблице даны соотношения классификаций предраковых поражений шейки матки. [9]
| Система Папаниколау | Описательная система ВОЗ | CIN | Терминологи- ческая система Бетесда (ТСБ) |
|---|---|---|---|
| Класс 1 (норма) | Отсутствие злокачественных клеток | Отсутствие неопластических изменений | Норма |
| Класс 2 (метаплазия эпителия, воспалительный тип) | Атипия, связанная с воспалением | Реактивные изменения клеток ASC: ASC - US, ASC - H | |
| Класс 3 ("дискариоз") | Слабая дисплазия | CIN 1 койлоцитоз | LSIL |
| Умеренная дисплазия | CIN 2 | HSIL | |
| Тяжелая дисплазия | CIN 3 | ||
| Класс 4 (клетки, подозрительные на рак или карцинома in situ | Карцинома in situ | ||
| Класс 5 (рак) | Инвазивная карцинома | Карцинома | Карцинома |
Осложнения дисплазии шейки матки
Последствия дисплазии шейки матки
Основное и самое опасное осложнение цервикальной интраэпителиальной неоплазии заключается в развитии рака шейки матки, любой случай развития которого — результат упущенных возможностей диагностики и лечения дисплазии шейки матки. [7]
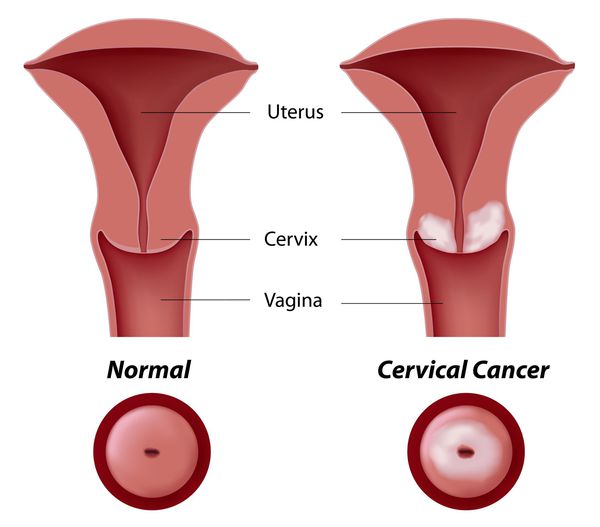
Проводились длительные, систематические исследования риска рака шейки матки у женщин с диагнозом цервикальной интраэпителиальной неоплазии 3 степени (CIN3) по сравнению с женщинами, у которых были нормальные цитологические результаты. Согласно полученным данным, долгосрочный относительный риск развития рака шейки матки зависит от различных гистологических типов CIN3 и выше всего он для аденокарциномы in situ. Даже через 25 и более лет после конизации (хирургического иссечения патологических тканей шейки матки) риск злокачественного перерождения клеток был значительным. [4]
Диагностика дисплазии шейки матки
Для ранней диагностики предраковых поражений шейки матки во многих странах мира существует система цервикального скрининга.
Методы диагностики дисплазии шейки матки
В России система цервикального скрининга включает последовательность действий:
- Цитологическое исследование: РАР-тест;
- ВПЧ-тестирование: в США и странах Евросоюза ВПЧ-тест применяется для первичного скрининга рака шейки матки (РШМ). В России его использование вариативно: при первичном скрининге в сочетании с РАР-тестом, в качестве самостоятельного теста, при ведении пациенток с неясными результатами РАР-теста (ASCUS) и для наблюдения паценток после лечения HSIL;
- Кольпоскопия: показаниями к исследованию являются положительные результаты РАР-теста (класс 2-5). Метод основан на осмотре шейки матки при помощи увеличивающих оптических систем и проведения диагностических проб с растворами уксусной кислоты и йода (Люголя). С помощью кольпоскопии определяют локализацию поражения, его размер, выбирают участок для проведения биопсии, определяют тактику лечения.
При кольпоскопии должна быть тщательно оценена зона трансформации (переходная зона стыка двух видов покровного эпителия шейки матки).
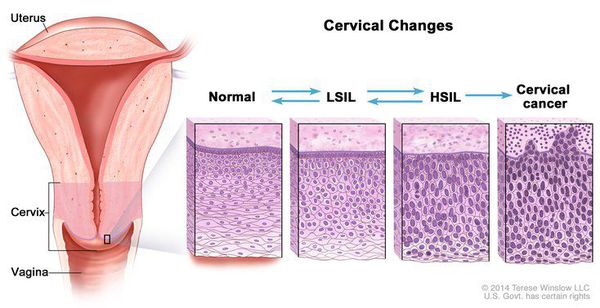
Влагалищная часть шейки матки (экзоцервикс) покрыта многослойным плоским эпителием. В канале шейки матки (цервикальном канале, эндоцервиксе) — цилиндрический эпителий. Место перехода цилиндрического эпителия цервикального канала в многослойный плоский эпителий поверхности шейки матки носит название зоны трансформации. Эта область имеет большое клиническое значение, поскольку именно в ней возникает более 80% случаев дисплазии и рака шейки матки.
- Зона трансформации 1 типа — переходная зона видна полностью. Это самый оптимальный и прогностически «благоприятный» вариант кольпоскопического заключения.
- Зона трансформации 2 типа — переходная зона частично скрыта в канале шейки матки. Адекватно оценить такую картину сложно, так как наиболее измененные участки могут быть не видны и пропущены.
- Зона трансформации 3 типа — переходная зона находится глубоко в канале шейки матки и оценить её кольпоскопически невозможно. Кольпоскопия в этом случае считается неинформативной, поскольку глубина залегания патологического очага остается неизвестной.
- Биопсия: прицельная или расширенная биопсия (конизация) всегда должна выполняться под контролем кольпоскопии. Выбор метода биопсии зависит от типа поражения, возраста пациентки и зоны трансформации. Важной информацией, которую дает биопсия, является возможность иммуногистохимического определения маркера ранней диагностики дисплазии с высокой степенью риска озлокачествления: p16INK4a.
Лечение дисплазии шейки матки
Динамическому наблюдению подлежат молодые пациентки (до 35 лет) с LSIL (ВПЧ, ЦИН 1, ЦИН 2, если при биопсии не обнаружен белок р16, являющийся признаком проникновения ВПЧ высокого риска в геном и трансформации опухолевых клеток под действием вируса). Наблюдать возможно пациенток только с 1 и 2 кольпоскопическим типом зоны трансформации.
Контрольные осмотры, цитологическое и ВПЧ-тестирование показаны через 6 и 12 месяцев после первичного обнаружения патологии.
Хирургическое лечение дисплазии
При выявлении HSIL (ЦИН 2 c обнаружением белка р16 при биопсии, ЦИН 3) неизбежно хирургическое лечение в виде абляции («прижигания») или эксцизии (удаления) поврежденной ткани. Для абляции используют электро-/радио-, крио- и лазерные воздействия. Эксцизия возможна электро-/радиоволновая или ножевая.
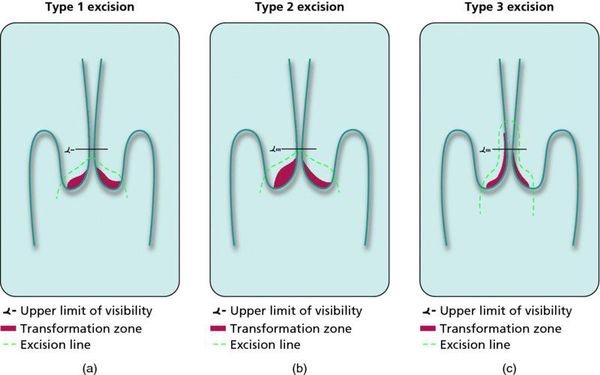
Немаловажно, что при выявлении по кольпоскопии 3 типа зоны трансформации на фоне положительного РАР-теста гинеколог обязан провести выскабливание слизистой канала шейки матки и/или широкую эксцизионную биопсию (конизацию шейки матки) для исключения опухолевого процесса, потенциально располагающегося вне зоны кольпоскопического обзора. Немаловажно наблюдение после операции через 6 и 12 месяцев с выполнением цитологического соскоба и ВПЧ-теста.
Следует отметить, что процедура хирургического иссечения патологических тканей на шейке матки увеличивает риск преждевременных родов. А сама по себе цервикальная интраэпителиальная неоплазия первой степени на течении беременности и родов никак не отражается и зачастую опасности не представляет. [12]
Средний возраст женщин, когда может потребоваться хирургическая коррекция цервикальной внутриэпителиальной неоплазии — около 30 лет. Хирургическое лечение нередко ассоциировано с неблагоприятным течением последующей беременности. Частота и тяжесть неблагоприятных осложнений возрастают с увеличением глубины иссекаемых тканей. [13]
Реабилитация после хирургического лечения
В течение месяца после операции следует воздержаться от спринцеваний, половых контактов и не пользоваться тампонами. На 2–3 недели исключают тяжёлые физические нагрузки и тепловые процедуры. Незначительные сукровичные выделения, усиливающиеся иногда до менструальноподобных, в течение 10–20 дней после операции — это нормальное явление.
При реабилитации после хирургического лечения шейки матки эффективны препараты, содержащие антисептик и стимулятор регенерации эпителия.
После лечения возможен рецидив, поэтому необходимо пожизненное наблюдение: цитологический мазок через 6 и 12 месяцев после операции, затем раз в год в течение 10 лет, далее раз в 3 года.
Планировать беременность после операции на шейке матки можно не ранее, чем через 3–6 месяцев. Эти сроки будут зависеть от глубины эксцизии или конизации и длины шейки матки [9] .
Лечение дисплазии при беременности
В большинстве случаев лечение должно быть отложено на послеродовый период. При беременности на фоне дисплазии шейки матки каждые три месяца проводится кольпоскопический и цитологический контроль. При выявлении рака шейки матки пациентку консультирует онкогинеколог. Доктор подбирает тактику лечения, может потребоваться прервать беременность по онкологическим показаниям [9] .
Прогноз. Профилактика
Дополнительными факторами риска прогрессирования ПВИ с формированием предраковой патологии являются:
- курение;
- длительное использование гормональных контрацептивов;
- многократные травматичные роды;
- ВИЧ-инфекция.
- У пациенток с ЦИН часто обнаруживают вирус простого герпеса 2 типа, цитомегаловирусную инфекцию, хламидийную урогенитальную инфекцию, бактериальный вагиноз, ассоциированный с резким снижением или отсутствием вагинальной лактофлоры, повышенным ростом во влагалище Gardnerella vaginalis и Atopobium vaginae, повышение концентрации в бакпосеве грибов рода Candida, Mycoplasma hominis.
Устранение и профилактика данных факторов способны снизить вероятность развития предраковой патологии шейки матки.
Рак шейки матки поражает преимущественно женщин репродуктивного возраста. Скрининг является важной стратегией вторичной профилактики. Длительный процесс канцерогенной трансформации от появления в организме вируса папилломы человека (ВПЧ) до инвазивного рака дает широкие возможности для выявления заболевания на стадии, когда лечение высокоэффективно. Подходящими скрининговыми тестами в мире признаны цитологическое исследование, визуальный осмотр после применения уксусной кислоты и тесты на выявление ВПЧ. Всемирная организация здравоохранения рекомендует проводить скрининг женщин по крайней мере один раз в жизни в возрасте от 30 до 49 лет. [14]
Согласно приказу Министерства здравоохранения РФ от 03.02.2015. N36ан "Об утверждении порядка проведения диспансеризации определенных групп взрослого населения", осмотр со взятием мазка (соскоба) с поверхности шейки матки и цервикального канала на цитологическое исследование производится 1 раза в 3 года для женщин в возрасте от 21 года до 69 лет включительно.
Хроническое воспаление слизистой оболочки желудка на фоне нерационального питания, злоупотребления алкоголем и приема отдельных групп лекарственных медикаментов, со временем может привести к развитию кишечной метаплазии. Чаще всего заболевание диагностируется у людей средней возрастной группы и пожилых пациентов. Эта патология сопровождается характерными клиническими симптомами и негативно отражается на общем состоянии человека.
Что такое метаплазия
В основе этого заболевания лежит планомерная атрофия эпителия слизистой оболочки желудка, с последующим его замещением на эпителий толстого или тонкого кишечника. Изменённая слизистая оболочка начинает выполнять функции того органа, к которому оно принадлежит по факту. Таким образом, желудок теряет свои функции как орган пищеварения со всеми вытекающими последствиями. Метаплазия относится к редким патологиям пищеварительной системы, при этом не является самостоятельным заболеванием, а возникает только при длительном хроническом повреждении слизистой оболочки органа на фоне воспалительного процесса. Это заболевание несет прямую угрозу не только здоровью, но и жизни человека. Несмотря на это, своевременная диагностика и комплексное лечение дают все шансы на полное выздоровление.
Виды метаплазии
В гастроэнтерологии выделяют такие разновидности кишечной метаплазии или атрофии:
- Толстокишечная (незрелая или неполная). Эта разновидность метаплазии наиболее опасна для человека, так как её появление сопровождается риском злокачественного перерождения.
- Тонкокишечная (зрелая или полная). По сравнению с предыдущим вариантом, эта разновидность метаплазии не сопровождается риском перерождения в онкологию.
Кроме перечисленных двух видов, может развиваться и смешанный вариант кишечной метаплазии слизистой, при котором в желудке обнаруживаются клетки эпителия как толстого, так и тонкого кишечника.
По степени распространённости выделяют такие формы метаплазии:
- Выраженная. Более 20% поверхности стенок желудка содержит клетки эпителия кишечника.
- Умеренная. Площадь поражения желудка составляет не более 20%.
- Слабовыраженная. В данном случае, кишечный эпителий покрывает не более 5% площади желудка.
Существует также классификация данного заболевания по характеру распространения. Выделяют такие разновидности метаплазии:
- Диффузная. Местом локализации патологических изменений является антральный и пилорический отделы желудка. По мере прогрессирования болезни, клетки кишечного эпителия могут обнаруживаться в фундальном отделе органа.
- Очаговая. Эта форма заболевания характеризуется локальным изменением клеточного состава оболочки желудка в антральном и пилорическом отделах. Этот процесс развивается на фоне нарушения механизма естественного обновления клеток, а также при длительном вялотекущем воспалительном процессе.
Абсолютная тонкокишечная метаплазия
Эта форма метаплазии характеризуется появлением клеток эпителия тонкого кишечника по всей площади желудка. Характерным признаком абсолютной тонкокишечной метаплазии является появление клеток Панета. По структуре и функциональным особенностям, желудок полностью напоминает тонкий кишечник. Эта форма метаплазии чаще сопровождается хроническим гастритом.
Частичная толстокишечная метаплазия
Для этой формы заболевания не характерно появление клеток Панета, но при этом наблюдается появление эпителиальных клеток, которые выстилают внутреннюю поверхность толстого кишечника. При толстокишечной метаплазии может нарушаться процесс дифференцирования и созревания клеток, что указывает на высокую вероятность образования злокачественной опухоли.
Причины возникновения
Первопричины развития данного состояния до конца не установлены, но существует ряд предрасполагающих факторов, которые могут спровоцировать развитие метаплазии. К таким факторам можно отнести:
- хронический вялотекущий воспалительный процесс в желудке;
- инфицирование желудка бактерией Хеликобактер Пилори; .
Клинические симптомы
Для каждой формы метаплазии характерны свои симптомы, но существует ряд признаков, которые указывают на развитие данного состояния. К таким признакам относят:
- частичная или полная утрата аппетита;
- расстройства кишечника;
- приступы тошноты, эпизоды рвоты;
- боль и дискомфорт в подложенной области;
- повышенная или пониженная кислотность желудочного сока;
- отрыжка с кислым или горьким привкусом.
Диагностика
Наиболее информативным методом диагностики метаплазии является фиброгастродуоденоскопия, с помощью которой удается не только обнаружить патологически измененные очаги на стенках желудка, но и взять образец биоматериала для последующего гистологического анализа. В отдельных случаях применяется методика гастроскопии с использованием контраста (хромогастроскопия). В качестве окрашивающего вещества используется метиленовый синий.
Лечение
Комплексное лечение включает использование безоперационных и хирургических методов. Лечение назначается индивидуально, при этом во внимание берутся такие факторы, как возраст пациента, результаты обследования и наличие сопутствующих заболеваний. Медикаментозное лечение может включать прием таких групп лекарственных медикаментов:
- ингибиторы протонной помпы;
- антибактериальные средства широкого спектра действия;
- обволакивающие средства;
- антациды;
- блокаторы Н2 гистаминовых рецепторов.
При кишечной метаплазии желудка очень важно позаботиться о нормализации микрофлоры, так как при нарушении баланса микроорганизмов в желудке и кишечнике страдает не только иммунитет, но и подрывается здоровье всего ЖКТ. Свою эффективность в восстановлении кишечной и желудочной микрофлоры доказал метапребиотик Стимбифид Плюс, содержащий натуральную питательную среду для полезных микроорганизмов, обитающих в просвете ЖКТ. Стимбифид Плюс не только восстанавливает нормальный баланс бактерий при хроническом гастрите, но и ускоряет процесс восстановления эпителия желудка, препятствуя дальнейшему прогрессированию метаплазии.
Владимир Трофимович Ивашкин, академик РАМН, доктор медицинских наук:
– Пришло время для выступления Алексея Владимировича Кононова из Омска.
Алексей Владимирович Кононов, профессор:
– Дорогие коллеги, мы сегодня поговорим с вами о взаимоотношениях специалистов в таком сложном деле, как канцерпревенция и курации пациентов с предраковыми состояниями и предраковыми изменениями. Центральной проблемой канцерпревенции стоит проблема атрофии слизистой оболочки, которая является феноменом, располагающимся между собственно воспалительными изменениями слизистой оболочки желудка и предраковыми изменениями, которые вот Сергей Владимирович Кашин блестяще демонстрировал и называл дисплазией эпителия. Мне больше нравится термин «неоплазия», который подчеркивает необратимость этих процессов даже в виде низкой степени градации неоплазии. Таким образом, и у патологоанатома, и у клинициста встает один вопрос – это идентификация, детекция атрофии слизистой оболочки желудка и интерпретация этого заключения.
Что делать, когда термин «атрофия», «атрофический гастрит» появляется в патологоанатомическом заключении? На сегодняшний день как будто бы проблем с этим нет. Существует основной классификационный вариант для оценки атрофии слизистой оболочки – это модифицированная сиднейская система, где в визуально-аналоговой шкале эти состояния ранжированы на уровни: нет атрофии, слабая, умеренная, выраженная, как в теле, так и в антральном отделе желудка. Но проблема состоит вот в чем. Проблема состоит в том, что для точной идентификации атрофии даже по модифицированной сиднейской системе необходим не один фрагмент слизистой оболочки, не два фрагмента, а 5 фрагментов, взятых по протоколу: по большой и малой кривизне тела желудка, в области угла желудка и по большой и малой кривизне в антральном отделе желудка. Больше того, когда в 2008 году мы получили новую классификацию хронического гастрита, где атрофия и воспаления оцениваются как интегральные понятия на уровне целого органа, то это взятие биоптата из 5 точек является просто необходимой процедурой, без которой система, которая получила название OLGIM, просто не работает.
Вот это визуально-аналоговая шкала, отечественный вариант ее. По уровню абсцисс и ординат пиктограммы изменения слизистой оболочки – слабая, выраженная, умеренная атрофия в теле, в антральном отделе, а на перекрестии стадия, выраженность на уровне целого органа атрофических изменений. Точно так же построена шкала для оценки воспалительных изменений, которые называются степенью гастрита, там тоже пиктограммы. Смотрите, вот это воспалительный инфильтрат, причем здесь интегрально и нейтрофильные лейкоциты, и мононуклеары, которые, по сути, собой представляют воспалительный ответ слизистой оболочки, и мукозальный иммунитет одновременно. Проблема состоит в том, что появилось новое понимание атрофии слизистой оболочки. Это не просто уменьшение объема желез в теле и антральном отделе, но и замена их метаплазированным эпителием. Это так называемая метапластическая атрофия, и вот ее место в каскаде Пелайо Корреа. Причем сам, кстати, Пелайо Корреа очень положительно относится к этому термину и идентификации кишечной метаплазии с оценкой вместе с атрофией слизистой оболочки. Проблема возникает в другом. Иногда воспалительный инфильтрат настолько раздвигает желудочные железы, что возникает феномен так называемой неопределенной атрофии.
Вот давайте полечим больного, воспалительный инфильтрат рассосется частично в результате апоптоза воспалительных клеток, частично в результате миграции по лимфатическим сосудам, межтканевым щелям и так далее, а потом мы посмотрим. Но если выраженная кишечная метаплазия, то она никуда не исчезнет. Эксперты Маастрихт-4 считают, что метаплазия не подвергается обратному развитию, поэтому вот понимание кишечной метаплазии приобрело некоторое такое мистическое направление. Вдобавок она еще разработана по типам – полная, неполная метаплазия, тонкокишечная, толстокишечная, тип IIA, IIВ и так далее. Все это приводит к тому, что появляются мысли: а не является ли собственно кишечная метаплазия прекурсором, предшественником рака желудка кишечного типа? Ну, по этому поводу написаны горы статей и сломаны многочисленные копья, на сегодняшний день все упирается в Кохрановский обзор от сентября прошлого года. Доказательных, совершенно выстроенных по критериям медицины, основанной на доказательствах, исследований в отношении того, что кишечная метаплазия предрак, нет, поэтому давайте прислушаемся к личному мнению Дэвида Грэхема, который высказывается, как всегда, четко, ясно и совершенно понятно: кишечная метаплазия на сегодняшний день – это надежный показатель атрофии слизистой оболочки. Есть кишечная метаплазия – значит, есть атрофия слизистой оболочки.
Вот здесь вот слева обозначены изменения, которые находит врач эндоскопической диагностики и патологоанатом в своем заключении, а справа написано, что должен делать клиницист с пациентом. Определены дефиниции, что такое неоплазия, что такое неоплазия низкой степени, что такое неоплазия высокой степени. Мы можем просто посмотреть, пока я говорю, следующие слайды. Пожалуйста, следующий, еще следующий слайд. Неопределенная неоплазия. Вот так же, как неопределенная атрофия, так и неопределенная неоплазия – то ли это изменения регенеративные, то ли это уже действительно опухолевый процесс. А вот здесь интересная работа, которая опубликована в прошлом году в американском журнале «Клинические патологии», которая нас призывает интегрировать два этих представления – атрофию слизистой оболочки и неопластические изменения. Вот когда мы сумеем интегрировать оба этих понятия в своих заключениях, мы сможем дать точный прогноз. Я хотел бы подчеркнуть, что опухолевые изменения клеток слизистой оболочки желудка возникают не в воздухе, они возникают на фоне и в сочетании с атрофическими изменениями слизистой оболочки вообще.
Какие возможны утешения? Только ли наблюдать? Только ли брать биопсии и ставить диагноз? Сегодня мы знаем новые молекулярные клеточные мишени, открывшиеся сравнительно недавно для хорошо известного препарата на основе ионов висмута. Ну, во-первых, антиоксидантное свойство висмута. Свободные радикалы нейтрофильных лейкоцитов, возникающие при кислородном взрыве в них, нарушают ДНК стволовых клеток слизистой оболочки желудка до уровня двунитевых разрывов. Эти двунитевые разрывы подвергаются репарации, но при этом возникают мутации, накопление которых может закончиться канцерогенезом. Таким образом, препараты висмута в условиях воспалительной инфильтрации слизистой оболочки защищают ДНК, предотвращают процесс маргинализации. Это вторичная профилактика. Опять же, ионный эффект висмута великолепно продемонстрирован в попытке создания нового препарата, где висмут будет в составе растворимого соединения, и ионная активность его будет повышаться.
2 года назад Нобелевскую премию получили молекулярные биологи за изучение серпантинных рецепторов и G-белков, которые являются регуляторными путями клетки. Оказывается, в них вмешивается висмут и запускает в стволовых клетках пролиферативный стимул, и проводя эрадикацию с помощью солей висмута мы попутно решаем и вторую задачу – мы мобилизируем и стимулируем местные стволовые клетки в слизистой оболочке желудка, и если не устраняем атрофию, то по крайней мере препятствуем ее обратному развитию. Что еще появилось нового в отношении ионов висмута как фармакопрепаратов? Появились следующие результаты. Это работа, которая известна пока еще только в препринте, январский номер, она еще не вышла. О чем говорит препринт? Культура ткани и ионы висмута. Оказывается, ионы висмута обладают меньшей степенью повреждения бактериальной клетки Helicobacter рylori, нежели висмут металлический, который нанесен в виде монослоя, атомарный висмут, на носители, которые взаимодействуют с бактериальной клеткой. Нанотехнологии и антибактериальный эффект препаратов висмута – это новое.
Давайте обсудим клинический пример. Пациенту 55 лет, с диспептическими жалобами, выполнена эндоскопическая биопсия слизистой оболочки желудка. Что получил патологоанатом и что он написал? «Два фрагмента слизистой оболочки – тело и антральный отдел». Я хочу обратить ваше внимание – два фрагмента. Дальше патологоанатом по классификационной схеме, модифицированной сиднейской системе описывает ситуацию. Все очень правильно, в каждом кусочке, и он определяет изменения в теле и антральном отделе желудка. Что должен делать клиницист, получив такое заключение? Ну, прежде всего, принять, что верифицирован Helicobacter-ассоциированный атрофический гастрит. Очень хорошо. Затем он должен отметить про себя, что идентифицировать стадию по системе OLGA и. соответственно, риск рака желудка невозможно. О чем еще должен подумать клиницист? Он должен подумать, что, конечно, риск рака желудка есть, особенно если это атрофия у пациента старше 50 лет, но риск не определен. Затем он должен выполнить наверняка эрадикационную терапию, а вот уже когда он будет выполнять контрольное эндоскопическое исследование через 4 недели после окончания эрадикационной терапии, то тут необходимо, просто необходимо взять 5 биоптатов из совершенно точно по протоколу указанных точек и определить стадию атрофии по системе OLGA. Вот так это все выглядит в идеале, а вот так это выглядит в только что рассматриваемом примере, причем это обычная практика.
Давайте посмотрим, как это выглядит вообще на популяционном уровне. Вот посмотрите, 20 тысяч гастробиоптатов от 9 тысяч пациентов, и только 4% исследований могут быть оценены с позиции определения риска рака желудка 3-й, 4-й стадии по классификации OLGA. Давайте посмотрим, что в Америке происходит. Роберт Максимилиан Гента, известный патологоанатом-гастроэнтеролог, эксперт ВОЗ по опухолям пищеварительного тракта, проделал точно такое же исследование, что проделали мы, только в 20 раз больше, там было 400 тысяч биоптатов. Но он получил тот же самый процент: только 4% пригодны для оценки риска рака желудка по современной классификации. Второй клинический пример. У пациента 45 лет при эндоскопическом исследовании верифицирован видимый участок изменений в виде площадки 0,5х0,7 см, из которого взят биоптат. Что пишет патологоанатом? Один биоптат. Патологоанатом пишет: «Морфологические признаки очаговой эпителиальной дисплазии/неоплазии, – ну, «дисплазия» и «неплазия», как мы с вами договорились, это термины-синонимы, – низкой степени (тубулярная аденома с неоплазией низкой степени)».
О чем должен думать клиницист? Не сговариваясь с Сергеем Владимировичем, мы обсудили эту ситуацию, поэтому я могу только прокомментировать. Ну, прежде всего, принять наличие у пациента предопухолевого состояния или даже предопухолевого заболевания. Затем необходимо отметить, что степень риска развития рака желудка определить невозможно. Во-первых, один фрагмент. Взятый рядышком фрагмент может показать дисплазию/неоплазию высокой степени, а еще третий может показать инвазивную карциному. Значит, весь объем образования должен быть представлен достаточно репрезентативно при повторных биопсиях, если нет возможности выполнить мукозальную резекцию так, как это написано в Европейских рекомендациях по предраковым состояниям. Ну, и, наконец, что делать врачу-гастроэнтерологу или терапевту в данной ситуации? Он должен, по крайней мере, заказать повторное исследование для того, чтобы взять биоптаты из визуально измененного участка, а также обязательно 5 биоптатов по системе OLGA для того, чтобы точно определить риск рака желудка у пациента.
И последний пример. Пациенту 55 лет с хроническим Helicobacter-ассоциированным гастритом, выраженной атрофией (стадия III) – должен отметить, риск рака желудка априори увеличен в 5-6 раз по сравнению с популяцией – выполнена успешная эрадикационная терапия. Эндоскопическое исследование через 4 недели после окончания терапии имеет следующий результат. Взяты 5 фрагментов по схеме. Вот это картинки, которые мы с вами рассматриваем в микроскоп. Это пластическая атрофия в антральном отделе, но что нас особенно взволновало – это то, что спустя месяц после окончания эрадикационной терапии в собственной пластинке слизистой оболочки в инфильтрате сохранились нейтрофильные лейкоциты. А мы с вами уже договорились, чем чреват кислородный взрыв нейтрофильных лейкоцитов, и это атрофический гастрит, кстати говоря.

Как известно, H.Pylori приводит к длительной инфильтрации слизистой оболочки желудка воспалительными клетками, что в свою очередь ведет к атрофии желез и кишечной метаплазии (КМ). Последняя связана с высоким риском развития дифференцированного рака желудка кишечного типа. В связи с этим, выявление данной предраковой патологии, наряду с атрофией, является крайне важным пунктом диагностической эзофагогастродуоденоскопии.
Если при осмотре в белом свете (WLI) на слизистой оболочке желудка визуализируются белесовато-серые, бледно-розовые, плоские или выступающие в просвет участки слизистой оболочки с шероховатой поверхностью, то врач-эндоскопист может заподозрить наличие кишечной метаплазии.
Однако эти признаки имеют низкую чувствительность, специфичность и установка диагноза КМ не возможна только по данным эндоскопии в белом свете и требует гистологического подтверждения.
С развитием высоких эндоскопических технологий, таких как увеличительная эндоскопия и эндоскопия с осмотром в узком спектре, чувствительность выявления участков КМ значительно повысилась.
В 2006 году, японские коллеги N.Uedo et al., в городе Осака установили высокоспецифичный признак КМ при осмотре в узком спектре и назвали его light blue crest (LBC) (дослов. «светло голубой гребень»). Это явление возникает при отражении узко-полосного света с центральной длиной волны 450нм от щеточной каемки кишечного метаплазированного эпителия. В настоящее время этот признак известен всему миру, как надежный в отношении эндоскопической диагностики КМ.
В последующем японскими учеными был обнаружен еще один признак, который также часто встречался на метаплазированной слизистой при хроническом гастрите и в области эпителия аденом и карцином. Он был назван white opaque substance (WOS) (дослов. «белесоватая матовая субстанция (вещество)»). Путем гистопатологических исследований они обнаружили, что эти субстанции содержат большое количество микроскопических липидных частиц, которые накапливаются в эпителии при опухолях и КМ. Липидные частицы отражают и рассеивают проецируемый свет, образуя белесоватое вещество на поверхности и делая непрозрачной субэпителиальную сосудистую сеть.
В дальнейших наблюдениях они изучили существование WOS на метаплазированной слизистой оболочке желудка без признаков LBC, используя для осмотра увеличительную узкоспектральную эндоскопию.
В исследовании, опубликованном в статье от 2017г. T.Kanemitsu, K.Yao, T.Nagahama было доказано, что признаки LBC и WOS являются полезными маркерами кишечной метаплазии слизистой желудка при хроническом атрофическом гастрите. Всего было обследовано 40 пациентов с июля по декабрь 2014 года. Главной конечной точкой этого исследования была оценка диагностической эффективности увеличительной узкоспектральной эндоскопии для гистологически подтвержденной кишечной метаплазии слизистой с положительными WOS и LBC.
Читайте также:

