Эндометрия матки при герпесе
Обновлено: 28.04.2024
При лечении ХЭ необходимо учитывать все звенья патогенеза заболевания, поэтому оно должно быть комплексным, последовательным, этиопатогенетическим и контролируемым.
1. Прежде всего, необходимо элиминировать имеющихся возбудителей бактериальной инфекции. При наличии микозов или бактериального вагиноза, целесообразно проводить первостепенное лечение этих патологических состояний, которые затрудняют терапию любого воспалительного процесса.
Эффективным средством для лечения вагинального кандидоза (ВК) является пимафуцин (натамицин) – противогрибковый антибиотик полиенового ряда, обладающий фунгицидной активностью в отношении различных видов грибов рода Candid. Он применяется в виде крема, вагинальных свечей и таблеток для перорального применения. При остром ВК достаточно назначения пимафуцина по 1 свече на ночь в течение 6 дней. При хроническом течении ВК оптимально использовать комбинированную терапию: пимафуцин по 1 свече на ночь и пимафуцин в таблетках 2-4 раза в сутки в течение 6-9 дней. Следует отметить, что таблетированные формы пимафуцина не обладают системным действием, а лишь способствуют элиминации грибов из кишечника, поэтому их можно применять и во время беременности. Пимафуцин обладает высокой эффективностью. Достигающей 96%, отсутствием способности вызывать резистентность у различных видов грибов и отсутствием побочных эффектов.
Бактериальный вагиноз (БВ) при подготовке к беременности необходимо лечить даже при отсутствии клинических проявлений. Высокой эффективностью в терапии этого патологического состояния обладает трихопол, действующий преимущественно на анаэробную флору, гарднереллы, доминирующие при БВ, а также трихомонады. Трихопол применяется в виде вагинальных таблеток (500мг) и таблеток для перорального применения (250 мг). Трихопол легко проникает в одноклеточные организмы (простейшие, бактерии), вызывая нарушение структуры ДНК, действует на Trichomonas vaginalis, Lamblia intestinalis, Entamoeba histolytica, Balantidum col. Он активен в отношении некоторых аэробных грамотрицательных бактерий (гарднерелла), грамотрицательных и грамположительных бактерий (стрептококки, клостридии), а также простейших (трихомонады).
В настоящее время широко используются вагинальная форма трихопола. Преимуществами ее являются высокая эффективность при отсутствии отрицательного влияния на микрофлору влагалища, т.к. он не подавляет продукцию и функцию лактобацилл. Оптимальным является комбинированный прием трихопола: сочетание перорального и интравагинального путей введения препарата, что позволяет уменьшить дозу перорального трихопола и, следовательно, частоту побочных реакций. Стандартная схема применения трихопола: 1 вагинальная таблетка 1 раз в сутки в течении 7 –10 дней, в сочетании с пероральным приемом трихопола по 1 таблетке 2 раза в день.
Согласно международным рекомендациям CDC, для лечения БВ эффективна так же схема: внутрь метронидазол 500 мг 2 раза в сутки или клиндамицин 300 мг 3 раза в сутки в течение 7 дней и во влагалище клиндамицин-крем 2%-5 г 1 раз в сутки в течение 3-7 дней или клиндамицин свечи 100 мг 1 раз в сутки в течение 7 дней или метронидазол-гель 0,75% 5,0г 2 раза в сутки в течение 5 дней.
В клинической практике хорошо себя зарекомендовал вагинальный крем клиндацин, содержащий клиндамицина фосфат, который активен в отношении всех микроорганизмов, вызывающих бактериальный вагиноз и неспецифические вагиниты. Клиндацин хорошо переносится, назначается коротким курсом. Высокая эффективность клиндацина обеспечивается как действующим началом, так и особенностями основы, в состав которой входит полиэтиленоксид (ПЭО), оказывающий дегидратирующее действие, а также натрия бензоат, обладающий антимикотическим действием.
Терапия бактериальных инфекций предполагает назначение антибиотиков широкого спектра действия и высокой способностью проникновения в клетку. Таким требованиям более всего удовлетворяют макролиды последнего поколения. Среди них наибольшей эффективностью в отношении всех видов хламидий, микоплазм и других возбудителей обладает вильпрафен (джозамицин). Он назначается по 500 мг 3 раза в день в течение 10 дней. Он легко проникает через биологические мембраны и накапливается в тканях, отличаясь высокой концентрацией, поэтому его эффективность составляет 95-97% при очень низкой частоте рецидива инфекции. Достоинствами препарата в отличие от других антибиотиков является также отсутствие негативного влияния на функцию печени и метаболизм других препаратов, на нормальную кишечную флору и моторику кишечника. Кроме того, пища и другие лекарственные препараты не снижает его биодоступность. Вильпрафен значительно превосходит эритромицин по профилю безопасности, поэтому он разрешен к применению во время беременности и лактации. Кроме этого используется вильпрафен - солютаб в дозе 1000 мг. В качестве альтернативной антибактериальной терапии могут применяться новые формы антибиотиков: юнидокс солютаб (доксициклина моногидрат) 100 мг 2 раза в сутки 7-10 дней, флемоклав солютаб (амоксициллин клавуланат) 500 мг 2-3 раза в сутки, флемоксин солютаб (амоксициллин тригидрат) 500 мг 2-3 раза в сутки в течение 10 дней. По сравнению с амоксициллином (капсулы) эти препараты обладают более высокой биодоступностью, меньше влияют на микрофлору и обладают низкой вероятностью развития резистентности.
Поскольку более 80% всех урогенитальных инфекций являются смешанными, в комплексное лечение необходимо включать трихопол, который эффективен в отношении микрофлоры, нечувствительной к антибиотикам. Его применение обусловленно также способностью индуцировать синтез интерферона, обеспечивающего иммунопротективный эффект. Трихопол назначается одновременно с антибиотиками по 1 таблетке 3 раза в день в течение 10 дней.
2. Терапия рецидивирующего герпеса должна быть комплексный и этиопатогенетической, включающей не только противовирусные и иммуномодулирующие средства, но и противовоспалительные, гормональные, седативные средства и препараты, ускоряющие репарацию тканей.
Этиотропная терапия предполагает применение противовирусных средств:
- аномальные нуклеотиды;
- ингибиторы с различными механизмами действия;
- интерфероны и индукторы интерферона;
- гипериммунные и полиспецифические иммуноглобулины;
- вакцины.
Наиболее распространенными и эффективными этиотропными препаратами являются аномальные нуклеотиды, которые проникая в инфицированную клетку, фосфорилируются, благодаря действию вирусной тимидинкиназы, и блокируют синтез вирусной ДНК, замещая натуральные нуклеотиды.
На фармацевтическом рынке в настоящее время имеются 2 группы эти препаратов: ацикловир и его производные, представляющие из себя нуклеозидный аналог гуанина и фамвир, действующим компонентом которого является пенцикловир. Первая группа препаратов ингибирует преимущественно вирусную ДНК-полимеразу, вторая – тимидинкиназу. . В целом же эти препараты близки по эффективности. Особенности их действия обусловливают тот факт, что наибольшей эффективностью они обладают именно в момент обострения заболевания. Семы лечения в момент обострения индивидуальны, в среднем 5-10 дней, но могут быть и длительными (до 30 дней и более).
Ацикловир назначается по 0,2-0,4г 4-5 раз в день, валацикловир по 0,5г 2 раза в день, фамвир - 60 мг 2-4 раза в день
Назначение аномальных нуклеотидов, в том числе и длительных супрессивных схем, практически не меняют уровень иммунной защиты, что может приводить к рецидивам инфекции сразу после отмены препаратов. Поэтому в комплексной терапии вирусной инфекции необходимо применение иммуномодулирующих средств.
3. Особое значение при бактериальной и вирусной инфекции имеет применение иммуномодуляторов, особенно препаратов интерферона.
Интерфероны являются основными компонентами иммунной системы, сдерживающие развитие клинических форм герпетической инфекции и способствующие противомикробной защите.
По своей функциональной активности интерфероны подразделяются на 2 типа.
К I типу относятся ИФН α, β, σ, ω, τ, которые продуцируются в ответ на инфицирование клетки вирусами. Основной противовирусный эффект ИФН - это нарушение синтеза вирусных частиц на этапе трансляции, т.е. синтеза вирусспецифических белков в результате дискриминации вирусных информационных РНК.
II тип интерферонов представлен γ-интерфероном. Он обладает выраженной иммуномодулирующей активностью, вовлекая различные клеточные компоненты иммунной системы, в первую очередь цитотоксические клетки, в развитие иммунного ответа.
В акушерстве и гинекологии применяя.тся преимуществнно препараты α-интерферона. Высокой противовирусной, антибактериальной и иммуномодулирующей активностью обладает генферон (фирма «Биокад») – комбинированный препарат, содержащий: α-интерферон, оказывающий иммуномодулирующее, противовирусное и антибактериальное действие; таурин, обладающий антиоксидантными, регенерирующими, противовоспалительными и мембраностабилизирующими свойствами, пролонгирует и потенцирует действие интерферона; анестезин, способствующий устранению боли, зуда и жжения. Генферон выпускается в виде свечей для ректального и вагинального применения по 250000, 50000 и 1000000МЕ. При смешанной бактериально-вирусной инфекции наиболее эффективными схемами применения препарата являются: генферон 250 тыс. ед. 2 раза в сутки интравагинально в течение 10 дней после антибактериальной и местной терапии или генферон 500 тыс. ед. 2 раза в сутки ректально одновременно с антибактериальной и местной терапией в течение 10 дней.
При использовании генферона интравагинально создается высокая концентрация интерферона в очаге инфекции, что способствует быстрому купированию субъективных симптомов, снижению доз и длительности курса антибиотикотерапии. Его использование не сопровождается побочными эффектами.
Среди иммуномодулирующих препаратов, оказывающих влияние на противовирусный иммунитет, наибольшее распространение в нашей стране получили индукторы интерферона. Основным свойством индукторов интерферона является способность вызывать в организме синтез эндогенного интерферона. Наиболее эффективным индуктором интерферона является тилорон, торговое название «лавомакс» (фирма «Нижфарм»). Тилорон вызывает синтез -α, -β и –γ ИФН-ов в фибробластах энтероцитах, гепатоцитах, Т-лимфоцитах, нейтрофилах, гранулоцитах, а также в других клетках, проходит через гематоэнцефалический барьер и индуцирует образование ИФН в клетках нейронах мозга.
Лавомакс применяется в комплексе с этиотропными препаратами в течение 20-40 дней: по 125 мг 2 дня подряд и в дальнейшем каждые 48 часов. Он способствует нормализации интерферонового статуса и профилактике частоты и длительности рецидивов
Использование препаратов интрферона и индукторов интерферона показано и в межрецидивный период заболевания с профилактической целью.
4. Важным и в то же время самым сложным и длительным этапом в лечении ХЭ является восстановление обменных процессов в органах и тканях, способствующее нормализации структуры, функции и рецептивности эндометрия. С этой целью используется как лекарственные средства, так и физиотерапевтическое воздействие.
В комплексном лечении ХЭ хорошо зарекомендовал себя вобэнзим, содержащий протеолитические энзимы, которые обладают иммуномодулирующим действием по нормализации всех параметров иммунной системы, оказывает прямое стимулирующее действие на процессы фагоцитоза, секркторную активность макрофагов, естественных киллеров. Данная терапия проводилась на фоне системной энзимотерапии препаратом Вобэнзим по 5 драже 3 раза в день 1 месяц. Препарат вобэнзим содержит протеолитические энзимы, которые обладают иммуномодулирующим действием по нормализации всех параметров иммунной системы, оказывает прямое стимулирующее действие на процессы фагоцитоза, секркторную активность макрофагов, естественных киллеров.
Выраженным антиоксидантным действием обладает хофитол - препарат, основу которого составляет вытяжка из водного экстракта свежих листьев артишока. Благодаря входящим в его состав активным компонентам (каффеолиновые кислоты, флавоноиды, инулин, витамины группы А, В, С, макро- и микроэлементы, включая Fe, P, Mn и др.) хофитол является мощным антиоксидантом, улучшает реологические свойства крови, уменьшает токсико-метаболические нарушения в организме, что способствует полноценной регенерации эндометрия. Кроме того, он обладает выраженными дезинтоксикационными свойствами, нормализует липидный, белковый, азотистый и углеводный обмен, улучшает функцию печени и почек. Это очень важно при лечении пациенток с сопутствующими экстрагенитальными заболеваниями.
Для улучшения метаболических процессов в эндометрии применяются также витамины Е, группы В.
С целью восстановления рецептивности эндометрия эффективно использование физиотерапевтичских процедур, улучшающих кровообращение в органах малого таза и репаративные процессы в эндометрии: электрофорез с цинком, магнием; лазеротерапия, магнитотерапия, иглорефлексотерапия, озонотерапия.
5. Инфекционно- воспалительные процессы гениталий приводят к нарушению функции яичников, что проявляется, прежде всего, недостаточностью лютеиновой фазы. Для их реабилитации после проведенного противовоспалительного лечения показана гормональная терапия низко- и микродозированными комбинированными контрацептивами (КОК), содержащих высокоактивный гестаген. Оптимальными препаратами являются регулон (30 мкг этинилэстрадиола и 150 мкг дезогестрела) и новинет (20 мкг этинилэстрадиола и 150 мкг дезогестрела). Их назначают по 1 таблетке с 5 по 25 дни менструального цикла в течение не менее 3 месяцев. Благодаря низкому содержанию гормонов, и высокоэффективному гестагенному компоненту, эти препараты не оказывают анаболического, андрогенного действия, не влияют на липидный спектр крови и артериальное давление. Кроме того, применение регулона оказывает положительный эффект при дисменорее и предменструальном синдроме, нередко сопровождающих ХЭ.
В ряде случаев (при достаточном содержании эстрогенов) для коррекции НЛФ достаточно назначения гестагенов во вторую фазу цикла. С этой целью целесообразно назначение утрожестана - натурального микронизированного прогестерона, полностью идентичного эндогенному прогестерону. Он не обладает антигонадотропной активностью, не подавляет продукцию естественного прогестерона яичниками женщины, не имеет «ребаунд» эффекта. Клинические эффекты утрожестана анологичны эндогенному прогестерону: прогестагенный, антиэстрогенный, антиальдостероновый, антиандрогенный (физиологический эффект регуляции уровня андрогенов), токолитический, успокаивающий, положительный нейротропный, иммунокорригирующий. Утрофестан назначают по 100 мг 2 раза в день с 16 по 25 день цикла в течение 2-3 месяцев.
Комплексная терапия ХЭ у пациенток с невынаиванием беременности должна завершаться оценкой ее эффективности, для того, чтобы максимально снизить риск последующих репродуктивных потерь.
Критериями эффективности лечения ХЭ являются:
- купирование клинических симптомов заболевания
- элиминации патогенной микрофлоры из полости матки, подтвержденная результатами бактериологического и ПЦР исследования.
- восстановление эхографической картины эндометрия, кровотока в овариальных и маточных артериях
- восстановление морфологической структуры эндометрия (отсутствие признаков воспаления, адекватное дню цикла состояние эндометрия), подтвержденное гистологическим исследованием эндометрия на 5-8 дни менструального цикла, полученного с помощью шприца-аспиратора Ipas MVA Plus и канюль Ipas EasyGrip диаметром 4 мм
- восстановление функционального состояния эндометрия (нормализация продукции АМГФ, определяемое в смыве из полости матки, полученных на 22-24 дни цикла с помощью шприца-аспиратора Ipas MVA Plus и канюль Ipas EasyGrip диаметром 4 мм
- нормализация менструального цикла с полноценной лютеиновой фазой
Адекватная терапия ХЭ на этапе прегравидарной подготовке женщин с репродуктивными потерями в анамнезе, способствующая элиминации всех возможных инфекционных возбудителей, а также восстановлению структуры и функции эндометрия является залогом успешной имплантации, плацентации и благополучного течения следующей беременности.

Основным местом локализации первичной генитальной инфекции ВПГ у женщин является шейка матки. Чаще всего, герпетические поражения у женщин локализуются на больших и малых половых губах (68,6%), в области вульвы (41,8%), клитора (35,7%), влагалища и шейки матки (84,4%).
ВПГ был изолирован из шейки матки во время первичного заражения у 88—90 % женщин с первичной инфекцией ВПГ-2, которые имели везикулезную сыпь на наружных гениталиях, у 65 % — с повторным эпизодом инфекции ВПГ-2, и у 80 % женщин с ВПГ-1. Большинство (89 %) женщин, выделяющих вирус при первичном эпизоде заболевания, имели изменения на шейке матки.
Особенностью генитального герпеса (Herpes genitalis) женских половых органов является многоочаговость. В патологический процесс нередко вовлекаются нижний отдел мочеиспускательного канала, слизистая оболочка ануса и прямой кишки. Вовлечение в инфекционный процесс этих органов может происходить вторично, вслед за возникновением герпеса наружных гениталий, но может протекать и как изолированное поражение.
Рецидивирующая герпетическая инфекция (РГИ) может проявляться клиникой вульвовагинита и цервицита, вызывать поражения слизистой матки, труб и придатков. В 83,6 % случаев при стойких, не поддающихся терапии кольпитах, лейкоплакиях шейки матки выделяют вирус простого герпеса (ВПГ) как один из ведущих этиологических факторов заболевания.
По некоторым данным, в 66 % случаев у женщин герпетическая инфекция (ГИ) протекает атипично. Об имеющейся длительно текущей хронической ГИ можно говорить на основании особенностей клинического течения, наличия герпетического антигена в эпителиальных клетках вульвы, влагалища и периферической крови.
д) хронических часто рецидивирующих сальпингоофоритах (воспаление маточных труб и яичников) и эндометритах, не поддающихся стандартной антибактериальной терапии;
У 1–2% женщин, поступающих в гинекологическую клинику, независимо от основного заболевания, обнаруживают цитологические доказательства ВПГ-инфекции.
Герпес наружных половых органов у женщин
При рецидивирующем герпесе (РГ) наружных половых органов у женщин, очаг поражения находится в области наружных гениталий и перианальной области. Герпетические высыпания у женщин возникают на больших и малых половых губах, области лобка и промежности.
Типичная форма РГ наружных гениталий характеризуется ярко выраженными симптомами болезни, классическим развитием очага поражения (эритема, образование везикул, развитие эрозивно-язвенных элементов, эпителизация) и субъективными ощущениями (зуд, чувство жжения, болезненность, недомогание). проявляется повторяющимися пузырьковыми высыпаниями. Выраженная симптоматика позволяет врачам визуально поставить диагноз РГГ, своевременно назначить лечение и информировать больного об инфекционном характере заболевания и опасности заражения полового партнера.
Герпес нижнего отдела урогенитального тракта, анальной области и ампулы прямой кишки
Поражение слизистых оболочек входа во влагалище, влагалища, влагалищной части шейки матки, цервикального канала, уретры, мочевого пузыря, анальной области и ампулы прямой кишки проявляется в двух клинических формах:
- очаговой, характеризующейся появлением типичных для простого герпеса слизистых оболочек везикулезно-эрозивных элементов,
- диффузной, при которой патологический процесс протекает по типу неспецифического воспаления.
Герпес верхнего отдела полового тракта (поражение матки, маточных труб).
Типичная клиническая картина герпетических поражений органов верхнего отдела мочеполового тракта проявляется симптомами неспецифического воспаления. Неспецифические герпетические поражения внутренних половых органов проявляются эндоцервицитом, эрозией шейки матки, вагинитом. Ряд авторов цервициты без наружных язв также относят к атипичным проявлениям ГГ.
Клинические проявления герпетических поражений внутренних половых органов не имеют специфических особенностей по сравнению с воспалительными процессами невирусной этиологии. Обычно больные предъявляют жалобы на выделения из влагалища, периодически появляющиеся боли в малом тазу, области проекции матки, яичников.
Герпетические поражения шейки матки
Герпетические поражения шейки матки могут носить типичный и нетипичный характер. В типичном варианте генитального герпеса – это всегда хорошо заметные множественные, довольно мелкие, с четкими границами округлые эрозии; высыпные элементы быстро минуют везикулярную стадию, в которой, кстати, эти элементы плохо различимы без применения кольпоскопии. Проблема причастности ВПГ к развитию нетипичных герпетических изменений слизистой шейки матки в настоящее время находится в стадии исследований.
При кольпоскопии в острый период герпетической инфекции шейки матки определяют изъязвление с неровными краями с сукровицей в области дна. Эволюция этого поражения идет от изъязвления с красным дном к простой эрозии до полного исчезновения в течение 3-х недель. К предшествующим изменениям относят маленькие буллезные образования, затем округлые микроэрозии с последующим формированием простых красных пятен, которые похожи на местный пятнистый кольпит.
Исследования показали, что выделение ДНК ВПГ с поверхности эрозии шейки матки в 60 % случаев сопровождается репликативной фазой ГИ (репликация и сборка вирусных частиц в инфицированных клетках). При эрозии и дисплазии шейки матки ВПГ-2 выявляется в 27,2% случаев непосредственно в соскобах со слизистой цервикального канала и сопровождается повышением титра специфических иммуноглобулинов в крови до диагностических уровней.
Особое значение влияние герпетической инфекции на состояние эпителия шейки матки имеет у женщин, длительно принимающих оральные гормональные контрацептивы. Известно, что длительный прием комбинированных стероидов в той или иной мере усиливает процессы плоскоклеточной метаплазии, а также может вызывать эффект эндоцервикальной гиперплазии, причем этот эффект в случае его развития наблюдается как в эпителии цервикального канала, так и в участках псевдоэрозии на фоне эктропиона, в полипах слизистой цервикального канала. В связи с этим прием оральных комбинированных контрацептивов может являться кофактором в развитии рака шейки матки, особенно в сочетании с герпетической инфекцией.
Герпетический цервицит
В настоящее время под термином экзоцервицит (эктоцервицит) понимают воспаление влагалищной части шейки матки. Эндоцервицит - воспаление слизистой оболочки канала шейки матки (цервикального канала). Понятие «цервицит» объединяет эти два термина.
Герпетический цервицит – это воспалительный процесс, вызванный ВПГ. Для клинических проявлений герпетического цервицита характерно разнообразие проявлений — от легкой гиперемии с небольшим количеством эрозий до тяжелого некротического поражения (под эрозией шейки матки понимают дефект эпителия в результате воспаления). Цервицит диагностируется у 70-90% женщин с герпетическим поражением половых органов. Шейка матки при герпетическом эндоцервиците отечна, часто имеет эрозии, легко кровоточит при манипуляциях.
Герпетический эндометрит
Эндометрит — это воспаление внутренней (слизистой) оболочки матки (эндометрия) с поражением как функционального, так и базального слоя. Эндометрит, вызванный вирусом простого герпеса, является следствием длительной персистенции (существования) вируса в эндометрии. Герпетический эндометрит, как правило, возникает при атипичном или бессимптомном течении ГГ, типичная форма отмечается редко (~20% случаев). Клинические симптомы при вирусном поражении эндометрия чаще всего отсутствуют или проявляются нетипично, что приводит к ошибкам в диагностике и позднему началу лечения.
При герпетическомпоражении ткани нарушаются факторы местного и общего иммунитета, целостность поверхности эпителия, что приводит к созданию благоприятных условий для развития других инфекционных процессов .
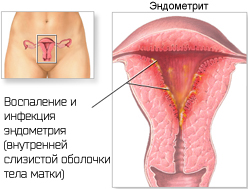
Клинически герпетический эндометрит чаще проявляется во второй фазе менструального цикла или во время беременности, что, возможно, обусловлено повышением уровня простагландинов в этот период или супрессией Т-клеточного звена иммунитета, способствующих реактивации ВПГ, персистирующего в эндометрии. Субклиническая латентная внутриматочная герпетическая инфекция является важным фактором невынашивания беременности. Эндометриты ВПГ-этиологии встречаются нечасто, но эти заболевания очень опасны и могут вызвать гибель женщины и плода.
Герпес уретры и мочевого пузыря (герпетический уретрит)
Герпетический уретрит у женщин субъективно проявляется болями и резями в начале мочеиспускания, частыми позывами к мочеиспусканию. У 4,8% женщин имеет место очень болезненное мочеиспускание, или задержка мочеиспускания в результате инфекции уретры и слизистой оболочки мочевого пузыря. Нормализация функции мочевого пузыря у больных с задержкой мочеиспускания обычно происходит в течение 6–10 дней.
При осмотре наблюдаются гиперемия наружного отверстия уретры, наличие скудных слизистых выделений; при уретроскопии в передней части уретры иногда удается обнаружить мелкие поверхностные эрозии, катаральное воспаление.
Герпетический цистит
Ведущими симптомами герпетического цистита являются цисталгия, появление болей в конце мочеиспускания, дизурические явления. При герпетическом цистите появляются гематурия (кровь в моче), появление болей в конце мочеиспускания, боли в области мочевого пузыря. У женщины это может быть первым и единственным признаком ВПГ-инфицирования мочеполовой сферы. Он нередко возникает в первые 1-3 месяца после начала половой жизни или после смены полового партнера.
Герпес анальной области и прямой кишки
Очаг поражения в анальной области обычно представляет собой рецидивирующую трещину, что нередко является поводом для диагностических ошибок. Такие больные с ошибочным диагнозом "трещина заднего прохода" попадают к хирургам. Зудящая форма герпеса ануса и герпетическое поражение геморроидальных узлов, также трудны для диагностики.
Поражение анальной области может возникнуть первично как самостоятельное заболевание или вторично – в результате затекания отделяемого влагалища и мацерации слизистой оболочки ануса при наличии у пациентки герпетического кольпита, сопровождающегося обильной экссудацией.
При поражении сфинктера и слизистой оболочки ампулы прямой кишки (герпетический проктит) больных беспокоят зуд, чувство жжения и болезненность в очаге поражения, возникают мелкие эрозии в виде поверхностных трещин с фиксированной локализацией, кровоточащие при дефекации. При ректоскопии определяется катаральное воспаление, иногда эрозии.
Герпес внутренних гениталий - субклиническая и бессимптомная формы.
Для субклинической формы герпеса внутренних гениталий (влагалища, матки, яичников и т.д.) типично отсутствие у пациентки жалоб, иногда имеются указания на периодически появляющиеся необильные слизистые выделения из влагалища. При гинекологическом осмотре симптомы воспаления не выявляются. При динамическом лабораторном исследовании мазков отделяемого канала шейки матки, влагалища и уретры периодически выявляется повышенное количество лейкоцитов (до 200–250 и выше в поле зрения), свидетельствующее о наличии воспалительного процесса. При вирусологическом исследовании мазков методом иммунофлюоресценции в лейкоцитах определяется антиген ВПГ.
Бессимптомная форма герпеса внутренних гениталий характеризуется отсутствием у больных каких-либо жалоб на половую сферу, объективных клинических данных, подтверждающих воспаление. При лабораторном исследовании отделяемого урогенитального тракта выделяется ВПГ, в то время как в мазках признаков воспаления (лейкоцитоза) нет. Бессимптомная форма герпеса внутренних гениталий выявляется у 20–40% женщин, страдающих РГГ ягодицы и бедра. Это важное обстоятельство необходимо учитывать при планировании беременности у женщин с этой формой РГГ в связи с существующей вероятностью развития во время беременности осложнений ВПГ-инфекции.
Согласно данным литературы, у 83,6% женщин, страдающих не поддающимися терапии кольпитами и лейкоплакией шейки матки, ВПГ является одним из факторов заболевания. Доказано, что ВПГ может быть причиной развития эндометрита и сальпингоофорита.
Герпетический вульвовагинит
У женщин часто встречаются герпетический вульвовагинит, особенностью течения которого является нередкое присоединение отека пораженной области. Вирус герпеса могут изолированно поражать вульву и влагалище. Заражение происходит от больных. Герпетический вульвовагинит проявляется мелкими пузырьками на гиперемированной вульве. Пузырьки содержат прозрачную, а при присоединении вторичной инфекции — гнойную жидкость. Через 5—7 дней пузырьки вскрываются с образованием эрозий и язвочек, которые покрываются струпом. В начале заболевания выражены жжение, боли и зуд в области вульвы. Общие симптомы включают головную боль, озноб, повышение температуры тела.
У женщин диагноз «атипичная форма генитального герпеса» ставится гинекологами для обозначения хронического воспалительного процесса вульвы при наличии лабораторно подтвержденной герпетической природы заболевания, в отличие от типичной картины болезни, при которой на слизистой оболочке этих органов имеются очаги поражения с везикулезно-эрозивными элементами.
Генитальный герпес во время беременности
Заболевание ВПГ женщин во время беременности может явиться причиной гибели плода, мертворождения, преждевременных родов. Герпесвирусы вызывают до 30% спонтанных абортов на ранних сроках беременности и свыше 50% поздних выкидышей, занимают второе место после вируса краснухи по тератогенности (развитие уродств плода).
Тяжелейшие формы неонатального герпеса развиваются при инфицировании новорожденного вирусом простого герпеса в родах. При первичном ГГ у матери инфицируется от 30% до 80% детей, при рецидивирующем герпесе – 3–5%. Инфицирование плода во время родоразрешения, если у матери в конце беременности имели место герпетические высыпания, происходит у 50% женщин, больных РГГ; при этом у 60–80% инфицированных детей развивается энцефалит.
Герпес менструальный
Менструальный герпес — это генитальный герпес (ГГ) с монотонным типом рецидивирования и тяжелым течением, характеризующийся ежемесячными обострениями инфекционного процесса до, во время или после менструации. Такое течение заболевания может стать для женщины сильнейшим психотравмирующим фактором, ограничивающим ее социальную активность и снижающим качество жизни.
Этот вариант ГИ является сложным для лечения. Поэтому разработка адекватных и эффективных способов лечения и профилактики рецидивов у больных с данными формами ГГ остается актуальной. Европейские стандарты лечения пациенток предусматривают длительную (годами) супрессивную терапию противовирусными препаратами , что не исключает повторного рецидирования ГГ и бессимптомного вирусовыделения, появления побочных эффектов и резистентности вирусов герпеса к лекарственной терапии.
Рассмотрены факторы риска развития хронического эндометрита, клинические симптомы заболевания, методы диагностики и подходы к комплексной терапии.
An examination was performed on the factors of the risk of the development of chronic endometritis, clinical symptoms of disease, methods of diagnostics and approaches to complex therapy.
.jpg)
В структуре гинекологической патологии у женщин репродуктивного возраста частота хронического эндометрита (ХЭ) по данным разных авторов составляет от 3% до 73% [3, 4]. Это связано, прежде всего, с трудностями морфологической верификации диагноза, различиями в исходно анализируемом материале и контингенте больных, значительной вариабельностью числа наблюдений. По нашим данным, частота ХЭ среди гинекологических больных составляет около 3%.
В настоящее время актуальность проблемы ХЭ приобретает не только медицинское, но и социальное значение, поскольку данное заболевание часто приводит к нарушению репродуктивной функции, являясь причиной бесплодия, неудачных попыток экстракорпорального оплодотворения (ЭКО), невынашивания беременности (НБ), осложненного течения беременности и родов [1].
Хронический эндометрит — клинико-морфологический синдром, характеризующийся комплексом морфофункциональных изменений эндометрия воспалительного генеза, приводящих к нарушению нормальной циклической трансформации и рецептивности ткани.
Среди пациенток с ХЭ 97,6% составляют женщины репродуктивного периода, что подчеркивает особую значимость данной патологии с точки зрения влияния на репродуктивную функцию [2].
У женщин с бесплодием ХЭ встречается в 12–68% случаев, достигая своего максимума при наличии трубно-перитонеального фактора бесплодия. У больных с неудачными попытками ЭКО и переноса эмбрионов (ПЭ) частота ХЭ возрастает до 60% и более. Наибольшие показатели распространенности ХЭ отмечены у больных с привычным невынашиванием беременности и составляют более 70% [5, 6].
По данным различных авторов, факторами риска развития ХЭ являются все инвазивные вмешательства в полости матки (гистероскопия, выскабливание полости матки, биопсия эндометрия, гистеросальпингография, манипуляции в программах вспомогательных репродуктивных технологий и др.), инфекционно-воспалительные осложнения после беременностей и родов, использование внутриматочных спиралей (ВМС), инфекции влагалища и шейки матки, бактериальный вагиноз, деформации полости матки с нарушением циклического отторжения эндометрия, лучевая терапия в области органов малого таза [1, 7, 8].
В современных условиях эндометрит характеризуется рядом особенностей: изменением этиологической структуры с увеличением значимости вирусной и условно-патогенной флоры, ростом резистентности флоры к фармакотерапии, трансформацией клинической симптоматики в сторону стертых форм и атипичного течения, длительными сроками терапии и высокой ее стоимостью [9]. Современная общепризнанная классификация ХЭ, выстроенная по этиологическому фактору, претерпела в последнее десятилетие значительные изменения в сторону расширения перечня специфических форм заболевания. Существуют вирусные (вирус папилломы человека — ВПЧ, цитомегаловирус, вирус иммунодефицита человека), хламидийные, микоплазменные, грибковые, протозойные и паразитарные специфические эндометриты, отдельно выделен саркоидоз эндометрия [1, 10]. Для идентификации инфекционного агента обязательно проводить тщательное микробиологическое исследование соскоба эндометрия с определением чувствительности флоры к антибактериальным препаратам. В одной трети случаев при гистологически верифицированном ХЭ выявляются стерильные посевы эндометрия, что может свидетельствовать о важной роли условно-патогенной флоры в развитии воспалительного процесса или недостаточной детекции возбудителя, особенно в случае вирусной инвазии [11]. Длительная и часто бессимптомная персистенция инфекционных агентов в эндометрии приводит к выраженным изменениям в структуре ткани, препятствуя нормальной имплантации и плацентации, формируя патологический ответ на беременность, а также вызывает нарушение пролиферации и нормальной циклической трансформации ткани [12]. По различным данным, у больных с бесплодием частота ХЭ составляет в среднем 10% (от 7,8 до 15,4%). Среди женщин с верифицированным ХЭ в 60% случаев диагностируется бесплодие (в 22,1% — первичное бесплодие, в 36,5% — вторичное бесплодие), неудачные попытки ЭКО и переноса эмбрионов в анамнезе отмечены у 40% женщин [4, 12]. Клиническая картина ХЭ в значительной степени отражает глубину структурных и функциональных изменений в ткани эндометрия. Неполноценная циклическая трансформация эндометрия на фоне воспалительного процесса, нарушение процессов десквамации и регенерации функционального слоя эндометрия приводят к появлению основного симптома заболевания — маточных кровотечений (перименструальные, межменструальные). Достаточно постоянными являются жалобы на тянущие боли внизу живота, дисменорею и диспареунию, нередко отмечаются серозные и серозно-гноевидные бели. Среди клинических симптомов особое место занимает бесплодие (преимущественно вторичное), неудачные попытки ЭКО и НБ. Более половины пациенток в анамнезе имеют инвазивные вмешательства в полости матки и на органах малого таза. Часто хронический эндометрит сочетается с хроническим сальпингоофоритом и спаечным процессом в малом тазе. Важно отметить, что использование минимальных критериев для диагностики воспалительных заболеваний органов малого таза (ВЗОМТ), предложенных CDC (Centers for Disease Control and Prevention, США, 1993), информативно в случае с хроническим эндометритом только в 33% [7]. В целом у 35–40% пациенток какие-либо клинические симптомы заболевания отсутствуют [8, 13]. Диагностика ХЭ основана на анализе клинических симптомов, данных анамнеза, эхографической картины [2, 11]. Обязательным этапом диагностики заболевания является морфологическое исследование эндометрия [14].
Эхографические критерии ХЭ впервые разработаны профессором В. Н. Демидовым с соавт. (1993 г.). Исследование проводят дважды на 5–7 и 17–21 день менструального цикла. Часто при ХЭ полость матки после менструации расширена до 0,4–0,7 см, в ряде случаев имеется асимметричность расширения полости матки и неровность внутренней поверхности эндометрия. Изменение структуры эндометрия также выражается в возникновении в зоне срединного М-эха участков повышенной эхогенности различной величины и формы. Внутри участков выявляются отдельные зоны неправильной формы и сниженной эхогенности. Другой важный признак — наличие пузырьков газа, иногда с характерным акустическим эффектом «хвоста кометы». В базальном слое эндометрия часто визуализируются четкие гиперэхогенные образования диаметром до 0,1–0,2 см, представляющие собой очаги фиброза, склероза или кальциноза. Довольно редким, но важным признаком эндометрита является асимметрия толщины передней и задней стенок эндометрия. О наличии патологии свидетельствует также истончение М-эха во второй трети менструального цикла менее 0,6 см. У каждой пятой больной отмечается наличие нескольких из перечисленных признаков [15].
В настоящее время для диагностики внутриматочной патологии широко используется гистероскопия [16]. Наиболее частыми признаками воспалительного процесса в эндометрии являются: неравномерная толщина эндометрия — 30% случаев, полиповидные нарастания — 32,2%, неравномерная окраска и гиперемия слизистой оболочки — 23% и 11,8%, точечные кровоизлияния — 9%, очаговая гипертрофия слизистой оболочки — 7%. Трудности гистероскопической интерпретации данных связаны с отсутствием типичных макроскопических признаков хронического эндометрита, с очаговым характером воспалительного процесса и стертыми формами заболевания [17]. По разным данным гистероскопия позволяет по макроскопическим признакам точно идентифицировать хронический эндометрит только в 16–35% случаев [7, 16]. При подозрении на ХЭ гистероскопия важна для исключения всего спектра внутриматочной патологии, но для верификации диагноза во всех случаях необходимо проведение морфологического исследования эндометрия [8].
«Золотым стандартом» диагностики ХЭ является морфологическое исследование эндометрия, которое должно быть обязательным звеном алгоритма обследования [7, 13]. Диагностическое выскабливание слизистой оболочки матки производят в среднюю и позднюю фазу пролиферации, на 7–10 день менструального цикла. В последние годы общепринятыми критериями морфологической диагностики ХЭ являются [1]:
- Воспалительные инфильтраты, состоящие преимущественно из лимфоидных элементов, расположенные чаще вокруг желез и кровеносных сосудов, реже диффузно. Очаговые инфильтраты имеют вид «лимфоидных фолликулов» и располагаются не только в базальном, но и во всех отделах функционального слоя, в состав их входят также лейкоциты и гистиоциты.
- Наличие плазматических клеток.
- Очаговый фиброз стромы, возникающий при длительном течении хронического воспаления, иногда захватывающий обширные участки.
- Склеротические изменения стенок спиральных артерий эндометрия, появляющиеся при наиболее длительном и упорном течении заболевания и выраженной клинической симптоматике. Различия в трактовке гистологических особенностей ХЭ обусловлены наличием вариантов, которые определяются особенностями общей и тканевой реактивности, этиологическим фактором, продолжительностью заболевания, наличием обострений и степенью их выраженности [18].
Несмотря на значительное развитие фармакологической основы терапии, лечение ХЭ в настоящее время представляет значительные трудности для клиницистов [4].
Комплексная терапия ХЭ должна быть этиологически и патогенетически обоснованной, поэтапной и базироваться на результатах максимально тщательного обследования [5]. Алгоритм лечения должен учитывать все звенья патогенеза заболевания.
Необходимость использования этиотропных препаратов для элиминирования повреждающего агента или снижение вирусной активности не вызывает сомнения. Принимая во внимание, что почти в 70% случаев ВЗОМТ применение рутинных методов диагностики не позволяет выявить этиологический фактор, эмпирическая антимикробная терапия при ХЭ всегда оправдана и приводит к достоверному уменьшению частоты клинических симптомов. При этом она должна обеспечивать элиминацию широкого спектра возможных патогенных микроорганизмов, включая хламидии, гонококки, трихомонады, грамотрицательные факультативные бактерии, анаэробы, стрептококки и вирусы. Оправдано назначение нескольких курсов этиотропной терапии со сменой групп препаратов [5, 18].
Выбор группы лекарственных препаратов зависит от данных микробиологического исследования содержимого влагалища и полости матки, анамнестических указаний на использование антибактериальных препаратов в течение последнего года, от выраженности клинической симптоматики и обширности воспалительного процесса [16].
Основу базовой антибактериальной терапии должны составлять комбинации фторхинолонов и нитроимидазолов; цефалоспоринов III поколения, макролидов и нитроимидазолов, а также сочетание защищенных пенициллинов (амоксициллин/клавулановая кислота) с макролидами. При наличии вирусной инфекции (чаще вируса простого герпеса) в зависимости от клинической картины применяют современные аналоги нуклеозидов (Ацикловир или Валтрекс), как правило, в длительном режиме — в течение не менее 3–4 месяцев [3, 19].
Одновременно на основании данных иммунного и интерферонового статуса проводится коррекция иммунных нарушений [20].
Второй этап лечения ХЭ направлен на восстановление морфофункционального потенциала ткани и устранение последствий вторичных повреждений: коррекция метаболических нарушений и последствий ишемии, восстановление гемодинамики и активности рецепторного аппарата эндометрия. Данный этап лечения крайне важен, должен быть продуманным и достаточно продолжительным [11].
Метаболическая терапия при ХЭ направлена на усиление тканевого обмена, активацию энергетических процессов в клетках, устранение последствий гипоксии ткани, в том числе угнетение анаэробного гликолиза [4, 12]. С этой целью используются комплексные метаболические препараты, длительность приема которых должна составлять не менее 3–4 недель. Представителем данной группы препаратов является Актовегин, полученный посредством диализа и ультрафильтрации, в состав которого входят низкомолекулярные пептиды и дериваты нуклеиновых кислот. Актовегин активирует клеточный метаболизм путем увеличения транспорта, накопления и усиления внутриклеточной утилизации глюкозы и кислорода, что приводит к ускорению метаболизма аденозинтрифосфата (АТФ) и повышению энергетических ресурсов клетки. Актовегин удобен для приема. Его выпускают и в таблетках, и в растворе для инъекций. Поэтому женщины, которые по каким-либо причинам не могут лечь в стационар или систематически приезжать на прием, принимают его дома по схеме, расписанной врачом. Актовегин таблетки принимают, не разжевывая, перед едой, запивая небольшим количеством жидкости, по 1 таблетке 2 раза в день в течение 30 дней [21]. При введении в форме инфузии к 200–300 мл основного раствора (0,9% раствор хлорида натрия или 5% раствор декстрозы) добавляют 10–20 мл Актовегина, раствор используют по следующей схеме: внутривенно через день в течение не менее двух недель. Скорость введения: около 2 мл/мин [22].
Положительное влияние Актовегина на кровообращение связано с улучшением доставки и утилизации кислорода, увеличением перфузии глюкозы и восстановлением аэробного метаболизма как в периферических тканях, так и в нейрональных структурах. Путем активации фермента супероксиддисмутазы препарат оказывает выраженное антиоксидантное и противоишемическое действие. Актовегин хорошо сочетается с другими лекарственными средствами, что очень удобно для комплексного лечения хронического эндометрита.
Традиционно в комплексной терапии ХЭ применяются физические факторы. Наиболее часто в комплексной терапии ХЭ применяют электроимпульсную терапию, интерференционные токи, переменное магнитное поле низкой частоты, ток надтональной частоты. Задачи физиотерапии при ХЭ заключаются в улучшении гемодинамики органов малого таза, стимуляции функции рецепторов, ускорении процессов регенерации эндометрия, повышении иммунологических свойств [4].
Дискуссионными остаются вопросы о целесообразности использования в комплексном лечении ХЭ циклической гормональной терапии. В настоящее время считается, что при хроническом эндометрите оправдано только дифференцированное назначение гормонотерапии при наличии гипофункции яичников или ановуляции. Потенциал к патологической регенерации ткани, который таит в себе хроническое воспаление, при назначении циклической заместительной гормональной терапии может быть усилен и реализован [3, 8].
Контроль эффективности терапевтических мероприятий должен проводиться не ранее чем через 2 месяца после окончания лечения с учетом эффекта последействия физиотерапии [2, 5]. При этом оценивается динамика клинических симптомов, проводится ультразвуковое исследование матки (допплерометрия сосудов матки) и аспирационная биопсия эндометрия (на 7–10 день менструального цикла) с последующим морфологическим исследованием эндометрия [1, 11].
Литература
- Кузнецова А. В. Хронический эндометрит // Арх. патол. 2000; 3 (62): 48–52.
- Краснопольский В. И., Серова О. Ф., Туманова В. А. и др. Влияние инфекций на репродуктивную систему женщин // Российский вестник акушера-гинеколога. 2004, № 5.
- Sharkey A. M., Smith S. K. The endometrium as a cause of implantation failure // Best Practice & Research Clinical Obstetrics Gynecology. 2003; 17 (2): 289–307.
- Сухих Г. Т., Шуршалина А. В. Хронический эндометрит: руководство. М.: ГЭОТАР-Медиа, 2010.
- Шуршалина А. В., Ежова Л. С., Силантьева Е. С. Патогенетические подходы к терапии хронического эндометрита // Акушерство и гинекология. 2004. № 6. С. 54–56.
- Стругацкий В. М., Силантьева Е. С. // Акуш. и гин. 2002; 6: 51–53.
- Mount S., Mead P., Cooper K. Chlamydia trachomatis in the endometrium: can surgical pathologists identify plasma cell // Adv Anat Pathol. 2001; 8 (6): 327–329.
- Stern R. A., Svoboda-Newman S. M., Frank T. S. Analysis of chronic endometritis for Chlamydia trachomatis by polymerase chain reaction // Hum Pathol. 1996; 27 (10): 1085–1088.
- Eckert L. O., Hawes S. E. Endometritis: The clinical-pathologic syndrome // Am J Obstet Gynecol. 2002; 186 (4): 690–695.
- Ingerslev H. J., Meller B. R. Chlamydia trachomatis in acute and chronic endometritis // Scand J Inf Dis. 1982.
- Шуршалина А. В. Хронический эндометрит у женщин с патологией репродуктивной функции: автореф. дис. д-ра мед. наук. М., 2007. 37 с.
- Glasser S. R., Aplin J. D. The endometrium. Taylor and Francis., 2002.
- Чен П. Т. К., Гоулдстайн М., Роузенвэкс З. Секреты репродуктивной медицины. Пер. с англ. Под общ. ред. акад. РАМН, проф. В. И. Кулакова. М.: МЕДпресс-информ, 2006.
- Buckley C. H., Fox H. Biopsy pathology of the endometrium. Arnold., 2002.
- Демидов В. Н., Гус А. И. Патология полости матки и эндометрия. ВМК. Практическое пособие. М., 2001; 16–21.
- Подзолкова Н. М., Бархина Т. Г., Осадчев В. Б. и др. Роль панорамной и микрогистероскопии в диагностике хронического эндометрита // Российский вестник акушера-гинеколога. 2004, № 6.
- Eisert W. G. Dipiridamole. Platelets/Ed. by Michelson A. D. Cambridge (USA), 2002. P. 215. Glasser S. R., Aplin J. D. The endometrium. Taylor and Francis., 2002.
- Haggerty C. L., Ness R. B., Amortegui A. et al. Endometritis does not predict reproductive morbidity after pelvic inflammatory disease // Am. J. Obstet. Gynecol. 2003. Vol. 188. P. 141–148.
- Шубич М. Г., Авдеева М. Г. Медиаторные аспекты воспалительного процесса // Apx. патол. 1997; 2: 3–8.
- Шуршалина А. В., Дубницкая Л. В. Иммуномодулирующая терапия в программе реабилитации пациенток с хроническим эндометритом // Российский вестник акушера-гинеколога. 2006. № 1. С. 36–38.
- Кулаков В. И., Шуршалина А. В. Хронический эндометрит // Гинекология. 2005. Т. 11. № 5, с. 18–20.
- Сидорова И. С., Макаров И. О., Унанян А. Л. Патогенез и патогенетически обоснованная терапия хронического эндометрита (клиническая лекция) // Акушерство, гинекология и репродукция. 2010; № 3, c. 21–24.
А. З. Хашукоева, доктор медицинских наук, профессор
Н. Д. Водяник, кандидат медицинских наук, доцент
С. А. Хлынова, кандидат медицинских наук
Е. А. Цомаева
ГБОУ ВПО РНИМУ им. Н. И. Пирогова Минздравсоцразвития России, Москва
О важности толщины эндометрия задумываются только тогда, когда у женщины возникают проблемы со стороны репродуктивной системы.
Колебания возможны в обоих направлениях – утолщение (гиперплазия) или снижение толщины ниже нормы (гипоплазия).
Выявить патологию достаточно просто – достаточно пройти УЗИ органов малого таза.
А вот, чтоб привести толщину эндометрия в норму – не обойтись без помощи квалифицированного специалиста.

Толщина эндометрия: функциональная и анатомическая характеристика
Эндометрием называется слой ткани, выстилающей изнутри полость матки.
У него достаточно сложное строение, которое к тому же меняется в зависимости от фазы и периода менструального цикла.
В соответствии с гормональными колебаниями, отмечаются разные варианты нормы для толщины эндометрия.
Отобразим усредненные показатели в таблице:
Состояние эндометрия (по данным УЗИ)
Десквамации (отторжения) эндометрия, 3-4 день, стадия кровотечений.
Структура неоднородная, толщина в разных участках матки колеблется. Местами – нулевая. Отмечаются скопления крови.
Ранняя пролиферация, 5-7 день.
Толщина 3-6 мм, в центре формируется небольшая щель (будущая полость матки).
Утолщение слоя до 5-10 мм, в месте смыкания переднего и заднего листков формируется хорошо выраженная щель.
Поздняя пролиферация, 11-14 дни цикла.
Толщина эндометрия вырастает до 7-14 мм.
Ранняя секреторная, 15-18 дни.
Внутренний слой матки утолщается до 10-16 мм, становится однородным из-за чего исчезает щель в месте смыкания полости матки.
Средняя секреторная, 19-23 дни.
Состояние не меняется, увеличивается толщина до 10-18 мм.
Поздняя секреторная, 24-27 дни.
Отмечается небольшая регрессия эндометрия – физиологичной снижение толщины до 9-17 мм.
Видно, что максимальные показатели толщины эндометрия приходятся на середину секреторной фазы, перед самыми месячными.
Затем этот слой отторгается и в начале цикла практически отсутствует.
В любом случае, физиологический предел нормы – толщина эндометрия 15 мм.
Все, что больше – считается гиперплазией, пациентку необходимо дообследовать.
Что касается минимальной границы нормы, то она для каждой фазы месячного цикла разная.
Соответствие или несоответствие толщины эндометрия физиологическим параметрам можно проверить только на УЗИ.

Толщина эндометрия: гиперплазия
Это общий термин, которым называют все случаи чрезмерной толщины эндометрия.
При этом подразумевается, что внутренний слой матки увеличен диффузно, по всей площади.
Вызывать такое состояние могут несколько разных факторов:
- Чрезмерная секреция эстрогенов и прогестерона стимулирует размножение клеток выстилки матки, рост сосудов.
- Воспалительные повреждения эндометрия (тогда гиперплазия – один из вариантов заживления).
- Вирусные инфекции.
- Метаболические нарушения – сахарный диабет, гиперактивность щитовидной железы.

Толщина эндометрия и гиперэстрогенемия
Суть проста: слишком высокие уровни эстрогенов и прогестерона в крови.
Механизма два:
- Первый – гиперсекреция этих гормонов железами внутренней секреции.
- Второй – выделение эстрогенов нормальное, но снижена продукция конкурирующих с ними андрогенов.
Оба явления сами по себе являются достаточно серьезной патологией.
Таким образом гиперплазия эндометрия может быть ведущим симптомом разной патологии:
- Персистенция фолликула, когда он после выхода яйцеклетки не рассасывается, а остается и продолжает синтез половых гормонов.
- Фолликулярные гормонально активные кисты яичников.
- Патологическая активность аденогипофиза – железы, которая расположена в головном мозгу и оказывает регулирующее действие на активность яичников.
- Нарушения обмена эстрогенов при нормальном уровне их синтеза: ожирение, болезни печени, гипотиреоз.
- Гиперплазия коркового слоя надпочечников.
Иногда диффузную гиперплазию эндометрия встречают даже при низких уровнях эстрогена (эстрадиола).
Как правило, это отмечается на фоне значительного повышения прогестерона.

Толщина эндометрия - что это?
Попельницкая Наталья Олеговна
Содержание данной статьи проверено и подтверждено на соответствие медицинским
стандартам врачем гинекологом
Гаряевой Ириной Владимировной
| Наименование | Срок | Цена |
|---|---|---|
| Прием гинеколога с осмотром на кресле | 1200.00 руб. |
Толщина эндометрия и воспалительные повреждения
В подобных ситуациях утолщение эндометрия – всего лишь компенсаторная реакция в ответ на тот или иной раздражитель.
Очень часто это бывает хроническая инфекция (ЗППП).
При этом могут отмечаться диффузное утолщение всего внутреннего слоя матки.
Так и очаговые изменения – кистозные перерождения, формирование участков с фиброзной (рубцовой) тканью.

Со временем, такой подостро текущий хронический эндометрит оказывает тормозящее влияние на работу яичников и ановуляцию.
Естественно, подобная патология делает зачатие и беременность невозможной.
Вирусные инфекции и толщина эндометрия
Цитомегаловирусы и другие представители этого вида микроорганизмов вызывают достаточно серьезные повреждения эндометрия.
Часто такому негативному воздействию повергается не только поверхностный железистый слой, но и более глубокий – базальный.
При сочетании хронической вирусной инфекции часто увеличивается концентрация рецепторов к эстрогенам на отдельном участке матке.
Результат – появление железистого полипа.
Эти образования бывают одиночными или множественными.
Часто располагаются в области дна и углов матки, негативно сказываются на возможности имплантации и вынашивания.

Какие ситуации наиболее серьезные?
Особого внимания требуют пациентки с неоднородной структурой – участками нормального и утолщенного эндометрия.
Физиологически, такое может быть только сразу после месячных или после выскабливания.
Во всех других случаях необходимо исключать онкологическую патологию.
Наиболее серьезные состояния, при которых может отмечаться гиперплазия эндометрия, это раковые процессы.
В гинекологии 50-х годов XX века даже считалось, что подобные состояния – прямое показание к удалению матки.
Сейчас же таким женщинам показано скрининговое УЗИ 2 раза в год и лечение основного процесса, вызвавшего патологию.
Толщина эндометрия: гипоплазия
Термин слегка относительный, так как в разные фазы менструального цикла, колебания довольно значительны.
Непосредственно гипоплазией считается несоответствие толщины эндометрия фазам регул.
Меньше 7 мм в первой половине (пролиферации) и меньше 8 мм во второй половине (секреции).
Причинами такого «недоразвития» могут становиться:
- Хронический эндометрит (ИППП, неспецифические инфекции)
- Гипофункция яичников
- Ожирение
- Снижение активности щитовидной железы
- Высокий уровень пролактина (гормона гипофиза)
- Синдром поликистозных яичников
- Врожденные аномалии надпочечников
При диффузном недоразвитии, несостоятельности, эндометрия ключевой проблемой является бесплодие.

Для того, чтоб после зачатия оплодотворенная яйцеклетка смогла уверенно и прочно имплантироваться, толщина эндометрия должна быть от 8 мм и больше.
В противном случае будет отмечаться классическое женское бесплодие.
Либо частые выкидыши: из-за слишком маленькой прослойки эндометрия не сможет полноценно сформироваться плацента.
Современные репродуктивные технологии помогают многим женщинам увеличить толщину эндометрия до физиологической нормы и все же стать матерью.
Но как этого добиться – всегда решается индивидуально.
Беременность и толщина эндометрия
После имплантации плодного яйца, в организме женщины начинаются серьезные гормональные перестройки.
Отражаются они и на эндометрии.
Чтоб обеспечить адекватное питание эмбриона, тот утолщается и на раннем сроке прослойка достигает 2 см и выше.
В дальнейшем, при нормально протекающей беременности, толщина не меняется, может несколько регрессировать ближе к родам.
Толщина эндометрия в менопаузе
С наступлением климакса снижается активность половых желез – яичников.
Это неизбежно приводит к падению уровней эстрогенов и как следствие – инволюции эндометрия.
Темпы снижения толщины внутреннего слоя матки всегда индивидуальны.
Но общая тенденция одинакова – физиологическая гипоплазия до 1-3 мм в периоде состоявшейся менопаузы.
(Без месячных на протяжении года и более).

Пролиферативные процессы и толщина эндометрия
Это всегда патология:
Единичные четко отграниченные участки обычно являются полипами.
Это доброкачественные разрастания, которые, однако, могут перерождаться в рак.
По толщине эндометрия заметить злокачественность сложно.
Врачи больше опираются на данные биопсии.
И при подозрении на рак матки, берут кусочек подозрительной ткани для цитологического анализа.
Аденомиоз и толщина эндометрия
Еще такую патологию называют «внутренний эндометриоз».
Участки утолщения эндометрия появляются за счет того, что он прорастает в мышечную оболочку матки.

Проявления неспецифичны:
- Обильные, затяжные менструации
- Заметное увеличение матки, в продвинутых стадиях процесса пальпаторно можно прощупать неровности контура ее тела
Зачатию и имплантации ранние формы аденомиоза практически не мешают.
Однако в процессе вынашивания и при родах могут создавать определенные проблемы.
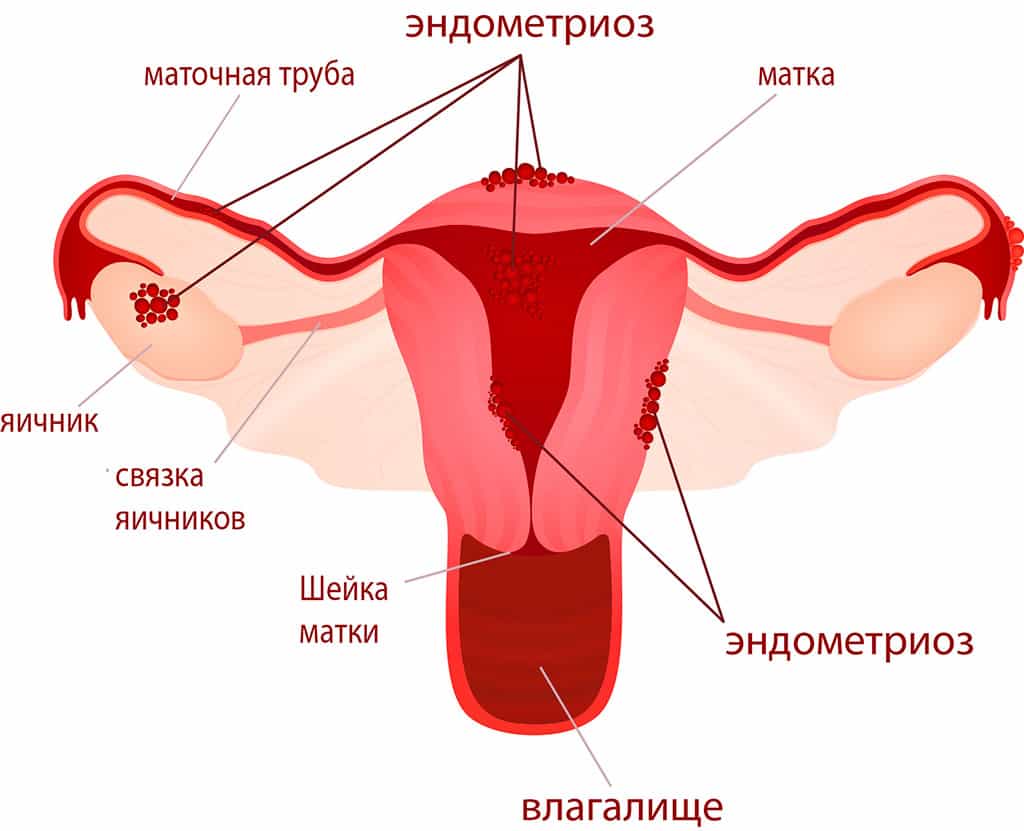
Толщина эндометрия при эндометриозе
На фоне этой патологии толщина эндометрия меняется незначительно.
Но он приобретает узелковую, неоднородную структуру.
И обнаруживается там, где его быть не должно, например – в цервикальном канале, на яичниках.
Рак и толщина эндометрия
Очень опасная и многоликая патология.
Единственный положительный момент.
Злокачественные опухоли практически всегда вырастают из очагов гиперплазии эндометрия: полипов, миоматозных узлов.
Выявить начальные стадии можно только методом УЗИ, МРТ или гистероскопии.
Поэтому такие обследования рекомендуется проходить не менее раза в год.
Особенно женщинам с бесплодием, патологией месячных и в менопаузе.
Если врач советует избавиться от доброкачественного внешне узла – стоит прислушаться к мнению профессионала.
При патологии эндометрия обращайтесь к опытным гинекологам нашего медицинского центра.
Читайте также:

