Экзема при недостатке витамина д
Обновлено: 23.04.2024
Для цитирования: Дворянкова Е.В., Пирузян А.Л., Смолкина О.Ю., Корсунская И.М. Влияние витамина D на течение атопического дерматита // Эффективная фармакотерапия. 2020. Т. 16. № 9. С. 40–43.
- Аннотация
- Статья
- Ссылки
- Английский вариант
Атопический дерматит – заболевание со сложным патогенезом. Как показывают результаты исследований, тяжесть его течения коррелирует с уровнем витамина D в сыворотке крови.
Рассматривается современное представление о роли витамина D в формировании барьерной функции эпидермиса, иммуномодулирующих процессах и изменении функции антимикробных пептидов кожи, влияющих на клинические проявления атопического дерматита. Обоснована необходимость включения витамина D в комплексную терапию данного заболевания.
- КЛЮЧЕВЫЕ СЛОВА: витамин D, дерматит, гиповитаминоз, зуд, высыпания
Атопический дерматит – заболевание со сложным патогенезом. Как показывают результаты исследований, тяжесть его течения коррелирует с уровнем витамина D в сыворотке крови.
Рассматривается современное представление о роли витамина D в формировании барьерной функции эпидермиса, иммуномодулирующих процессах и изменении функции антимикробных пептидов кожи, влияющих на клинические проявления атопического дерматита. Обоснована необходимость включения витамина D в комплексную терапию данного заболевания.
Атопический дерматит – хроническое рецидивирующее воспалительное заболевание кожи, вызывающее ксероз кожного покрова и характеризующееся зудом и высыпаниями, затрагивающими определенные участки тела. По мере того как заболевание прогрессирует от острого к подострому, к хронической стадии повышается интенсивность зуда и риск присоединения вторичных инфекций.
В ряде исследований изучалась связь между дефицитом витамина D и развитием атопического дерматита. Генетические полиморфизмы, включая те, которые связаны с рецептором витамина D и мутацией гена филаггрина (до 50% популяции с атопическим дерматитом в зависимости от конкретной мутации), были идентифицированы как факторы, способствующие развитию данной патологии [1, 2]. Было также обнаружено, что сывороточный уровень 25(OH)D коррелирует с тяжестью течения атопического дерматита. Он ниже у пациентов с тяжелой и среднетяжелой формой заболевания [3, 4]. Тем не менее существуют и противоположные данные. Например, более высокое потребление витамина D в течение первого года жизни ребенка коррелировало с повышенным риском развития атопического дерматита в течение первых шести лет. Независимо от семейного анамнеза данное заболевание было наиболее распространено у детей с самым высоким потреблением витамина D [5]. Другие исследователи не обнаружили ассоциации между развитием атопического дерматита у детей, степенью его тяжести и дефицитом витамина D [6].
С одной стороны, витамин D выступает в качестве защитного фактора, улучшая барьерные свойства кожи, с другой – в качестве фактора риска развития атопического дерматита. Эти противоречивые данные можно объяснить гипотезой, выдвинутой A.A. Benson и соавт. [7]. По мнению исследователей, существует статистически значимая нелинейная связь между уровнями 25(OH)D и иммуноглобулина E (IgE) в сыворотке крови. Пациенты с низким уровнем витамина D ( 54 нг/мл) имеют значительно более высокий уровень IgE, чем относительно здоровые люди (40–50 нг/мл). Было отмечено, что последующая коррекция уровня сывороточного содержания витамина D значительно снижает уровень IgE.
Согласно опубликованным данным, дефицит витамина D также коррелирует с выраженностью пищевой сенсибилизации. S.A. Lee и соавт. [8] при обследовании 157 больных атопическим дерматитом в возрасте от нуля до 15 лет выявили, что у 36 из них имела место пищевая аллергия. При этом сывороточный уровень витамина D был значительно выше у больных с легкими проявлениями непереносимости пищевых продуктов (21,20 ± 5,18 нг/мл), чем у лиц с умеренно выраженной и тяжелой пищевой аллергией (17,90 ± 4,02 и 13,30 ± 5,11 нг/мл соответственно).
Как было отмечено ранее, витамин D3 играет важную роль в обеспечении барьерной функции кожи. Он модулирует структурные белки ороговевшего слоя дермы, регулируя гликерамиды, необходимые для гидратирующего защитного липидного барьера, который поддерживает кожу увлажненной [9]. Он также модулирует врожденный иммунитет посредством производства антимикробных пептидов, кателицидина и дефензина, которые могут снизить риск инфицирования кожи [10]. Кроме того, U. Amon и соавт. указали на возможность витамина D оказывать ингибирующее влияние на продукцию моноцитов через Toll-подобные рецепторы, а также уменьшать активность дендритных клеток и снижать интенсивность высвобождения тучных клеток и интерлейкина 10 (ИЛ-10) [11]. Кроме того, они обсудили механизмы, за счет которых витамин D уменьшает высвобождение провоспалительных цитокинов из Th1-клеток и ингибирует высвобождение IgE [11]. Теоретически указанные механизмы могут уменьшить хроническое воспаление кожи.
Положительное воздействие витамина D заключается во влиянии не только на гомеостаз кальция, но и на метаболизм костной ткани.
Витамин D обладает иммуномодулирующим эффектом как на врожденный, так и на адаптивный иммунитет. Ядерные рецепторы к витамину D были обнаружены на многих иммунных клетках, таких как макрофаги, Т- и В-лимфоциты, особенно при их активации. Установлено, что активация этих рецепторов на дендритных клетках запускает антигенпрезентирующий механизм в адаптивном иммунном ответе, стимулирует активность Тh2 и влияет на дифференцировку нативной T-клетки в Тh2 [12]. Кроме того, витамин D ингибирует продукцию интерферона гамма и способствует выработке ИЛ-4, ИЛ-5 и ИЛ-10.
Рассматриваемый витамин стимулирует выработку и регулирует экспрессию антимикробных пептидов кожи, таких как кателицидины [13]. Учитывая вышесказанное, можно предположить, что дефицит витамина D может предрасполагать к развитию суперинфекции кожи Staphylococcus aureus или его суперантигенами у больных атопическим дерматитом.
T.T. Wang и соавт. в исследовании in vitro установили, что действие антимикробных пептидов, таких как кателицидин и бета-дефензин, усиливалось после приема витамина D [14]. P.T. Liu и соавт. [15] зафиксировали антимикробный ответ, вызванный Toll-подобным рецептором и опосредованным витамином D иммунитетом.
В клинических испытаниях также показано, что добавка витамина D способствует выработке кателицидина и вызывает экспрессию LL-37.
Таким образом, витамин D способствует противомикробной активности. При более низком уровне витамина D снижается как противомикробная активность, так и внешняя переносимость патогенов, что определяет ключевую роль витамина D в патогенезе атопического дерматита [16]. Низкий уровень витамина D может ухудшить течение патологии, особенно у детей.
В обзоре S.R. Hattangdi-Haridas и соавт. [17] отмечено, что в большинстве исследований зафиксировано снижение количества кожных инфекций после приема витамина D. В некоторых работах указывалось на наличие связи между более низкой концентрацией 25(OH)D и повышением риска вторичной колонизации кожи S. aureus и герпесом. Это позволило предположить, что повышение уровня 25(OH)D в популяции с атопическим дерматитом может способствовать снижению риска развития и профилактике вторичных кожных инфекций. При этом ученые отметили, что данное заключение было основано на небольшом количестве исследований, данных для проведения метаанализа недостаточно.
Улучшение уровня 25(OH)D приводит к усилению активности функционального человеческого кателицидина (hCAP18) в кератиноцитах как у пациентов с атопическим дерматитом, так и у больных псориазом и лиц со здоровой кожей [18]. В поддержку вышеупомянутых механизмов следует привести данные L.H. Albenali и соавт. [19]. Они указали, что более высокий уровень IgE, более высокая вирулентность и колонизация S. aureus были зафиксированы при низком уровне 25(OH)D в сыворотке крови. У лиц с дефицитом витамина D с помощью метициллин-резистентного S. aureus (MRSA) был обнаружен значительно повышенный риск поражения кожи [20–22]. M. Udompataikul и соавт. [23] отметили снижение колонизации S. aureus в детской популяции при добавлении витамина D. В свою очередь Z. Samochocki и соавт. [24] не наблюдали случаев заражения среди взрослых. L.H. Albenali и соавт. при добавлении витамина D зафиксировали четырехкратную активацию LL-37 в роговом слое и снижение выраженности атопического дерматита, осложненного герпетической экземой.
На содержание витамина D в сыворотке крови у детей влияет его величина у матери во время беременности. Так, у матерей, в крови которых содержание витамина D было достаточно высоким, рождались дети с низким риском развития атопического дерматита [25], в то время как дети матерей, у которых содержание витамина D было низким во время беременности, чаще болели указанной патологией.
В 2008 г. было проведено двойное слепое рандомизированное контролируемое исследование у детей с атопическим дерматитом [26]. Больные принимали витамин D в дозе 1000 МЕ/сут зимой в течение одного месяца. На фоне его приема значительно снизились клинические проявления атопического дерматита. Значительное уменьшение значения шкалы оценки тяжести атопического дерматита (SCORing Atopic Dermatitis – SCORAD) у больных, получавших витамин D в дозе 1600 МЕ/сут, было продемонстрировано в другом, достаточно крупном плацебоконтролируемом исследовании [27].
Известно, что прием витамина D приводит к синтезу и активации кателицидинов в кератиноцитах [18]. Повышенная частота развития и обострения инфекционных заболеваний кожи в зимний период может объясняться именно уменьшением продукции антимикробных пептидов кератиноцитами на фоне снижения выработки витамина D в организме.
Российские исследования также подтверждают эффективность включения препаратов витамина D в комплексную терапию атопического дерматита. В частности, в работе В.Ю. Пестовой указано, что назначение витамина D в дозе 500 мг два раза в день в течение трех недель привело к выраженному снижению показателей SCORAD [28].
Таким образом, результаты большого количества проведенных клинических исследований свидетельствуют о роли витамина D в патогенезе атопического дерматита и положительном его влиянии на течение заболевания. Эти наблюдения подтверждаются данными фундаментальных исследований, доказавших, что витамин D воздействует на многие структуры и функции организма, в том числе на работу иммунной системы.
В настоящее время широкое использование витамина D в терапии атопического дерматита ограниченно в связи с необходимостью накопления большего количества данных клинических исследований, а также отдаленных наблюдений.
Представляется целесообразным дальнейшее изучение перспектив применения витамина D в комплексной терапии атопического дерматита, уточнение эффективных терапевтических доз, а также схем и продолжительности лечения, которые должны корректироваться с учетом поступления данного витамина с продуктами питания и выработки его под воздействием естественной инсоляции и ультрафиолетового излучения в рамках физиотерапии.
Микеланджело Вестита, Анжела Филони, Маурицио Конгедо, Катерина Фоти, Доменикано Бонамонте. Университет Бари, Италия.
ВВЕДЕНИЕ
Атопический дерматит (АтД) – это распространенное хроническое заболевание кожи, клинически характеризующееся кожным зудом, эритематозными высыпаниями и нарушением эпидермального барьера [1].
АтД чаще встречаться у детей, но может возникать и у взрослых [2]; у этих пациентов обнаруживаются врожденные дефекты иммунной системы и снижение барьерной функции кожи [3].
Зачастую АтД связан с индивидуальной или семейной историей аллергических заболеваний I типа (аллергический ринит, бронхиальная астма) [4], возникает в результате взаимодействия экологических, генетических и иммунологических факторов.
Современное лечение тяжелых заболеваний является трудной задачей, так как терапия системными препаратами из – за отсутствия безопасности при их применении является ограниченной.
ВИТАМИН Д
Витамин Д (холекальциферол) – активный стероидный гормон. Функция витамина Д, традиционно, связана с метаболизмом кальция и фосфора, но последние исследования доказывают, что витамин Д играет роль в развитии сердечно – сосудистых заболеваниях, онкопатологии, инфекционных процессов и аутоиммунных заболеваниях [5]. В недавних исследованиях также обнаружена связь между дефицитом витамина Д и развитием аллергических заболеваний [7].
Существуют два пути синтеза витамина Д: при употреблении витамина Д с пищей, а также при фотохимическом воздействии ультрафиолетовых лучей спектра В. Витамин Д может поступать в организм с растительной пищей в виде витамина Д2 и животной пищей в виде витамина Д3 [8]. Далее витамин Д3 в печени подвергается гидроксилированию до образования 25 – гидроксивитамина Д. Эта молекула поступает в почки, где снова гидроксилируется с образованием зрелого витамина Д (1.25 – гидроксивитамин Д). Далее происходит активация рецептора витамина Д (VDR), который способствует экспрессии генов, отвечающих за метаболизм кальция, апоптоз, пролиферацию, дифференцировку и адаптивный иммунитет [9]. Лица с темной кожей, у которых меланин действует как природный солнцезащитный крем, те, которые регулярно используют солнцезащитные крема и которые долгое время проводят в помещениях, а также те, кто проживает в местностях с низкой инсоляцией, подвержены снижению синтеза витамина Д [10].
Выявлена обратная зависимость между уровнем витамина Д в сыворотке крови и возрастом. Причина этому в настоящее время неясна, но возможно это связано с тем, что взрослые меньше употребляют витамин Д с пищей, а также меньше времени проводят на открытом воздухе [11].
Такие причины, как ожирение, нарушения всасываемости в желудочно – кишечном тракте, паратиреоидный гормон, кальций, фосфор, факто роста фибробластов, влияют на уровень витамина Д в сыворотке крови.
Американская Академия педиатрии рекомендует детям и младенцам ежедневный прием витамина Д в дозировке 400 МЕ/сут, а Институт медицины и Общество по эндокринологии рекомендуют ежедневный прием витамина Д в дозе 400 МЕ грудным детям и 600 МЕ детям от 1 года до 18 лет [16].
ВИТАМИН Д И ИММУННАЯ СИСТЕМА
Биологическое действие витамина Д не ограничивается поддержанием кальциевого гомеостаза. Витамин Д также имеет иммуномодулирующее действие на врожденный и приобретенный иммунитет [17].
VDR, являясь ядерным рецептором, оказывает широкий спектр действия на иммунные клетки, такие как макрофаги и Т – и В – лимфоциты, особенно при его активации [19].
Активация VDR приводит к подавлению дендритных клеток, усилению Тh2 – клеточного ответа и подавлению Тh1 – клеточного ответа, а также смещению баланса в сторону продукции противовоспалительных цитокинов [20]. Также было отмечено влияние на дифференцировку наивных Т – клеток в Th2 – клетки [21].
Boonstra и соавт. [22] показали, что витамин Д у мышей подавляет продукцию ИНФ – γ и усиливает продукцию ИЛ – 4, ИЛ – 5 и ИЛ – 10.
Эти исследования указывают на то, что дефицит витамина Д приводит к активации Th1 – клеток и подавлению Th2 – клеток. Однако имеются ограниченные исследования доказывающие обратное.
ВИТАМИН Д И НАРУШЕНИЕ БАРЬРНОЙ ФУНКЦИИ КОЖИ
Витамин участвует в формировании барьера рогового слоя посредством синтеза белка (филаггрин), а также пролиферации и дифференцировки кератиноцитов.
Витамин Д стимулирует и регулирует выработку антимикробных пептидов в коже, таких как кателицидины [23]. Предположительно, что этот механизм связан с взаимодействием Toll – like рецепторов 2 порядка.
Антимикробные пептиды способствуют прямой антимикробной активности, а также через индукцию клеточного иммунитета (продукция цитокинов, процессы воспаления и ангиогенеза).
Учитывая вышеуказанные предположения, можно предположить, что дефицит витамина Д у пациентов с АтД способствует инфицированию кожи золотистым стафилококком и его суперантигенами [24].
ВЛИЯНИЕ ВИТАМИНА Д НА ТЯЖЕСТЬ И РАСПРОСТРАНЕННОСТЬ АТОПИЧЕСКОГО ДЕРМАТИТА
Имеются несколько исследований, которые оценивали уровень витамина Д на распространенность АтД.
Peroni и соавт. [26] обследовали 37 детей с легким течением АтД, 15 детей – с умеренным течением АтД, 9 детей – с тяжелым течением АтД. Тяжесть течения оценивали с помощью индекса SCORAD. Ими было отмечено, что уровень 25(ОН)Д в сыворотке крови был выше у пациентов с легким течение АтД по сравнению с пациентами с умеренным и тяжелым течением АтД. Аналогичные результаты были получены у El Taieb с соавт., которые обследовали 29 детей с АтД и 30 здоровых детей; у Wang с соавт. [28], которые сравнили 498 детей с АтД в Гонконге с 328 здоровыми детьми. Результаты этих исследований свидетельствуют о том, что тяжесть АтД связана с концентрацией витамина Д.
Однако, несмотря на вышеуказанные доказательства, ряд авторов указывают на противоположные результаты [29].
Back и соавт. [30] отмечают, что высокое употребление витамина Д в течение первого года жизни связано с риском развития АтД в возрасте до 6 лет. Ими было обследовано 123 ребенка в возрасте 6 лет с диагнозами АтД, аллергического ринита и бронхиальной астмы посредством анкетирования. Независимо от семейной анамнеза по атопии, у лиц с высоким употреблением витамина Д наблюдалось развитие АтД.
В рамках общенационального кросс – секционного исследования, в котором приняли участие 9838 немецких детей и подростков, страдающих АтД, Heimbeck с соавт. показали, что риск развития АтД ниже у детей с низким уровнем витамина Д в сыворотке крови по сравнению с контрольной группой [31].
Chiu и соавт., обследовав 94 ребенка в возрасте от1 года до 16 лет, которые проживали в Милуоки (США), обнаружили отсутствие достоверной значимости между уровнем витамина Д и тяжестью АтД [32]. У детей с легким течением АтД были обнаружены низкие уровни витамина Д в сыворотке крови по сравнению с пациентами с умеренным и тяжелым течением АтД, хотя эта разница была статистически не значима.
Преобладающее число исследований указывают на витамин Д в качестве защитного фактора от АтД, но также имеются данные о том, что высокий уровень витамина Д влияет на развитие АтД. Эти противоречивые результаты могут быть объяснены гипотезой, предложенной Benson с соавт [33], о бимодальном и/или гендерном отношении витамина Д и аллергическими заболеваниями кожи. Hypponen и соавт. [34] также показали статистически значимую нелинейную связь между концентрацией сывороточного витамина Д и уровнем общего IgE. Так, пациенты с низким (54 нг/мл) уровнями витамина Д имели достоверно более высокие уровни IgE по сравнению со здоровыми лицами (40 – 50 нг/мл). Последовательная корреляция сывороточной концентрации витамина Д значительно снижает уровень общего IgE.
ВЛИЯНИЕ КЛИМАТИЧЕСКИХ УСЛОВИЙ НА АТОПИЧЕСКИЙ ДЕРМАТИТ И УРОВЕНЬ ВИТАМИНА Д
Общеизвестно, что солнечное облучение, как правило, благотворно влияет на клиническое течение АтД. Так, распространенность АтД выше среди детей, рожденных осенью и зимой [35]. Аналогично, течение АтД ухудшается в зимний период вследствие снижения солнечной активности; также высокая распространенность дерматоза наблюдается среди детей, живущих в странах с неблагоприятным климатом [36].
Так как солнечное облучение увеличивает концентрацию витамина Д в сыворотке крови, некоторыми авторами было предложено, что клиническое улучшение течения АтД опосредовано витамином Д на молекулярном уровне.
Это предположение подтверждается наблюдениями, в которых указывается на то, что дефицит витамина Д связан с более тяжелыми поражениями на тех участках, которые не подвергались солнечному облучению [37]. Это может означать, что витамин Д является локальным защитным фактором в отношении развития поражений кожи.
Тем не менее, изучив пять различных популяционных выборок, Tissen и соавт. показали, что более высокие концентрации витамина Д обнаружены у носителей мутации в гене филаггрина. Это косвенно наводит на гипотезу, что рост АтД может быть следствием недостаточности витамина Д и низкого солнечного облучения.
АССОЦИАЦИЯ МЕЖДУ ПРЕДРАСПОЛОЖЕННОСТЬЮ К АТОПИЧЕСКОМУ ДЕРМАТИТУ И ВИТАМИНОМ Д
Lee и соавт. [39], обследовав 157 пациентов с АтД, 73.3% которых были в возрасте от 0 до 15 лет, установили, что у 36 пациентов были с пищевой сенсибилизацией, а уровни сывороточного витамина Д были значительно выше у пациентов с легким течением АтД (21.2±5.18 нг/мл) по сравнению с умеренным течением АтД (17.9±4.02 нг/мл) и тяжелым течением АтД (13.3±5.11 нг/мл).
Mohiuddin и соавт. [40] подтвердили эти результаты, показав, что у пациентов с тяжелым течением АтД, при повышении концентрации сывороточного витамина Д, вероятность развития пищевой аллергии уменьшается на 6%.
Akan и соавт. [42], обследовав 73 ребенка, показали отрицательную корреляцию между индексом SCORAD и уровнем витамина Д в сыворотке крови в группе с предрасположенностью к аллергическим заболеваниям, а также в группе без сенсибилизации.
ВИТАМИН Д У БЕРЕМЕННЫХ И КОРМЯЩИХ И АТОПИЧЕСКИЙ ДЕРМАТИТ
Уровень витамина Д у беременных
Давно изучается профиль витамина Д в течение беременности. Camargo и соавт. показали, что риск развития АтД снижен у детей, чьи матери имели высокие концентрации витамина Д во время беременности.
Gale и соавт [44]. сообщают о том, что высокие значения витамина Д у матерей во время беременности могут способствовать развитию аллергических заболеваний: у детей, чьи матери во время беременности имели концентрацию витамина Д более 30 нг/мл, имелся повышенный риск развития АтД в течение первых 9 месяцев жизни по сравнению с теми, чьи матери имели уровень витамина Д менее 12 нг/мл.
С другой стороны, в других исследованиях было показано, что дети, рожденные от матерей, которые мало употребляли рыбу и витамин Д во время беременности, имели высокую распространенность АтД [45, 46].
Уровень витамина Д в сыворотке пуповинной крови и атопический дерматит
Уровень витамина Д у кормящих
Существуют доказательства, что грудное вскармливание в первые четыре месяца способствует снижению риска развития АтД в первые 4 года жизни [51].
Back и соавт. доказали, что при грудном вскармливание и низком употреблении витамина Д , в отличие от вскармливания заменителями грудного молока, содержащими витамин Д, риск развития АтД у детей выше.
Пытаясь выяснить, может ли материнский витамин Д во время лактации способствовать улучшению течения АтД и других аллергических заболеваний, было проведено рандомизированное двойное слепое, плацебо – контролируемое исследование, в котором приняли участие 164 кормящих женщин с младенцами, у которых на лице были признаки АтД [52].
Проведенный анализ показал, что добавление витамина Д не способствует снижению выраженности АтД в возрасте 3 месяцев, но может способствовать развитию пищевой аллергии до 2 лет. Недостатками этого исследования являются большое количество пациентов, исключенных из анализа в ходе исследования, а также неадекватные критерии постановки диагноза АтД.
Milner и соавт. [53] выявили, что употребление поливитаминов в младенческом возрасте способствует развитию пищевой аллергии и астмы у африканской расы.
Однако, полученные данные о добавлении витамина Д в рацион питания и распространенности АтД должны оцениваться критично.
Пищевая сенсибилизация и высокая частота атопии у детей связаны с повышенной кишечной проницаемостью. Таким образом, рост распространенности АтД у детей с повышенным употреблением витомина Д может возникнуть в результате данной алиментарной особенности, а не с уровнем витамина Д в сыворотке крови.
ПОЛИМОРФИЗМ ГЕНОВ ВИТАМИНА Д
В 2002 году Heine с соавт. [54] установили, что взрослые люди с тяжелыми формами АтД часто имеют полиморфизм гена VDR. Это открытие свидетельствует о том, что ген VDR посредством регуляции функции эпидермального барьера и иммунной системы влияет на развитие и течение АтД.
Собственно говоря, ген VDR подавляет созревание дендритных клеток и снижает продукцию провоспалительных цитокинов (IL – 6, TNF – α). Тем не менее, полиморфизм гена VDR также часто встречается у здоровых людей. Было предположено, что ген VDR действует в качестве кофактора, и для развития заболевания требуется дополнительные экологические и генетические факторы.
В 2014 году Wang с соавт. [54] установили ассоциацию между витамином Д и полиморфизмом гена rs4674343 на CYP27A1 на развитие атопической экземы. Гены (VDR, CYP2R1) увеличивают предрасположенность к развитию АтД, изменяя уровень эозинофилов и общего IgE.
Van Belle и соавт. установили, что полиморфизм гена VDR и генов метаболизма является предрасполагающим фактором развития аутоиммунных заболеваний, но требуются дальнейшие исследования этих утверждений.
Также имеются доказательства относительно повышенного риска развития атопии и бронхиальной астмы и полиморфизма гена VDR [57, 58].
ТЕРАПЕВТИЧЕСКАЯ ТАКТИКА
Назначение витамина Д
В исследовании [59], в котором принимали участие 132 пациента с АтД и 132 здоровых человека, было выявлено, что пациенты с АтД имели дефицит витамина Д в пище по сравнению с контрольной группой. Уровень витамина Д в сыворотке крови у них не измеряли.
На основании этого исследования были проведены клинические испытания для изучения терапевтической роли назначения витамина Д в виде пищевых добавок на лечение АтД.
В 2008 году было проведено двойное слепое рандомизированное контролируемое исследование по влиянию применения витамина Д в дозировке 1000 МЕ/сутки в течение одного зимнего месяца у детей с АтД [60]. 5 пациентов принимали витамин Д, а 6 пациентов находились в группе плацебо. У 4 из 5 детей, получавших витамин Д, наступило улучшение, и только у 1 из 6 из контрольной группы также наблюдалось улучшение состояния. Это исследование было ограничено числом пациентов.
Других исследований с детской выборкой нет, но имеется большой объем данных по взрослым. Javanbakht и соавт. провели рандомизированное, двойное слепое, плацебо – контролируемое исследование, включающее 45 пациентов с АтД [61]. Для оценки клинического улучшения использовался индекс SCORAD, который снизился у пациентов, которые принимали витамины Д и Е.
В другом исследовании [62] также было показано снижение индекса SCORAD после применения витамина Д. 30 пациентов принимали витамин Д в дозировке 1600 МЕ/сутки, и 30 пациентов принимали плацебо. В группе, где пациенты принимали витамин Д, наблюдалось улучшение через 60 дней вне зависимости от тяжести и течения АтД, и уровень витамина Д в сыворотке крови был достоверно выше по сравнению с исходными значениями. В группе плацебо улучшение было незначительное.
Hata и соавт. проанализировали применение витамина Д в дозе 1000 МЕ/сутки в течение 3 недель у 14 пациентов с умеренным и тяжелым течением АтД [64], и показали значительный рост кателицидинов в поврежденной коже.
Mallbris и соавт. подтвердили это открытие, показав что прием витамина Д способствует активации кателицидинов и пролиферации кератиноцитов. Приведенные исследования объясняют причину развития инфекционных дерматозов зимой, когда снижена стимулированная витамином Д, выработка антимикробных пептидов в коже.
Однако, в систематическом обзоре 2012 года неописано существенных различий течения АтД на фоне приема витамина Д по сравнению с приемом плацебо [65].
Пытаясь прояснить этот вопрос, в 2013 году Samochocki и соавт. провели исследование, для которого были отобраны 20 из 95 пациентов для применения витамина Д (2000 МЕ холекальциферола (25(ОН)Д) в сутки). Средние концентрации витамина были низкими, между 4 и 15 нг/мл. После приема витамина Д индекс SCORAD был ниже. Аналогично, после приема витамина Д все параметры индекса SCORAD, кроме лихенификации, оказались ниже по сравнению с исходными. Через 3 месяца применения витамина Д пациенты перешли от дозировки
Солнечное облучение (гелиотерапия)
Многие исследователи оценивали влияние гелиотерапии на уровень витамина Д и тяжесть течения АтД. Vahavihu и соавт. провели исследование, в которое вошли 23 пациента из Скандинавии, получавшие ежедневно гелиотерапию в январе (11 пациентов) и в марте (12 пациентов). Перед гелиотерапией 17 из 23 пациентов имели дефицит витамина Д. После 2 недель проведения гелиотерапии только у 4 пациентов наблюдался дефицит витамина Д. Следует отметить, что имеется положительная корреляция между увеличением витамина Д и снижением индекса SCORAD у пациентов, которые участвовали в марте. Аналогичное исследование было проведено на 18 пациентах с АтД. 16 из 18 пациентов имели дефицит витамина Д. Они прошли 15 сеансов узкополосной УФО – В. Эта терапия привела к увеличению концентрации витамина Д в сыворотке крови. Также у этих пациентов отмечено снижение индекса SCORAD.
Топическая терапия
Имеются наблюдения, направленные на изучение роли местного применения аналогов витамина Д. Было замечено, что местное применение 1.25 – дигидроксикальциферола у мышей приводит к появлению высыпаний подобных таковым при атопическом дерматите. Данное проявление было объяснено, как не проявление раздражающего контактного дерматита, а скорее VDR – зависимый и тимусный стромальный лимфопротеин – зависимый процессы [71, 72].
ВЫВОДЫ
Эпидемиологические и клинические доказательства указывают на положительную роль витамина Д при АтД. Эти доказательства подкрепляются фундаментальными исследованиями, показывающие влияние витамина Д на функции иммунных клеток. Однако, пока неясно, как данные доказательства могут способствовать массовому применению витамина Д населением.
Кроме того, в настоящее время невозможно разработать тактику лечения витамином Д при АтД по многим причинам: в существующих исследованиях представлены противоречивые данные, ограниченное число участвовавших в этих исследования, а также короткий срок проведения исследований и нет данных по фиксированной дозировки витамина Д и концентрации витамина Д в сыворотке крови. Поэтому в настоящее время нет возможности рекомендовать применение витамина Д при АтД в детской дерматологии, за исключением случаев, когда традиционная терапия оказывается неэффективной.
Дополнительные исследования с адекватной выборкой участников, коррекцией дозировки витамина Д, определением концентрации витамина Д в сыворотке крови должны быть продолжены. А также необходим учет тяжести АтД и стандартизация оценки тяжести АтД, сопутствующих факторов, таких как солнечное облучение и рацион питания.

Эпигенетика может играть важную роль в развитии заболеваний человека. По образному выражению Питера и Джин Медаваров, «генетика предполагает, а эпигенетика располагает» [1]. Полиморфизм генов предрасположенности в сочетании с неблагоприятными внутренними и внешними факторами повышает риск развития заболеваний. К числу важнейших факторов, влияющих на эпигеном, относятся питание, физическая активность, неблагоприятная экология, ионизирующая радиация и др. Сбалансированный пищевой рацион и рациональная нутрициональная поддержка помогают укрепить собственные защитные силы организма, повысить его сопротивляемость и репаративный потенциал в т.ч. за счет эпигенетической модуляции работы клеточного генома.
Ключевые слова: эпигенетика, нутрициональная поддержка, омега-3 полиненасыщенные жирные кислоты, витамин D
Кожные заболевания, такие как атопический дерматит (АД), экзема, псориаз, витилиго, красная волчанка и другие, по праву можно отнести к группе сложных многофакторных заболеваний, в основе которых лежит генетическая предрасположенность. На возникновение и течение хронических дерматозов, помимо генетической предрасположенности, влияют следующие эпигенетические факторы: образ жизни и уровень стресса (оксидативный, физиологический, психологический), воздействие факторов окружающей среды (токсины, загрязняющие вещества, радиация), нутрициональные факторы (дефицит макро- и микронутриентов, в частности омега-3 ПНЖК, железа, витамина D), гормональные факторы и старение (возраст-ассоциированные изменения).
В течение последних десятилетий рацион современного человека претерпел значительные изменения, что отразилось на содержании в пищевых продуктах специфических компонентов, таких как омега-3 ПНЖК, витамин D, антиоксиданты, железо, фолаты, и это не моглоне сказаться на глобальном росте аутоиммунных и аллергических заболеваний в обществе. В настоящее время в России у очень немногих людей питание может считаться сбалансированным. Повседневный рацион большинства россиян в XXI в. — высокоуглеводная и жирная пища с недостаточным количеством животного белка, дефицитом витаминов и микроэлементов.

Дефицит витамина D является новой неинфекционной пандемией XXI в. среди взрослых людей, проживающих севернее 35-й параллели, что обусловлено дефицитом инсоляции у жителей мегаполисов. Он патогенетически связан с ростом распространенности аутоиммунных заболеваний — сахарного диабета 1-го типа, ревматоидного артрита, атопического дерматита, гнездной алопеции, системной красной волчанки, псориаза и др. [2–7]. Жители всей территории России, Европы, практически всей Северной Америки попадают в зону риска дефицита/недостаточности витамина D, что неудивительно, так как угол падения УФ-лучей в этих регионах земного шара не позволяет полноценно использовать механизм синтеза витамина D в коже. Согласно данным многочисленных исследований, можно утверждать, что не менее 50% населения земного шара имеют в той или иной выраженности дефицит витамина D [8]. В группе риска находятся грудные младенцы, пожилые люди, люди с ограниченными возможностями пребывания на солнце, темнокожие, люди с ожирением, люди с заболеваниями, сопровождающимися нарушением всасывания жиров, в т.ч. перенесшие операции шунтирования желудка. С возрастом доля людей с дефицитом витамина D увеличивается до 80–90% [9].
В настоящее время витамин D рассматривается не только как гормон, регулирующий кальциевый гомеостаз и остеогенез, но и как фактор, участвующий в регуляции клеточной пролиферации и дифференцировке, апоптозе, иммуногенезе [10]. Доказано влияние витамина D на патогенез многих дерматозов, в особенности с аутоиммунным механизмом развития.
К центральным механизмам, лежащим в основе системных проявлений как псориаза, так и дефицита витамина D, относят низкоактивное генерализованное неспецифическое воспаление [11]. Под влиянием витамина D увеличивается синтез IL-10, подавляющего активность Thl-клеток, и снижаются уровни TNF-α и IFN-γ [12]. В исследованиях Бекировой Э.Ю. выявлено ингибирующее действие на синтез TNF-α мононуклеарными клетками витамина D [13]. В исследовании Peterson C.A., Heffernan M.E. доказана обратная корреляционная зависимость между сывороточными уровнями 25(OH)2D и уровнем TNF-α, что подтверждает противовоспалительные биологические эффекты витамина D [14].
На настоящий момент существуют как экспериментальные, так и клинические работы, демонстрирующие мощный антипролиферативный эффект витамина D в кератиноцитах эпидермиса, что может обеспечивать защиту кожи от некоторых видов рака, в т.ч. и наиболее злокачественной формы — меланомы.
Омега-3 ПНЖК
Значительное количество пищевых нутриентов уже имеют доказанное влияние на иммунные функции. Наиболее хорошо изучены в этом контексте полиненасыщенные жирные кислоты омега-3 (ПНЖК), которые используют в терапии хронических воспалительных заболеваний кожи — псориаза, атопического дерматита, акне, трофических язв и др. Они способствуют предотвращению и снижению воспалительных и аллергических процессов, в т.ч. при заболеваниях с нарушением в иммунном статусе.
В эстетической медицине омега-3 ПНЖК рекомендуют для профилактики преждевременного старения кожи, защиты от повреждений, связанных с инсоляцией. Омега-3 ПНЖК стимулируют рост и деление клеток, обеспечивают синтез коллагена, что позволяет бороться с морщинами, атрофией и ксерозом кожи.
Выявленные патогенетические изменения у больных псориазом показывают, что они нуждаются не только в медикаментозной, но и нутрицевтической поддержке. Эту необходимую поддержку обеспечивают омега-3 ПНЖК, являясь эссенциальными факторами питания [19–21]. Они незаменимы для нормального обмена веществ в организме человека. Доказано, что в результате проведения коррекции дефицита омега-3 ПНЖК у больных псориазом наблюдается положительный противовоспалительный эффект, уменьшается активность течения дерматоза и количество рецидивов заболевания. Важно отметить, что данная коррекция способствует нормализации показателей липидного обмена и повышению эффективности терапии в целом [22–26].
На сегодняшний день существует необходимая доказательная база, достаточная для утверждения, что каждый человек, проживающий в регионе с обедненным содержанием омега-3 ПНЖК в рационе (вся территория России), должен дополнительно принимать к пище препараты, содержащие ЭПК и ДГК для профилактики возраст-ассоциированных заболеваний, неинфекционных заболеваний, увеличения продолжительности и качества жизни.
Дефицит железа
Железо является эссенциальным биометаллом, играющим важную роль в функционировании всех клеток организма. Биологическое значение железа определяется его способностью обратимо окисляться и восстанавливаться, что обеспечивает его участие в процессах тканевого дыхания. При дефиците железа развивается состояние гипоксии во всем организме.
По данным ВОЗ, железодефицитное состояние диагностируется у 3,6 млрд человек, что превышает 1/3 часть всего населения нашей планеты, и бо´льшая часть из них — женщины и дети. Несбалансированное и недостаточное как в качественном, так и в количественном отношении питание привело к тому, что на территории России около 12% женщин фертильного возраста страдают ЖДА, а скрытый дефицит железа наблюдается почти у половины данной категории женщин. А по данным Минздравсоцразвития РФ, в России каждый третий ребенок и практически каждая беременная и кормящая женщина страдают ЖДА либо имеют латентный дефицит железа.Значительное влияние дефицита железа на психическое и физическое развитие, поведение и работоспособность делает его серьезной проблемой для здоровья общества. Со стороны кожного покрова сидеропения проявляется повышенной сухостью, замедлением регенерации кожи, тусклостью, ломкостью и замедленным ростом волос, ониходистрофией и койлонихией. Кроме этого, отмечается извращение вкуса и обоняния из-за развития эпителиопатии.
Восполнить дефицит железа без назначения лекарственных препаратов невозможно, однако поддержание его достаточного уровня в организме — задача грамотной диетической коррекции. Содержание железа в продуктах питания может быть достаточным, но его биодоступность невысока: не более 10% гемового и 1–1,5% негемового железа. Кроме того, усвоение железа сильно зависит от микроокружения пищи. Следовательно, использование продуктов питания, дополнительно обогащенных железом, является не только целесообразным, но и необходимым.
Заместительная гормональная терапия
Состояние кожи и ее производных (волос и ногтей) находится под влиянием целого ряда нейрогуморальных факторов, среди которых важную роль играют гормоны. Гормоны определяют толщину и рельеф эпидермиса, тип оволосения и свойства волос, секреторную активность сальных и потовых желез, состояние ногтей, кровоснабжение кожи и др. [27].
Основными половыми гормонами, обеспечивающими красоту и здоровье кожи, являются эстрогены, которые в физиологических концентрациях придают коже упругость, способствуют синтезу волокон зрелого коллагена, участвуют в регенерации, укрепляют дермо-эпидермальное соединение и регулируют функции сальных желез. Поэтому дефицит эстрогенов способен быстро приводить к увяданию и истончению кожи, повышению ее сухости и травматизации, что внешне будет проявляться в виде сетки мелких морщин и шелушения.
Однако для здоровья кожи и ее производных женщине необходимы не только эстрогены, но и прогестерон с тестостероном. Прогестерон тормозит синтез тропоколлагена в фибробластах соединительной ткани и оказывает незначительное стимулирующее действие на сальные железы, способствуя секреции кожного сала [28]. Сегодня есть данные об эффективности применения прогестерона при лечении угревой болезни у женщин, поскольку он тормозит биотрансформацию тестостерона в 5α-дигидротестостерон (5α-ДГТ) и конкурирует с 5α-ДГТ за андрогеновые рецепторы в волосяных фолликулах и сальных железах, снижая их активность.
Тестостерон регулирует интенсивность клеточного деления, процессы дифференциации, секреции и ороговения. Этот гормон придает коже мягкость, эластичность, упругость и влияет на бактерицидные функции кожи, которые зависят от уровня ее кровоснабжения и функционального состояния потовых и сальных желез. Под влиянием тестостерона кожа сохраняет необходимую увлажненность за счет формирования полноценного липидного барьера вследствие повышения активности сальных желез. Тестостерон также оказывает противовоспалительные эффекты, поскольку он подавляет действие протеолитических ферментов, связанных с деградацией коллагена. Тестостерон отвечает за синтез коллагена, миозина, актина и других мышечных белков, поэтому его роль в поддержании мышечного тонуса кожи является одной из ключевых [27].
Старение кожи является отражением всех гормональных нарушений, которые развиваются в связи с системным старением. К настоящему времени накоплен огромный доказательный базис для утверждения, что клинический дефицит половых гормонов (эстрогенов, прогестерона и тестостерона) у женщин является абсолютным показанием для назначения им заместительной гормональной терапии соответствующими гормонами. Такой подход позволяет укрепить женское здоровье и красоту изнутри, что одновременно способствует улучшению здоровья кожи, существенно повышая эффективность традиционных косметологических процедур.
Кроме того, при проведении исследования влияния ЗГТ на течение псориаза 2-го типа у женщин в постменопаузе было доказано, что дополнительное включение ЗГТ в состав комплексной терапии псориаза способствует повышению эффективности терапии с выраженной редукцией клинических симптомов и улучшением качества жизни и сопряжено с коррекцией гормонального статуса крови [29].
Заключение
Таким образом, к лечению дерматологического пациента нужно подходить комплексно, учитывая все эпигенетические факторы. Ведь, как уже говорилось выше, «генетика предполагает, а эпигенетика располагает». Поэтому, помимо назначения стандартной схемы лечения дерматоза, важно заниматься коррекцией нутрициональных и гормональных дефицитов. Особое значение имеет коррекция дефицита витамина D, омега-3 ПНЖК, железа и возраст-ассоциированного дефицита половых гормонов.
Хочется отметить линейку препаратов NFO (NFO Оmega-3; NFO Gentle Iron; NFO Vitamin D), зарекомендовавших себя как эффективные компоненты нутрицевтической поддержки. Важно понимать, что при устранении всех этих триггерных факторов у пациента будет наблюдаться более длительная ремиссия. Соответственно, комплексный подход к лечению пациента — ключ к успеху.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Утолщение кожи: причины появления, при каких заболеваниях возникает, диагностика и способы лечения.
Определение
Гиперкератоз – это аномальное утолщение верхнего слоя кожи (эпидермиса) в результате избыточной инсоляции, воздействия химических веществ, частого трения или давления. Кроме того, гиперкератоз может возникать на фоне некоторых заболеваний.
Утолщение кожи происходит в роговом слое эпидермиса, который является конечной точкой процесса дифференцировки кератиноцитов - клеток, содержащих белок кератин. Именно в роговом слое кератиноциты теряют воду и ядро и превращаются в чешуйки рогового слоя – корнеоциты.
При гиперкератозе происходит ускоренная дифференцировка кератиноцитов, а физиологическое слущивание роговых чешуек с поверхности кожи, наоборот, замедляется.
Разновидности гиперкератоза
В зависимости от происхождения выделяют приобретенный и наследственный гиперкератоз.
По клиническим проявлениям.
- Мозоли – часто встречающаяся разновидность гиперкератоза. Различают несколько видов мозолей, но все они появляются вследствие утолщения кожи в местах, наиболее подверженных механическому воздействию. Причем такое изменение кожи может быть связано как с усиленными физическими нагрузками, так и с различными хроническими заболеваниями, что характерно для пожилых пациентов.
- Роговая (тилотическая) экзема проявляется гиперкератозом ладоней и подошв.
- Псориаз - аутоиммунное воспалительное заболевание, при котором на коже формируются гиперкератотические чешуйчатые бляшки.
- Актинический кератоз обычно представлен небольшими красноватыми чешуйчатыми выпуклостями, которые появляются после избыточной инсоляции. Актинический кератоз – серьезное состояние с высокой вероятностью озлокачествления и требует обязательной консультации врача.
- Себорейный кератоз характеризуется маленькими коричневыми или черными пятнами, обычно локализующимися на лице, шее, плечах и спине. Это одно из наиболее распространенных доброкачественных новообразований кожи у взрослых.
- Фолликулярный гиперкератоз («гусиная кожа») характеризуется закупоркой устьев фолликулов ороговевшими клетками эпидермиса.
- Эпидермолитический гиперкератоз - редкое наследственное заболевание, которое проявляется сразу при рождении. Новорожденные имеют красноватую кожу, иногда покрытую небольшими волдырями.
Гиперкератоз кожи может возникнуть у людей, которые пренебрегают регулярными процедурами по уходу за кожей, в результате чего отмершие клетки рогового слоя скапливают и формируют кератомы – доброкачественные новообразования.
Наша кожа постоянно подвергается воздействию неблагоприятных внешних факторов, таких как хлорированная вода и моющие средства, УФ-излучение. В результате повреждается защитный липидный слой кожи, и влага начинает интенсивно испаряться с ее поверхности, а корнеоциты теряют способность к физиологическому слущиванию.
При сахарном диабете гиперкератоз становится следствием нарушения обмена веществ и ухудшения микроциркуляции кожи.
Ношение тесной или неудобной обуви, особенно при плоскостопии, врожденных патологиях стоп, ожирении, может стать причиной утолщение кожи на стопах.
Развитию гиперкератоза шейки матки (лейкоплакии) способствует вирус папилломы человека.
Причиной гиперкератоза может стать хроническое грибковое поражение, а также опоясывающий лишай.
Считается, что симптомы утолщения и сухости кожи могут быть вызваны дефицитом витаминов А, Е, D и С.
Гиперкератоз нередко становится следствием недостатка гормона эстрогена у женщин в период менопаузы.
Заболевания и состояния, при которых развивается гиперкератоз
- Сахарный диабет.
- Ожирение.
- Плоскостопие.
- Ихтиоз.
- Псориаз.
- Экзема.
- Менопауза.
- Грибковое поражение кожи.
- Опоясывающий лишай.
- Эритродермия.
- Атопический дерматит.
- Себорейный кератоз.
Чаще всего за первой консультацией по поводу утолщения кожи обращаются к врачу-дерматологу. После тщательного осмотра, сбора жалоб, выяснения медицинской и семейной истории пациента, проведения лабораторных и инструментальных исследований может потребоваться консультация врача-эндокринолога , врача-онколога , врача-инфекциониста.
Диагностика и обследования при утолщении кожи
Тщательный сбор анамнеза с учетом всех жалоб пациента, осмотр и проведение дополнительных методов диагностики помогут установить причину гиперкератоза.
-
Клинический анализ крови с развернутой лейкоцитарной формулой для выявления воспалительных процессов в организме.
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Напоминаем вам, что самостоятельная интерпретация результатов недопустима, приведенная ниже информация носит исключительно справочный характер.
25-OH витамин D: показания к назначению, правила подготовки к сдаче анализа, расшифровка результатов и показатели нормы.
Показания для назначения исследования
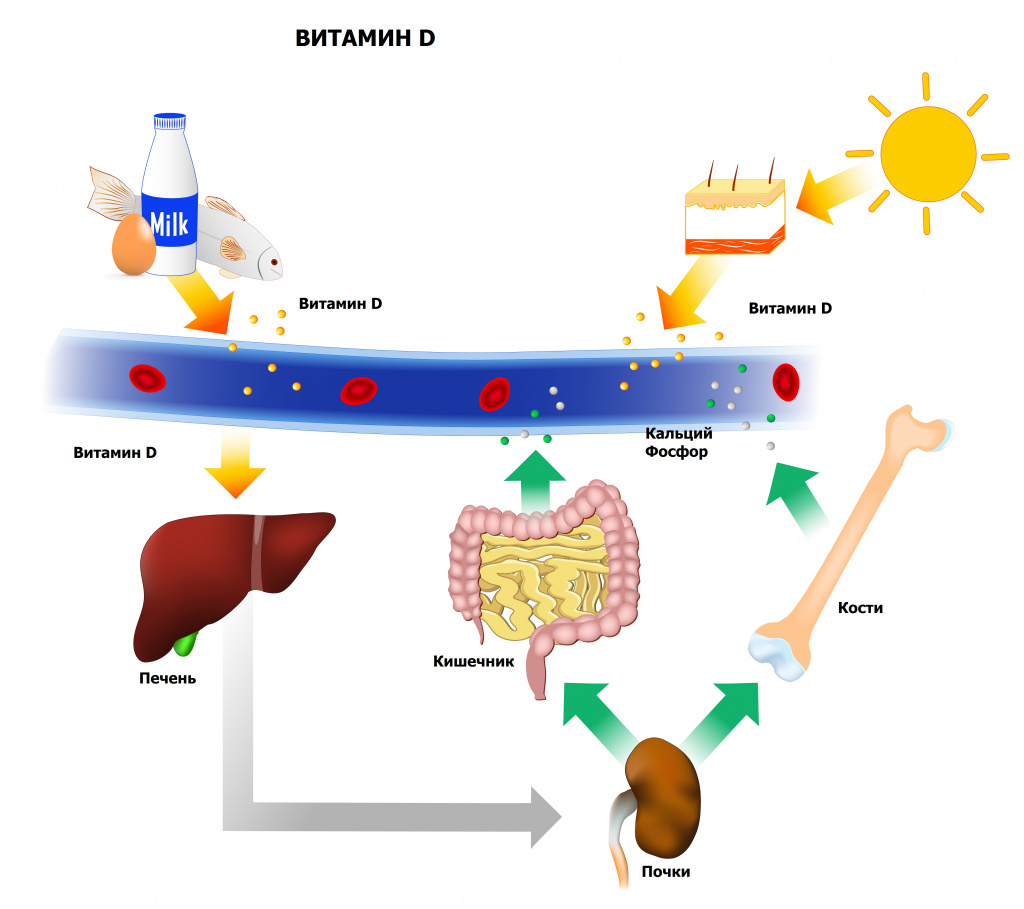
Витамин D – жирорастворимое вещество, которое обеспечивает всасывание в тонком кишечнике кальция и фосфора и поддержание в крови их уровня. Он вырабатывается в коже под воздействием ультрафиолетовых лучей (витамин D3, холекальциферол), а также поступает в организм с пищей (витамин D2, эргокальциферол): содержится в жирной рыбе, яйцах и молочных продуктах. Концентрация 25(OH)D отражает вклад обоих компонентов.

Анализ на витамин D могут назначить врачи разных специальностей: педиатр, терапевт, ортопед, травматолог, ревматолог или эндокринолог при наличии одного или нескольких показаний:
- дефицит витамина D (симптомы рахита у детей, остеопороза – у взрослых);
- комплексная диагностика обмена кальция;
- синдром мальабсорбции (нарушение всасывания питательных веществ в кишечнике);
- контроль эффективности лечения препаратами, содержащими витамин D;
- подготовка к беременности или во время беременности;
- повышенная усталость, депрессивные состояния.
Подготовка к процедуре
Синонимы: Анализ крови на витамин Д; Витамин Д; 25-гидроксивитамин D; 25-гидроксикальциферол. Холекальциферол и эргокальциферол. Vitamin D, 25-Hydroxy; 25-Hydroxycalciferol; 25-OH-D; calcidiol (25-hydroxy-vitamin D); calcifidiol (25-hydroxy-vitamin D); 25(OH)D, Cholecalciferol Metabolite, Vitamin D.
Что может повлиять на результат
- При проведении исследования в весенне-летний период возможно получение нормального результата. Однако с уменьшением длины светового дня уровень витамина D снижается. Поэтому для получения более достоверного показателя рекомендуется сдавать этот анализ осенью или зимой.
- При приеме витамина D в дозировке более 7000 МЕ/сут определение 25(OH)D целесообразно проводить не ранее, чем через три дня с момента последнего приема препарата, если иное не предписано лечащим врачом.
- Если пациенту проводилась флуоресцентная ангиография (исследование сосудов глазного дна), то анализ крови на витамин D рекомендовано сдавать не ранее, чем через 72 часа после процедуры.
Сдать 25-OH витамин D (анализ крови на витамин D) вы можете в ближайшем медицинском офисе ИНВИТРО. Список офисов, где принимается биоматериал для лабораторного исследования, представлен в разделе «Адреса».
Интерпретация результатов исследования содержит информацию для лечащего врача и не является диагнозом. Информацию из этого раздела нельзя использовать для самодиагностики и самолечения. Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза, результатов других обследований и т. д.
D 25-OH витамин D – основной метаболит витамина D, присутствующий в крови. Он синтезируется преимущественно в печени, обладает умеренной биологической активностью, переносится в комплексе с транспортным белком. Небольшая часть 25(OH)D подвергается гидроксилированию в почках с образованием более активного метаболита – 1,25(OH)D, который стимулирует всасывание кальция в кишечнике и реабсорбцию кальция и фосфора в почках. Уровень 25(OH)D считается лучшим индикатором статуса витамина D в организме.
Нормальные показатели
Рекомендации Российской ассоциации эндокринологов по интерпретации результата
| Возраст | Рекомендации по интерпретации 25-OH витамин D, нг/мл |
| До 18 лет | < 20 нг/мл – дефицит 20–30 – недостаточность 30–100 – адекватный уровень > 100 – возможен токсический эффект |
| Старше 18 лет | < 10 нг/мл – выраженный дефицит < 20– дефицит 20–30 – недостаточность 30–100 – адекватный уровень (целевые значения при коррекции дефицита витамина D – 30–60) > 150 – возможен токсический эффект |
Расшифровка показателей
- недостаточное поступление с пищей (строгая вегетарианская диета);
- нарушение всасывания в кишечнике (синдром мальабсорбции, воспалительные заболевания кишечника);
- недостаточное количество солнечного света (проживание в северных регионах, осенне-зимний период);
- хронические заболевания печени или почек, из-за которых нарушается обмен витамина D;
- прием лекарств (фенитоина, фенобарбитала, рифампицина, пероральных антикоагулянтов), влияющих на способность организма преобразовывать или усваивать витамин D.
Кто подвержен риску дефицита витамина D
- Дети, длительное время находящиеся на грудном вскармливании.
- Беременные.
- Вегетарианцы и веганы.
- Проживающие в местности с малым количеством солнечных дней в году.
- Пожилые, поскольку с возрастом снижается эффективность выработки кожей витамина D и способность почек преобразовывать его в активную форму.
- Пациенты с болезнью Крона или целиакией, при которых нарушено нормальное всасывание питательных веществ в кишечнике из-за воспалительных процессов.
- Пациенты, перенесшие шунтирование желудка.
- Пациенты с остеопорозом – заболеванием, при котором происходит снижение минеральной плотности костной ткани. Чаще возникает в пожилом возрасте.
- Имеющие хроническое заболевание почек или печени.
- Пациенты с гиперпаратиреозом – заболеванием паращитовидных желез, при котором повышается уровень паратиреоидного гормона, участвующего в обмене кальция в организме.
- Больные саркоидозом, туберкулезом, гистоплазмозом или другими гранулематозными болезнями, при которых образуются специфические воспалительные узелки – гра¬нулемы, вызывающие нарушения в функционировании органов и систем.
- Пациенты с некоторыми видами злокачественных лимфом.
- Принимающие препараты, которые влияют на обмен витамина D: холестирамин, противосудорожные, глюкокортикоиды, противогрибковые, лекарства от ВИЧ.
Причины, ведущие к повышению уровня витамина D
- Передозировка витамина D.
- Длительное пребывание на солнце, частое посещение солярия.
- Прием эстрогенсодержащих препаратов, длительный прием антацидов при лечении изжоги или изониазида при лечении туберкулеза.
- Почечная недостаточность и прием тиазидных диуретиков.
Дополнительные обследования при отклонении показателя от нормы
Врач может назначить дополнительные анализы и обследования для выявления причины снижения или повышения уровня витамина D:
-
Кальций общий (Ca, Calcium total)
Общий кальций – основной компонент костной ткани и важнейший биогенный элемент, обладающий важными структурными, метаболическими и регуляторными функциями в организме. Синонимы: Анализ крови на общий кальций; Общий кальций в сыворотке. Total blood calcium; Total calcium; Bl.
Читайте также:

