Эксплант кожи что это
Обновлено: 23.04.2024
Ревитализация: что это такое? Какие разновидности существуют? Кому и когда показано проведение процедуры ревитализации? Возможные противопоказания.
Современная косметология предлагает своим потребителям множество различных услуг, которое позволяют улучшить внешний вид. И ревитализация является одной из самых популярных процедур. Возникает закономерный вопрос — ревитализация: что это такое? Кому можно проводить такую процедуру, а кому лучше отказаться?
Что нужно знать о ревитализации?
Ревитализация — это процедура, направленная на омоложение кожи. Механизм ее действия достаточно прост: препараты оказывают глубокое увлажнение, стимулируют обменные процессы в дерме, а также способствуют активации процессов регенерации. Есть два вида ревитализации:
- биоревитализация (применяются препараты гиалуроновой кислоты и различные витаминные коктейли);
- стволовая ревитализация (используется биологический материал пациента — выращенные в лаборатории стволовые клетки).
Многие люди задаются вопросом: ревитализация — что это такое? Очередной маркетинговый ход или реально работающая процедура? В 2015 году ученые из института клинических исследований и биоинженери в Италии опубликовали работу, посвященную оценке эффективности биоревитализации.
В общей сложности 64 пациентки прошли четыре сеанса биоревитализации с 3-недельными интервалами, включая множественные инъекции в лицо (внешний угол глаза и щеку), шею, область декольте и тыльную сторону рук. Эстетический результат был оценен в начале исследования и через 6, 9 и 12 недель. Наблюдалось значительное улучшение качества кожи, уменьшение выраженности пигментации и глубоких морщин.
Кому показано проведение процедур?
Не нужно думать, что ревитализация — это исключительно удел зрелых женщин. Часто бывает, что признаки старения появляются уже тогда, когда девушка не успела разменять даже третий десяток. Основные показания к проведению процедур:
- снижение тургора и эластичности кожи;
- обезвоженность и наличие микроморщин;
- наличие стрий (растяжек) и рубцов;
- маска хронической усталости;
- мешки под глазами;
- появление гиперпигментации;
- изменение овала лица;
- предстоящая процедура химического пилинга или лазерной шлифовки.
Противопоказания к ревитализации
Как и любая другая косметологическая процедура, ревитализация имеет определенные противопоказания. Перед тем, как заняться омоложением кожи, необходимо с ними познакомиться: это поможет избежать вероятных осложнений. К основным противопоказаниям относятся:
Источники:
- Вернуться в оглавление раздела "Дерматология"
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

Многие из анатомии знают, что кожа выступает как «защитная оболочка» организмов людей и животных. Она состоит из двух частей – эпидермиса (верхняя многослойная поверхность эпителия) и дермы (соединительнотканная часть, которая объединяет эпидермис и мышечные ткани организма). Кожа занимает большую площадь на теле человека. У взрослых людей она достигает 1,5-2,3 м 2 . Её главная задача - в защите тела от широкого спектра внешних воздействий. Клетки кожи, как и органы дыхания, принимают внутрь кислород, которым обогащают свою деятельность в организме. При различных травмоопасных ситуациях (например, ожогах и крупных порезах) человек может лишатся своей «защитной оболочки». На заживление и восстановление кожного покрова требуется большое количество времени. Поэтому, чтобы облегчить этот процесс и помочь коже приобрести здоровый вид, учёными были разработаны варианты искусственной человеческой кожи, которая ускорит заживления на теле.
Построение искусственной кожи выглядит следующим образом – на коллагеновый гель (основу искусственной кожи), который содержит дермальные клетки – фибробласты (это аналог дермы, имеющий большое количество коллагена и фибробластов), выкладывают верхним слоем эпителиальные клетки – кератиноциты, которые точь-в-точь похожи на эпидермис – верхний слой кожи. Таким образом, искусственная кожа состоит из двух слоёв, как и настоящая человеческая кожа. На рану накладывается готовое изделие той же структуры, что и кожа пациента, и начинается процесс заживления.
Хотя сама искусственная кожа приживается лишь на время, входящие в ее состав клетки активно секретируют различные ростовые факторы, которые стимулируют собственные клетки пациента к делению и миграции в область раны. Благодаря этому рана начинает быстрее затягиваться по краям. Кожа восстанавливается. Клетки донора постепенно замещаются вновь образованными клетками самого больного. Конечно, в качестве источника кожи можно использовать и собственную кожу пациента с неповреждённых участков, но при ожогах большой площади этого, как правило, не хватает. Так как искусственная кожа по своей структуре напоминает настоящую человеческую кожу, то её также используют и для бионических протезов с сохранением чувствительности.
В России новый материал был разработан в ходе получения смеси из латекса и биоактивных растительных компонентов. Искусственная ткань плотно прилегает к ране, защищает её в дальнейшем от внешних воздействий и выполняет лечебный процесс. Учёные отмечают, что самые сложные повреждения с новой «кожей» затягиваются в течение двух дней. В Институте теоретической и экспериментальной биофизики РАН было создано идеальное раневое покрытие, которое защищает больное место от механических повреждений и вредоносных инфекций. Кроме того, искусственная кожа создает оптимальные условия для роста клеток, пропускает воздух и водные пары, чтобы рана под таким покрытием не высыхала и не мокла. Когда тончайшая пленка накладывается на рану, клетки начинают переходить в нее, смешиваясь с клетками пациента, и активизируют выработку коллагена для зарастания раны и образования рубца. Латексная «подложка» после этого просто отсоединяется, и медикам нет необходимости мучить пациентов бесконечными перевязками. Причем после выписки пациент может самостоятельно использовать лечебные мази, нанося их на латексную пленку, которая имеет микропоры, как обычная кожа.

Эксперимент с использованием 3D-биопринтера на животном
В 2019 году ученые впервые создали 3D-биопринтер, который печатает кожу в два слоя собственной кожи пациента прямо на ране. Над этим исследованием работали специалисты из Института регенеративной медицины (США). Принтер использует «чернила», которые состоят из клеток пациента, чтобы минимизировать риск отторжения. Вначале делается биопсия здоровой кожи пациента и выращивается большое количество клеток, после чего их смешивают с гидрогелем для образования "чернил" 3D-биопринтера. Точнее создаются два типа "чернил" – для внутреннего слоя (из клеток-фибропластов) и внешнего (из клеток-кератиноцитов). После удачных экспериментов, проведенных на мышах, был получен отличный результат, который в дальнейшем позволит проводить клинические испытания на людях.


3D-принтер печатает искусственную кожу с сосудами (Living Skin Can Now be 3D-Printed With Blood Vessels Included/ Теперь живую кожу можно напечатать на 3D-принтере, включая кровеносные сосуды)
После изобретения 3D-биопринтера, печатающего искусственную кожу, идентичную коже пациента, было принято решение усовершенствовать разработку, так как просто полученная кожа могла подойти не каждому пациенту. Основная причина в этом - отсутствие кровеносных сосудов, которые нужны для коммуникации трансплантированного участка с окружающими тканями. Ученые из Политехнического института Ренсселера (Нью Йорк, США) выяснили, что если в биочернила добавить эндотелиальные клетки человека, которые выстраиваются внутри кровеносных сосудов, и клетки перицита человека, обволакивающих вокруг эндотелиальных клеток, вместе с животным коллагеном и другими структурными клетками, то в течение нескольких недель они начинают формировать сосуд. Так, в ходе исследований ученые пересадили участок искусственной кожи мышке. Он удачно прижился на животном и не вызвал отторжения. Кроме того, его сосуды благополучно соединились с кровеносной системой мыши и начали снабжать клетки ткани кровью.

Искусственная кожа с эффектом чувствительности
В сентябре прошлого года исследователи Университета RMIT в Мельбурне представили электронную искусственную кожу, которая чувствует боль и прикосновения. Считается, что новая технология успешно найдет своё применение в протезировании, робототехнике и кожной трансплантации. Данное изобретение может показывать ощущение боли. Устройство имитирует почти мгновенную обратную связь и способно реагировать на боль с той же скоростью, с какой нервные сигналы поступают в мозг. Учёные отмечают, что эта разработка стала значительным прогрессом в области биомедицинских технологий и интеллектуальной робототехники следующего поколения. В будущем такая искусственная кожа может стать вариантом неинвазивных кожных трансплантатов, особенно в случаях, когда традиционный подход нежизнеспособен или не работает.

Кожная пластика с использованием расщепленного кожного лоскута является самым простым способом заживить обширные раневые поверхности.
Смысл этой пластики заключается в использовании тонкого 0,1-0,8 мм поверхностного слоя кожи, который забирается специальным инструментом дерматомом. Этот кожный лоскут перфорируется, что позволяет увеличить его площадь в несколько раз.
После этого он укладывается на подготовленную воспринимающую рану и фиксируется отдельными швами.
В результате операции пересаженная кожа врастает в рану и закрывает ее. Участок, откуда кожа забиралась заживает самостоятельно, так как ростковая часть кожи остается на месте.
Преимущества лечения в ИСЦ
По сравнению с другими клиниками нашей страны Инновационный сосудистый центр имеет неоспоримые преимущества в применении методов пластической хирургии для лечения сосудистых больных. В нашей клинике закрытием кожных ран и трофических язв занимаются в специализированном отделении по лечению критической ишемии. Таким образом, лечением ран занимаются хирурги, которые и обеспечивают восстановление кровообращения, необходимое для успешного заживления раны.
Нам хорошо известно течение раневых процессов у пациентов и мы выбираем для каждого случая необходимое время и метод закрытия трофической язвы или раны. Для подготовки ран к пересадке кожи мы используем методы активной подготовки раневой поверхности . Перевязки и антибактериальные препараты назначаются с учетом чувствительности раневой микрофлоры.
Благодаря инновационным технологиям нам удается заживить такие раны, за которые не берется ни одна другая клиника в нашей стране!
Подготовка к лечению
Для успеха кожной пластики необходимо соблюсти ряд условий. Организм человека должен быть стабилизирован по показателям крови, синтеза белка. Необходимо остановить инфекционный процесс. Условия для выполнения кожной пластики должны быть местными:
- Хорошая кровоточивость краев раны, активные сочные грануляции.
- Рана в стадии грануляции (без признаков активной инфекции и гнойного воспаления).
- Рана должна хорошо кровоснабжаться (предварительно кровообращение должно быть восстановлено).
- Рана должна быть ощищена от омертвевших тканей с помощью физических и химических методов.
Общие условия для выполнения кожной пластики:
- Уровень белка в крови должен быть не менее 60 г/литр.
- Уровень гемоглобина не менее 90 г/литр.
- Пациент должен быть стабилизирован по общему состоянию
Непосредственная подготовка к операции предполагает бритье места забора кожного лоскута, катетеризация мочевого пузыря, установка эпидурального катетера для анестезии.
Обезболивание при лечении
При операциях на конечностях используется преимущественно эпидуральная или спинальная анестезия. Преимущество их заключается в локальном воздействии на организм. Эпидуральная анестезия позволяет осуществлять продленное обезболивание в послеоперационном периоде.
С целью контроля над функциями сердечно-сосудистой системы к пациенту подключается специальный слядящий монитор.
Как проходит метод лечения

Пациент помещается на операционном столе так, чтобы был обеспечен хороший доступ к ране. После обработки операционного поля и закрытия зоны операции стерильными простынями проводится хирургическая обработка трофической язвы или раны. Во время этой обработки удаляются все оставшиеся некротизированные участки тканей и обеспечивается точечное кровотечение из грануляций.
После этого производится забор расщепленного кожного лоскута. В толщу кожи нагнетается физиологический раствор, который приподнимает собственно кожу и облегчает ее разделение. После создания такой "водной подушки" производится забор лоскута с помощью специального инструмента - электродермотома. Это специальный дисковый нож, который выставляется на определенную толщину необходимого лоскута. После этого бритва этого дерматома снимает тончайший кожный лоскут нужного размера.
Для увеличения площади кожного лоскута его пропускают через специальный инструмент - перфоратор. Перфоратор в шахматном порядке наносит небольшие разрезы на лоскуте. Теперь лоскут при растягивании может покрыть площадь в несколько раз большую, чем его изначальная.
После перфорации лоскут размещают на раневой поверхности и моделируют по форме раны. С целью фиксации его подшивают тончайшими швами к краям раны и прижимают давящей повязкой.
Донорский участок закрывают конурной повязкой с антисептиком.
Возможные осложнения при лечении
Первую перевязку после пересадки лоскута желательно делать через 2-3 дня после операции. За это время большая часть лоскута прирастает к грануляционной ткани и не отрывается при смене повязки. В любом случае смену повязки надо проводить крайне аккуратно, снимая ее послойно с помощью инструмента.
Во время перевязки отмечается фиксация пересаженного лоскута к грануляциям, убираются не прихватившиеся кусочки кожи. Если отмечается локальная инфекция, то берется посев и используются повязки с антисептиками.
Донорскую рану можно не открывать, если не наблюдается признаков ее инфицирования. Достаточно поменять повязку сверху. Со временем кожа эпителизируется и повязка отойдет сама. Обычно через на 14 - 21 день после операции.
Прогноз после метода лечения
Если операция проводится по показаниям, при условии устранения причин развития некрозов и трофических язв, то результаты кожной пластики очень хорошие. Правильно проведенная операция заканчивается успехом в 95% случаев. В послеоперационном периоде происходит постепенная замена пересаженной кожи своим эпидермисом, что проявляется в появлении небольших корочек, под которыми заметна молодая кожа.
Аутодермопластика может являться окончательным методом закрытия ран, если эта рана не находится на опорной поверхности или в области крупного сустава. В таких местах молодая кожа может повреждаться при нагрузке с образованием трофических язв. Для опорных и костных поверхностей лучше использовать полнослойную кожную пластику лоскутами на сосудистой ножке.
Программа наблюдения после метода лечения
Оперирующий хирург должен наблюдать пациента до полной эпителизации трофической язвы или раны, на которую была пересажена кожа.
В послеоперационном периоде могут назначаться препараты, которые уменьшают процесс рубцевания кожи в области пластики. Эти мази (Контратубекс) могут втираться в рану на протяжении 3-6 месяцев и способствуют формированию мягкого нежного рубца.
Окончательный исход операции по пересадке кожи зависит от течения сосудистого заболевания, которое послужило причиной образования трофической язвы или некротической раны. Поэтому основное наблюдение проводится за результатами сосудистого этапа лечения.
Заболевания
Кожная пластика расщепленным лоскутом (аутодермопластика) является основным метом закрытия обширных гранулирующих ран, трофических язв и глубоких пролежней.
Операцию отличает простота выполнения и хорошие непосредственные результаты. Залогом успеха является хорошая подготовка раневой поверхности и общего состояния больных.
Нижегородская государственная медицинская академия, Нижний Новгород, Россия
Государственный институт усовершенствования врачей МО РФ
Акне и эпидермальный барьер
Журнал: Клиническая дерматология и венерология. 2015;14(1): 90‑93
Нижегородская государственная медицинская академия, Нижний Новгород, Россия
Представлены данные о состоянии эпидермального барьера и рогового слоя эпидермиса у больных акне. Обсуждается влияние различных компонентов препаратов для наружной терапии акне на состояние эпидермального барьера.
Нижегородская государственная медицинская академия, Нижний Новгород, Россия
Государственный институт усовершенствования врачей МО РФ
Акне (аcne vulgaris) — хроническое воспалительное заболевание, проявляющееся открытыми или закрытыми комедонами и воспалительными поражениями кожи в виде папул, пустул, узлов [1], один из наиболее распространенных дерматозов, на долю которого приходится 22—32% всех случаев дерматологической патологии [2]. Это заболевание значительно снижает качество жизни, принося пациентам эстетический дискомфорт и ограничивая их во многих сферах жизнедеятельности [3]. За последние несколько лет знания специалистов существенно пополнились новыми сведениями об этиологии, патогенезе, клинике этого заболевания, сформулированы международные и отечественные рекомендации и алгоритмы терапии [1, 4]. Наружная терапия и уход за кожей пациентов с акне всегда был в фокусе внимания дерматологов и производителей лекарств и косметики, что подтверждается огромным количеством различных средств на лекарственном рынке. В настоящее время большое внимание уделяется изучению роли эпидермиса (особенно его рогового слоя) в возникновении кожной патологии, поэтому актуальным является анализ структурных или функциональных особенностей эпидермального барьера, которые характерны для акне, и которые необходимо учитывать при назначении терапии. Важным является также то, что различные лекарственные препараты, используемые для лечения акне, могут изменять как отдельные свойства, так и структуру эпидермального барьера в целом. Это может провоцировать возникновение побочных реакций и обострения заболевания [5]. Кожный барьер является сложной структурой с многогранными функциями и включает гидролипидную пленку, роговой слой, межклеточный цемент, а также линию иммунологической защиты — часть врожденной иммунной системы (Тоll-подобные рецепторы — TLR), комплемент, дендритные клетки и антигензависимые реакции. Изменения в кожном барьере наблюдаются при различных заболеваниях кожи, таких как акне, розацеа, атопический дерматит и другие [6]. При исследовании биоптатов кожи пациентов с акне был выявлен ряд структурных особенностей кожи и эпидермального барьера: изменение структуры и толщины рогового слоя, изменение состава липидов в нем, а также изменение физико-химических свойств водно-липидной мантии и проницаемости эпидермального барьера [7]. В работах J. Strauss и D. Thiboutot [8] было показано, что при акне увеличивается число сальных желез, повышается синтез кожного сала и изменяется его состав. Было установлено, что существует обратная взаимосвязь между секрецией кожного сала и содержанием в нем линолевой кислоты: чем выше активность секреции кожного сала, тем ниже концентрация кислоты.
D. Downing и соавт. [9] обнаружили, что низкая концентрация линолевой кислоты приводит к дефициту необходимых жирных кислот в фолликулярном эпителии. Именно этот факт, по мнению большинства ученых, является причиной фолликулярной кератинизации и нарушения десквамации, что и лежит в основе формирования микрокомедонов. Дальнейшие исследования продемонстрировали, что дефицит линолевой кислоты также усиливает проницаемость стенки комедона для факторов воспаления и фолликулярного гиперкератоза. Несколько лет назад было показано, что такой дефицит ассоциирован и с продукцией провоспалительного цитокина ИЛ-1α — значимого фактора в развитии воспаления [10].
При возникновении акне распространение Propionibacterium acnes внутри фолликула инициирует каскады воспалительных реакций, связанных с врожденными, приобретенными и гуморальными иммунологическими реакциями и прямым противовоспалительным действием ферментов (липаз, матричных металлопротеаз). Каталитические продукты распада запускают воспалительный процесс [11, 12].
A. Jeremy, D. Holland [10, 13, 14] показали, что у пациентов с акне наблюдается появление в дерме перифолликулярной и фолликулярной воспалительной клеточной инфильтрации и экспрессия маркеров воспаления, т. е. субклиническое воспаление присутствует с самого начала развития акне даже при отсутствии фолликулярного гиперкератоза и микрокомедонов.
A. Yamamoto и K. Takenouchi [15] исследовали секрет сальных желез, состав липидов рогового слоя эпидермиса, выраженность трансэпидермальной потери жидкости (ТЭПЖ) и степень гидратации рогового слоя эпидермиса. Было выявлено, что у пациентов с акне значительно повышена секреция сальных желез, увеличена ТЭПЖ и снижена гидратация рогового слоя (обнаружено при корнеометрии), кроме того, в роговом слое эпидермиса наблюдалось значительное снижение свободного сфингозина и общих керамидов, что свидетельствует о нарушении строения и функции межклеточной липидной мембраны. Полученные результаты свидетельствуют о нарушении структуры и повышении проницаемости кожного барьера. Было доказано, что степень изменения структуры и проницаемости кожного барьера находится в прямой зависимости от степени тяжести акне. Филаггрин — это ключевой белок, участвующий в эпидермальной дифференцировке, способствующий структурной и функциональной целостности рогового слоя эпидермиса. Выявлено, что P. acnes увеличивают экспрессию филаггрина в культивируемых кератиноцитах, а также в эксплантатах кожи человека [16], т. е. при акне увеличивается экспрессия филаггрина в кератиноцитах, выстилающих стенку фолликула [17], но пока неясно, являются ли изменения экспрессии филаггрина при акне первичными или вторичными [18].
Лечение акне определяется тяжестью патологического процесса и характером его течения. Наружное лечение включает применение ретиноидов, бензоил пероксида (БПО), топических антибиотиков, комбинированных препаратов и азелаиновой кислоты [1, 4]. Накоплены сведения как о негативном, так и о позитивном влиянии ряда препаратов на состояние эпидермального барьера. Монотерапия топическими антибиотиками может способствовать дисбиозу кожи, нарастанию антибиотикорезистентности P. acnes и других микроорганизмов, поэтому в настоящее время предпочтение отдают комбинированным схемам терапии [19]. БПО — антимикробный препарат, который используется для терапии акне в течении длительного времени; он может увеличивать ТЭПЖ и повышать проницаемость эпидермального барьера, а у некоторых пациентов может вызывать жжение и раздражение кожи [20].
В своем эксперименте S. Weber и соавт. [21] показали, что после применения 10% БПО наблюдалось увеличение ТЭПЖ в 1,8 раза. Исследователи предположили, что данная ситуация возникает из-за повреждения липидной структуры рогового слоя эпидермиса и ухудшения эпидермального антиоксидантного барьера за счет уменьшения уровня витамина Е, поэтому попытались дополнительно назначать пациентам местное применение альфа-токотриенола (изомер витамина Е). Применение альфа-токотриенола уменьшало перекисное окисление липидов рогового слоя эпидермиса, индуцированное БПО, но полностью не компенсировало увеличение ТЭПЖ [22]. Если рассматривать топические ретиноиды, то эти препараты вызывают истончение рогового слоя и качественные изменения в составе высокоспециализированных липидов в нем, а также усиление его проницаемости. В течение первых 2 нед местного лечения ретиноидами у многих пациентов развиваются видимые признаки дерматита (эритема, шелушение), называемые «ретиноидным дерматитом» [23]. В работе E. Tanghetti было предложено одновременное применение с ретиноидами увлажняющего крема для профилактики нарушения проницаемости эпидермального барьера. В результате наблюдалось сохранение эффективности и улучшение переносимости терапии [24]. S. Feldman, D. Chen [25] также показали, что применение увлажняющих кремов, часто по инициативе самих пациентов, помогает снизить побочные действия и симптомы, вызванные ретиноидным дерматитом. В исследовании по использованию 0,025% крема с третиноином у женщин в возрасте от 35 до 55 лет с симптомами фотостарения (n=50) было показано, что применение увлажняющего крема за 2 нед до лечения третиноином и во время терапии предотвращает увеличение ТЭПЖ [26]. Показана также более оптимальная переносимость ретиноидов при заключении их в липосомальные структуры или при уменьшении размеров частиц действующего средства. Кроме того, уменьшению раздражающего действия ретиноидов способствует комбинация их с топическими антибиотиками [27].
Сравнительный анализ влияния 0,025% третиноина и 0,1% адапалена на состав высокоспециализированных липидов рогового слоя продемонстрировал существенные различия между ними. Адапален в отличие от третиноина вызывал существенное снижение содержания свободных жирных кислот, эфиров стерола и сквалена, а также повышение уровня ряда керамидов. Полученные результаты указывают на позитивное влияние адапалена на состояние барьеров кожи и опосредованное — на липофильные пропионобактерии, которые ферментируют жирные кислоты [28]. Аналогичный эффект в отношении свободных жирных кислот дает азелаиновая кислота [29].
В работе H. Gollnick и соавт. [30] представлены данные двух клинических исследований по изучению эффективности 15% геля азелаиновой кислоты по сравнению с 5% гелем БПО и 1% гелем клиндамицина. Авторы показали, что при применении препаратов в течение 4 нед была достигнута эффективность 70% по снижению числа воспалительных элементов во всех группах. Побочные эффекты в виде локального жжения и раздражения более выражеными были в группе пациентов, применявших БПО, чем в группе больных, которым была назначена азелаиновая кислота. Минимальные побочные эффекты наблюдали в группе больных, использовавших для лечения гель клиндамицин. В исследовании G. Stinco и соавт. [31] изучали себостатическое действие азелаиновой кислоты, адапалена и БПО при лечении больных с акне средней тяжести. Все используемые препараты оказывали сравнимый терапевтический эффект. Уровень секреции кожного сала на всех участках лица (лоб, подбородок, щеки) более значимо снижался у пациентов, которые применяли азелаиновую кислоту. В группе больных, применявших БПО, также отмечалось уменьшение секреции кожного сала, тогда как адапален не оказывал эффекта на количество продукции кожного сала на лбу, на щеках снижал на 7%, а на подбородке — увеличивал на 6%. Таким образом, данное исследование показало отсутствие корреляции клинической эффективности и снижения уровня синтеза кожного сала на различных участках лица у пациентов с акне. Авторами был сделан вывод, что азелаиновая кислота является эффективным топическим средством для лечения акне, обладающим выраженным себостатическим действием. При изучении безопасности топических лекарственных средств отмечен тренд к лучшей переносимости/безопасности азелаиновой кислоты по сравнению с местными ретиноидами и БПО.
L. Swinyer [32] отметил, что существуют различия при лечении акне у пациентов, проживающих в условиях относительно нормальной и сниженной влажности. Он предположил, что сухость кожи является фактором, ухудшающим течение болезни и, следовательно, снижающим эффективность лечения. После этого E. Jackson и соавт. [33] провели 4-этапное исследование с целью проверки гипотезы L. Swinyer, в ходе которого было показано, что использование для ежедневного ухода средств не только с очищающими, но и с увлажняющими свойствами ускоряет процесс исчезновения высыпаний акне и повышает эффективность назначенной схемы лечения. С целью повышения эффективности терапии и улучшения переносимости лечебных средств производители предпринимают попытки модифицировать основу препаратов, включая в ее состав увлажнители, эмоленты, аллантоин, производные витамина Е и другие ингредиенты с увлажняющим, смягчающим и противовоспалительным эффектом [34].
Для практической медицины интересен новый препарат, который недавно появился на фармацевтическом рынке — 15% гель азелаиновой кислоты Азелик (Акрихин). Азелик содержит сквалан, который восстанавливает барьерные свойства кожи и улучшает переносимость препарата. Сквалан является высококачественным эмолентом, не обладающим комедогенными свойствами; он заполняет пространства между чешуйками рогового слоя эпидермиса, смягчает и устраняет чувство стянутости, глубоко увлажняет кожу. Исследование А.В. Стаценко и соавт. [35] показало высокий уровень безопасности и хорошую переносимость геля Азелик. Была доказана высокая терапевтическая эффективность геля Азелик в лечении папулопустулезной формы акне легкой и средней степени тяжести. Также было отмечено, что гель Азелик обладает увлажняющими свойствами, а кроме того, его длительное применение способствует нормализации рН кожи и улучшает индекс качества жизни пациентов.
Выводы
Таким образом, к настоящему времени накоплено уже большое количество знаний о состоянии барьерных свойств кожи у пациентов с акне, однако в то же время остается еще ряд вопросов для обсуждения и дальнейшего изучения. Для практических врачей важно помнить о важности рекомендаций по применению увлажняющих средств и средств базового ухода, так как они существенно снижают риск побочных эффектов лечения, одновременно повышая качество жизни пациентов и их приверженность к терапии. Гель Азелик, содержащий высококачественный эмолент, может быть рекомендован в качестве препарата выбора для лечения папулопустулезной формы акне легкой и средней степени тяжести.
Статья посвящена актуальной проблеме сохранения редких видов растений азиатской части России. Показана возможность массового получения растений-регенерантов и их сохранения с помощью метода культуры ткани при использовании в качестве эксплантов фрагментов неокрашенных цветков 3 редких видов лилий азиатской части России. Проведенный гистологический анализ позволил выделить 3 варианта развития морфогенетической реакции у эксплантов лилий в зависимости от минерального состава среды и регуляторов роста растений. В статье рассмотрены преимущества использования тканей и органов цветка в качестве эксплантов для введения в культуру in vitro трех редких видов лилий азиатской части России с целью сохранения и последующего массового размножения данных видов. Изучены пути реализации морфогенетической реакции трех различных типов эксплантов в зависимости от минерального состава питательной среды и регуляторов роста. С помощью гистологического анализа ранних этапов пролиферации тканей и органов цветка подтверждена возможность получения растений - регенерантов всех трех видов лилий путем адвентивного органогенеза, тогда как соматический эмбриогенез был отмечен у L. pumilum и L. cernuum. Процесс образования микролуковичек у всех изученных видов лилий происходил более интенсивно на вариантах среды N6m, чем на средах MSm-1 и MSm-2. Применение холодовой обработки полученных микролуковиц позволило успешно провести адаптацию растений-регенерантов в почвенной культуре.

1. Бутенко Р.Г. Биология клеток высших растений in vitro и биотехнологии на их основе. – М.: ФБК–ПРЕСС, 1999. – 160 с.
2. Калинин Ф.Л., Сарнацкая В.В., Полищук В.Е. Методы культуры ткани в физиологии и биохимии растений. – Киев: Наукова думка, 1980. – 488 с.
3. Растения Красной книги России в коллекциях ботанических садов и дендрариев/ РАН. Отд-ние. биол. наук. Совет ботан. садов России. Глав. ботан. сад им. Н. В. Цицина. – М., 2005. – 142 с.
4. Azadi P., Khosh-Khui M. Micropropagation of Lilium ledebourii (Baker) Boiss as affected by plant growth regulator, sucrose concentration, harvesting season and cold treatments// Electron. J. Biotechn. – 2007. – Vol. 10. №4. DOI: 10.2225/vol10-issue4-fulltext-7
5. Chu C.C. The N6 medium and its application to anther culture of cereal crops: In: Proc. Symp. Plant Tissue Culture, – Beijing: Science Press, 1978. – P. 43–50.
6. Кedra M., Bach A. Morphogenesis of Lilium martagon L. explants in callus culture// Acta Biol. Cracov. Ser. Bot. – 2005. – Vol.47. №1. – P. 65-73.
7. Murashige T., Skoog F. A revised medium for rapid growth and bioassays with tobacco tissue cultures// J. Physiol. Plant. –1962. – Vol.15. – P. 473-497.
8. Paunescu A. Biotechnology for Endangered Plant Conservation: A Critical Overview// Rom. Biotechnol. Lett. – 2009. Vol. 14. №1. – P. 4095-4103.
9. Pelkonen V.-P., Kauppi A. The effect of auxins on the regeneration of lily (Lilium regale Wil.) cells by somatic embryogenesis and organogenesis// Int. J. Plant Sci. – 1999. Vol. 160. – P. 483–490.
10. Subotic A., Trifunovic M., Jevremovic S., Petric M. Morpho-histological study of direct somatic embryogenesis in endangered species Frittilaria meleagris// Biol. Plant.– 2010. Vol. 54. №3. – P. 592-596.
L. distichum, L. pumilum и L. cernuum (сем. Liliaceae) являются редкими видами азиатской России, нуждающимися в охране. L. distichum, L. pumilum занесены в Красные книги Хабаровского края (2000), Еврейской Автономной области (2006) как исчезающие виды сокращающие численность, тогда как L. cernuum из-за сокращения ареала и численности популяций внесена в Красную книгу РФ (2008).
В условиях интродукции, особенно в климатической зоне средней полосы, возобновление этих видов традиционными способами затруднено [3]. В связи с этим, необходимым является поиск методов размножения лилий, позволяющих не только размножить ценные декоративные растения, но и сохранить их в природе. При выборе стратегии сохранения биоразнообразия редких, исчезающих видов растений многими исследователями показана эффективность методов биотехнологии в сравнении с традиционными способами их размножения [8].
С помощью метода культуры ткани ранее были успешно размножены многие редкие виды лилий: L. martagon L. [6], L. ledebourii (Baker) Boiss [4] и некоторые другие. При использовании эксплантов, представлявших собой ткани либо фрагменты генеративного побега лилий, большинство исследователей отмечали появление регенерантов путем образования адвентивных почек из каллуса, тогда как для сохранения генотипов редких и исчезающих растений предпочтительны методы, позволяющие избежать сомаклональной изменчивости у регенерантов. Необходимость изучения ранних стадий морфогенеза лилий в культуре in vitro с помощью гистологического анализа объясняется тем, что первичные процессы органогенеза в тканях эксплантов, как правило, определяют их дальнейший путь морфогенеза [6]. При использовании флоральных эксплантов редких видов лилий в культуре in vitro исключается возможность повреждения или гибели материнских растений в природе.
Цель исследования – определить особенности регенерации и реализации морфогенетического потенциала различных типов эксплантов, выделенных из цветков 3-х редких видов рода Lilium L. в зависимости от минерального состава питательной среды и внесенных регуляторов роста.
Объекты и методы
Объектами для введения в культуру in vitro являлись три вида из р. Lilium, произрастающие в азиатской части России: L. cernuum Kom..L. distichum Nakai, L. pumilum Delile. L. cernuum и L. distichum получены из природных популяций Дальнего Востока. L. pumilum собрана из окрестностей села Б. Голоустное (западное побережье о. Байкал). Исследования по микроразмножению данных объектов проведены в лаборатории биотехнологии Центрального сибирского ботанического сада. Эксплантами служили различные ткани и органы, выделенные из неокрашенных бутонов трех видов лилий: 1. Поперечные срезы оси соцветия, толщиной 1,5-2 мм; 2. Фрагменты цветоложа такой же толщины; 3. Пыльник с тычиночной нитью и с частью цветоложа. Экспериментальные работы с использованием метода культуры тканей проводили по общепринятым методикам [2]. Для стерилизации бутонов проводили их обработку 96 %-м этанолом в течение 1 мин, далее их обжигали в пламени спиртовки, после чего выдерживали 5 минут в 0,1 %-м водном растворе HgCl2 (0.1%), а затем 4 раза промывали в стерильной дистиллированной воде.
Для инокуляции и культивирования эксплантов использовали две питательные среды: МS [7] и N6 [5] модифицированные нами и обозначенные – МSm и N6m. Модификация состояла в том, что концентрация сахарозы была увеличена до 4%, содержание микросолей и органических компонентов в данных средах было идентично среде MS. Концентрации и компонентный состав макросолей в каждой из сред соответствовал их базовому уровню. Для получения полутвердой питательной среды применяли агар-агар марки «Bacto agar» в концентрации 4-6 г/л. Значение рН сред = 5.7-5,8, продолжительность одного пассажа составляла 3-4 недели. Дальнейшее изучение морфогенетических потенций эксплантов тканей и органов цветков у данного вида лилии было проведено на 4 вариантах питательных сред MSm и N6m, содержавших регуляторы роста 2,4 Д и БАП как по отдельности, так и в комбинации друг с другом.
На всех этапах культивирования растения выращивались: а) при искусственном освещении 40 мкмоль∙м -2/сек-1, 16 часовом фотопериоде и температуре 22 ± 24° С; б) для лучшей адаптации перед высадкой ex vivo растения - регенеранты выдерживали 1-1,5 месяца в световом термостате фирмы Rumed (Германия) при + 7° С.
Гистологическое изучение тканей регенерантов было выполнено на постоянных препаратах, для дифференцированной окраски на ДНК-РНК ткани окрашивали метиловым зеленым и пиронином. Готовые препараты и образцы тканей просматривали на микроскопе “Axiolab” фирмы “Zeiss” в центре коллективного пользования ЦСБС.
Результаты и обсуждение
Предварительные эксперименты показали, что морфогенетическая реакция вышеуказанных типов эксплантов тканей и органов цветка 3 видов лилий отсутствовала при их инокуляции на среды MSm и N6m без регуляторов роста. Использование таких эксплантов у лилий, как ось соцветия или ткани цветоложа, являющихся органами осевой природы, часто еще не закончивших развитие и не утративших своих морфогенетических способностей, как правило, приводит к образованию микролуковичек непрямым путем, т. е. путем каллусогенеза [9]. В процессе развития регенерантов важно исключить эту стадию, чтобы получить растения-регенеранты идентичные исходному генотипу. Перед нами стояла задача подобрать такие типы эксплантов, которые представляли бы собой индивидуальные органы, выделенные с частью побега, имеющие наибольшую регенерационную способностью без образования каллуса.
Гистологическое изучение тканей эксплантов генеративной сферы L. pumilum, L. cernuum было проведено с целью построения прогнозируемой модели морфогенеза регенерантов, исключающей возможность возникновение сомаклональной изменчивости. Начальные стадии морфогенеза у данных видов лилий in vitro были отмечены образованием скоплений меристематических клеток у эксплантов, выделенных из тканей и органов цветков. На постоянных препаратах делящиеся группы клеток, находящиеся в субэпидермальном слое эксплантов были выявлены благодаря дифференцированной окраске, начиная с 20-25 дня инокуляции, и представляли собой мелкие клетки с хорошо различимыми ядрами, образовывавшие шаровидные структуры, включающие васкулярные элементы (рис.1). Подобные меристематические структуры были отмечены ранее многими исследователями – [6], [10] на ранних стадиях морфогенетического развития эксплантов луковичных растений в культуре in vitro. В нашем эксперименте эти центры адвентивного побегообразования в дальнейшем давали начало эндогенно образующимся микролуковицам лилий.
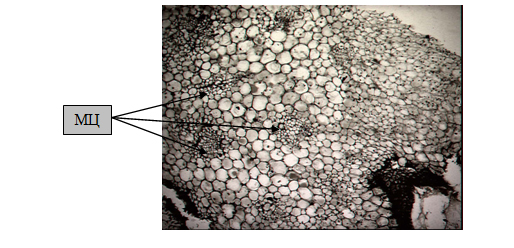
Рис.1. Заложение меристематических центров (МЦ) в паренхиме цветоложа L. pumilum, инокулированного на среду N6m-1, увеличение × 250
Отмечено, что образование микролуковичек происходило на всех типах эксплантов, выделенных из цветков 3 видов лилий в большинстве случаев по пути адвентивного побегообразования (гемморизогенеза) как на средах МSm, так и на средах N6m. Минеральная основа среды для инициации, а также концентрация ауксина 2,4- Д оказывали существенное влияние на образование микролуковичек у различного типа эксплантов, взятых из тканей и органов цветка L. pumilum, L.cernuum и L. distichum. Процесс образования побегов и микролуковичек у всех изученных видов лилий происходил более интенсивно на вариантах среды N6m, чем на средах MSm (табл. 1).
Влияние минерального состава среды и концентрации 2,4- Д на тип морфогенетической реакции и интенсивность регенерации (шт. микролуковиц на эксплант) у эксплантов тканей и органов цветка Lilium cernuum, L. distichum, L. pumilum, n=24
Читайте также:

