Дренаж при гематоме печени
Обновлено: 24.04.2024
Хасанов А.Г. 1 Шайбаков Д.Г. 1 Шамсиев Р.Э. 1 Фаязов Р.Р. 1 Бадретдинов А.Ф. 1 Бакиров С.Х. 1 Махиянова Д.Р. 1 Шайбакова К.Д. 1
Гнойные заболевания печени в хирургии встречаются редко, но протекают тяжело. До широкого внедрения в медицинскую практику ультразвукового исследования (УЗИ) диагностика абсцессов печени была трудной проблемой.Ограниченные гнойники печени среди госпитализируемых больныхвстречаются нечасто (до 0,16%), но, как правило, требуют хирургического лечения, сопровождающегося высоким риском серьезных послеоперационных осложнений.В последние годы в хирургии для диагностики и лечения заболеваний печени, в том числе абсцессов, широко используют УЗИ и компьютерную томографию (КТ). Точность диагностики и снижение летальности при абсцессах печени часто связаны с внедрением в хирургическую практику УЗИ, КТ, а также внедрением малоинвазивных хирургических технологий. В представленной статье проанализирован пятилетний опыт наблюдения, диагностики и лечения 19 больных с абсцессами печени по материалам хирургических отделений ГБУЗ ГКБ №8 г.Уфы.Мы добились выздоровления всех 19 пациентов путем пункционной аспирации (12 человек) и дренирования (7 человек) абсцессов.Для санации внутрипеченочных гнойников 8 пациентам было достаточно однократной пункции, в 3 случаях потребовалась двукратная и в 1– трехкратная пункция. Дренирование абсцессов проводилось катетерами pig tail диаметром 8–12 Fr. При абсцессах менее 10 см в диаметре было достаточно дренирования одним микродренажом (5 больных). При больших размерах абсцесса (более 10 см в диаметре) с выраженной капсулой полость абсцесса дренировали двумя катетерами (2 случая). При пункционном лечении абсцессов печени наблюдалось два осложнения. Было однокровотечение при эвакуации содержимого абсцесса при помощи медицинского электроотсоса, что было ликвидировано при помощи тугого наполнения полости физиологическим раствором на 13–15 мин, в другом случае при пункции краевого абсцесса VI сегмента печени размерами более 12см в диаметре был прорыв гноя в брюшную полость, что удалось ликвидировать лапароскопической санацией.

1. Зубов А.Д., Вилсон Дж.И. Абсцессы печени: этиологические факторы и диагностические ошибки // Вестник клуба панкреатологов. 2015. № 2. С. 37–41.
2. Гаюров У.Х.,Курбонов К.М. Диагностика и тактика лечения холангиогенных абсцессов печени //Актуальные вопросы гепатобилиарной хирургии: материалы XXI Международного конгресса ассоциации гепатобилиарных хирургов стран СНГ. Пермь, 2014. С. 87-88.
3. Нартайлаков М.А. Хирургия печени и желчных путей// Здравоохранение Башкортостана. 2005. № 3. С. 112-114.
5. Овчинников В.А., Малов А.А., Акуленко С.В., Захаров А.Г., Парахонян Н.В., Галанин И.А. Современная тактика в лечении бактериальных абсцессов печени // Медицинский альманах. Хирургия. 2013. Т. 29. № 5.С. 99–103.
6. Romano G., Agrusa A., Frazzetta G., De Vita G., Chianetta D., Di Buono G., Amato G., Gulotta G. Laparoscopic drainage of liver abscess: case report and literature review. G. Chir. 2013. V. 34 (5–6). Р. 180–182.
Ограниченные гнойные заболевания печени встречаются редко, но трудно поддаются диагностике и протекают тяжело. Среди госпитализированных в хирургический стационар больных пациенты с абсцессами печени составляют до 0,16%.
Выделяют следующие группы абсцессов печени: 1) холангиогенные (54,8%); 2) криптогенные (19,1%); 3) травматические (7,1%); 4) пилефлебитические (4%); 5) послеоперационные (4,7%); 6) контактные (4,7%); 7) амебные (4%) [1] (рис. 1).

Рис. 1. Этиология абсцессов печени
Лечение этой патологии чаще хирургическое, и до внедрения пункционных методов лечения больные с абсцессами печени обычно подвергались большим полостным операциям, нередко сопровождающимся послеоперационной летальностью от 16,9% до 55,0% [2, 3]. В современной хирургии с диагностической и лечебной целью широко используют компьютерную томографию (КТ) и ультразвуковое исследование (УЗИ) 4.
До внедрения в клиническую практику КТ и УЗИ лечение ограниченных гнойников печени проводилось в основном на основании клинических данных. Прорывом в лечении и, конечно, «золотым стандартом» в лечебной тактике явилось внедрение в клиническую практику методов КТ и УЗИ. Чрескожная пункция и дренирование гнойников печени свое доминирующее место в хирургии приобрели при ультразвуковой навигации. Метод открыл новые возможности для диагностики и лечения, позволил внедрить малотравматичные методы эвакуации гнойников печени. Ведущее место в лечении больных с абсцессом печени занимают пункционные методы. К их достоинствам относят: отсутствие риска общего обезболивания, сокращение сроков нахождения на стационарном лечении, низкий уровень операционной агрессии, невысокий процент летальных исходов 6.
Цель исследования: анализ результатов лечения абсцессов печени пункционным способом под ультразвуковой навигацией.
Материалы и методы исследования
В отделениях хирургии ГКБ № 8 г. Уфы с 2014 по 2019 гг. с солидными абсцессами печени находились 19 больных. Возраст пациентов варьировал от 31 до 72 лет, средний возраст составил 53,5±0,3 года, соотношение мужчин и женщин было соответственно14 (73,7%) и 5 (26,3%) (рис. 2).

Рис. 2. Гендерный состав анализируемых больных (%)
Следует отметить, что в анализируемой группе преобладали более молодые мужчины (их средний возраст составил 38±0,15 года) и более пожилые женщины (средний возраст 65±0,15 года) (рис. 3).

Рис. 3. Частота встречаемости абсцессов печени
Пик заболеваемости приходился на возраст от 31 до 55 лет (43± 0,3 года) (11 пациентов, 57,9%). Гнойный процесс в правой доле выявлялся в 17 (89,5%) случаях, в левой доле – в 2 (11,5%) случаях (рис. 4).

Рис. 4. Локализация абсцессов печени (%)
УЗИ больным с подозрением на абсцесс печени проводили в течение первых 3 суток от момента госпитализации. Степени тяжести состояния больных определяли при помощи шкалы SAPS II, в анализируемой группе среднее число баллов составило 41±1,18. Средний период диагностики составил 4,1±0,7 сут. (таблица).
Этиология абсцессов печени в клинической группе
Результаты исследования и их обсуждение
При УЗИ обычно выявляли увеличение размеров печени, образование округлой или неправильной формы с анэхогенной структурой содержимого, а по периферии имелась капсула повышенной эхогенности. В диагностике приоритетными являлись результаты УЗИ, по ним фактически определялась тактика лечения. При необходимости дифференциальной диагностики применялась КТ. Исходя из стадии формирования абсцессов бактериальной этиологии выделяют 3 возможные вариации эхоскопической картины.
Первоначально при УЗИ в печени выявляется неоднородный, нечетко обозначенный фрагмент паренхимы повышенной эхогенности, внутри которой выделяется бесструктурный гипоэхогенный участок (стадия инфильтрации). В этой стадии в паренхиматозной ткани печени вероятно выявление участка сниженной яркости, который имеет разнородное строение и неотчетливые контуры, которые переходят в здоровую ткань. В центре этого участка мы наблюдаем анэхогенный бесструктурный участок некроза (рис. 5).
Такая картина может наблюдаться непродолжительный отрезок времени, буквально несколько часов, и уловить во время УЗИ ее удается редко.
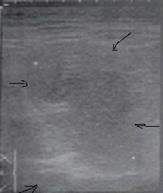
Рис. 5. Эхограмма. Стадия некроза печени
Со временем в зоне инфильтрации образуется полость с гноем, без четких границ, ее содержимое гипоэхогенное, чаще неоднородное (стадия абсцедирования). Характер содержимого полости связан с наличием гноя и тканевого детрита. В ткани печени, прилежащей к данному участку, имеется воспаление средней степени выраженности. Клинические проявления, соответственно, становятся более выраженными, что соответствует образованию гетерогенной жидкости (рис. 6).
Помимо свойственных для жидкостной структуры эхографических признаков («усиление» задней стенки, эффект боковых теней, эффект длительного псевдоусиления эхосигнала), обнаруживаются нестандартные показатели: внутреннее содержимое полости абсцесса обособляется, в связи с этим образуется граница «жидкость – жидкость» с горизонтальным уровнем, более плотная часть содержимого при этом находится ниже границы; у верхней стенки полости вероятно присутствие воздушных пузырьков в виде гиперэхогенных структур (они дают реверберирующий эффект – «хвост кометы»).
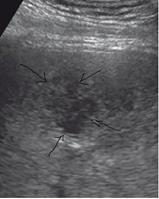
Рис. 6. 2-й вариант эхографической картины, стадия абсцедирования
Третья стадия (хронизации процесса) характеризуется выявлением плотной, толстой пиогенной капсулы по контуру гнойника. При УЗИ мы наблюдаем хронический абсцесс печени, характеризующийся четкими контурами, центральной частью сниженной яркости, толстая стенка очага эхогенная, с явлениями кровотока. Также вероятно выявление кальцинированных компонентов в капсуле (рис. 7). Следовательно, выявление при УЗИ в печени очага обызвествления является возможным признаком обратного развития абсцесса.
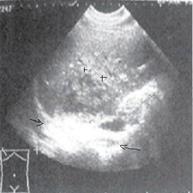
Рис. 7. Стадия хронизации абсцесса печени
При проведении исследования с помощью аппарата УЗИ в абсцессах могут быть выявлены в различной степени акустические эффекты, которые присущи кистам. Также имеются такие особенные признаки абсцессов, как разграничение содержимого на два компонента: жидкость и осадок, в гнойной полости выявляются пузырьки воздуха (гиперэхогенные компоненты с реверберирующим эффектом на стенках полости), сдвиг содержимого гнойной полости, который фиксируется с помощью УЗИ.
Для проведения пункционных, УЗ-ассистированных методов лечения противопоказаниями являлись технические причины (отсутствие безопасной пункционной трассы) и тяжелые нарушения свертывающей системы крови.
Пациентам после постановки диагноза под местной анестезией и под контролем УЗИ производили чрескожно-чреспеченочную пункцию и дренирование места абсцесса. Для наглядного контроля при прицельных чрескожных пункциях и для введения дренажей пользовались ультразвуковыми аппаратами «Aloka 1000» и «Medison SonoAce» с конвексным и линейным датчиком с диапазоном частоты 3,5–10 МГц. Для более точного позиционирования пункционной иглы применялся биопсийный адаптер. Показания для выполнения пункционного лечения выставлялись при помощи ультразвуковой диагностики, пункция осуществлялась только под ультрасонографической навигацией, что позволяло проводить прицельную и безопасную пункцию. Для пункции применяли иглы с внешним диаметром 1,5 мм, длиной 15–20 мм.
Местная анестезия, которую применяли при пункционном лечении, является вполне достаточной. Место пункции зависит от пораженного сегмента печени, но чаще ее проводили по задней подмышечной линии. Нами был использован также добавочный доступ в XI–X межреберье между передней и средней подмышечными линиями справа для проведения пункционной манипуляции для более качественного промывания при полостях большого размера. Во время манипуляции производили максимальное удаление гноя из полости с последующим промыванием полости дезинфицирующим раствором (хлоргексидином, диоксидином). В послеоперационном периоде проводили антибактериальную, дезинтоксикационную и направленную на общее укрепление организма терапию.
Мы добились выздоровления всех 19 пациентов путем пункционной аспирации (12 человек) и катетеризации (в 7 случаях). При этом для санации внутрипеченочного гнойника 8 пациентам была достаточна однократная пункция, в 3 случаях потребовалась двукратная и в 1 – трехкратная.
Катетеризацию мы проводили чаще всего катетерами pig tail диаметром 8–12 Fr. При абсцессах менее 10 см в диаметре было достаточно дренирования одним микродренажом (5 больных). При абсцессах большого размера (диаметром более 10 см) и наличии выраженной капсулы мы выполняли двойное дренирование полости (2 случая, 10,5%).
Среднесуточное стояние дренажа у этих больных составило 8±1,4 сут.
В каждом случае мы проводили микробиологическое исследование извлеченной посредством пункции жидкости. При этом этиологическими факторами содержимого абсцесса выступали разнообразные микроорганизмы: гемолитический стрептококк, золотистый стафилококк, энтеробактерии, кишечная палочка, клебсиелла, анаэробные микроорганизмы. Нередко при посеве гноя выделяется смешанная флора. Во время выполнения процедуры эвакуации содержимого полость сокращалась на 60–75%. В динамике после катетеризации абсцесса печени в различные сроки наблюдали полное сокращение остаточных полостей. В проекции дренированного абсцесса жидкость не определяется, в ткани печени визуализируются два дренажа (рис. 8).

Рис. 8. УЗИ в динамике. В проекции дренированного абсцесса в ткани печени визуализируются два дренажа
Больные после первичной пункции находились под наблюдением хирурга поликлиники, в зависимости от общего состояния им выполнялись контрольное УЗИ и по показаниям повторные пункции. Интервал между пункциями определялся индивидуально в зависимости от ультрасонографической динамики, чаще через 1,5–2 месяца. Дренаж мы убирали, если по нему отсутствовало отделяемое после контрольного исследования с помощью аппарата УЗИ.
При пункции абсцессов наблюдалось 2 осложнения. При эвакуации содержимого абсцесса при помощи медицинского электроотсоса отмечалось необильное наружное кровотечение, остановленное при помощи тугого наполнения полости физиологическим раствором на 13–15 мин. В другом случае при пункции краевого абсцесса VI сегмента печени размерами более 12 см в диаметре был прорыв гноя в брюшную полость, что удалось ликвидировать при помощи лапароскопической санации.
1. Способ санации абсцессов печени с помощью пункции под контролем УЗИ обладает доступностью, эффективностью и низкой травматичностью. Данная методика повышает эффективность комплексного лечения, снижая интоксикацию и вероятность послеоперационных осложнений.
2. При небольших абсцессах печени (до 5 см в диаметре) пункция абсцесса в большинстве случаев оказывается достаточной для его санации, при абсцессах от 5 до 10 см в диаметре лечебный эффект может быть достигнут дренированием одним микродренажом, при диаметре абсцесса более 10 см в диаметре и выраженной капсуле полость предпочтительнее дренировать двумя катетерами.
3. Частота постманипуляционных осложнений при лечении абсцессов печени с помощью диапевтических технологий невысока, эти осложнения могут быть купированы без лапаротомии.
Доступ и ход операции дренирования абсцесса печени
Диагноз абсцесса печени у лихорадящего больного легко установить, выполнив УЗИ или томографию, несмотря на тот факт, что это заболевание сопровождается скудной симптоматикой. Чаще всего абсцесс печени бывает вызван патологией желчных путей.
Воспаление дивертикулов толстой кишки и другие воспалительные процессы в брюшной полости также могут вызывать абсцессы печени. Нередки абсцессы неясной этиологии. В большинстве случаев абсцессы печени удаётся излечить чрескожным пункционным дренированием. Однако иногда встречают множественные абсцессы печени, рецидивные абсцессы или абсцессы, которые не удаётся излечить чрескожным дренированием. В таких случаях может потребоваться лапаротомия и открытое дренирование.
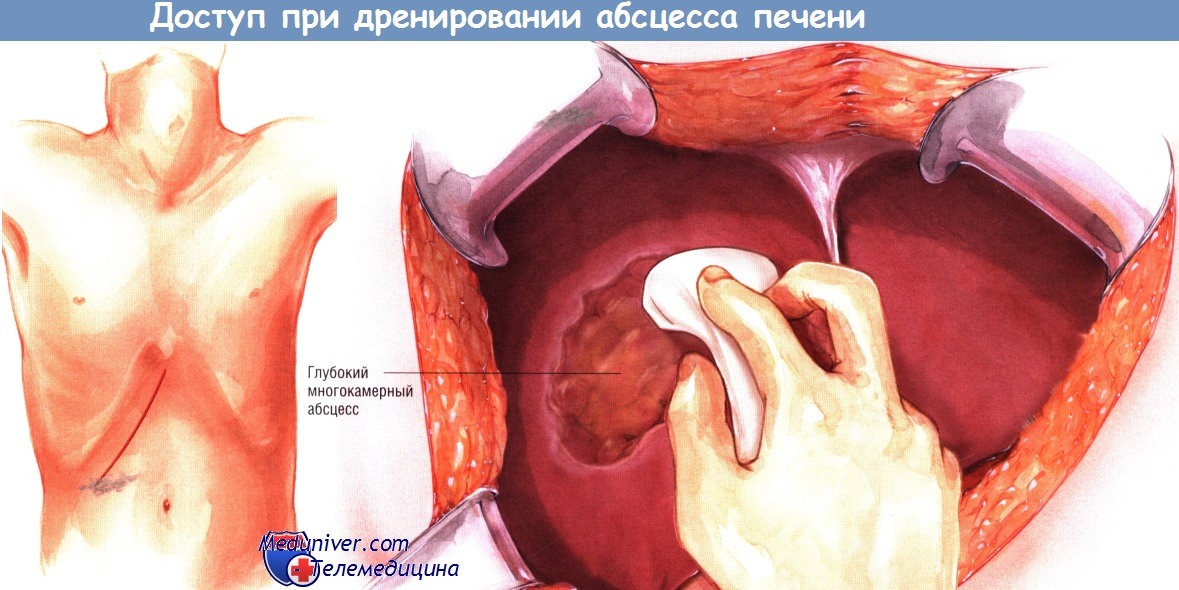
Обычно ревизию брюшной полости проводят через правый подрёберный доступ. Если патология локализована в левой доле печени, разрез можно расширить через срединную линию. Максимальной экспозиции можно достичь, применив ранорасширитель. Обнажают печень, спайки рассекают электроножом.
При глубоко расположенных абсцессах полезно применение интраоперационного УЗИ, позволяющего выявить локализацию, размеры и место, где абсцесс расположен ближе всего к поверхности печени.
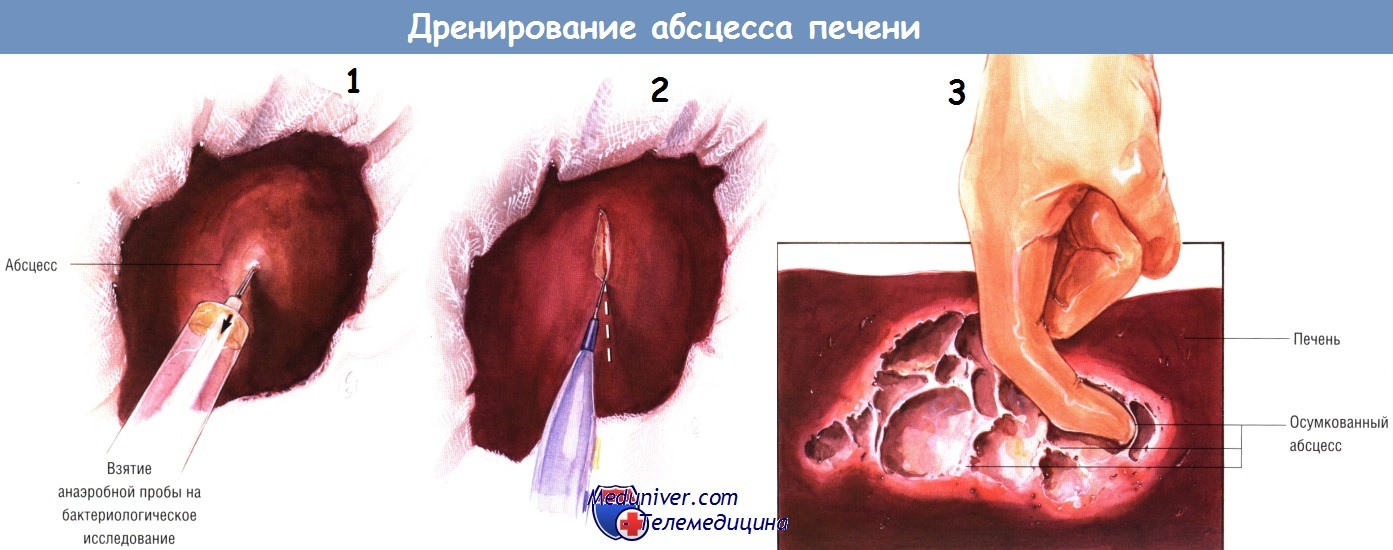
Сначала абсцесс следует опорожнить шприцем и отослать гной для посева на аэробные и анаэробные микроорганизмы. После этого абсцесс вскрывают диатермокоагулятором и полностью отсасывают его содержимое. Полость гнойника исследуют вручную, чтобы убедиться в отсутствии неопорожнённых «карманов» до её промывания.
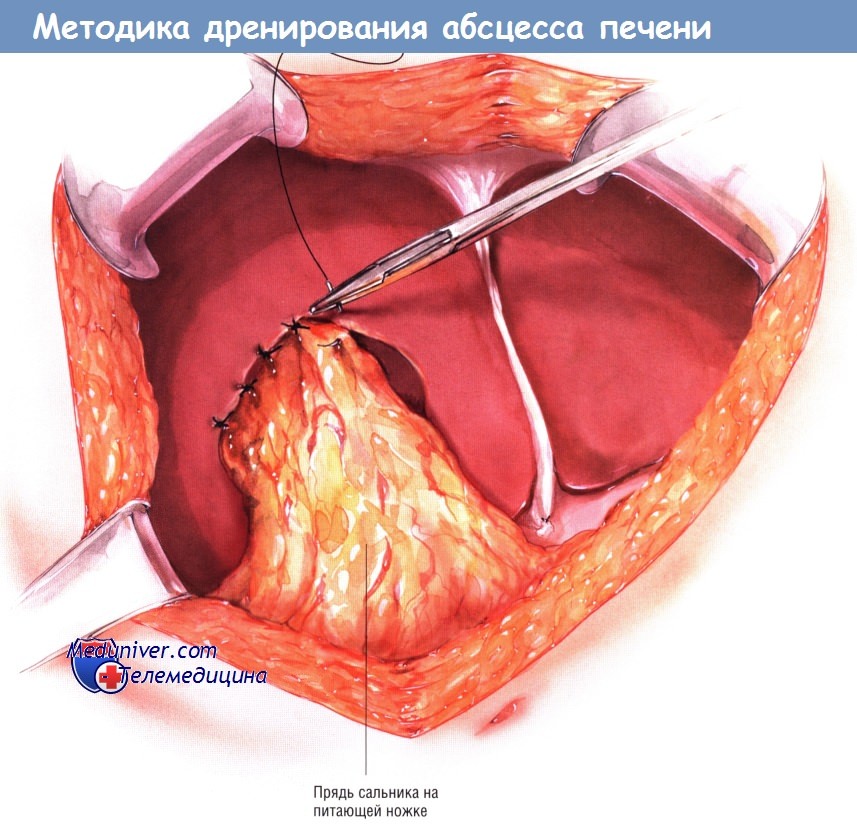
Если полость абсцесса большая или глубокая, тогда для уменьшения вероятности рецидива её можно заполнить прядью сальника на питающей ножке.
Дренажи должны стоять как в полости абсцесса, так и около печени.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Тампонада, печеночные дренажи при травме печени. Техника
При очевидно высокой смертности после прямого восстановления вен и анатомических резекций интерес в лечении тяжелых сосудистых повреждений сместился к методам тампонирования и сдерживания венозных травм в сочетании с эмболизацией источников артериальных кровотечений.
Многие из методов, применяемых при тяжелых травмах паренхимы, также эффективны при повреждениях крупных вен. В Мемфисе смертность пациентов с околопеченочными венозными повреждениями, которых лечили тампонадой сальником, составила лишь 20,5%. В другой статье, описывающей тампонирование у 14 пациентов с повреждением печеночной вены и шестерых пациентов с повреждением позадипеченочной части полой вены, общая смертность была всего 14%.
Cue et al. описали четырех пациентов с повреждением позадипеченочной полой вены, печеночных вен и их сочетанием, выживших после проведения первичного тампонировани. Хотя тампонирование и восполнение жидкости могут привести к синдрому замкнутого пространства в животе, если не применяется тактика открытого живота, в литературе не приводится данных о тромбозе крупных вен при тампонировании.
В настоящее время наиболее успешным методом лечения тяжелых травм позадипеченочной части полой вены и печеночных вен представляется тампонирование и сдерживание. Прямое восстановление поврежденных сосудов даже у опытных хирургов сопровождается значительными осложнениями. Резекция также показала себя чреватой осложнениями альтернативой с выживаемостью в первую очередь стабильных пациентов у опытных специалистов.
В целом оптимальный подход при тяжелых травмах печени включает:
а) соответствующую диагностику и оперативное вмешательство у нестабильных пациентов с кровотечением,
б) мобилизацию печеночных связок, не затронутых гематомой,чтобы лучше увидеть местоповреждения,
в) помещение пряди сальника на ножке в дефект,
г) быстрое определение потребности в тампонировании марлей, если прямые хирургические маневры неудачны и д) ангиогра-фическую эмболизацию поврежденных ветвей печеночной артерии при наличии продолжающегося кровотечения или контрастного пятна при КТ.
Печеночные дренажи при травме
Печеночные дренажи начали ставить вскоре после Второй мировой войны, когда была отмечена повышенная частота сепсиса при скоплении желчи и крови в области печени после травмы. Однако в 1978 г. Fischer et al. установили, что дренажи Пенроуза, наиболее часто использовавшиеся для дренирования этих скоплений, на самом деле увеличивают частоту инфекции при травмах печени I и II степени. Повреждения более высокой степени с очевидным желчеистечением обычно дренируются.
Многочисленные публикации четко подтверждают преимущества активных дренажей по сравнению с дренажем Пенроуза. В исследовании 1991 г. сообщалось о частоте околопеченочных абсцессов 6,7% без дренирования, 3,5% при активном дренировании и 13% при дренаже Пенроуза. В исследовании из госпиталя Шарите была обнаружена частота абсцессов 1,8% без дренирования, 0% при активном дренировании и 8,3% при открытом дренировании.
Однако на основании этих данных не просматривается достоверных различий в частоте абсцессов между группами без дренирования и с активным дренированием. Действительно, в обзоре 161 значительного повреждения печени, 78 пациентов подверглись активному дренированию, а 83 были оставлены без дренажа. Степень повреждения, кровопотеря, тяжесть шока и сочетаемые повреждения были сходными в обеих группах. Между двумя этими группами не было различий в смертности, образовании абсцессов и желчных свищей. Исследование завершается выводом, что дренирование должно выполняться только при повреждениях, сопровождающихся очевидным желчеистечением, отмеченным на момент лапаротомии.
Эта точка зрения была подтверждена в статье 1988 г., где указывается, что наличие гипотензии и многократных трансфузий является лучшим прогностическим фактором образования абсцесса, чем установка дренажа. При современном развитии техник интервенционной радиологии, повседневное дренирование перестало быть темой для обсуждения. В большинстве центров принята тактика выжидания с установкой дренажей только при очевидном желчеистечении. В случае же развития скопления или абсцесса можно воспользоваться методом чрескожного введения трубки под радиологическим наведением.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
кафедра эндоскопической хирургии ФПДО МГМСУ
Кафедра эндоскопической хирургии факультета последипломного образования МГМСУ
Кафедра эндоскопической хирургии факультета последипломного образования МГМСУ
Кафедра эндоскопической хирургии факультета последипломного образования МГМСУ
Анализ осложнений желчеотводящих вмешательств и мероприятия по их предотвращению
Журнал: Эндоскопическая хирургия. 2011;17(6): 17‑20
Емельянов С.И., Петров А.М., Хабицов В.С., Аккиев М.И. Анализ осложнений желчеотводящих вмешательств и мероприятия по их предотвращению. Эндоскопическая хирургия. 2011;17(6):17‑20.
Emel'ianov SI, Petrov AM, Khabitsov VS, Akkiev MI. Analysis and prevention of complications after drainage of the biliary system. Endoscopic Surgery. 2011;17(6):17‑20. (In Russ.).
кафедра эндоскопической хирургии ФПДО МГМСУ
Проведен сравнительный клинический анализ осложнений основных методик чреспеченочного дренирования у больных с механической желтухой, оценены их эффективность и безопасность, определены меры по предотвращению и уменьшению количества осложнений декомпрессионных вмешательств.
кафедра эндоскопической хирургии ФПДО МГМСУ
Кафедра эндоскопической хирургии факультета последипломного образования МГМСУ
Кафедра эндоскопической хирургии факультета последипломного образования МГМСУ
Кафедра эндоскопической хирургии факультета последипломного образования МГМСУ
На протяжении длительного срока большое количество осложнений желчеотводящих вмешательств обусловливало сдержанное отношение к чрескожному чреспеченочному дренированию у больных механической желтухой. Сложилось устойчивое и обоснованное мнение, что чрескожная чреспеченочная холангиостомия является в целом сложной и достаточно опасной процедурой, нередко сопровождающейся серьезными осложнениями [1, 2].
Однако совершенствование методик и использование тонких гибких игл, проводимых к желчному протоку под ультразвуковым контролем, позволило по иному взглянуть на показания к наружному желчеотведению у больных с механической желтухой. Такие осложнения, как жировая и воздушная эмболии, незапланированные пункции внутрибрюшных органов и плевральной полости при использовании современных средств планирования пункционных траекторий стали редкостью [3, 4]. Тем не менее полностью избежать осложнений чрескожных чреспеченочных вмешательств не удается, и они остаются серьезной проблемой, чаще возникая в особенно сложных случаях [5—8].
Осложнения декомпрессионных вмешательств были отмечены нами в 17,4% случаев. Все наблюдаемые осложнения были разделены на тяжелые и нетяжелые. Тяжелым мы считали осложнение, которое приводило к значительному ухудшению состояния больного и/или обусловливало необходимость выполнения хирургического вмешательства. Среди тяжелых осложнений мы выделяли геморрагические осложнения, требующие интенсивной терапии по жизненным показаниям, гнойно-септические, среди которых наиболее частым был холангит, а также желчеистечение в брюшную полость.
Всего на госпитальном этапе лечения осложнения развились у 16 больных. Частота развития тяжелых осложнений при чрескожной холангиографии составила 0,4%, при наружном дренировании билиарной системы — 3,1%, при эндопротезировании желчных протоков — 4,1%. У больных с опухолевой желтухой тяжелые осложнения встречались на 46,1% чаще. У 3 больных осложнения возникли дважды: после первого желчеотводящего вмешательства — дислокация дренажа без развития перитонита, а после выполнения повторного желчеотводящего вмешательства у 2 — дислокация дренажа и перитонит и у одного гемобилия. Более 80% осложнений произошло в течение 1-й недели после выполнения чрескожного желчеотведения, причем более половины из них были тяжелыми.
Среди ранних осложнений превалировали геморрагические осложнения — 11,2% всех осложнений данного периода, в том числе 2 тяжелых. В ближайшем послеоперационном периоде преобладали геморрагические, гнойные и гнойно-геморрагические осложнения. Из них 68,6% были тяжелыми.
Наиболее частым осложнением была дислокация дренажа, которая отмечена после 11 вмешательств. Чаще дислокации возникали в ближайшем и раннем послеоперационном периодах. Среди причин дислокации дренажей наибольшее значение имели длительное паллиативное желчеотведение, применение катетеров без фиксирующих приспособлений на дистальном конце, недостаточная глубина введения катетера в билиарную систему, применение наружного желчеотведения, сильный кашель и глубокое дыхание больного.
Наибольшее число дислокаций отмечалось при использовании катетеров без фиксирующих устройств и неглубоком положении дренажа в протоках и являлось пусковым механизмом развития других, более тяжелых осложнений, таких как кровотечение, желчеистечение и перитонит, перфорация желчных протоков, абсцессов брюшной полости. Чем раньше смещались дренажи, тем чаще они приводили к развитию тяжелых вторичных осложнений. Так, дислокации в раннем послеоперационном периоде вызвали 3 тяжелых осложнения, в позднем — всего одно. В отдаленном периоде осложнений, связанных с перемещением дренажа, не отмечено.
Желчеистечение в брюшную полость было вторым по частоте осложнением чрескожных желчеотводящих процедур. В 4 случаях желчеистечение сопровождалось дислокацией, желчным перитонитом или кровотечением. В одном случае желчеистечение было самостоятельным осложнением, не сочеталось с дислокацией дренажа и развитием перитонита. На наш взгляд, основными причинами желчеистечения в брюшную полость при холангиостомии являлись применение игл большого диаметра, выполнение нескольких поисковых пункций, незапланированная пункция поверхностно расположенных внутрипеченочных протоков, случайная пункция внепеченочных протоков или желчного пузыря. Желчеистечению также способствовали высокое давление в билиарной системе, наличие асцита, выполнение чрескожного эндопротезирования без предварительного дренирования, неадекватное наружное желчеотведение.
Повреждение стенок желчных протоков и паренхимы печени чаще возникало при проведении бужей и катетеров по гибким проводникам. При этом даже небольшие встречные препятствия могли приводить к боковым смещениям и изгибам проводника и катетера, выходу проводника из билиарной системы, разрывам стенки желчного протока и паренхимы печени.
Кровотечение было третьим по частоте осложнением и развилось у одного больного с доброкачественной и у 3 больных со злокачественной желтухой. У 2 больных кровотечение было в брюшную полость, у 2 — по дренажу. У одного больного кровотечение развилось во время выполнения вмешательства, у 3 — в ближайшем послеоперационном периоде. В 2 случаях кровотечение было массивным (объемом более 1000 мл), в одном — умеренным (объемом от 500 до 1000 мл) и еще в одном случае — небольшим (объемом менее 500 мл). У 2 больных кровотечение сочеталось с желчеистечением в брюшную полость. Кровотечения развились в результате травмы вен печени во время пункции и дренирования желчных протоков (3 случая) и дислокации дренажа (один случай).
Гемобилия развилась после 3 эндобилиарных вмешательств (у 2 больных с опухолевой окклюзией желчных протоков и у одного — с холедохолитиазом). У 2 больных на 12—14-е сутки после дренирования были выявлены абсцессы в правом поддиафрагмальном пространстве.
После имплантации пластиковых эндопротезов в 2 случаях из-за инкрустации эндопротеза возник рецидив желтухи. Эндопротезы были удалены эндоскопическим методом, после чего выполнены чрескожная чреспеченочная холангиостомия и повторное эндопротезирование. Установка эндопротезов диаметром 12F с погружением наружного конца в подкожную клетчатку не вызвала технических сложностей и осложнений.
По поводу развившихся осложнений были оперированы 9 больных. Повторные чрескожные пункции и дренирования под ультразвуковым контролем были выполнены 7 больным.
В нашем исследовании после чрескожных желчеотводящих вмешательств умерли 9 (9,8%) человек. На результаты лечения и летальность значительное влияние оказывали тяжесть состояния больных до начала декомпрессии, длительность желтухи, уровень билирубинемии, наличие холангита. Средний возраст умерших больных составил 62,5 года.
Анализ летальных исходов показал, что 5 (55,6%) больных умерли от печеночно-почечной недостаточности и ее сочетания с гнойной интоксикацией и сердечно-сосудистой недостаточностью, 2 — от острой сердечно-сосудистой недостаточности. Осложнения чрескожных желчеотводящих вмешательств явились причиной смерти 2 больных.
Средняя продолжительность жизни прослежена нами у 22 больных. При наружном и наружновнутреннем желчеотведении у больных со злокачественными новообразованиями желчных протоков и поджелудочной железы средняя продолжительность жизни составила 7,2 мес. Наибольшая продолжительность жизни была отмечена у больных с опухолями желчного пузыря и метастатическим поражением ворот печени. Выполнение на втором этапе лечения эндопротезирования желчных протоков у отдельных больных увеличивало продолжительность жизни до 9—11 мес.
В целях снижения вероятности желчеистечения в брюшную полость для пункции мы старались выбирать глубоко расположенный желчный проток диаметром не менее 5 мм. Так как повторные пункции капсулы значительно увеличивают риск развития кровотечения, при необходимости выполнения нескольких пробных пункций капсулу печени пунктировали только один раз. У больных с внутрипеченочным уровнем блока для пункции, как правило, выбирали один из сегментарных желчный протоков, что обеспечивало более протяженное расположение катетера в билиарной системе и снижало риск дислокации.
Для снижения риска дислокации дренажа его проводили максимально близко к месту блокады желчеоттока, его дистальный конец закручивали в виде петли. Применение дренажей с фиксирующей нитью, по нашему мнению, особенно важно при холецистостомии, так как нежелательные смещения дренажей при этом виде желчеотведения наблюдаются чаще.
Тем не менее использование катетеров с петлей на конце, как и баллон-катетеров, не обеспечивает абсолютно надежную защиту от дислокации, а лишь снижает ее частоту. От случайного удаления катетер лучше всего предохраняет надежная фиксация на коже. Опасность случайного удаления дренажа значительно возрастает при неадекватном поведении больного, в таких случаях мы стремились выполнить эндопротезирование желчных протоков.
Для уменьшения риска разрыва печени и профилактики кровотечения при установке дренажей мы выполняли осторожное манипулирование инструментами и старались катетеризировать билиарную систему через периферические сегменты правой доли печени. При этом данные трехмерной визуализации позволяли планировать пункционную траекторию по кратчайшему расстоянию без пересечения ветвей печеночных и воротной вен.
При наличии большого количества крови в отделяемой желчи для определения сброса контрастного вещества в кровеносные сосуды выполняли холангиографию. В большинстве случаев купировать кровотечение удавалось изменением положения катетера таким образом, чтобы боковые отверстия дренажа не совпадали с просветом сосудов. В 2 случаях для остановки кровотечения потребовалось временное пережатие дренажа, в одном случае — его замена катетером большего диаметра.
Для снижения риска развития осложнений при эндопротезировании желчных протоков мы устанавливали эндопротезы не ранее чем через 7—9 сут после полноценного наружного или наружновнутреннего желчеотведения. Как правило, к этому времени успевал сформироваться пункционный канал, а общее состояние больного значительно улучшалось. Кроме того, при этом практически исключалась возможность гемобилии и закупорки эндопротеза сгустками крови.
При длительном паллиативном желчеотведении из-за повышения риска закупорки дренажей и эндопротезов их промывали растворами антисептиков не реже одного раза в 3 дня, а через 4—6 нед производили профилактическую замену дренажей.
При нарушении проходимости эндопротеза к нему восстанавливали подход чрескожным или эндоскопическим доступом, а затем проводили реканализацию внутреннего просвета с помощью проводника или специальной щетки. В нескольких случаях просвет эндопротеза был восстановлен путем чрескожной пункции протока иглой 20G и проведением иглы к боковому отверстию протеза с последующим промыванием канала эндопротеза сильной струей стерильной жидкости.
Профилактику рецидива холангита при наружном желчеотведении мы проводили путем дачи внутрь доксициклина, тщательного ухода за кожей вокруг дренажа, постоянного контроля за проходимостью катетера, введения антисептических растворов в желчеприемник, предотвращения аспирации кишечного содержимого во время санации наружновнутренних дренажей. Перед выпиской из стационара пациенту и его родственникам разъясняли правила ухода за дренажом, указывали на возможность его смещения и закупорки.
При наличии холангита или выраженной перитуморозной инфильтрации нам не всегда удавалось провести дренаж через плотные стенки внутрипеченочных протоков. В такой ситуации мы не форсировали проталкивание катетера, а временно прекращали вмешательство, оставляя проводник в просвете протока, а кончик дренажа — возле его стенки. Через сутки попытку введения дренажа в просвет протока повторяли, при этом катетер, как правило, легко проходил через стенку протока.
При холангиостомии стремились вводить дренаж максимально глубоко в желчные протоки, что снижало риск дислокации. Если это не удавалось (особенно при высоком уровне блокады), в просвете протоков оставляли металлический проводник. Наружный конец проводника помещали внутри удлинительной магистрали. Катетер подшивали к коже, а удлинительную магистраль в нескольких местах фиксировали к коже липкой лентой. Оставленный проводник образовывал в просвете протоков один или два витка, что препятствовало его смещению. Кончик дренажа в этом случае не упирался в стенку протока, что также предотвращало направленное смещение дренажной трубки. При неполном смещении проводник частично оставался в протоке, и по нему можно было снова ввести выпавший катетер.
Важным мероприятием, направленным на профилактику дислокации дренажей, мы считаем проведение катетера за зону обструкции. Подтекание желчи в брюшную полость, обусловленное прохождением катетера через несоединенную с печенью стенку желчного пузыря, удавалось предупреждать легкой тракцией катетера наружу. При этом листки брюшины, покрывающие печень и желчный пузырь, смыкались и закрывали пункционный канал. При безуспешных попытках выполнения холангиостомии мы всегда оставляли катетер в паренхиме печени, что позволяло тампонировать пункционный канал и предотвратить желчеистечение.

Человеческий организм пронизан кровеносными сосудами. Во время бытовых, производственных или спортивных травм нарушается целостность стенки того или иного сосуда. Это чревато кровотечением или образованием гематомы. Гематома – скопление жидкой или свернувшейся крови в толщине мягких тканей. Зачастую это безобидное явление, но в ряде случаев медики часто сталкиваются с необходимостью удаления большой гематомы, которая может мешать жизнедеятельности тканей и соседних органов.
Гематомы могут образовываться:
- при любых видах травм – закрытых и открытых;
- в любом из участков человеческого тела;
- при травмах любой степени – от незначительных (в этом случае роль играет не физическое усилие, а хрупкость сосудистой стенки) до выраженных.
Гематомы могут возникать не только в момент прикладывания физической силы к тканям, но и через несколько часов и дней после этого. Примером послужит внутренняя гематома после операции – когда наступает несостоятельность швов, наложенных на кровеносные сосуды, поврежденные во время хирургического вмешательства. О возможности таких кровоизлияний в ткани нужно помнить постоянно. От этого зависит своевременность диагностики, а значит и успешность лечения гематомы.
Общие принципы врачебной тактики при гематомах
В превалирующем большинстве случаев травмы поверхностные и скопление крови в тканях незначительное. Зачастую врачебное вмешательство (в частности дренирование гематомы) не требуется, поскольку через определенное время гематома исчезает сама по себе. Этот процесс проходит благодаря постепенному лизису (разрушению) плазмы и клеток крови, образовавших гематому.
Скорость рассасывания гематомы после ушиба зависит от:
- количества излившейся крови;
- возраста (у пожилых гематомы рассасываются медленнее, чем у детей или молодых людей);
- присоединившейся инфекции (в этом случае гематома не рассасывается, а нагнаивается);
- состояния сосудов (при их патологической хрупкости может произойти повторное излияние крови в ткани в той же локации, и гематома просто не успеет рассосаться).
Прежде чем задаваться вопросом, как лечить большую гематому на руке, следует помнить, что в этой области проходят крупные сосуды, и излияние крови, образовавшей гематому, может сигнализировать о повреждении стенок этих сосудов и угрозе более выраженного кровотечения.
Реже гематомы возникают:
- в мышцах;
- в жировой клетчатке;
- в толще паренхиматозного органа;
- под мозговыми оболочками;
- в тканях мозга.
Объединяет их общая черта: кровь устремляется в ткани по принципу наименьшего сопротивления. Зная характеристики тканей, можно с большой уверенностью определить, где могла образоваться гематома. Успех лечения во многом зависит от этого фактора.
Врачебная тактика при скоплении крови в тканях зависит от ряда нюансов:
- локализации гематомы;
- возраста пациента;
- сопутствующих заболеваний.
Лечению гематомы небольших размеров на голове у ребенка следует уделить не меньшее внимание, чем обширной гематоме на передней брюшной стенке спортсмена. А острое инфекционное заболевание способно привести к тому, что при скоплении в тканях даже небольшого количества крови может наступить нагноение.
Консервативные и оперативные методы лечения гематом
Консервативное лечение гематомы – это оказание первой помощи и устранение возникшего скопления крови.
В качестве первой помощи при видимых гематомах применяют воздействие низких температур. С этой целью к месту возникновения гематомы прикладывают любую емкость с холодным содержимым. Это может быть лед из холодильника, холодная ложка (при гематоме небольшого размера – например, в области глаза) или даже пакет с молоком из охлаждаемой витрины.
Через несколько дней, чтобы гематома быстрее рассосалась (например, если пациент спрашивает, как убрать гематому на ноге в кратчайшие сроки), можно задействовать физиотерапевтические методы: УВЧ; СВЧ и другие.
Хирургическое лечение гематом проводится в случае их большого размера, из-за чего отмечается их давление на окружающие ткани; или при симптомах нагноения.
Вскрытие и дренирование подкожной гематомы может быть проведено в условиях перевязочной. Содержимое эвакуируют, образовавшуюся полость промывают, накладывают стерильную повязку.
Гематомы, возникающие под мозговыми оболочками и во внутренних органах, требуют экстренного хирургического вмешательства, проводимого в операционных отделениях стационара. Во время операции жидкую или свернувшуюся кровь удаляют и проводят дренирование. Кровь – отличная питательная среда для микроорганизмов. Поэтому после вскрытия больших гематом, даже если не было признаков присоединения инфекции, назначают антибиотики широкого спектра действия.
Лечение гематомы на голове у ребенка
Из-за чрезмерной подвижности дети часто травмируются. Большой процент детских травм составляют ушибы головы, которые часто сопровождаются возникновением гематом и образованием «шишек».
Первая медицинская помощь заключается в прикладывании холодного предмета к месту возникновения гематомы. Это нужно делать в первые несколько часов. Важно: учитывая несовершенство терморегуляции у детей (высокая чувствительность к низким температурам), применение холода у малышей должно быть дозированным – около получаса и с интервалами.
Читайте также:

