Дозировка преднизолона при красной волчанке
Обновлено: 25.04.2024
Системная красная волчанка (СКВ) – это аутоиммунное заболевание, приводящее к поражению различных органов и тканей, которое может протекать с развитием миастеничекого синдрома. Представляем клиническое наблюдение больной Г., 1979 года рождения с длительным, относительно благоприятным течением заболевания без тяжелого поражения внутренних органов с наличием миастенического синдрома.
Ключевые слова
Статья
Системная красная волчанка (СКВ) является системным аутоиммунным заболеванием, для которого характерны потеря толерантности к ядерным антигенам, нарушение активации Т- и В-лимфоцитов с дальнейшей поликлональной активацией В-лимфоцитов, вырабатывающих антитела, развитие иммунных комплексов, приводящих к повреждению различных органов и тканей [1]. За последние десятилетия в лечении СКВ достигнуты большие успехи - выживаемость больных значительно выросла и достигла 90% через 5 лет и около 80% – через 20 лет после установления диагноза[2].
Однако ряд проблем, связанных ведением больных СКВ, остается актуальным и на современномэтапе. Нередко наблюдается сложность трактовки отдельных синдромов, в частности, миастенического синдрома, рефрактерность к проводимой терапии, что требует назначения персонифицирующей терапии [3].
Представляем клиническое наблюдение больной Г., 1979 г.р.
С весны 2000 г. у больной появилась сыпь на лице в виде «бабочки», артрит пястно-фаланговых, коленных суставов, стал отмечаться геморрагический синдром (кровоточивость десен, мелкоточечные геморрагии на коже верхних и нижних конечностей, меноррагии), периодическое повышение температуры до 37,7–38,1ºС. Была госпитализирована в терапевтический стационар по месту жительства. В общем анализе крови (ОАК) были обнаружены анемия (эритроциты – 2,7х10 9 г/л, гемоглобин – 110 г/л), тромбоцитопения (90х10 9 г/л), повышение СОЭ до 54 мм/час. В биохимическом анализе крови (БАК), общем анализе мочи (ОАМ) изменений выявлено не было. При иммунологическом исследовании ревматоидный фактор был отрицателен, обнаружены положительные LE-клетки, положительные антитела к ДНК. При эхокардиографии был выявлен незначительный выпот в перикарде. Больной выставлен диагноз СКВ, подострое течение по началу заболевания, активность III (индекс активности SLEDAI 2K - 12 баллов), анемия, тромбоцитопения, дерматит, полиартрит, перикардит, положительные антитела к ДНК. С учетом высокой степени активности был назначен прием преднизолона 60 мг/день внутрь, проведена пульс-терапия преднизолоном 1000 мг № 3 с хорошим эффектом. На фоне лечения уменьшились проявления анемии, тромбоцитопении, был купирован геморрагический синдром, дерматит, полиартрит. Пациентке было рекомендовано продолжить прием преднизолона в течение одного месяца с дальнейшим медленным снижением этого препарата в течение 8 месяцев до 15 мг/день, прием препаратов кальция, ингибиторов протонной помпы.
Ухудшение состояния наступило в августе 2001 года на фоне снижения дозы преднизолона до 7,5 мг/день. У больной рецидивировали субфебрильная лихорадка, дерматит, анемия, артрит суставов кисти, впервые появился нефрит (суточная протеинурия 2,3 г, микрогематурия), отмечалось повышение СОЭ до 40 мм/час. С этого времени больная постоянно наблюдалась в ревматологическом отделении ГУЗ «Областная клиническая больница» (ОКБ). При поступлении состояние больной было средней тяжести. Температура тела 37,8℃. Кожные покровы и слизистые обычного цвета. Умеренно выраженное «лунообразное» лицо. Незначительная припухлость, болезненность при пальпации суставов кисти. В легких везикулярное дыхание. Число дыхательных движений в покое – 19 в мин. Границы сердца в пределах нормы. Пульс-72 в минуту, ритмичен. АД - 135 и 90 мм рт. ст. Изменений со стороны органов пищеварения, нервной системы не выявлено. Анамнез жизни –без особенности.
Доза преднизолона была увеличена до 50 мг/день. Больной была назначена программная пульс-терапия преднизолоном 1000 мг, циклофосфамидом 1000 мг 1 раз в месяц на протяжении 6 месяцев, затем 1 раз в 2–3 месяца на протяжении года. Больной был рекомендован прием эналаприла 5 мг/день, гидроксихлорохина 200 м/день. На фоне проводимого лечения состояние больной значительно улучшилось, нормализовалась температура тела, содержание эритроцитов, гемоглобина, были купированы явления артрита, нефрита.
С 2002 по 2009 гг. состояние пациентки было удовлетворительным, активность СКВ минимальная. Уровень антител к ДНК был в пределах нормы. Поддерживающая доза преднизолона составляла 5,0–7,5 мг/день, гидроксихлорохина – 200 мг/день.
С осени 2009 года у больной стали отмечаться птоз верхнего века, постоянное ощущение тяжести и диплопии правого глаза, головные боли, боли и небольшая слабость в мышцах плечевого и тазового пояса. При госпитализации в ревматологическое отделение ОКБ в октябре 2009 года выявлено повышение СОЭ до 32 мм/час, повышение антител к ДНК – 220 МЕ/л. Уровень креатинфосфокиназы (КФК), исследуемый в динамике, был в пределах нормы. При проведении магнитно-резонансной томографии (МРТ) головы и компьютерной томографии (КТ) орбит патологии не выявлено. Неврологом и окулистом диагностировано поражение n. oculomotorius справа, что расценено как проявление васкулита сосудов головного мозга. При выполнении электронейромиографии (ЭНМГ) лицевого нервабыли выявленыизменения,характерные для аксонального поражения правого лицевого нерва, признаки блока нервно-мышечной проводимости 1 степени миастенического характера, при ЭНМГ верхних и нижних конечностей патологии не выявлено. При проведении КТ грудной клетки была исключена патология вилочковой железы. После завершения необходимого обследования неврологом был выставлен диагноз миастенического синдрома, частичного поражения глазодвигательного нерва справа в рамках СКВ, рекомендовано продолжить терапию основного заболевания.
С учетом поражения мышц диагноз СКВ был сформулирован следующим образом:
Основное заболевание: СКВ, подострое течение по началу заболевания, активность II степени, индекс активности SLEDAI 2K – 10 баллов. Васкулит головного мозга. Миастенический синдром. Частичное поражение глазодвигательного нерва справа. Положительные антитела к ДНК. Перикардит, нефрит, полиартрит в анамнезе.
Осложнения: Медикаментозный синдром Иценко-Кушинга. Вторичная артериальная гипертензия.
С учетом нарастания активности СКВ, появления церебрального васкулита, миастенического синдрома доза преднизолона была увеличена до 30 мг/день внутрь на 1 месяц с дальнейшим постепенным снижением до 10 мг/день. Пациентке была назначена повторная программная пульс-терапия циклофосфамидом 1000 мг, преднизолоном по 1000 мг 1 раз в месяц в течение 6 месяцев, затем 1 раз в 3 месяца на протяжении года. На фоне терапии прошли головные боли, уменьшились миалгии, явления диплопии правого глаза.
Через 10 месяцев с момента возобновления программной пульс-терапии преднизолоном, циклофосфамидом, на фоне приема преднизолона 10 мг/день у больной вновь стала нарастать мышечная слабость верхних и нижних конечностей, появились диплопия и птоз правого глаза. Уровень КФК оставался нормальным, при ЭНМГ верхних и нижних конечностей патологии не выявлено. Других клинических и лабораторных признаков нарастания активности СКВ не найдено. При проведении онкопоиска данных в пользу злокачественной опухоли не получено. С учетом усиления миастенического синдрома доза преднизолона была увеличена до 30 мг/день на 2 недели с дальнейшим ее снижением до 10 мг/день. Циклофосфамид заменен на метотрексат 7,5 мг/неделю с постепенным увеличением дозы до 12,5–15,0 мг/неделю. Данная терапия оказалась эффективной.
В течение последующих 10 лет течение заболевания было относительно благоприятным. На фоне поддерживающих доз преднизолона 5,0–7,5 мг/день, метотрексата 5,0–7,5 мг/неделю, активность СКВ была преимущественно минимальной. Периодически отмечалось уменьшение мышечной слабости в конечностях, увеличение диплопии, птоза правого глаза, которые коррегировались кратковременным повышением дозы глюкокортикоидов и метотрексата.
Клиническая картина СКВ отличается большим разнообразием. При СКВ в 50% случаев наблюдаются миалгии [4,5]. Значительно реже – в 4–16 % при данном заболевании обнаруживается миозит с характерными клиническими, лабораторно-инструментальными признаками в рамках перекрестного синдрома (сочетание СКВ с полимиозитом) [4,6].
У пациентки в данном клиническом наблюдении отмечено редкое для системных заболеваний соединительной ткани, в том числе и СКВ, поражение глазодвигательных мышц. У пациентки выявлено и типичное для системных заболеваний соединительной ткани поражение мышц плечевого и тазового пояса, но при этом не было повышения уровня КФК и отсутствовало первично-мышечное поражение по данным ЭНМГ. С учетом этих особенностей поражение мышц рассматривалось как проявление миастенического синдрома при СКВ, а не как полимиозита в рамках перекрестного синдрома.
Еще одна особенность данного клинического наблюдения состоит в относительно благоприятном течении СКВ на протяжении 20 лет и отсутствии тяжелого поражения жизненно важных органов.
Определение тактики лечения в описанном наблюдении не всегда было однозначным. При появлении симптомов васкулита головного мозга, поражения глазодвигательных мышц, мышц плечевого и тазового пояса встал вопрос о выборе цитостатической терапии у пациентки. С учетом васкулита головного мозга проводилась терапия циклофосфамидом, на фоне чего удалось стабилизировать состояние и добиться исчезновения головных болей, уменьшения птоза, диплопии правого глаза, болей, слабости в мышцах конечностей. В связи с кратковременным эффектом и нарастанием миастенического синдрома циклофосфамид был заменен на метотрексат, терапия которым оказалась успешной.
На протяжении последних 10 лет на фоне поддерживающих доз ГК и метотрексата активность СКВ оставалась минимальной, нарастания миастенического синдрома, анемии, проявлений нефрита и церебрального васкулита не отмечено.
- Клиническая картина СКВ может отличаться большим разнообразием.
- Выбор базисной терапии у больных СКВ представляет сложности. Он должен осуществляться с учетом преимущественного поражения органов и тканей.
- Применение адекватных доз ГК и цитостатиков обеспечивает длительное благоприятное течение заболевания.
Литература
1. Российские клинические рекомендации. Ревматология/Под ред. Е.Л. Насонова. М.: ГЭОТАР – Медиа, 2017: 464 с.
2.Doria A, Iaccarino L, Ghirardello A, et al. Long-term prognosis and causes of death in systemic lupus erythematosus. Am J Med. 2006;119(8):700-6.
3. Насонов Е.Л., Александрова Е.Н., Новиков А.А. Аутоиммунные ревматические заболевания – проблемы иммунопатологии и персонифицированной терапии. Вестник РАМН, 2015, 2: 169–182.
4. Maazoun F, Frikha F, Snoussi M, et al. Systemic lupus erythematosus‐myositis overlap syndrome: report of 6 cases. Clin Pract 2011;1: 89.
5. Garton MJ, Isenberg DA. Clinical features of lupus myositis versus idiopathic myositis: A review of 30 cases. Br J Rheumatol 1997; 36:1067‐74.
6. Miller JB, Paik JJ. Overlap syndromes in inflammatory myopathies. Curr Treat Options in Rheum 2017; 3:289‐98.
За последние два десятилетия благодаря рациональному использованию кортикостероидных гормонов (КГ) и цитотоксических иммунодепрессантов (ЦИ) удалось значительно улучшить жизненный прогноз больных системной красной волчанкой (СКВ). Проведение пульс-терапи
За последние два десятилетия благодаря рациональному использованию кортикостероидных гормонов (КГ) и цитотоксических иммунодепрессантов (ЦИ) удалось значительно улучшить жизненный прогноз больных системной красной волчанкой (СКВ). Проведение пульс-терапии метилпреднизолоном (МП) и циклофосфаном (ЦФ) у больных с волчаночным нефритом, поражением центральной нервной системы (ЦНС) и цитопеническим кризом способствует ускорению сроков достижения клинического улучшения. Патофизиологическим обоснованием для применения ударных доз метилпреднизолона является его способность активно влиять на систему иммунитета и подавлять воспалительные реакции. Один из важнейших эффектов ударных доз КГ — подавление активности нейтрофилов и моноцитов и способность вызывать транзиторную перераспределительную лимфопению. Угнетающее воздействие мегадоз кортикостероидов на функцию В-лимфоцитов приводит к стойкому снижению продукции иммуноглобулинов, а следовательно, и аутоантител, а также к уменьшению образования патологических иммунных комплексов. Из других важных компонентов механизма действия ударных доз КГ заслуживают внимания воздействие на систему цитокинов-интерлейкинов-1,6, фактора некроза опухоли, металлопротеиназ и липокортина, ингибиция экспрессии и функциональной активности Fc и СЗ рецепторов мононуклеарных фагоцитов.
Однако далеко не во всех случаях классическая ПТ позволяет быстро и надежно решать сложнейшие вопросы лечения в критических ситуациях и прогностически неблагоприятных вариантах течения СКВ. В настоящее время достаточно четко выявляется особая группа риска. В эту группу в первую очередь включаются пациенты с развитием СКВ в подростковом возрасте, быстропрогрессирующим волчаночным нефритом с диффузным поражением клубочкового аппарата и «полулуниями», стойкой артериальной гипертензией и азотемией, быстрым развитием нефротического синдрома в молодом возрасте, церебропатией с судорожным синдромом и комой, поперечным миелитом, геморрагическим пневмонитом, тромбоцитопенией, генерализованным поражением кожи и слизистых оболочек с развитием некрозов, сопровождающихся криоглобулинемией, гипокомплементемией и высоким уровнем антиядерных антител. Огромное значение в оценке жизненного прогноза у этой группы пациентов имеет своевременное назначение патогенетической терапии.
Консервативная терапия с использованием подавляющих доз преднизолона и цитостатиков, назначаемых внутрь, у некоторых больных улучшает клиническую картину, но почти не влияет на жизненный прогноз, особенно в случаях прогрессирующего волчаночного нефрита, церебрального криза и геморрагического пневмонита. Однократное трехдневное применение ПТ МП может за сравнительно короткое время уменьшить клиническую и лабораторную активность при нефротическом синдроме. Однако 5-летняя выживаемость пациентов, как правило, не превышает 60%. Другими словами, ударные дозы МП прекрасно зарекомендовали себя в качестве фактически ургентной терапии, с успехом применяющейся в ситуациях, непосредственно угрожающих жизни пациента, при нарастании симптоматики и в случаях неэффективности или невозможности использования консервативной схемы лечения.
Практически при всех прогрессирующих хронических заболеваниях, в том числе и аутоиммунных, жизненный и социальный прогноз в огромной степени зависит от системного, программного подхода к терапии.
Различные схемы и программы интенсивной терапии у больных СКВ стали появляться уже с середины 80-х годов и сводились к назначению ПТ в ежемесячном режиме в течение полугода. Несколько позже появилась схема программного назначения ПТ в комбинации с циклофосфаном: 1 г циклофосфана может быть добавлен к стандартной пульс-терапии обычно на 2-3-й день лечения или дополнительно к метипреду при ежемесячном режиме. Показанием для комбинированного использования циклофосфана и метипреда является манифестная высокоактивная СКВ с выраженными иммунологическими нарушениями. Программное применение пульс-терапии ЦФ у больных быстро прогрессирующим люпус-нефритом впервые в стране предложила группа исследователей во главе с профессором И. Е. Тареевой. Согласно этой методике, ЦФ вводится внутривенно из расчета 1 г на 1 м 2 поверхности тела 1-2 раза в месяц в течение года. По сравнению с пероральным назначением ЦФ эта программа позволяет добиться хороших и стабильных результатов более чем у 70% больных с прогрессирующим нефритом. Особенно важным представляется то, что внутривенное введение мегадоз ЦФ оказывает значительно меньшее токсическое воздействие на эпителий мочевого пузыря и костный мозг, практически не вызывая геморрагических циститов и агранулоцитоза.
Другое направление интенсивной терапии ревматических заболеваний — экстракорпоральные методы лечения: плазмаферез (ПФ) и практически все сорбционные технологии, гемо- и плазмосорбция. В современном исполнении ПФ осуществляется с помощью центрифужной или мебранной технологии с удалением 40-60 мл плазмы на 1 кг веса больного. Для замещения потери белка используется альбумин или свежезамороженная плазма. Стандартные курсы ПФ состоят из 3-6 процедур, проводимых последовательно или с короткими интервалами, с суммарной эксфузией плазмы до 15 л.
Интерес к ПФ у ревматологов возник на рубеже 60-80-х годов после фундаментальных исследований, посвященных иммунокомплексной природе СКВ, изучению механизмов иммунокомплексного поражения органов и тканей и патогенетической роли антител к нативной ДНК. Представлялось вполне рациональным уменьшить степень тканевых повреждений за счет удаления из циркуляции иммунных комплексов (ЦИК), антител к ДНК (а-ДНК), криоглобулинов и цитокинов.
Первые попытки применения терапевтического ПФ у больных СКВ продемонстрировали возможности этого метода в первую очередь в ситуациях, когда кортикостероидная и иммуносупрессивная терапия оказывается неэффективной, при наличии высокого уровня ЦИК, а-ДНК, криоглобулинемии, цитопениях. Выявлена прямая зависимость между адекватным удалением из циркуляции патологических белковых структур и клиническим эффектом, изучены механизмы деблокирования РЭС и повышения естественного клиренса.
Эффективность плазмафереза (от нескольких процедур до многократно повторяемых серий при неблагоприятном течении СКВ) хорошо известна и доказана в ходе многочисленных, в основном зарубежных, исследований 80-90-х годов. Пока не получено убедительных данных об эффективности ПФ у больных люпус-нефритом. Результаты проведенных в США и Канаде открытых и контролируемых испытаний весьма противоречивы.
Изолированное применение ПФ при СКВ в большинстве случаев существенно ограничено развитием так называемого синдрома рикошета, возникающего непосредственно после удаления достаточно большого объема плазмы. Резкое повышение уровня аутоантител в ближайшие дни после процедуры — «рикошет» — связывается со стимуляцией лимфоцитов, продуцирующих аутоантитела по принципу обратной связи. Обычно лабораторный «рикошет» сопровождается обострением клинической картины, что в целом производит впечатление терапевтической неудачи. Логичными представляются два выхода из этой ситуации. Первый — сокращение времени между процедурами и проведение длительных серий ПФ в течение нескольких месяцев или даже лет. Второй, по-видимому, более рациональный и эффективный способ достижения стойкого клинического эффекта при назначении ПФ у больных СКВ — комбинирование экстракорпоральных методов и пульс-терапии МП и ЦФ в синхронном режиме.
Идея синхронной ИТ материализовалась уже в 80-х годах и является практически неотъемлемой частью лечения некоторых системных васкулитов, синдрома Гудпасчера, Вегенера, Хаммана-Ричи, криоглобулинемической пурпуры и поражения центральной и периферической нервной системы при болезни Шегрена. Первые успешные попытки применения синхронной ИТ у больных СКВ были предприняты в 1984 году в Японии, России и Германии: за рубежом — плазмаферез в комбинации с ЦФ, в России — ПФ в комбинации с пульс-терапией МП и ЦФ.
В Институте ревматологии начиная с середины 80-х изучалась эффективность синхронного применения ПФ и пульс-терапии МП и ЦФ у 56 больных СКВ с неблагоприятным жизненным прогнозом. Методика проведения синхронной интенсивной терапии (СИТ) заключалась в следующем: в течение первого месяца больным проводились три процедуры ПФ с удалением не менее 1500 мл плазмы за сеанс, интервалы между процедурами составляли 5-6 дней. После каждой процедуры назначался внутривенно 1 г метипреда, а после второй процедуры к МП добавлялся 1 г ЦФ. Далее в течение года через каждые 3 месяца проводилась одна процедура ПФ с последующим введением 1 г МП и 1 г ЦФ. Основу группы составляли молодые женщины, в подавляющем большинстве с небольшим сроком заболевания, с развернутой клиникой СКВ. Почти у каждого пациента наблюдался прогрессирующий волчаночный нефрит, более чем у половины — нефротический синдром, церебропатия, у трети больных на фоне криоглобулинемии наблюдался распространенный генерализованный васкулит кожи и слизистых оболочек. Высокая клиническая активность сопровождалась значительным повышением уровня антител к ДНК, ЦИК и гипокомплементемией.
Особо следует подчеркнуть, что у половины больных этой группы стандартная терапия, включавшая в себя массивные дозы кортикостероидов и иммунодепрессантов, была неэффективной, а почти трети пациентов адекватная терапия вообще не проводилась.
Многолетнее наблюдение за этой группой больных по окончании 12-месячной СИТ позволило сделать заключение о ее высокой эффективности. Среди этих пациентов 5-летняя выживаемость составила 81%. Наиболее показательными оказались результаты применения СИТ в группе из 12 подростков, у которых течение волчанки, как правило, приобретает фатальный характер. За весь период наблюдения состояние, близкое к клинико-лабораторной ремиссии, было отмечено у 8 из 12 больных, у 2 пациентов эпизодически наблюдались кратковременные обострения СКВ. Ежедневная доза преднизолона составляла от 2,5 до 15 мг, у одной пациентки кортикостероиды были полностью отменены. Большинству больных удалось вернуться к нормальной жизни, учебе, посильной работе, некоторые пациентки вышли замуж и имеют здоровых детей.
Таким образом, программа синхронной интенсивной многомесячной терапии оказывает значительное влияние на клинико-лабораторные проявления и существенно улучшает жизненный и социальный прогноз у больных СКВ с прогностически неблагоприятным вариантом течения. Синхронное назначение ПФ и внутривенное введение ударных доз МП и ЦФ могут использоваться по жизненным показаниям в случаях так называемого волчаночного криза — при тромбоцитопенической пурпуре, церебральной коме, развитии тромбозов, инфарктов и инсультов у больных с антифосфолипидным синдромом и геморрагическим пневмонитом. В этих ситуациях проведение СИТ обычно ограничивается 3-4 последовательными процедурами — вплоть до купирования ургентной ситуации. В случаях с заведомо неблагоприятным долгосрочным жизненным прогнозом — прогрессирующий гломерулонефрит или поражение ЦНС, язвенно-некротический васкулит, острое начало болезни у подростка — требуется проведение длительных программ СИТ.
Нам представляется, что возможности программной СИТ далеко не исчерпаны. Перспективным может оказаться добавление в схему внутривенного иммуноглобулина, моноклональных антител и интерферонов, применение которых способно блокировать образование аутоантител и патологических ЦИК. Весьма актуальным остается индивидуальный подбор программы с более частым (ежемесячным, еженедельным) назначением плазмафереза и ПТ. Особенно важным аспектом, обеспечивающим возможность проведения более длительных и полноценных курсов экстракорпоральных процедур, является внедрение новых технологий обработки плазмы, таких, как каскадная фильтрация и иммуносорбция, применение которых позволяет сводить к минимуму потерю альбумина и селективно удалять из циркуляции патологические аутоантитела и иммунные комплексы.
Приведенная научная информация является обобщающей и не может быть использована для принятия решения о возможности применения конкретного лекарственного препарата.
Владелец регистрационного удостоверения:
Лекарственная форма
Форма выпуска, упаковка и состав препарата Преднизолон
| Раствор для в/в и в/м введения | 1 мл |
| преднизолон (в форме натрия фосфата) | 30 мг |
1 мл - ампулы темного стекла (10) - пачки картонные.
1 мл - ампулы темного стекла (3) - пачки картонные.
Фармакологическое действие
ГКС. Подавляет функции лейкоцитов и тканевых макрофагов. Ограничивает миграцию лейкоцитов в область воспаления. Нарушает способность макрофагов к фагоцитозу, а также к образованию интерлейкина-1. Способствует стабилизации лизосомальных мембран, снижая тем самым концентрацию протеолитических ферментов в области воспаления. Уменьшает проницаемость капилляров, обусловленную высвобождением гистамина. Подавляет активность фибробластов и образование коллагена.
Ингибирует активность фосфолипазы А 2 , что приводит к подавлению синтеза простагландинов и лейкотриенов. Подавляет высвобождение ЦОГ (главным образом ЦОГ-2), что также способствует уменьшению выработки простагландинов.
Уменьшает число циркулирующих лимфоцитов (T- и B-клеток), моноцитов, эозинофилов и базофилов вследствие их перемещения из сосудистого русла в лимфоидную ткань; подавляет образование антител.
Преднизолон подавляет высвобождение гипофизом АКТГ и β-липотропина, но не снижает уровень циркулирующего β-эндорфина. Угнетает секрецию ТТГ и ФСГ.
При непосредственной аппликации на сосуды оказывает вазоконстрикторный эффект.
Преднизолон обладает выраженным дозозависимым действием на метаболизм углеводов, белков и жиров. Стимулирует глюконеогенез, способствует захвату аминокислот печенью и почками и повышает активность ферментов глюконеогенеза. В печени преднизолон усиливает депонирование гликогена, стимулируя активность гликогенсинтетазы и синтез глюкозы из продуктов белкового обмена. Повышение содержания глюкозы в крови активизирует выделение инсулина.
Преднизолон подавляет захват глюкозы жировыми клетками, что приводит к активации липолиза. Однако вследствие увеличения секреции инсулина происходит стимуляция липогенеза, что способствует накоплению жира.
Оказывает катаболическое действие в лимфоидной и соединительной ткани, мышцах, жировой ткани, коже, костной ткани. В меньшей степени чем гидрокортизон, влияет на процессы водно-электролитного обмена: способствует выведению ионов калия и кальция, задержке в организме ионов натрия и воды. Остеопороз и синдром Иценко-Кушинга являются главными факторами, ограничивающими длительную терапию ГКС. В результате катаболического действия возможно подавление роста у детей.
В высоких дозах преднизолон может повышать возбудимость тканей мозга и способствует понижению порога судорожной готовности. Стимулирует избыточную продукцию соляной кислоты и пепсина в желудке, что приводит к развитию пептической язвы.
При системном применении терапевтическая активность преднизолона обусловлена противовоспалительным, противоаллергическим, иммунодепрессивным и антипролиферативным действием.
По сравнению с гидрокортизоном противовоспалительная активность преднизолона в 4 раза больше, минералокортикоидная активность в 0.6 раза меньше.
Фармакокинетика
При приеме внутрь хорошо всасывается из ЖКТ. C max в плазме отмечается через 90 мин. В плазме большая часть преднизолона связывается с транскортином (кортизолсвязывающим глобулином). Метаболизируется преимущественно в печени.
T 1/2 составляет около 200 мин. Выводится почками в неизмененном виде - 20%.
Показания активных веществ препарата Преднизолон
Для приема внутрь и парентерального применения: ревматизм; ревматоидный артрит, дерматомиозит, узелковый периартериит, склеродермия, болезнь Бехтерева, бронхиальная астма, астматический статус, острые и хронические аллергические заболевания, анафилактический шок, болезнь Аддисона, острая недостаточность коры надпочечников, адреногенитальный синдром; гепатит, печеночная кома, гипогликемические состояния, липоидный нефроз; агранулоцитоз, различные формы лейкемии, лимфогранулематоз, тромбоцитопеническая пурпура, гемолитическая анемия; малая хорея; пузырчатка, экзема, зуд, эксфолиативный дерматит, псориаз, почесуха, себорейный дерматит, СКВ, эритродермия, алопеция.
Для внутрисуставного введения: хронический полиартрит, посттравматический артрит, остеоартрит крупных суставов, ревматические поражения отдельных суставов, артрозы.
Для инфильтрационного введения в ткани: эпикондилит, тендовагинит, бурсит, плечелопаточный периартрит, келоиды, ишиалгии, контрактура Дюпюитрена, ревматические и сходные с ними поражения суставов и различных тканей.
Открыть список кодов МКБ-10| Код МКБ-10 | Показание |
| C81 | Болезнь Ходжкина [лимфогранулематоз] |
| C91 | Лимфоидный лейкоз [лимфолейкоз] |
| C92 | Миелоидный лейкоз [миелолейкоз] |
| C93 | Моноцитарный лейкоз |
| C95.9 | Лейкоз неуточненный |
| D59 | Приобретенная гемолитическая анемия |
| D69.3 | Идиопатическая тромбоцитопеническая пурпура |
| D70 | Агранулоцитоз |
| E16.1 | Другие формы гипогликемии (гиперинсулинизм) |
| E25 | Адреногенитальные расстройства |
| E27.1 | Первичная недостаточность коры надпочечников |
| E27.4 | Другая и неуточненная недостаточность коры надпочечников |
| I02 | Ревматическая хорея |
| J45 | Астма |
| J46 | Астматическое статус [status asthmaticus] |
| K72 | Печеночная недостаточность, не классифицированная в других рубриках (в т.ч. печеночная кома, печеночная энцефалопатия) |
| K73 | Хронический гепатит, не классифицированный в других рубриках |
| L10 | Пузырчатка [пемфигус] |
| L20.8 | Другие атопические дерматиты (нейродермит, экзема) |
| L21 | Себорейный дерматит |
| L23 | Аллергический контактный дерматит |
| L24 | Простой раздражительный [irritant] контактный дерматит |
| L26 | Эксфолиативный дерматит |
| L28.0 | Простой хронический лишай (ограниченный нейродермит) |
| L28.1 | Почесуха узловатая |
| L28.2 | Другая почесуха |
| L29 | Зуд |
| L30.0 | Монетовидная экзема |
| L40 | Псориаз |
| L50 | Крапивница |
| L53.9 | Эритематозное состояние неуточненное |
| L63 | Гнездная алопеция |
| L66 | Рубцующая алопеция |
| L91.0 | Гипертрофический рубец |
| L93.0 | Дискоидная красная волчанка |
| M05 | Серопозитивный ревматоидный артрит |
| M13 | Другие артриты |
| M15 | Полиартроз |
| M16 | Коксартроз [артроз тазобедренного сустава] |
| M17 | Гонартроз [артроз коленного сустава] |
| M19 | Другие артрозы |
| M30 | Узелковый полиартериит и родственные состояния |
| M32 | Системная красная волчанка |
| M33 | Дерматополимиозит |
| M34 | Системный склероз |
| M45 | Анкилозирующий спондилит |
| M54.3 | Ишиас |
| M54.4 | Люмбаго с ишиасом |
| M65 | Синовиты и теносиновиты |
| M70 | Болезни мягких тканей, связанные с нагрузкой, перегрузкой и давлением |
| M71 | Другие бурсопатии |
| M72.0 | Ладонный фасциальный фиброматоз [Дюпюитрена] |
| M75.0 | Адгезивный капсулит плеча |
| M77 | Другие энтезопатии (эпикондилит) |
| M79.0 | Ревматизм неуточненный |
| N04 | Нефротический синдром |
| T78.2 | Анафилактический шок неуточненный |
| T78.3 | Ангионевротический отек (отек Квинке) |
| T78.4 | Аллергия неуточненная |
| T80.5 | Анафилактический шок, связанный с введением сыворотки |
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
При приеме внутрь для замещающей терапии у взрослых начальная доза составляет 20-30 мг/сут, поддерживающая доза - 5-10 мг/сут. При необходимости начальная доза может составлять 15-100 мг/сут, поддерживающая - 5-15 мг/сут. Суточную дозу следует уменьшать постепенно. Для детей начальная доза составляет 1-2 мг/кг/сут в 4-6 приемов, поддерживающая - 300-600 мкг/кг/сут.
При в/м или в/в введении доза, кратность и продолжительность применения определяются индивидуально.
При внутрисуставном введении в крупные суставы применяют дозу 25-50 мг, для суставов средней величины - 10-25 мг, для мелких суставов - 5-10 мг. Для инфильтрационного введения в ткани в зависимости от тяжести заболевания и величины области поражения применяют дозы от 5 до 50 мг.
Побочное действие
Со стороны эндокринной системы: нарушения менструального цикла, угнетение функции надпочечников, синдром Иценко-Кушинга, подавление функции гипофизарно-надпочечниковой системы, снижение толерантности к углеводам, стероидный диабет или манифестация латентного сахарного диабета, замедление роста у детей, задержка полового развития у детей.
Со стороны пищеварительной системы: тошнота, рвота, стероидная язва желудка и двенадцатиперстной кишки, панкреатит, эзофагит, кровотечения и перфорация ЖКТ, повышение или снижение аппетита, метеоризм, икота. В редких случаях - повышение активности печеночных трансаминаз и ЩФ.
Со стороны обмена веществ: отрицательный азотистый баланс из-за катаболизма белков, повышенное выведения кальция из организма, гипокальциемия, повышение массы тела, повышенное потоотделение.
Со стороны сердечно-сосудистой системы: потеря калия, гипокалиемический алкалоз, аритмия, брадикардия (вплоть до остановки сердца); стероидная миопатия, сердечная недостаточность (развитие или усиление симптомов), изменения на ЭКГ, характерные для гипокалиемии, повышение АД, гиперкоагуляция, тромбозы. У пациентов с острым инфарктом миокарда - распространение очага некроза, замедление формирования рубцовой ткани, что может привести к разрыву сердечной мышцы.
Со стороны костно-мышечной системы: замедление роста и процессов окостенения у детей (преждевременное закрытие эпифизарных зон роста), остеопороз (очень редко - патологические переломы, асептический некроз головки плечевой и бедренной кости), разрыв сухожилий мышц, мышечная слабость, стероидная миопатия, уменьшение мышечной массы (атрофия).
Со стороны нервной системы: головная боль, повышение внутричерепного давления, делирий, дезориентация, эйфория, галлюцинации, маниакально-депрессивный психоз, депрессия, нервозность или беспокойство, бессонница, головокружение, вертиго, псевдоопухоль мозжечка, судорожные припадки.
Со стороны органа зрения: задняя субкапсулярная катаракта, повышение внутриглазного давления (с возможным повреждением зрительного нерва), трофические изменения роговицы, экзофтальм, склонность к развитию вторичной инфекции (бактериальной, грибковой, вирусной).
Со стороны кожи и подкожно-жировой клетчатки: петехии, экхимозы, истончение и хрупкость кожи, гипер- или гипопигментация, угри, стрии, склонность к развитию пиодермии и кандидозов.
Реакции, обусловленные иммунодепрессивным действием: замедление процессов регенерации, снижение устойчивости к инфекциям.
При парентеральном введении: в единичных случаях анафилактические и аллергические реакции, гипер- или гипопигментация, атрофия кожи и подкожной клетчатки, обострение после интрасиновиального применения, артропатия типа Шарко, стерильные абсцессы, при введении в очаги на голове - слепота.
Противопоказания к применению
Для кратковременного применения по жизненным показаниям - повышенная чувствительность к преднизолону.
Для внутрисуставного введения и введения непосредственно в очаг поражения: предшествующая артропластика, патологическая кровоточивость (эндогенная или вызванная применением антикоагулянтов), внутрисуставной перелом кости, инфекционный (септический) воспалительный процесс в суставе и периартикулярные инфекции (в т.ч. в анамнезе), а также общее инфекционное заболевание, выраженный околосуставной остеопороз, отсутствие признаков воспаления в суставе ("сухой" сустав, например при остеоартрозе без синовита), выраженная костная деструкция и деформация сустава (резкое сужение суставной щели, анкилоз), нестабильность сустава как исход артрита, асептический некроз формирующих сустав эпифизов костей.
Применение при беременности и кормлении грудью
При беременности (особенно в I триместре) применяют только по жизненным показаниям. При необходимости применения в период лактации следует тщательно взвесить ожидаемую пользу лечения для матери и риск для ребенка.
Применение при нарушениях функции печени
Применение при нарушениях функции почек
Применение у детей
У детей в период роста ГКС следует применять только по абсолютным показаниям и под тщательным контролем врача.
Противопоказание для наружного применения: детский возраст (до 2 лет, при зуде в области ануса - до 12 лет).
Применение у пожилых пациентов
С осторожностью применять у пациентов пожилого возраста во избежание риска обострения хронических заболеваний.
Особые указания
C осторожностью применять при паразитарных и инфекционных заболеваниях вирусной, грибковой или бактериальной природы (в настоящее время или недавно перенесенные, включая недавний контакт с больным) - простой герпес, опоясывающий герпес (виремическая фаза), ветряная оспа, корь, амебиаз, стронгилоидоз (установленный или подозреваемый), системный микоз; активный и латентный туберкулез. Применение при тяжелых инфекционных заболеваниях допустимо только на фоне специфической терапии.
С осторожностью применять в течение 8 недель до и 2 недель после вакцинации, при лимфадените после прививки БЦЖ, при иммунодефицитных состояниях (в т.ч. СПИД или ВИЧ-инфицированность).
С осторожностью применять при заболеваниях ЖКТ: язвенной болезни желудка и двенадцатиперстной кишки, эзофагите, гастрите, острой или латентной пептической язве, недавно созданном анастомозе кишечника, неспецифическом язвенном колите с угрозой перфорации или абсцедирования, дивертикулите.
С осторожностью применять при заболеваниях сердечно-сосудистой системы, в т.ч. после недавно перенесенного инфаркта миокарда (у больных с острым и подострым инфарктом миокарда возможно распространение очага некроза, замедление формирования рубцовой ткани и вследствие этого разрыв сердечной мышцы), при декомпенсированной хронической сердечной недостаточности, артериальной гипертензии, гиперлипидемии), при эндокринных заболеваниях - сахарном диабете (в т.ч. нарушении толерантности к углеводам), тиреотоксикозе, гипотиреозе, болезни Иценко-Кушинга, при тяжелой хронической почечной и/или печеночной недостаточности, нефроуролитиазе, при гипоальбуминемии и состояниях, предрасполагающих к ее возникновению, при системном остеопорозе, миастении, остром психозе, ожирении (III-IV степени), при полиомиелите (за исключением формы бульбарного энцефалита), открыто- и закрытоугольной глаукоме.
При необходимости внутрисуставного введения с осторожностью применять у пациентов с общим тяжелым состоянием, неэффективности (или кратковременности) действия 2 предыдущих введений (с учетом индивидуальных свойств применявшихся ГКС).
Во время лечения (особенно длительного) необходимо наблюдение окулиста, контроль АД и водно-электролитного баланса, а также картины периферической крови, глюкозы в крови; с целью уменьшения побочных эффектов можно назначить анаболические стероиды, антибиотики, а также увеличить поступление калия в организм (диета, препараты калия). Рекомендуется уточнить необходимость введения АКТГ после курса лечения преднизолоном (после проведения кожной пробы!).
При болезни Аддисона следует избегать одновременного применения с барбитуратами.
После прекращения лечения возможно возникновение синдрома отмены, надпочечниковой недостаточности, а также обострение заболевания, по поводу которого был назначен преднизолон.
При интеркуррентных инфекциях, септических состояниях и туберкулезе, необходимо одновременное проведение антибиотикотерапии.
У детей в период роста ГКС следует применять только по абсолютным показаниям и под тщательным контролем врача.
Лекарственное взаимодействие
При одновременном применении с салицилатами возможно повышение вероятности возникновения кровотечений.
При одновременном применении с диуретиками возможно усугубление нарушений электролитного обмена.
При одновременном применении с гипогликемическими препаратами уменьшается скорость снижения уровня глюкозы в крови.
При одновременном применении с сердечными гликозидами усиливается риск развития гликозидной интоксикации.
При одновременном применении с рифампицином возможно ослабление терапевтического действия рифампицина.
При одновременном применении гипотензивных средств возможно снижение их эффективности.
При одновременном применении производных кумарина возможно ослабление антикоагулянтного эффекта.
При одновременном применении рифампицина, фенитоина, барбитуратов возможно ослабление действия преднизолона.
При одновременном применении гормональных контрацептивов - усиление действия преднизолона.
При одновременном применении ацетилсалициловой кислоты возможно снижение содержания салицилатов в крови.
При одновременном применении празиквантела возможно уменьшение его концентрации в крови.
Появлению гирсутизма и угрей способствует одновременное применение других ГКС, андрогенов, эстрогенов, пероральных контрацептивов и стероидных анаболиков. Риск развития катаракты повышается при применении на фоне ГКС антипсихотических средств, карбутамида и азатиоприна.
Одновременное назначение с м-холиноблокаторами (включая антигистаминные препараты, трициклические антидепрессанты), нитратами способствует развитию повышения внутриглазного давления.
Для цитирования: Насонов Е.Л., Чичасова Н.В. СИСТЕМНОЕ ПРИМЕНЕНИЕ ГК ПРИ РЕВМАТИЧЕСКИХ ЗАБОЛЕВАНИЯХ. РМЖ. 1999;8:5.
Несмотря на длительную историю использования ГК при ревматических заболеваниях, по-прежнему остается немало вопросов, касающихся наиболее адекватных доз и лекарственных форм препаратов, путей введения, длительности терапии, путей предотвращения побочных эффектов.
Н есмотря на длительную историю использования ГК при ревматических заболеваниях, по-прежнему остается немало вопросов, касающихся наиболее адекватных доз и лекарственных форм препаратов, путей введения, длительности терапии, путей предотвращения побочных эффектов.
При ревматических заболеваниях широко применяются все основные варианты ГК-терапии:
1. Локальная (внутрисуставное, ректальное введение и др.)
2. Местная (мази, капли, аэрозоль)
3. Системная:
низкие дозы
высокие дозы
альтернирующая терапия
пульс-терапия
"мини-пульс" терапия
сочетанная (в первую очередь с цитотоксиками).
При назначении ГК при ревматическом заболевании необходимо принимать во внимание несколько общих принципов фармакотерапии, соблюдение которых позволяет повысить эффективность и безопасность лечения.
В лечении ГК условно выделяют 5 основных фаз:
• Индукция: ГК короткого действия (преднизолон или метилпреднизолон) в дозе примерно соответствующей 1 мк/кг/сут с 8 часовым интервалом.
• Консолидация: переход на однократный прием всей дозы ГК в утренние часы
• Снижение: скорость снижения зависит от дозы; возможен переход на альтернирующую терапию
• Поддерживающее лечение: минимально эффективная доза препарата
• Профилактика осложнений ГК-терапии (начинается с фазы индукции).
Обычно доза ГК варьирует от 40 мг до 100 мг (0,5 мг/ кг/сут - 1,5 мг/кг/день в пересчете на пр еднизолон). В начале дневную дозу препарата делят на 3 приема, затем переходят на однократный прием препарата в утренние часы. Лечение ГК необходимо проводить только по строгим показаниям. При этом не только врач, но и больной должны быть детально информированы о всех достоинствах и недостатках ГК-терапии. В процессе лечения врач должен стремиться использовать ГК короткого действия, в оптимальной дозе и по возможности не назначать эти препараты на срок, более длительный, чем это необходимо для контролирования активности болезни. Однако при наличии явных показаний, ГК следует назначать как можно раньше, не пытаясь использовать вначале более "мягкие" методы лечения. В случае необходимости длительного применения ГК следует стремиться как можно быстрее перейти на однократный прием всей дозы в утренние часы, а затем на альтернирующий режим ГК-терапии. Подбор начальной дозы ГК, длительности терапии и темпов снижения дозы следует проводить не эмпирически, а ориентируясь на стандартизованные клинико-лабораторные параметры активности заболевания. В процессе лечения необходимо помнить о том, что угнетение оси гипоталамус-гипофиз-надпочечник сохраняется у больных, получавших ГК даже в небольшой дозе (10 мг/сут в течение 3 нед и более), длительное время (до 1 года) после отмены препарата. При развитии тяжелых интеркуррентных заболеваний или необходимости хирургических вмешательств, эти больные должны получать заместительную терапию ГК.
Таблица 1. Основные показания к системному применению ГК при ревматических заболеваниях
Заболевания
Большое значение может иметь начальная и особенно поддерживающая доза преднизолона и время назначения препарата. Имеются данные об отсутствии существенного угнетения оси гипоталамус-гипофиз-надпочечник, если доза преднизолона не превышает 5 мг/сут. Развитие побочных реакций на фоне лечения ГК достоверно чаще развивается у больных, получавших более 10 мг преднизолона в сутки. Можно полагать, что снижение общей дозы преднизолона и оптимальное время приема препарата может позволить снизить риск развития побочных эффектов, например подавление функции остеобластов (ОБ), поскольку ГК подавляют ОБ зависимым от дозы образом. Например, имеются данные о том, что ночной прием ГК (в 2 ч ночи) позволяет снизить уровень ИЛ-6 (важного медиатора воспаления и костной резорбции при РА) в такой же степени, как и введение 15 - 20 мг ГК утром за 24 ч до исследования. Эти данные позволяют предположить, что лечение низкими дозами ГК может снизить потенциальный риск остеопороза за счет ингибиции синтеза ИЛ-6.
В настоящее время получены данные о том, что хронизация воспаления у больных РА, а возможно и другими аутоиммунными заболеваниями, может быть связана с дефектами на уровне оси ГГН. При изучении экспериментальной модели артрита у крыс, установлено, что хронический эрозивный артрит можно индуцировать только у самок крыс линии Lewis, в то время как у родственных линий крыс Fisher развиваются минимальные транзиторные воспалительные изменения в суставе. Единственным различием этих линий мышей являются нарушение в системе ГГН. Так, у мышей линии Lewis, в отличие от крыс Fisher, выявлено снижение уровня и РНК кортиколиберина в гипоталамусе, ослабление синтеза кориколиберина, кортикотропина и кортизола в ответ на иммунизацию мембраной стрептококка. При этом введение кортизола крысам Lewis после антигенной стимуляции предотвращает развитие артрита, а введение ингибитора кортикоидных рецепторов крысам Fisher вызывает развитие у последних тяжелого воспалительного поражения суставов. Сходные нарушения обнаружены и при РА. Описан больной РА, у которого после удаление кортизол-секретирующей аденомы, наблюдалось обострение заболевания. У больных PA отмечено отсутствие суточных колебаний концентрации кортизола в сыворотке крови, неадекватный синтез кортизола в ответ на стрессорные стимулы и низкий базальный уровень этого гормона, не соответствующий выраженности воспалительного процесса. У больных активным нелеченным РА отмечается ослабление базального и кортикотропин-стимулированного синтеза кортизола. Более того, примерно у 10% больных РА выявляются признаки надпочечниковой недостаточности. Очевидно, что у этих больных можно ожидать более высокую эффективность низких доз ГК, чем у больных без дефекта оси ГГН.
Интересные результаты получены недавно при изучении связи между клинической эффективностью ГК и временем назначения препаратов с учетом их фармакокинетики и суточных колебаний уровня кортизола и цитокинов. До последнего времени считалось, что прием ГК в утренние часы в меньшей степени угнетает синтез АКТГ и кортизола, чем в ночное и вечернее время. В норме уровень кортизола начинает увеличиваться в 2 ч ночи с пиком в 8 ч утра и возвращается к базальному уровню к 12 ч дня. Симптомы РА (скованность, воспалительная активность) обычно уменьшаются через несколько часов после пробуждения на пике синтеза кортизола. Предполагают также, что циркадное увеличение уровня ИЛ-6 также может ассоциироваться с нарастанием активности РА в утренние часы. Суточные колебания ИЛ-6 наблюдаются в норме и у больных PA. В норме пик концентрации ИЛ-6 наступает немного раньше, чем АКТГ и кортизола между 1 - 4 ч утра. Однако при РА пик ИЛ-6 запаздывает и наступает между 2 - 7 ч утра и концентрация ИЛ-6 существенно выше нормы. С другой стороны, судя по данным фармакокинетических исследований пиковая концентрация преднизолона в плазме достигается через 1 - 3 ч, продолжительность полужизни составляет 2 - 3,5 ч, а максимальный биологический эффект развивается примерно 6 ч. Недавно появились данные о том, что назначения ГК (5 - 7,5 мг) ночью (примерно в 2 ч ночи) более предпочтительно с точки зрения подавления секреции ИЛ-6 и ассоциируется с достоверно более выраженным снижением длительности утренней скованности, болей в суставах, индекса Лансбури, индекса Ричи и утренней концентрации ИЛ-6, по сравнению со стандартным приемом ГК в утренние часы.
Системное применение ГК относится к числу наиболее эффективных методов фармакотерапии некоторых ревматических заболеваний, позволивших существенно улучшить прогноз и продолжительность жизни пациентов. Основные показания к системному применению ГК в ревматологии суммированы в таблице 1.
Существует ряд ревматических заболеваний или синдромов, при которых системное применение ГК не целесообразно из-за низкой эффективности или возможности развития тяжелых осложнений. К ним относятся остеоартроз, дегенеративные поражения позвоночника, фибромиалгия, остеонекроз, спондилоартропатии, инфекционные артриты, а также феномен Рейно и склеродермический фиброз.
Таблица 2. Показания к пульс-терапии при ревматических заболеваниях
Заболевания
Пульс-терапия
Альтернирующая терапия
Альтернирующая терапия ГК - метод лечения, заключающийся в назначении ГК короткого действия без выраженной минералокортикоидной активности однократно, утром (около 8 ч) каждые 48 ч. Целью альтернирующей терапии является уменьшение выраженности побочных эффектов ГК при сохранении терапевтической эффективности. Полагают, что возможность альтернирующей терапии ГК должна обсуждаться у всех больных, которым планируется длительное лечение ГК (более нескольких нед). Показано, что альтернирующий режим в начале болезни может быть успешно применен при язвенном колите, хронических дерматозах, миастении гравис, бронхиальной астме. Однако при системных ревматических заболеваниях такая тактика лечения, как правило, не эффективна.
Таблица 3. Одна из возможных схем перехода на альтернирующий прием ГК

Преднизолон успешно применяется для лечения воспалительных и аутоиммунных заболеваний с 1955 года. Это лекарственное средство с доказанной эффективностью. Преднизолон имеет в «багаже» тысячи клинических исследований, входит в список жизненно необходимых и важнейших лекарств России и ВОЗ.
Рассказываем, когда Преднизолон помогает, какие у него побочные эффекты и как правильно применять препарат.
Преднизолон: от чего
Преднизолон — синтетический гормон глюкокортикоид. В организме человека глюкокортикоиды вырабатываются надпочечниками. Они регулируют углеводный, белковый и минеральный обмен.
- противовоспалительное
- противоотечное
- противоаллергическое
- противошоковое
- иммунодепрессивное
У препарата широкий спектр показаний, его применяют при:
- шоковых состояниях
- аллергических заболеваниях, в том числе при анафилактическом шоке
- отеке мозга
- бронхиальной астме
- системной красной волчанке и ревматоидном артрите
- воспалительных заболеваниях суставов
- острой надпочечниковой недостаточности
- тиреотоксическом кризе, тиреоидите
- гепатите и печеночной коме
- заболеваниях кожи и глаз
- болезнях органов кроветворения
- болезни легких (включая туберкулез и рак)
- при трансплантации органов
Лечение гормонами серьезно воздействует на органы и системы человеческого организма. Противопоказаний у Преднизолона достаточно много, полный список указан в инструкции к лекарству и в Регистре лекарственных средств России (РЛС). Препарат противопоказан при беременности и грудном вскармливании.
Для применения по жизненным показаниям единственным противопоказанием является повышенная чувствительность к преднизолону или компонентам препарата.
Преднизолон при аллергии
Противоаллергическое действие Преднизолона связано с тем, что препарат изменяет иммунный ответ организма на аллергены. Гормон подавляет синтез биологически активных веществ — медиаторов аллергии. Снижает количество клеток, отвечающих за иммунитет. Угнетает образование антител.
При анафилактическом шоке и бронхиальном статусе Преднизолон вводят внутривенно, в других случаях при аллергии врач назначает внутримышечные инъекции или таблетки.
Преднизолон при ковиде
Глюкокортикоиды, в том числе и Преднизолон, показаны при осложненном течении коронавирусной инфекции. Их назначают, когда развивается пневмония с дыхательной недостаточностью.
На основании данных клинических испытаний опубликованы Временные рекомендации Всемирной организацией здравоохранения (ВОЗ):
- Рекомендация №1: ВОЗ настоятельно рекомендует пероральное или внутримышечное введение кортикостероидов (дексаметазона, гидрокортизона или преднизолона) для лечения пациентов с тяжелой и критической формой COVID-19.
- Рекомендация №2: ВОЗ не рекомендует применять кортикостероиды при лечении пациентов с нетяжелой COVID-19, кроме случаев, когда пациент уже принимает данный препарат для лечения другого заболевания.
Преднизолон: дозировка
Доза Преднизолона и длительность терапии устанавливается врачом индивидуально в зависимости от показаний и тяжести заболевания.
В начале курса препарат назначают в более высокой дозе. При достижении лечебного эффекта ее снижают до поддерживающей.
Суточную дозу лучше принимать однократно утром. Это соответствует биологическому ритму надпочечников. Высокую дозу можно разделить на 2-4 приема, и самую большую дозировку принимать в интервале от 6 до 8 часов утра.
Отмена препарата проводится постепенно. Плавное снижение дозы обусловлено синдромом «отмены». При лечении Преднизолоном надпочечники перестают вырабатывать собственные глюкокортикоиды. При резком прекращении поступления Преднизолона организм остается без гормонов.
Возникает тяжелое состояние с риском для жизни. Необходимо постепенно уменьшать поступление гормона извне, чтобы восстановить функцию надпочечников. Врач должен составить схему, как снижать дозу Преднизолона. Для каждого случая она индивидуальна и зависит от продолжительности лечения и дозы, которую принимал пациент при лечении.
Последствия лечения Преднизолоном
К лечению гормонами надо подходить очень серьезно. Длительная терапия большими дозами Преднизолона сопровождается многочисленными побочными реакциями.
Одна из самых «заметных» — набор веса. Лучше с первых дней терапии выбрать рацион питания с большим количеством овощей, исключить сахар, ограничить углеводы, жирное и жареное. Устраивать разгрузочные дни, пить много воды и давать себе физическую нагрузку.
- принимать лекарства для защиты ЖКТ, сердца и костей
- следить за артериальным давлением
- наблюдаться у окулиста
- контролировать уровень глюкозы
- прием препарата прекращать постепенно под контролем лечащего врача
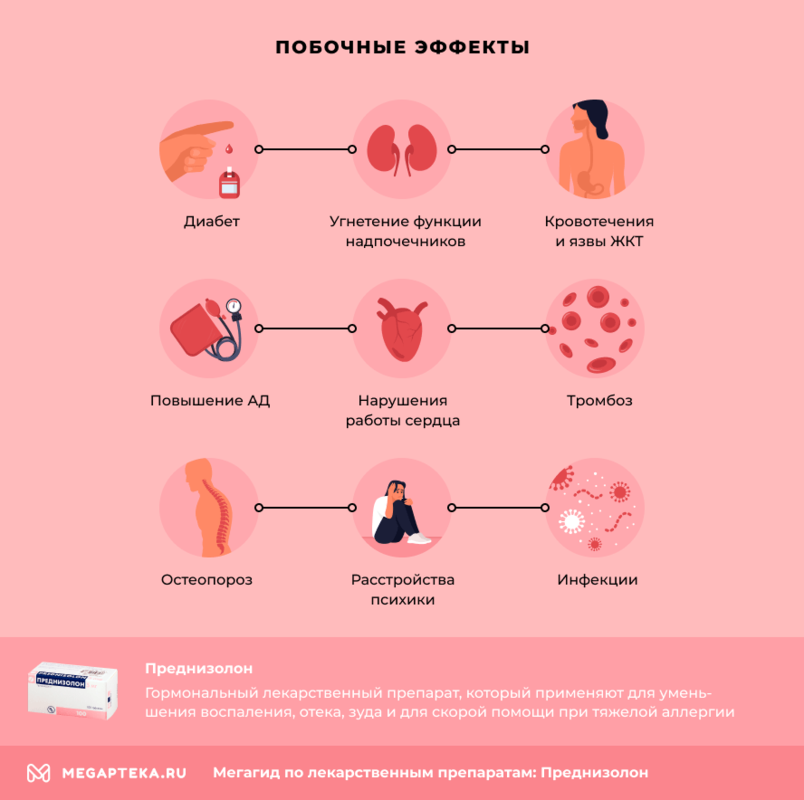
Преднизолон: побочные эффекты
- развитие диабета
- угнетение функции надпочечников
- кровотечения и язвы ЖКТ
- повышение артериального давления, нарушения сердечного ритма вплоть до остановки сердца, сердечная недостаточность
- тромбоз
- остеопороз
- расстройства психики
- развитие и обострение инфекций
Преднизолон и алкоголь
Употреблять спиртные напитки во время лечения Преднизолоном нельзя. Алкоголь увеличивает риск возникновения эрозий, язв и кровотечений в желудочно-кишечном тракте.
Читайте также:

