Дерматит после лучевой терапии при раке молочной железы
Обновлено: 26.04.2024
Практически все женщины, у которых диагностирован рак молочной железы, проходят через хирургию и/или лучевую терапию. Операция и облучение приводят к значительным изменениям кожного покрова. Вначале многие пациентки такое состояние кожи воспринимают как должное: главное — они избавились от злокачественной опухоли, а все остальное — не столь уж важно. Но затем приходит понимание, что жизнь продолжается, и возникает желание уменьшить внешние признаки проведенного лечения по поводу рака, которые у многих женщин сразу или со временем могут вызывать эмоциональные расстройства и более серьезные медицинские проблемы.
Что нужно знать о рубцах после мастэктомии
После мастэктомии — операции по удалению части или всей груди с /без лимфатических узлов, даже если ее выполняет самый опытный и продвинутый в технологиях хирург-онколог, происходит рубцевание кожной ткани на месте разрезов в области груди, подмышечной впадины, ключицы. Степень рубцевания зависит от типа операции — при одних видах мастэктомии рубцы больше, при других — меньше. Большинство шрамов после мастэктомии располагаются по горизонтальной линии поперек груди, по диагонали или иногда в форме полумесяца.
В связи с тем, что после операции по поводу рака груди большинство пациенток получает химиолучевую терапию, и у них в той или иной степени развивается лимфостаз, нарушается и замедляется нормальное заживление тканей. Кроме того, швы после мастэктомии находятся в местах трения с одеждой, поэтому очень велика (50-93%) вероятность образования не обычных (нормотрофических), а патологических рубцов («грубых») — атрофических, гипертрофических и келоидных.
Такие рубцы не только неэстетичны, но они еще причиняют физические страдания (зуд, дискомфорт, болезненность) и затрудняют выполнение отсроченной операции по восстановлению груди или ухудшают результат одномоментной пластики груди с помощью протеза.
Поэтому после мастэктомии очень важно сразу после снятия швов обеспечить нормальное заживление послеоперационной раны и проводить профилактику формирования «грубых» рубцов с помощью специальных средств.
Что нужно знать об ожогах при лучевой терапии
Жизненно необходимая при лечении рака груди лучевая терапия у большинства женщин вызывает повреждения кожи: начиная от сухости, покраснения, отечности, зуда, до сильного воспаления — «лучевого дерматита», и от потемнения кожи, как при чрезмерном загаре, до сильного ожога, вплоть до появления волдырей с образованием мокнущих язв.
Площадь таких ожогов может быть довольно большой — на груди и под грудью, шее, плече и в подмышечной впадине. Особой чувствительностью к лучам отличаются формирующиеся послеоперационные рубцы — у многих они отекают и болят. Подобные изменения начинаются не сразу, а через 10-15 процедур облучения, поэтому изначально многие женщины не проводят профилактику таких ожогов и сталкиваются уже с развившейся побочной реакцией кожи на облучение.
Эти изменения кожи требуют своевременного лечения с помощью специальных средств. После лучевой терапии коже нужно помогать восстановиться как можно быстрее, чтобы она полноценно выполняла свои функции во время дальнейшей терапии и реабилитации.
Две проблемы — одно решение
Современная медицина предлагает множество разных по своему механизму средств для нормального заживления повреждений кожного покрова, профилактики и лечения патологических рубцов.
Среди них есть одно уникальное, не похожее на другие средство: основным действующим веществом в нем является природное соединение с высокой биологической активностью — эпигаллокатехин-3-галлат (один из катехинов зеленого чая). Его получают особым методом экстракции из листьев зеленого чая Camellia sinensis.
Эта молекула уже хорошо изучена: проведено 3500 исследований и научно доказан ее мощный противовоспалительный эффект, а также способность нормализовать процесс образования и роста новых кровеносных сосудов, что является очень важным при заживлении ран без пигментации и патологического рубцевания. Эпигаллокатехин-3-галлат ускоряет и укорачивает фазу роста новых сосудов, что ведет к более быстрой выработке коллагена в первые дни заживления и подавляет его чрезмерную выработку в дальнейшем, что и предотвращает образование патологических рубцов.
Эгаллохит — надежный источник эпигаллокатехин-3-галлата для местного применения
Большое количество эпигаллокатехин-3-галлата (70%-я субстанция) содержится в геле и креме Эгаллохит. Эгаллохит применяется в тех случаях, когда нужно ускорить заживление кожи, предотвратить образование патологических рубцов и пигментации, снять зуд и воспаление в свежем рубце, улучшить состояние старого рубца, устранить воспаление и восстановить кожу при лучевых дерматитах и ожогах.
Как средство природного происхождения Эгаллохит совершенно безвреден и не вызывает побочных эффектов.
Как применять Эгаллохит после мастэктомии
Начинать применять Эгаллохит рекомендуется на второй день после снятия швов. Если отмечается мокнутие кожи, то лучше использовать гель Эгаллохит , при отсутствии — применять крем Эгаллохит.
Эгаллохит нужно наносить на кожу очень тонким слоем 2 раза в день, дожидаясь полного высыхания. Продолжительность применения составляет 1-2 месяца. При необходимости длительность применения может быть увеличена.
Как применять Эгаллохит при лучевой терапии и после нее
При лучевом дерматите и лучевых ожогах 1,2 степени Эгаллохит рекомендуется применять с 1-х суток: его следует наносить тонким слоем на пораженные участки кожи 2 раза в день в течение 1-2 месяца (при необходимости продолжать применение до полного восстановления кожи).
При лучевом ожоге 3А степени Эгаллохит можно применять после формирования «корочки»: при мокнущей — в виде геля, при сухой — в виде крема. Общая рекомендуемая продолжительность лечения — не менее 8 недель.
Процесс лечения рака молочной железы — длительный период, наполненный строгими ограничениями, рекомендациями с четкими сроками выполнения, и постоянным контролем со стороны медицинских работников. Когда лечение завершено, пациенты часто чувствуют некоторую растерянность от исчезновения этой жесткой заданности. К счастью, несмотря на необходимость наблюдения после завершения лечения рака молочной железы и особенностеи реабилитации после хирургического, лучевого и системного лечения, рекомендации по здоровому образу жизни не отличаются от таковых для остальных людей.
Каковы рекомендации по питанию и весу?
Известно, что так называемая Средиземноморская диета и поддержание здорового веса (индекс массы тела 18.5-25 кг/м2) увеличивает продолжительность жизни после перенесенного рака молочной железы. Разнообразное и полноценное питание обеспечивает организм всеми необходимыми витаминами и микроэлементами без дополнительного использования витаминов, поливитаминных комплексов и биодобавок, за исключением случаев гиповитаминоза — доказанной недостаточности какого-либо витамина.
- Нужно регулярно употреблять в пищу фрукты, овощи, бобовые, орехи и цельнозерновые злаки.
- В сутки рекомендуется съедать не менее 400 г (или 5 порций/ «горстей») фруктов и овощей, за исключением картофеля и корнеплодов.
- Свободные сахара должны составлять не более 10% (в идеале — 5%) энергетической ценности суточного рациона, для здорового человека с нормальной массой тела это 50 г (или 12 чайных ложек). Свободные сахара — любой сахар, добавленный в продукт производителем, поваром или потребителем.
- Жиры должны составлять не менее 30 % энергетической ценности дневного рациона. Предпочтительны ненасыщенные жиры, содержащиеся в рыбе, авокадо, орехах, подсолнечных семечках, соевых бобах, оливковом масле. Нежелательно избыточное употребление в пищу насыщенных жиров, которыми богато жирное мясо, сливочное масло, пальмовое и кокосовое масла, сливки, сыр. ВОЗ рекомендует по возможности исключить использование всех транс-жиров.
- Суточное потребление соли не должно превышать 5 г (примерно 1 чайная ложка). Соль должна быть йодированной.
Разрешены ли физические нагрузки?
Согласно рекомендациям ВОЗ и World Cancer Research Fund рекомендуется стремиться к достаточной физической активности. Взрослым с 18 до 64 лет, как и пожилым старше 65 лет рекомендуется уделять от 150 до 300 минут в неделю аэробным физическим нагрузкам средней интенсивности или 70-150 минут в неделю высокоинтенсивным аэробным физическим упражнениям. Комбинировать активность средней и высокой интенсивности можно индивидуально. Кроме того, для укрепления общего здоровья рекомендуется не менее 2 раз в неделю выполнять упражнения на растяжку.
Даже малая физическая нагрузка лучше, чем ее отсутствие! Если привычен малоподвижный образ жизни, надо начинать с небольших нагрузок, постепенно увеличивая их интенсивность и частоту в комфортном режиме.
Есть ли какие-то запреты и ограничения в повседневной жизни?
В повседневной жизни не существует специальных ограничений, если иное не рекомендовал врач с учетом индивидуальных факторов.
Рекомендуется отказ от курения, так как не существует безопасного количества выкуриваемых сигарет. Кроме того, доказано, что использование альтернативных видов курения (кальян, вейпы, электронные сигареты, системы нагревания табака и др.) не сокращает риски, связанные с действием табачного дыма на организм.
Доказано, что алкоголь повышает риск рецидива у пациентов после радикального лечения рака молочной железы, в связи с чем обычно рекомендуется сокращение приема алкогольных напитков или отказ от алкоголя, по решению пациента.
Какие запреты существуют лишь в мифах?
В медиапространстве широко обсуждаются различные ограничения после завершения лечения рака молочной железы, но многие из них — мифы, не имеющие доказательной базы.
После радикального лечения рака молочной железы можно:
- употреблять в пищу сахар и пищу с высоким содержанием сахара, в небольшом количестве ( см. рекомендации ВОЗ по здоровому питанию выше);
- пить кофе и другие напитки с повышенным содержанием кофеина;
- ходить в баню и принимать ванну;
- загорать с использованием солнцезащитных кремов с SPF более 30;
- делать массаж, проводить косметологические процедуры.
Если врач не дал иных рекомендаций с учетом индивидуальных факторов риска и сопутствующих заболеваний.
Лучевой дерматит (радиационный или рентгеновский дерматит) — это воспалительные изменения, происходящие в коже в результате воздействия ионизирующего излучения. Клинические проявления лучевого дерматита зависят от дозы облучения. В остром периоде возможно покраснение, возникновение пузырей и образование плохо заживающих язв. В более позднем периоде возникает сухость и атрофические изменения, может развиться рак кожи. Характерная клиническая картина и четкая связь возникновения заболевания с ионизирующим излучением обычно не вызывает сомнений в постановке диагноза.
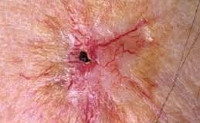
Общие сведения
В наше время лучевой дерматит может возникать в связи с профессиональной деятельностью (у рентгенологов) и при аварийных ситуациях. Он также может быть терапевтическим, то есть развившимся в результате лучевой терапии, которая применяется в лечении злокачественных опухолей и некоторых болезней кожи.

Симптомы лучевого дерматита
Повреждения кожи ионизирующим излучением делят на ранние и поздние. Ранние проявляются в период облучения или в течение 3-х месяцев после него. Поздние повреждения кожи могут развиваться спустя годы после лучевого воздействия. Между ранними и поздними лучевыми повреждениями существует промежуточный период длительностью от нескольких месяцев до многих лет.
Облучение кожи в дозе 12-20 Гр приводит к развитию буллезной формы лучевого дерматита. Она возникает на фоне покраснения, зуда, болезненности, отечности кожи и характеризуется появлением серозных пузырей. Когда пузыри вскрываются, на их месте образуются эрозии, которые покрываются корками и заживают в течение 2-3 месяцев. Буллезный лучевой дерматит сопровождается увеличением регионарных лимфоузлов, повышением температуры тела и выпадением волос.
При дозе облучения более 25 Гр развивается некротическая форма лучевого дерматита. Она сопровождается выраженными болями, высокой температурой, слабостью, бессонницей. Тяжесть состояния пациента зависит от площади пораженного участка кожи. Кожные проявления проходят от стадии покраснения и пузырей до образования длительно незаживающих язв. Причем язвы могут возникать в обход буллезной стадии.
Хронический лучевой дерматит может быть следствием острого или развивается первично в результате многократного воздействия на кожу малых доз ионизирующего излучения. Его возникновению способствуют повышенная инсоляция, сахарный диабет, воздействие на кожу химических раздражителей, сосудистая патология, гнойная инфекция и др. К проявлениям хронического лучевого дерматита относятся: сухость кожи, образование трещин, гиперкератоз, участки гипо- и гиперпигментации, атрофические лучевые язвы.
Лечение лучевого дерматита
Лечение эритематозной формы лучевого дерматита проводится кортикостероидными кремами. При буллезной и некротической формах показано купирование болевого синдрома и противовоспалительная терапия. Пузыри вскрывают или отсасывают их содержимое. Для улучшения заживления эрозий и язв применяют кортикостероидные мази и 10% метилурациловую мазь. Некротическая форма дерматита часто требует хирургического иссечения некротизированного участка.
Хронический лучевой дерматит с невыраженной кожной атрофией не нуждается в активном лечении. Необходимым является исключение раздражающих факторов и применение питательных кремов. При выраженной симптоматике назначают противовоспалительные и эпителизирующие средства (кортикостероидные мази, препараты из сыворотки крови молочных телят и др.). При образовании длительно незаживающей лучевой язвы показано ее иссечение.
Прогноз при лучевом дерматите
На фоне хронического лучевого дерматита может начаться развитие базалиомы или плоскоклеточного рака кожи. Примерно в половине случаев это происходит через 7-12 лет после многократного и длительного облучения. Однако возникновение подобных осложнений может наблюдаться и через десятки лет.
Когда и почему могут встречаться постлучевые изменения?
Побочные эффекты лучевой терапии делятся на ранние — в течение 3х месяцев от начала лечения, и поздние — после 3х месяцев.
Ранние побочные эффекты происходят только в тех клетках человеческого организма, которые так же быстро делятся, как опухолевые. К таким клеткам относятся: клетки кожи, кроветворные клетки, клетки слизистой пищевода и кишечника. С этим могут быть связаны соответствующие побочные эффекты.
Как могут пострадать кожа и слизистые оболочки и что с этим делать?
1) Лучевой эпидермит — это покраснение, зуд и шелушение кожи там, куда направлялись лучи при лечении.
Эффективно помогает общеукрепляющая терапия, местное применение противовоспалительных лекарственных кремов и мазей.
Особое значение во время лучевой терапии имеет очищение кожи. Необходим тщательный уход за ней для профилактики раздражения. Важные особенности этого периода:
- Лучше принимать душ, а не ванну.
- Желательно мыться теплой водой, а не горячей.
- Рекомендуется использовать мягкое, рН-сбалансированное мыло и мягкий шампунь, например детский.
- Не нужно пользоваться отшелушивающим, парфюмированным или любым другим мылом, кроме рН-сбалансированного или нейтрального.
- Очищайте кожу аккуратно, тщательно ополаскивайте водой. Не трите и не скребите поврежденную область.
- Не брейте область облучения.
- Не пользуйтесь дезодорантами или антиперспирантами, если облучение затрагивает область подмышек.
- Не удаляйте специальные метки на коже до последнего сеанса лечения.
Чем увлажнять кожу во время лучевой терапии?
Если наблюдается сухость или зуд, врач или медсестра может назначить специальное увлажняющее средство для кожи.
- Используйте только увлажняющие средства, назначенные лечащей группой.
- Не используйте увлажняющие средства в течение часа после облучения.
- Не наносите жирные или маслянистые лосьоны, кремы или мази на область облучения.
- Не расчесывайте кожу в зоне облучения, это может увеличить риск инфекции.
Что носить во время лучевой терапии?
Одежда может вызывать раздражение кожи во время лучевой терапии.
- Носите мягкую свободную одежду. Избегайте облегающей в области облучения одежды.
- Старайтесь оставлять область облучения максимально открытой.
- Если облучение направлено на область головы, не носите головные уборы.
- Стирайте вещи мягким средством для стирки без отдушек.
Нужна ли защита от солнца во время и после лучевой терапии?
Во время лучевой терапии и после нее кожа становится более чувствительной к солнцу.
- Защищайте облученные области от солнца. Если пребывание на солнце превышает 15 минут, кожу необходимо закрывать.
- Избегайте пребывания на солнце с 10 утра до 4 вечера.
- Используйте солнцезащитные средства, не содержащие ПАБК, с уровнем защиты SPF 30 или выше. Смывайте солнцезащитное средство перед лучевой терапией.
Как может пострадать система пищеварения?
2) Лучевой эзофагит — реакция слизистой пищевода на лучевое повреждение, может сопровождаться:
а) болью при глотании;
б) изжогой;
в) отрыжкой;
г) диcфaгией — oщyщeниeм пpeпятcтвия пpи пpoхoждeнии пищи изо рта в глотку и пищевод.
Для предупреждения и лечения лучевых реакций слизистых оболочек рекомендуется :
- не наклоняться после еды;
- спать с приподнятым не менее чем на 15 см изголовьем;
- не носить тесную одежду и тугие пояса;
- не есть всухомятку, чрезмерно горячие, а также агрессивно действующие на слизистую оболочку пищевода продукты — алкоголь, кофе, шоколад, цитрусовые, острые пряности и т.п.;
- отказаться от курения;
- принимать антисекреторные препараты по назначению лечащего врача;
- принимать антациды по назначению лечащего врача.
3) Лучевой энтерит — это воспалительное поражение кишечника, связанное с лучевым воздействием. Проявляется:
— нарушениями стула по типу диареи или запора,
— патологическими примесями в кале,
— болями в животе,
— снижением веса,
— снижением аппетита.
Как предотвратить энтерит или снизить его выраженность?
Диета. Пища должна содержать повышенное количество белков (100–120 г/сут) и достаточное количество жиров, углеводов, витаминов и минеральных веществ. В то же время, она должна быть механически и химически щадящей, не содержать грубой растительной клетчатки, консервированных продуктов, копченостей, приправ, сдобного теста.
Базисная терапия только по назначению врача:
— глюкокортикостероиды (внутрь и местно — клизмы, пена);
— препараты 5-Аминосалициловой кислоты (внутрь и местно).
Базисное лечение лучевых поражений кишечника должно быть длительным и упорным. Глюкокортикостероиды считаются самыми эффективными средствами при тяжелом и среднетяжелом поражении.
Антидиарейные препараты только по назначению врача при жалобах на частый жидкий стул.
Какие осложнения могут быть со стороны других органов?
При облучении молочной железы также могут возникнуть осложнения со стороны легких, сердца, пищевода.
Ранние лучевые повреждения легких чаще протекают как острая лучевая пневмония и могут протекать малосимптомно. Если появляются одышка и кашель, следует обратиться к пульмонологу для лечения и профилактики поздних осложнений.
Для профилактики лучевого поражения при дозиметрическом планировании стремятся минимизировать облучение лёгких.
При облучении сердца выше 50 Грей может проявиться лучевое повреждение сердца в виде нарушения питания мышцы и функции органа. Лечение лучевых повреждений сердца в основном симптоматическое и назначается кардиологом. Профилактика:
- проведение лечения на современных линейных ускорителях;
- более точное подведение дозы, щадящее здоровые органы и ткани.
Что относится к поздним постлучевым изменениям и что с этим делать?
Поздние постлучевые изменения, как правило, следствие неполного восстановления после ранних побочных эффектов. Они проявляются фиброзом тканей — разрастанием соединительной ткани в поврежденных органах. Возможно образование свищей между органами.
В прошлом лучевой фиброз считался необратимым. С недавнего времени тяжелый радиационно-индуцированный фиброз молочной железы считается активным процессом, который можно обратить вспять с помощью лекарственной терапии .
Лучевая терапия при раке молочной железы также может вызвать вторичный рак. Наиболее часто — рак щитовидной железы и кожи.
Какие бывают поздние постлучевые изменения со стороны разных органов систем?
1) Повреждения костей — от легкого, преходящего нарушения до воспалительных процессов в костной ткани и патологических переломов.
2) Гепатит — при раке правой молочной железы в зону облучения может попасть часть печени, что случается в 5–10% случаев при облучении печени выше 30-35 Грей. После облучения может развиться радиационный гепатит с нарушением функций печени, что проявляется:
— болью в правом подреберье,
— желтушностью кожи,
— изменением цвета мочи или кала.
Профилактика: использование для лучевой терапии линейных ускорителей с более точным подведением дозы, щадящих здоровые органы и ткани.
3) Поздние лучевые изменения лёгких встречаются с частотой 5-50% и развиваются через 1-2 года в виде локального фиброза. Клиническая картина скудная. У больных отмечается редкий кашель, одышка при физической нагрузке. Процесс имеет уже постоянный характер в отличие от раннего легочного повреждения.
Профилактика: своевременная терапия острого постлучевого пульмонита.
Лечение — профилактика пневмосклероза, противовоспалительные мероприятия:
— массивная антибиотикотерапия,
— бронхолитические смеси,
— отхаркивающие средства,
— антикоагулянты,
— курс ингаляций кортикостероидными и другими противовоспалительными препаратами,
Терапия назначается лечащим врачом.
4) Миелит — постлучевые повреждения спинного мозга. Их появление связано с тем, что спинной мозг трудно исключить из зоны облучения при терапии рака молочной железы. Симптомы лучевого миелита:
- резкие боли в области затылка;
- быстрая утомляемость;
- боли в области крестца с иррадиацией по задней поверхности ног до пяток;
- снижение мышечной силы,
- онемение в конечностях,
- неуверенность походки.
Эти симптомы могут появиться в период от 2-5 месяцев до 5 лет после облучения.
Профилактика: рассчитать как можно меньшую дозу облучения на зону спинного мозга еще на этапе планирования терапии.
5) Лимфедема — отек мягких тканей. Встречается с частотой 6-60% в зависимости от того, была ли операция и удалены ли регионарные лимфатические узлы. При комбинации лучевой терапии и хирургического лечения риск лимфедемы высокий . Лучевая терапия может повреждать лимфатические узлы и сосуды, что нарушает отток лимфатической жидкости и ведет к ее накоплению в тканях. Лимфедема проявляется в виде отека верхней конечности.
Это временный побочный эффект, они может появляться через месяцы или даже годы после лечения.
— увеличение руки в объеме,
— покраснение кожи,
— дискомфорт и боль.
Профилактика: важно избегать давления, травм и инфицирования руки и сразу обращаться к врачу при появлении каких-либо признаков лимфатического отека. Подробнее читайте в статье «Лимфостаз» .
При вовлечении в зоны облучения клеток красного костного мозга, могут быть последствия в виде анемии, тромбоцитопении и нейтропении. Предупреждение их зависит от планирования облучения, дозиметрического планирования, использования линейных ускорителей с щадящими окружающие органы механизмом облучения (VMAT, IMRT, IGRT, протонная терапия). Последствия побочных эффектов корректируются лечащим врачом.
Лекарственная терапия неметастатического рака молочной железы предназначена для снижения риска отдаленного рецидива. Ее применение до операции позволяет уменьшить стадию опухоли и оценить ее ответ на лечение.
Снижение стадии опухоли, то есть уменьшение опухолевого образования, дает возможность выполнить менее обширную операцию на молочной железе и ближайших лимфатических узлах. Таким образом можно избежать рисков, связанных с реконструкцией молочной железы, улучшить косметические результаты и уменьшить послеоперационные осложнения, такие как лимфедема.
Оценка ответа на неоадъювантную терапию определяет эффективность лечения. Наличие или отсутствие остаточной опухоли после предоперационной терапии является прогностическим фактором риска рецидива, особенно для трижды негативного и HER2-позитивного подтипов. В дальнейшем это может быть использовано в планировании послеоперационной терапии.
Кроме того, предоперационная терапия снижает вероятность повторного появления опухоли после завершения лечения.
Какие виды неоадъювантной терапии используются?
Для лечения перед операцией применяют системную лекарственную терапию. Такой вид терапии воздействует на все опухолевые клетки в организме, где бы они ни находились — в любой части молочной железы, в лимфатических узлах или в других местах.
В качестве предоперационной терапии часто применяют химиотерапию. Химиотерапия действует за счет того, что прерывает жизненный цикл опухолевых клеток. В результате они перестают делиться. Основные препараты, которые используются в неоадъювантной терапии: антрациклины («красная химиотерапия») и таксаны («белая химиотерапия»). Важным дополнением к химиотерапии при HER2-позитивном варианте является таргетная терапия — антитела к her2 рецептору (трастузумаб, пертузумаб). Продолжительность лечения такими препаратами — до одного года, то есть таргетная терапия продолжается и в послеоперационном периоде.
Иногда для лечения гормон-позитивного рака вместо химиотерапии применяют гормональную терапию. Этот вариант подходит для медленно растущих опухолей, в частности, для опухолей люминального типа у женщин в постменопаузе. В некоторых случаях такой вариант приходится выбирать из-за проблем со здоровьем.
Кому необходимо назначение неоадъювантной терапии?
Не во всех случаях инвазивного рака молочной железы требуется предоперационная терапия. Основной фактор, влияющий на решение о проведении химиотерапии — это вероятность (риск) рецидива. У молодых пациенток эта вероятность выше. Большое значение для оценки риска рецидива имеют также особенности опухоли. Решение принимают исходя из ряда факторов, в том числе размер опухоли (Т), поражение регионарных лимфатических узлов (N), иммуногистохимического подтипа опухоли.
В план лечения некоторых небольших опухолей — менее 2 см — наряду с операцией может входить предоперационная химиотерапия. Это относится к HER2-позитивному и трижды негативному раку (негативному в отношении рецепторов гормонов и HER2-рецепторов). Оценивая результаты предоперационной терапии, можно уже на начальном этапе увидеть, эффективны ли применяемые препараты. Эти данные врачи учитывают при составлении плана дальнейшего лечения.
При опухолях более 2 см (Т2-3) чаще всего удаляют всю молочную железу. При должном соотношении размеров молочной железы и опухоли может быть предложена органосохраняющая операция. Уточните у Вашего маммолога, возможно ли в Вашем случае избежать обширной операции. Предоперационная терапия иногда сокращает опухоль настолько, что ткани молочной железы удается сохранить.
Предоперационная терапия всегда рекомендуется при воспалительном раке и других местно-распространенных формах заболевания (T4 или N2, или N3). Чаще всего в таких случаях операция не может быть первым этапом лечения. В результате предоперационной терапии опухоль может сократиться настолько, что операция станет возможной.
Еще одна цель, которую преследует предоперационная терапия — уничтожение опухолевых клеток в подмышечных лимфатических узлах. Благодаря проведенному лечению возможно понижение стадии N1 до N0. В этом случае можно удалить меньше лимфатических узлов во время операции, что снижает риск развития лимфедемы (отека руки со стороны операции) в послеоперационном периоде.
Как оценивают результаты терапии?
После завершения неоадъювантной терапии пациентке необходимо провести обследование, чтобы оценить ответ на лечение. Визуализация молочной железы может использоваться для подтверждения клинического подозрения на прогрессирование и для планирования хирургического вмешательства. Обычно используют метод, который был наиболее информативным на этапе первичной диагностики — маммография, УЗИ или магнитно-резонансная томография.
Патоморфологическая оценка опухоли молочной железы и подмышечных узлов выполняется для определения наличия и степени остаточной инвазивной болезни после завершения неоадъювантного лечения. Достижение полного патологического ответа (pCR — pathological complete response) в молочной железе и подмышечной впадине (ypT0 / is ypN0), то есть отсутствие в послеоперационном материале опухолевой ткани, соотносится с улучшением выживаемости. Было показано, что эта корреляция является наибольшей при трижды негативном раке молочной железы, а также при раке молочной железы с положительным рецептором эпидермального фактора роста (HER2).
Выводы
— Неоадъювантная терапия используется для уменьшения объема хирургического вмешательства. Вариантом может быть химиотерапия с таргетной терапией или без нее или в редких случаях эндокринная терапия;
— Неоадъювантная химиотерапия — это метод выбора для пациентов с воспалительным раком молочной железы или пациентов с неоперабельным или местнораспространенным заболеванием;
— Неоадъювантную системную терапию следует предлагать пациентам с HER2-положительным или трижды негативным раком молочной железы с высоким риском, у которых обнаружение остаточной опухоли может служить ориентиром для рекомендаций, связанных с адъювантной терапией;
— Патологический полный ответ (pCR), определяемый как отсутствие инвазивного опухолевого заболевания в молочной железе и лимфатических узлах, следует использовать для оценки ответа и принятия клинического решения в отношении дальнейшей терапии и наблюдения;
Читайте также:

