Что такое рубец сэмба
Обновлено: 28.04.2024
Это злокачественное новообразование из эпителия молочной железы.
Злокачественное новообразование отличается от доброкачественного наличием бесконтрольно делящихся клеток, способных к инвазии, то есть проникновению в прилежащие ткани и к метастазированию: перемещению клеток опухоли в отдаленные органы с потоком крови, лимфы, по ходу нервов, сухожилий, контактным путем по оболочкам брюшной и плевральной полостей.
Эпителий - это особая разновидность клеток, находящихся на границе внешней или внутренней среды организма и формирующих большую часть желёз. Молочная железа состоит из значительного количества железистой ткани, то есть содержит массу эпителиальных клеток, которые в результате прогрессивного накопления молекулярных повреждений генетического аппарата могут превратиться в опухолевые клетки. Изменения в геноме клетки могут быть наследственными и приобретенными.
Назвать одну единственную причину возникновения рака молочной железы невозможно. Риск заболеть раком молочной железы считается многофакторным.
Основные факторы риска:
Наличие пролиферативных заболеваний молочных желез (склерозирующий аденоз, радиальный рубец Сэмба, внутрипротоковая папиллома, атипическая дольковая и внутрипротоковая гиперплазия, дольковая карцинома in situ);
Повышенная плотность ткани молочных желез (выявляется при ультразвуковом и рентгенологическом исследованиях);
Наследственные факторы (наличие мутаций генов BRCA1, BRCA2, CHEK2, наличие родственников, болевших раком молочной железы или раком яичников, принадлежность к евреям-ашкенази);
Лица, имеющие 2-х и более родственниц, страдающих раком молочной железы, либо имеющих родственницу с раком молочной железы первой степени родства моложе 50 лет;
Если в семье имелись множественные случаи онкологических заболеваний, показана консультация медицинского генетика.
В молочной железе возникает новообразование. Она может прощупываться в виде уплотнения либо узла под кожей или в толще железы. Прощупать возможно только образование, достигшее значительных размеров (около 1 см) и находящееся в поверхностных отделах молочной железы.
Существуют непальпируемые опухоли, которые по своей плотности не отличаются от окружающих тканей. Такие образования невозможно прощупать даже при очень значительных размерах, они не образуют узлов и могут быть замечены только на рентгеновских снимках по скоплениям отложений извести: группам микрокальцинатов.
Рак молочной железы растет, как правило, медленно, в течение нескольких лет, увеличиваясь, врастая в мышцы грудной стенки, меняя форму железы, прорастая кожу, образуя дефекты, язвы, с распадом тканей.
Существуют и молниеносно развивающиеся формы рака молочной железы, проявляющиеся в виде отека, покраснения, уплотнения железы, а также рак Педжета, поражающий сосок и ареолу.
Иногда (очень редко) опухоль молочной железы может вызвать боли, а также появление кровянистых выделений из соска пораженной железы.
Сегодня все заболевания молочной железы диагностируются амбулаторно. Врач, диагностирующий заболевания молочной железы и определяющий тактику лечения, называется маммологом. Он является хирургом, онкологом, владеет навыками ультразвуковой диагностики, расшифровки рентгеновских снимков молочных желез.
В диагностике рака молочной железы используются 3 основных метода визуализации:
Эти методы позволяют выявить злокачественные и доброкачественные образования менее 0,5 см, что позволяет достичь главной цели диагностики: раннего выявления рака молочной железы.
Маммолог путем опроса выявит жалобы, определит имеющиеся факторы риска пациентки, выяснит менструальный статус, тщательно осмотрит, пропальпирует молочные железы и составит индивидуальный план обследования. Как правило у молодых женщин и у женщин с плотными молочными железами отдается предпочтение ультразвуковой диагностике, у женщин с жировой структурой желез — маммографии. Для всех категорий пациенток наиболее чувствительным методом является МРТ молочных желез с контрастированием.
Подчеркну: только врач может определить план обследования! Так, при подозрении на наличие узлового образования, показана маммография в любом возрасте, а ультразвуковое исследование - также используют в любом возрасте для уточнения параметров опухолевого поражения и оценки состояния регионарных лимфоузлов.
При выявлении очаговых изменений в ткани молочной железы врач-маммолог производит биопсию: забор столбиков ткани измененного участка для гистологического и иммуно-гистохимического исследований при помощи специального оборудования: биопсийного пистолета и биопсийной иглы. Манипуляция проводится под местной анестезией и практически безболезненна. Контроль прохождения биопсийной иглы осуществляют при помощи ультразвукового аппарата или рентгенологической стереотаксической установки. Пациентка может наблюдать за ходом биопсии на экране.
Взятый материал маркируется и в контейнере с формалином отправляется в патоморфологическую лабораторию.
Гистологическое исследование определит наличие злокачественных изменений в ткани молочной железы и диагноз рака будет верифицирован, то есть подтвержден лабораторным методом исследования. В настоящее время определения гистологической разновидности образований недостаточно. Для выработки тактики лечения необходимо определить молекулярно-биологический подтип обраования. Для этого проводится иммуно-гистохимическое исследование тех же фрагментов ткани железы, полученных при биопсии.
Сохраняет актуальность цитологическое исследование, для которого берут клетки пораженной зоны пункционно-аспирационным методом (нагнетанием под давлением в иглу шприца). Если имеется язва, то производится соскоб с ее поверхности, и также производится цитологическое исследование.
Маммолог производит анализ результатов проведенных исследований и определяет последовательность дальнейших действий: указывает дату следующего контрольного осмотра (в случае исключения диагноза рака), либо назначает дополнительное обследование с целью исключения метастазов злокачественных образований в других органах (печени, легких, костях, яичниках, головном мозге) и направляет пациентку с подтвержденным диагнозом рака молочной железы в лечебное учреждение, где проводится онкологический консилиум.
Это совещание врачей различных специальностей (хирурга-онколога, химиотерапевта, радиолога) с целью определения тактики ведения пациента при необходимости использовать специальные методы лечения.
Каждый пациент с диагнозом злокачественного новообразования должен выполнить необходимый алгоритм обследования и пройти процедуру консилиума в специализированном лечебном учреждении онкологического профиля.
Современная амбулаторная диагностическая маммологическая служба даёт возможность установить диагноз рака молочной железы и выполнить весь алгоритм обследования менее чем за 2 недели.
Наша цель — сократить период от обнаружения опухоли до проведения консилиума и начала лечения, а также обеспечить высококвалифицированное сопровождение пациентки в процессе лечения: оно становится всё более амбулаторным.
Выявление ранних форм рака, качественное и быстрое обследование — это залог успешного лечения с большой вероятностью полного избавления от болезни.
Если выявленный процесс является распространенным, то нашей задачей становится эффективный контроль заболевания и поддержание качества жизни пациентки на высоком уровне.
Дифференциальная диагностика пальпируемых уплотнений мягких тканей после лучевой терапии.
К.Ю. Звездина , Е.В. Хмелевский, Н.В. Минх , З.С. Цалагова , О.Б. Рязанцев.
В ходе работы в РНЦРР было обследовано 270 больных с раком молочной железы II - IV стадии после комплексного лечения. В ходе осмотра было выделено 113 больных с пальпируемыми уплотнениями в зоне послеоперационного рубца. По результатам ультразвукового обследования были выделены следующие группы: 1)больные с рецидивом заболевания, 2) больные с постлучевым фиброзом и 3) больные с послеоперационными осложнениями.
В первой группе в подкожной клетчатке визуализировались гипоэхогенные образования с нечеткими контурами, полигональной формы.
При развитии фиброза, в подкожной клетчатке выявлялось снижение четкости дифференциации тканей с одновременным повышением эхогенности . Третья группа характеризовалась визуализацией в зоне послеоперационного рубца гипоэхогенных образований с четкими контурами, содержащих гиперэхогенные включения.
В результате исследования определена ультразвуковая семиотика изменений мягких тканей послеоперационного рубца и выработаны количественные критерии их оценки.
При обследовании пациенток после комплексного лечения рака молочной железы нередко возникают трудности с определением характера пальпируемых уплотнений в зоне послеоперационного рубца. Традиционные методы оценки таких изменений – визуальный осмотр и пальпация –с убъективны и далеко не всегда позволяют дифференцировать рубцовые изменения, узловые и диффузные рецидивы заболевания. Трактовка маммографического изображения оперированной молочной железы после лучевой терапии порой также представляет некоторые особенности. Рубец нередко имитирует картину рака – в виде участка уплотненной структуры звездчатой формы с радиарно расходящимися тяжами по периферии. При длительно существующем рубце в измененной ткани могут откладываться соли кальция, что еще больше осложняет дифференциальную диагностику рубца и рака молочной железы.[1]
В этих случаях именно эхографическая картина может позволить дифференцировать послеоперационные и постлучевые изменения мягких тканей, причем степень изменений обусловлена объемом и видом лечения и характеризуется интервалом времени после проведения облучения[2].
Целью данной работы является изучение возможностей ультразвукового исследования в оценке состояния мягких тканей в зоне послеоперационного рубца после комплексного лечения рака молочной железы.
Материалы и методы .
В поликлиническом отделении РНЦРР МЗ РФ было обследовано 270 больных с диагнозом рак молочной железы I I-IV стадии. Ультразвуковое исследование осуществлялось на сканере, работающем в режиме реального времени- Sonoace 7700 фирмы Medison , с использованием линейного датчика 7.5-12 МГц и фиксировалость на твердом носителе -т ермопринтере Sony UP - 860 CE (Япония). Для полного контакта датчика с поверхностью тела использовался специальный гель « Sonogel » фирмы « Vertriebs GHBH » (Германия).
Зона фокусировки ультразвуковых волн устанавливались в зависимости от глубины поражения. С целью регулировки контрастности изображения проводилась гамма-коррекция.
Эхография мягких тканей передней грудной стенки выполнялась в утреннее время без специальной подготовки в положении пациента лежа на спине с опущенными вдоль тела руками. Для обследования аксиллярной зоны пациент поднимал и отводил в сторону руку. Сканирование проводилось в поисковом и прицельном режимах.
При поисковом режиме для выявления патологических изменений исследовалась вся поверхность передней грудной стенки. Ультразвуковое исследование осуществлялось от парастернальных отделов к аксиллярным . Ориентирами служили стандартные анатомо-топографические линии: парастернальная , среднеключичная и средняя аксиллярная . Датчик перемещался от нижней поверхности ключицы косо вниз к нижним межреберьям и в аксиллярную область.
Прицельное сканирование проводилось только в области предполагаемых патологических изменений после тщательной клинической оценки ( визуальной и пальпаторной ).
Обследование начиналось с той половины грудной стенки, которая была подвергнута хирургическому и лучевому лечению. Затем исследовалась контрлатеральная , здоровая сторона. В случае двустороннего поражения в качестве контрольной зоны выбиралась паравертебральная область.
Для стандартизации исследования результаты осмотра фиксировались отдельно для парастернальной , аксиллярной зон и грудной стенки.
Для оценки состояния мягких тканей были выработаны следующие критерии:
1) наличие или отсутствие в зоне интереса узлового образования;
2) для узлового образования : а) контуры,
г) состояние окружающих тканей
3) при отсутствии узлового образования в зоне пальпируемого уплотнения оценивалось следующие параметры :
а) четкость дифференциации тканей
б) эхогенность тканей
в) состояние окружающих тканей.
4) Васкуляризация оценивалась по количеству цветных пикселей на единицу площади. За нормальное значение было принято 5-8 пикселей в зоне, размерами 3х3см и площадью 9см 2. Если количество пикселей превышало 10-12, васкуляризация считалась повышенной. Уменьшение цветных пикселей до 2 или их отсутствие означало снижение васкуляризации .
В процессе исследования использовались В- и А- режимы для оценки структуры и эхогенности мягких тканей, а также режимы цветного и энергетического допплеровского картирования для изучения васкуляризации облученной зоны.
А-сканирование, исторически первый режим отображения, в настоящее время находит применение в таком методе изучения состояния мягких тканей как, импедография [3], позволяющей установить взаимосвязь между параметрами А-эхограммы и параметрами ткани ( степень отражения структуры).
Во всех современных приборах существует функция графического представления полученных эхосигналов различной интенсивности в заданном объеме, которая называется «гистограмма» и является основой для проведения импедографии .
По оси Х откладывается значение интенсивности эхосигнала от 0 до 63, по оси Y - количество точек для каждого значения интенсивности эхосигнала, причем максимальное количество точек определенной интенсивности принимается равной 100% ( общее количество пикселей равно 1.0).
Вычисляемые параметры:
А- площадь зоны интереса.
N - количество точек с определенным уровнем интенсивности
M - степень отражения эхоструктуры
SD - стандартное отклонение
В работе использовался один из данных параметров - «М» -с тепень отражения эхоструктуры , который можно описать с помощью следующей формулы :
М= S n i =1 ( Xi ∙ fi ) [формула 1]
n - общее количество эхосигналов в изучаемом объеме
X - интенсивность эхосигнала
f - количество эхосигналов с определенным уровнеми нтенсивности [3]
В результате проведенных экспериментов была получена зависимость степени отражения эхоструктуры ( y ) от акустической плотности ткани ( x ) :
Y = 0 ,0379 x 2 – 0,134 x +0,82 [формула 2]
В дальнейшем учитывали отношение двух величин - степени отражения структуры изучаемого объема (Мо) и степени отражения структуры контрольной зоны ( контрлатеральная половина грудной стенки, противоположная паравертебральная зона ) ( Мк ) –к оторое обозначалось как индекс отражения эхоструктуры .
Статистическую обработку проводили с использованием стандартного пакета компьютерных программ ( «Описательная статистика», «Парный двухвыборочный t -тест для средних «, « Двухвыборочный t -тест с одинаковыми диспериями »
Результаты.
У 113 пациенток (42%) во время клинического осмотра были выявлены пальпируемые уплотнения в зоне послеоперационного рубца. Дифференциально - диагностический ряд таких изменений включал рецидив заболевания, послеоперационные и постлучевые изменения мягких тканей . После проведения ультразвукового исследования с последующей пункционной биопсией были получены следующие результаты: у 48 (42%) был выявлен постлучевой фиброз ( слабо- и умеренновыраженный ), у 32 (28%) - рецидив основного заболевания, у 19 (17%) - грануломы , у 14 (13%) - серомы .
Рецидивы ( 32 случая- 28%) визуализировались как гипоэхогенные образования с нечеткиим , часто лучистыми, контурами. Образования имеющие размеры до 1.0см сохраняли практически однородную структуру. В более крупных – появлялись анэхогенные полости и гиперэхогенные включения ( в виде мелких точек и извитых линий или структур полиго-нальной формы) (рис.1).
Индекс отражения эхоструктуры рецидивов : Мо / Мк.= 0,59+/-0,18
Состояние кожных покровов и окружающих тканей при небольших образованиях не были изменены. У 4 пациенток (12%) в зоне операционного рубца визуализировались гипоэхогенные пласты, захватывающие все слои мягких тканей с распространием на плевру, что соответствовало обширному
метастатическому поражению (рис.2).

Рис.1 Одиночное гипоэхогенное образование с нечеткими контурами.

Рис.2. Гипоэхогенные пласты в подкожной клетчатке, распространяющиеся на плевру.
В 3 случаях (9%) сложными для диагностики оказались гипоэхогенные зоны, проекционно наслаивающиеся на грудину или ребра. Контур надкостницы был нечетким, а зона сниженной эхогенности практически сливалась с ней. Методом выбора здесь являлась сцинтиграфия , позволяющая выявлять метастатическое поражение кости. При получении отрицательного результата на сцинтиграммах , пациентке проводилась пункционная биопсия интересующей зоны.
Зона фиброза в области послеоперационного рубца, в отличие от рецидива, характеризовалась повышенной эхогенностью . В зависимости от степени выраженности фиброза, гиперэхогенные участки могли быть различных размеров и обладать различной интенсивностью отраженных сигналов. Так, при слабовыраженном фиброзе ( 1-я стадия по клиссификации RTOG / EORTC ) [4] отмеченном у 22 пациенток (20%) сохранялась четкая дифференциация тканей. Толщина кожи практически не изменялась и составляла 2.4+/-0.35мм. Единственной особенностью являлось появление в подкожно-жировой клетчатке зон повышенной эхогенности с индексом отражения эхоструктуры : Мо/ Мк = 1.25+/-0.08 ( p < 0.0001) ( рис.3).

Рис.3 Зоны повышенной эхогенности в подкожной клетчатке.
При умеренновыраженном фиброзе ( 2-я стадия RTOG / EORTC ) ( 26 пациенток- 22%) наблюдалось нарушение дифференциации тканей, « смазывание» ультразвуковой картинки, с повышением эхогенности мягких тканей. Толщина кожи уменьшалась до 1.7+/-0.25мм. Индекс отражения эхоструктуры составлял: Мо/ Мк= 1.5+/-0.14 ( p <0.0001) (рис.4).
У 9 пациенток (35%) рядом с участками фиброза определялись признаки лимфостаза : от единичных эктазированных лимфатических сосудов до щелевидных скоплений жидкости ( чаще в аксиллярной зоне )( рис.5).

Рис.4 Умеренно выраженный фиброз. К зоне фиброза подходит эктазированный лимфатический сосуд.

Рис.5. Явления лимфостаза в аксиллярной области.
К послеоперационным изменениям мы относили грануломы и серомы . Грануломы ( 19 случаев- 17%) при ультразвуковом исследовании визуализировались как гипоэхогенные образования с четкими ровными контурами, содержащие мелкие гиперэхогенные включения (рис.6). Количество таких включенией зависело от длительности существования грануломы . «Молодые» грануломы ( менее 6 мес. после операции) могли содержать жидкостной компонент. Индекс отражения эхоструктуры гранулом составлял : Мо/М к= 0,83+/-0.25, что отличало его от эхогенности рецидивов( p < 0.001 )

Рис.6 Гипоэхогенные образованя округлой формы, с четкими контурами ( грануломы ).
Серомы ( 14 случаев- 13%) визуализировались как анэхогенные образования, чаще округлой формы, с четкими контурами. Индекс отражения эхоструктуры - Мо/ Мк =0.34+/- 0.06, что было ниже, чем у рецидивов ( р < 0.005) и у гранулом ( р < 0.0002). В течение 6мес.- 1 года после операции серомы , как правило, рассасывались.
Кафедра акушерства и гинекологии ГБОУ ВПО «Курский государственный медицинский университет», Минздрава России, Курск, Россия
Кафедра акушерства и гинекологии ГБОУ ВПО "Курский государственный медицинский университет" Минздрава России
Кафедра акушерства и гинекологии ГБОУ ВПО «Курский государственный медицинский университет», Минздрава России, Курск, Россия
Кафедра акушерства и гинекологии ГБОУ ВПО «Курский государственный медицинский университет», Минздрава России, Курск, Россия
Диагностика состояния нижнего сегмента матки после кесарева сечения
Журнал: Российский вестник акушера-гинеколога. 2016;16(5): 61‑65
Кафедра акушерства и гинекологии ГБОУ ВПО «Курский государственный медицинский университет», Минздрава России, Курск, Россия
Цель исследования — определить морфологические критерии несостоятельности нижнего сегмента матки в области рубца после кесарева сечения и выявить клинико-анамнестические факторы, влияющие на формирование рубца. Материал и методы. Обследованы 120 беременных, 80 из которых имели рубец на матке после кесарева сечения. В 1-ю группу включили 39 пациенток, имеющих признаки несостоятельности рубца на матке по данным морфологического исследования. Во 2-ю группу вошла 41 пациентка без выраженных морфологических изменений в миометрии; 40 пациенток, составивших контрольную группу, были впервые родоразрешены путем кесарева сечения. У обследуемых изучали данные соматического, акушерско-гинекологического анамнеза и статуса, выполняли объективное и морфологическое исследование области рубца на матке. Результаты. При гистологическом исследовании выявлено, что к признакам несостоятельности рубца относятся следующие: наличие патологических соединительнотканных изменений в области рубца, высокая степень дезорганизации и разобщенности пучков гладкомышечных клеток, значительная интенсивность и широкое распространение в миометрии гидропической дистрофии и изолирующихся «гладких» миоцитов. В результате сочетанного анализа клинико-морфологических данных были выделены группы риска женщин, у которых наиболее высока вероятность несостоятельности рубца после кесарева сечения. К ним отнесли короткий интервал между операциями (1—2 года), наличие интра- и послеоперационных осложнений после первого кесарева сечения, «незрелую» шейку матки при доношенном сроке беременности, а также аномалии родовой деятельности среди показаний к первому кесареву сечению. Заключение. При планировании следующей беременности у пациенток во время первого и повторного кесарева сечения необходимо выполнять биопсию миометрия для гистологического исследования и оценки состояния нижнего сегмента матки. На основании данных морфологического исследования разработана балльная шкала прогнозирования несостоятельности рубца на матке. Авторы информируют об отсутствии конфликта интересов.
Кафедра акушерства и гинекологии ГБОУ ВПО «Курский государственный медицинский университет», Минздрава России, Курск, Россия
Кафедра акушерства и гинекологии ГБОУ ВПО "Курский государственный медицинский университет" Минздрава России
Кафедра акушерства и гинекологии ГБОУ ВПО «Курский государственный медицинский университет», Минздрава России, Курск, Россия
Кафедра акушерства и гинекологии ГБОУ ВПО «Курский государственный медицинский университет», Минздрава России, Курск, Россия
Ежегодное увеличение числа случаев абдоминального родоразрешения является одной из важнейших проблем современного акушерства [1, 2]. В России частота этой операции составляет в среднем 15,9%, достигая в перинатальных центрах 30—50%, и продолжает расти [3, 4]. Несмотря на широкое распространение, абдоминальное родоразрешение относится к числу сложных операций с высокой частотой послеоперационных осложнений — 3,3—54,4%, которые во многом связаны с техникой вмешательства, видом шовного материала и особенностями самого организма [5—9].
В настоящее время при кесаревом сечении (КС) широко используется зашивание раны матки в один слой [10, 11]. Основанием к применению этой техники считают то, что частое наложение швов создает область гипоксии тканей с расстройством функции клеток миометрия, что нарушает течение репаративных процессов.
Одним из критериев благополучного течения беременности и родоразрешения пациенток с рубцом на матке считается наличие состоятельной зоны предшествующего разреза [12—14]. В литературе представлено немало исследований, посвященных изучению состоятельности рубца на матке после КС при морфологическом исследовании [3]. Критерии несостоятельности поперечного рубца на матке, приводимые разными авторами, имеют большой диапазон — от 22 до 50% [15]. Главным критерием состоятельности рубца на матке считают преобладание мышечной ткани над соединительной. К признакам морфологически неполноценного рубца относят наличие очагов дезорганизации соединительной ткани в виде фибриноидного набухания, наличие интрамуральных гематом, воспалительной инфильтрации, а также неоангиогенеза.
В связи с этим одним из важных аспектов данной проблемы являются морфологическая оценка состояния миометрия нижнего сегмента матки после КС и выявление возможных факторов риска, влияющих на формирование рубца.
Цель исследования — определить морфологические критерии несостоятельности нижнего сегмента матки после КС и выявить клинико-анамнестические факторы, влияющие на его формирование.
Материал и методы
Обследованы 120 беременных, 80 из которых имели рубец на матке после КС: 1-я группа — 39 пациенток с признаками морфологической неполноценности рубца, к которым относили наличие патологических изменений соединительной ткани в области рубца, высокую степень дезорганизации мышечной ткани, высокую степень распространенности гидропической дистрофии в миометрии и высокую степень разобщенности гладкомышечных клеток; 2-я группа — 41 пациентка без выраженных морфологических изменений в миометрии. Контрольную группу составили 40 пациенток, впервые родоразрешенных путем КС.
Обследование включало изучение общего, акушерского анамнеза, выяснение причины первого КС, осложнений послеоперационного периода. При акушерском обследовании учитывали жалобы пациентки при пальпации, определяли размеры, плотность, подвижность тканей послеоперационного рубца на передней брюшной стенке.
Всем пациенткам после лапаротомии матку вскрывали поперечным разрезом в нижнем сегменте по Гусакову, после извлечения плода и последа рану на матке зашивали однорядным обвивным швом с использованием викрила в качестве шовного материала. Во время КС выполняли забор ткани миометрия нижнего сегмента матки. Срезы фиксировали в 10% растворе формалина с последующей окраской гематоксилином и эозином и по Маллори.
При морфологическом исследовании образцов миометрия оценивали следующие критерии: 1) степень разобщенности гладкомышечных клеток, определяемую по величине соединительнотканных прослоек между крупными и мелкими их пучками; 2) степень дезорганизации миометрия, оцениваемую по хаотичности расположения пучков гладкомышечных клеток; 3) интенсивность и распространение гидропической (вакуольной) дистрофии; 4) интенсивность и распространение изолирующихся миоцитов. Выраженность каждого критерия оценивали в баллах (от 0 до 3). Статистическую обработку результатов проводили с использованием электронных таблиц Microsoft Excel и Биостатистика (версия 4.03). Корреляцию между изучаемыми параметрами определяли по коэффициенту Пирсона. Достоверность различий средних величин оценивали по t-критерию Манна—Уитни.
У всех обследуемых получено информированное согласие на выполнение КС и биопсии во время него, а также получено согласие этического комитета университета на проведение исследования.
Результаты и обсуждение
Обследуемые пациентки находились в возрасте от 17 до 42 лет, который составил в среднем у пациенток 1-й группы 30,56±3,64 года, у пациенток 2-й группы — 29,60±4,57 года и в контрольной группе — 25,20± 5,25 года (р>0,05).
Отмечался высокий уровень соматических заболеваний в группах: 61% у пациенток 1-й группы, 53,6% — 2-й группы, а также 52,5% у пациенток контрольной группы. Миопия отмечалась у 7 (17,5%) пациенток контрольной группы, что достоверно чаще, чем в 1-й — у 2 (5,1%) и во 2-й — у 2 (4,8%) группах (р<0,05); в 1-й группе с достоверным преобладанием выявлено варикозное расширение вен нижних конечностей у 8 (20,5%) пациенток, во 2-й группе — у 2 (4,8%) женщин (р<0,05), что может расцениваться как проявление малых форм недифференцированной дисплазии соединительной ткани (табл. 1).

Таблица 1.Факторы, предрасполагающиекформированиюнеполноценногорубцанаматкепослекесаревасечения Примечание. * — достоверные различия между 1-й и 2-й группами; ** — достоверные различия между 1-й и контрольной группами (р<0,05).
При изучении структуры гинекологической заболеваемости было выявлено, что у 8 (29,5%) женщин с признаками морфологической несостоятельности миометрия отмечались такие воспалительные заболевания, как сальпингоофорит и эндометрит, что достоверно чаще, чем в контрольной группе — 2 (5%) (р<0,05), однако статистически значимой корреляции между признаками не выявлено (χ²=0,41; p>0,05) (см. табл. 1).
Эндометрит в анамнезе после предшествующего КС отмечался в 2 раза чаще у пациенток в группе с признаками морфологической неполноценности рубца (1-я группа), чем во 2-й группе. Основными интраоперационными осложнениями в анамнезе были кровотечения, обусловленные нарушением сократимости матки или продлением раны в момент извлечения плода к краям матки (р<0,05), что косвенно могло указывать на неполноценность миометрия нижнего сегмента матки. Это требовало проведения дополнительного гемостаза и наложения лигатур, что могло в последующем привести к нарушению репаративных процессов из-за ишемии тканей в области раны.
У пациенток с рубцом на матке интервал между предшествующим КС и настоящей беременностью, составивший более 6 лет, выявлен в 58,9% случаев. У 25,6% пациенток в 1-й группе интервал между операциями составил менее 2 лет, что было достоверно чаще, чем в группе без выраженных морфологических изменений в миометрии — 4,8% (χ²=7,21; p<0,01). Это согласуется с данными некоторых исследователей [16] и может служить показанием к оперативному родоразрешению.
Среди часто встречаемых осложнений беременности у женщин с рубцом на матке была угроза прерывания беременности, которая отмечалась почти в 3 раза чаще, чем в контрольной группе (см. табл. 1). Полученные результаты согласуются с данными литературы, указывающими на угрозу прерывания беременности при наличии рубца на матке в 20—40,9% случаев [17]. Хроническая плацентарная недостаточность диагностирована у каждой четвертой женщины с рубцом на матке, тогда как в контрольной группе она была диагностирована только у 3 пациенток.
У пациенток контрольной группы при морфологическом исследовании отмечались типичное расположение мышечных волокон с равномерным окрашиванием, отсутствие патологических изменений соединительной ткани и фиброзных изменений вокруг сосудов (см. рис. 1, а и далее). Определялась рыхлая соединительная ткань в виде тонких прослоек между пучками мышечных волокон, в ней — сосуды различного типа с преобладанием венул, капилляров, единичных мелких артерий. У 9 (36%) пациенток в этой группе выявлены полнокровие вен, гидропическая дистрофия и разобщенность гладких миоцитов. Между пучками мышечных волокон определяли рыхлую соединительную ткань в виде тонких прослоек или широких полей, что свидетельствовало о патологических изменениях миометрия, обусловленных воспалительными процессами и внутриматочными выскабливаниями, предшествующими данной беременности. Эти изменения могут предопределять тактику последующего родоразрешения в пользу очередного КС.

Рис. 1. Микрофотография миометрия. а — у пациентки контрольной группы; б — у пациентки 2-й группы. Окраска гематоксилином и эозином. Ув. 200.
Следовательно, для оценки состояния нижнего сегмента матки и определения тактики последующего родоразрешения пациенток с рубцом на матке необходимо производить гистологическое исследование биоптата миометрия, полученного во время первой операции КС.
В гистологических препаратах у 41 (51,3%) пациентки 2-й группы мышечные волокна имели в основном типичное расположение. Между пучками мышечных волокон определялась рыхлая соединительная ткань чаще в виде широких полей. В некоторых наблюдениях встречалась более плотная соединительная ткань (см. рис. 1, б).
У пациенток 1-й группы область рубца в большинстве наблюдений выглядела в виде широких тяжей соединительной ткани с мелкими сосудами, фибробластами (рис. 2, а). Диагностированы гранулемы, окружающие остатки шовного материала в миометрии, с наличием фибробластов, фиброцитов, лимфоцитов, макрофагов, гигантских клеток инородных тел (см. рис. 2, б). Выявлено нетипичное, хаотичное расположение пучков гладкомышечных клеток, между ними определялись поля грубой, нередко гиалинизированной соединительной ткани (см. рис. 2, в). В некоторых наблюдениях рубец принимал форму более плотного тяжа фиброзной ткани с большим количеством макрофагов, гигантских клеток инородных тел, фибробластов и лимфоцитов, мышечных волокон (см. рис. 2, г).

Рис. 2. Морфологически неполноценные рубцы у разных пациенток 1-й группы после кесарева сечения. Окраска гематоксилином и эозином. Ув. 200. Объяснения в тексте.
В ряде образцов миометрия выявлены склеротические изменения вокруг сосудов, преимущественно вен, с разрастанием рыхлой соединительной ткани, в которой содержались фиброциты, фибробласты, лимфоциты и рыхло расположенные коллагеновые волокна. В гладкомышечных клетках отмечалась гидропическая (вакуольная) дистрофия, в большей степени затрагивающая наружный слой миометрия (рис. 3, а). Эта форма дистрофии, которая проявляется наличием вакуолей, наполненных жидкостью, вызвана нарушениями водно-электролитного, а также белкового обмена. Данные изменения возникают в результате нарушения проницаемости клеточных мембран вследствие отеков и воспалительных реакций. При переполнении гладкомышечных клеток водой возникают деструкция органелл и некроз. Следовательно, функциональная (сократительная, секреторная) активность таких миоцитов снижена. Наиболее выраженную степень дистрофии диагностировали у женщин, имевших воспалительные заболевания органов малого таза.

Рис. 3. Изменения гладкомышечных клеток в миометрии у пациенток 1-й группы. а — гидропическая дистрофия (окраска по Маллори. Ув. 200); б — интерстициальный отек в миометрии (окраска по Маллори. Ув. 40); в — изолирующиеся «гладкие» миоциты (окраска по Маллори. Ув. 200).
Кроме перечисленных критериев, мы выделили новую категорию клеток миометрия, которую назвали изолирующимися гладкими миоцитами (см. рис. 3, в). Миоциты приобретают округлую форму, возможно, находясь в сокращенном состоянии, и отделяются от соседних клеток. Таких миоцитов в образцах миометрия после повторного КС было достоверно больше (р=0,01), чем у пациенток контрольной группы.
Изменения в миометрии, выявленные при гистологическом исследовании (табл. 2), с высокой степенью дезорганизации мышечных пучков (р=0,01), значительным интерстициальным отеком (р=0,01), выраженной гидропической дистрофией при увеличении растяжения нижнего сегмента матки, обусловленном увеличением матки при беременности, могут привести к аномалиям родовой деятельности и предопределить тактику родоразрешения в пользу очередного КС.

Таблица 2. Шкала, рекомендуемая для оценки степени выраженности морфологических изменений миометрия
При анализе срезов биопсийного материала из области рубца на матке с наиболее выраженными изменениями предложенных морфологических критериев было выявлено, что в 46% наблюдений среди показаний к первому КС в этой группе были аномалии родовой деятельности. На основании анализа данных морфологического исследования нами разработана балльная шкала оценки степени выраженности морфологических изменений миометрия (см. табл. 2). Сумма более 9 баллов либо 7 баллов, но с учетом значительной степени выраженности хотя бы двух из четырех предложенных критериев, свидетельствует о риске возникновения аномалий родовой деятельности и несостоятельности послеоперационного рубца на матке.
Выводы
1. При морфологическом исследовании биоптата из области рубца после кесарева сечения (КС) в нижнем маточном сегменте рекомендуется использование таких критериев, как степень дезорганизации и разобщенности мышечных пучков, интенсивность и распространенность гидротической (вакуольной) дистрофии и изолирующихся гладких миоцитов и их оценки от 0 до 3 баллов. Сумма более 9 баллов либо 7 баллов, но с учетом значительной степени выраженности, хотя бы двух из четырех предложенных критериев, свидетельствует о риске возникновения аномалий родовой деятельности и несостоятельности послеоперационного рубца на матке.
2. Для оценки состояния нижнего сегмента матки при первом КС у пациенток, планирующих беременность в последующем, целесообразно производить гистологическое исследование биоптата миометрия, полученного при первой операции, с целью определения тактики родоразрешения в будущем.
3. К клинико-анамнестическим факторам риска формирования неполноценного рубца на матке относятся следующие: 1) интервал между операциями менее 2 лет; 2) наличие интра- и послеоперационных осложнений после первого КС; 3) «незрелая» шейка матки на доношенном сроке беременности; 4) аномалии родовой деятельности среди показаний к первому КС.
4. Родильницам, выписывающимся из акушерского стационара после КС, планирующим беременность в будущем, необходимо выдавать справку о КС с указанием показаний к операции, продолжительности, особенностей и осложнений операции и послеоперационного периода, вида используемого шовного материала, а также результатов гистологического исследования биоптата миометрия, полученного во время первой операции КС.
Причины появления радиального рубца молочной железы
- Радиальный рубец,синонимы: «черная звезда», смешанное склеротическое поражение, радиальное склеротическое поражение
- Доброкачественный пролиферативный процесс с гипертрофией фиброэластических элементов вокруг радиально расширенных протоков с эпителиальной гиперплазией
- радиальный рубец молочной железы содержит железистые элементы
- Возможная причина - хроническое воспаление или нарушение кровообращения
- Обнаруживается при гистологическом исследовании приблизительно в 50% хирургически удаленных образцов (диаметр около 5 мм)
- Звездчатые нарушения структуры паренхимы, не связанные с хирургическим лечением или предшествовавшей травмой
- Часто смещение центра рентгенопрозрачности (феномен «черной звезды»)
- Кальцинаты наблюдаются приблизительно в 50% случаев
- В 33% случаев определяется только в одной проекции (дисковидная форма).
Какой метод диагностики радиального рубца молочной железы выбрать: МРТ, КТ, УЗИ
Что покажет УЗИ молочных желез при радиальном рубце
- радиальный рубец в 50% случаев определяется как гипоэхогенное образование с радиальными спикулами 8 Могут давать выраженную дистальную акустическую тень.
Что покажут снимки маммографии при радиальном рубце
- Нарушения архитектоники
- Длинные спикулы (до 5 см)
- Рентгенопрозрачный центр
- Обнаружение возможно начиная с диаметра 1 см.
В каких случаях проводят МР-маммографию при радиальном рубце молочной железы
- Нарушения структуры на преконтрастном Т1-взвешенном изображении, если они попадают в плоскость изображения
- Отсутствие сигнала на Т2-взвешенном изображении
- В 50% случаев отмечается контрастное усиление
- Возможен патологический характер динамического контрастирования.
Клинические проявления
- Обычно непальпируемые нарушения архитектоники в паренхиме молочной железы без травмы в анамнезе
- Гистология: фиброэластический центр, окруженный радиально расходящимися протоками, редко с включениями жировой ткани («черная звезда»).
Выбор лечения
Течение и прогноз
- Повышение риска развития рака молочной железы составляет приблизительно 8%
- На периферии радиального рубца часто обнаруживается тубулярный рак.
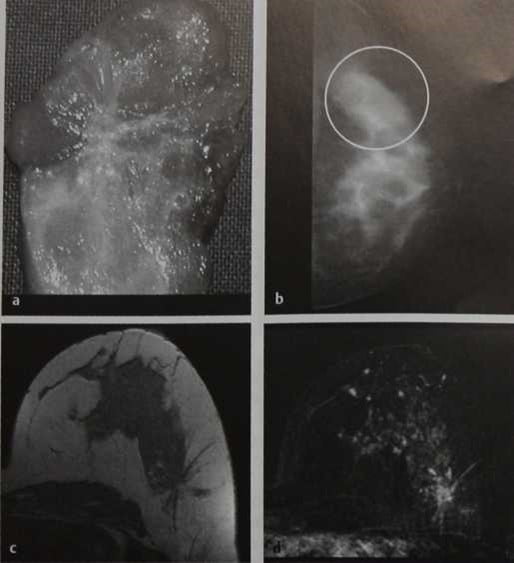
а-d Радиальный рубец
а Макропрепарат: радиальный рубец.
b Маммография, левая краниокаудальная проекция: нарушение архитектоники в латеральных отделах,
с МР-маммография (преконтрастное Т1 -взвешенное изображение): нарушение архитектоники в латеральных отделах левой железы.
d МР-маммография (изображение субтракции): нарушение архитектоники с умеренным контрастным усилением.
Какие заболевания имеют симптомы, схожие с радиальным рубцом молочной железы
- Протоковый рак in situ
- Инвазивный протоковый рак
- Послеоперационный рубец.
Советы и ошибки
Папиллома и радиальный рубец являются доброкачественными поражениями молочной железы, которые подлежат удалению, так как они имеют повышенный потенциал малигнизации.

Врач маммолог. Стаж 15+ лет. Принимает в Университетской клинике в Санкт-Петербурге. Стоимость приема 2000 руб.
- Запись опубликована: 24.09.2020
- Reading time: 5 минут чтения
Склерозирующий аденоз относится к пролиферативным поражениям молочной железы, при которых различные элементы тканей становятся твердыми. Заболевание может протекать бессимптомно или при клиническом обследовании проявляться в виде пальпируемого образования. Обнаруживается чаще всего случайно у женщин в перименопаузе, проходящих скрининговую маммографию.
Что представляет собой склерозирующий аденоз
Склерозирующий аденоз (СА) – распространенное, но плохо изученное доброкачественное поражение молочной железы, демонстрирующее повышенное количество деформированных долек, сопровождающееся фиброзом стромы. Его роль в канцерогенезе молочной железы остается неопределенной, однако, согласно некоторым исследованиям, патология увеличивает риск рака груди приблизительно в два раза.
Склерозирующий аденоз – пролиферативное поражение, которое обычно обнаруживается при доброкачественной биопсии молочной железы примерно в 28% всех случаев. Развитие заболевания не связано с индексом массы тела.

Склерозирующий аденоз
При изучении наличия СА по степени инволюции, оно значительно реже встречается у женщин с полной инволюцией долей молочной железы, чаще у тех, у кого дольчатая инволюция еще не начата или все еще продолжается.
Большинство случаев склерозирующего аденоза происходит с изменениями столбчатых клеток, еще одним компонентом пролиферативного заболевания груди. Примечательно, что патология также часто встречается при атипичной гиперплазии.
Это гистологически сложное образование, состоящее из увеличенных и деформированных долек, содержащих удвоенные и переполненные ацинусы, с выраженным миоэпителием и фиброзом стромы. Его инфильтрирующий вид и расширенные протоки из-за склероза могут имитировать карциному, поэтому для диагностики необходима биопсия с дальнейшим исследованием ткани.
Различают узловой и диффузный склерозирующий аденоз груди. Степень СА значительно варьируется: от микроскопического очага, меньшего, чем нормальная долька, до сливающегося процесса, который может напоминать злокачественное новообразование в силу выраженной клеточности.
Таким образом, SA – это уникальное гистологическое открытие, распознаваемая тканевая аномалия, связанная с более поздним развитием рака груди.
Причины склерозирующего аденоза
Причины развития склерозирующего аденоза неизвестны. Ученые определили СА как «феномен менструальной фазы жизни», предполагая, что эстрогены вызывают пролиферацию эпителия, которая предрасполагает к развитию аденоза и других эпителиальных опухолей.
Факторы риска развития заболевания
Предрасполагающие факторы склерозирующего аденоза следующие:
- Возраст . Данная патология чаще всего встречается у женщин в возрасте 45–55 лет (34,0%) по сравнению с 28,3% женщин старше 55 лет или 21,6% женщин младше 45 лет;
- Семейная предрасположенность . Чаще встречается у женщин с сильным семейным анамнезом рака груди (32,4 против 26,9% женщин без семейного анамнеза); ; . Применительно к СК длительный, когда уровень эстрогенов в крови повышен;
- Гиперпластические процессы малого таза , такие как гиперплазия эндометрия, нарушение работы яичников, поликистоз яичников (СПКЯ).
Патология чаще развивается у рожавших женщин.
Чем опасен склерозирующий аденоз груди
Хотя склерозирующий аденоз и определяется как доброкачественное пролиферирующее поражение, он является фактором риска развития рака молочной железы.
В одном крупном исследовании биопсий более 13 тысяч пациентов с доброкачественными новообразованиями (период наблюдения 15,7 года), данная патология обнаружена у 27,8% женщин. Подсчитано, что их стандартный коэффициент заболеваемости (SIR) развивающейся карциномы составил 2,10 по сравнению с 1,52 без СА, что влечет за собой двойной риск развития рака груди.
Склерозирующий аденоз может быть связан с доброкачественными поражениями (кистозные изменения, апокринная метаплазия, фиброаденома, внутрипротоковая папиллома), а также со злокачественными изменениями (карцинома in situ , инвазивная карцинома протоков). Поэтому для распознавания заболевания требуется тщательное обследование с диагностической биопсией.
Симптомы склерозирующего аденоза
Склерозирующий аденоз обычно протекает бессимптомно и часто является случайной микроскопической находкой в ткани груди, удаленной по другому показанию.
При наличии симптомов он может проявляться масталгией, а узловая форма может проявляться в виде пальпируемого образования (уплотнения).
Боль в груди бывает:
- ноющей;
- распирающей;
- колющей;
- отдавать в плечо, спину;
- при диффузной форме иногда усиливается в середине и/или второй фазе менструального цикла.
Диагностика склерозирующего аденоза груди
- Сбор анамнеза. Необходимо выяснить жалобы пациентки, связь симптомов с менструальным циклом, наличие злокачественных образований молочной железы в семье. Во время осмотра оценивается форма, симметрия каждой молочной железы, ее контуры, наличие деформации, состояние кожных покровов, сосков (редко, когда СА сочетается с другими доброкачественными патологиями, могут быть выделения прозрачного цвета).
После осмотра назначаются лабораторные (кровь на гормоны) и визуализирующие исследования (УЗИ, маммография, МРТ):
Определение гормонального фона (кровь на эстроген, прогестерон, ЛГ, ФСГ). Проводится, чтобы определить возможные нарушения как предрасполагающий фактор развития СА.
УЗИ молочных желез . Одно из первых и необходимых исследований в диагностике заболеваний груди. Относится к безопасным информативным (можно выявить патологические изменения на ранней стадии) обязательным для женщин после 30 лет методам диагностики.
Особенности УЗИ. Сонографический вид склерозирующего аденоза неспецифичен, включая овальные гипоэхогенные незатененные образования с ограниченными, нечеткими или микролобулированными краями. Он может выглядеть твердым или сложным кистозным.
УЗИ позволяет определить локализацию образования. Однако, на УЗИ узловой аденоз невозможно отличить от других доброкачественных процессов, таких как фиброаденома, или от четко ограниченного злокачественного новообразования, такого как медуллярная карцинома. Необходимы дальнейшие методы исследования.
Маммография назначается в первую очередь для диагностики рака груди на ранней стадии всем женщинам после 40 лет.
Особенности маммографии . Маммографически склерозирующий аденоз на снимке может проявляться по-разному:
- как очаговая асимметрия с соответствующими кластерными, круглыми или точечными микрокальцификациями;
- в виде архитектурных искажений, неравномерной плотности или спикулярной массы;
- узловатая форма может выглядеть как хорошо очерченная овальная или дольчатая масса.
Таким образом, на маммографии сочетание этих характеристик может имитировать карциному груди.
МРТ относится к способам диагностики в первую очередь злокачественных процессов на самых ранних стадиях (раньше, чем на рентгеновских снимках – маммограмме). Но исследование дорогостоящее, проводится по показаниям.
Особенности МРТ . Склерозирующий аденоз – одно из немногих доброкачественных поражений груди, которые на МРТ могут демонстрировать усиление или кинетическую кривую 3 типа.
Склерозирующий аденоз может проявляться в виде увеличения протока или однородно увеличивающейся массы овальной или круглой формы с дольчатыми или угловатыми краями. Обычно он имеет промежуточную интенсивность сигнала на изображениях, взвешенных по T1 и T2, с кривыми типа 2 или типа 3.
В общем, существует три типа усиления или кинетических кривых МРТ. Кривые типа 1 имеют медленный и непрерывный рост со временем и связаны с доброкачественными поражениями, вероятность их злокачественности составляет 6–9%. Кривая типа 3 показывает быстрый начальный подъем, за которым следует спад со временем (вымывание) в отсроченной фазе. Поражение с кинетикой 3 типа явно указывает на злокачественность (29–77%). Кривая типа 2 имеет начальный подъем, за которым следует плато в задержанной фазе. Вероятность злокачественного поражения с кинетикой 2 типа является промежуточной между 6% и 29-77%.
Если на МРТ наблюдаются кривые типа 2 или типа 3, для постановки окончательного диагноза требуется биопсия.
Биопсия. Проводится, чтобы осуществить забор ткани для последующего гистологического исследования. Только с ее помощью можно отличить злокачественную опухоль от доброкачественного процесса, а следовательно, склерозирующий аденоз от рака.

Биопсия молочной железы
Для постановки точного диагноза СА обязательна, поскольку на маммограмме он может выглядеть как рак груди и даже результаты МРТ часто оказываются спорными. Используется биопсия одного из следующих типов:
- стержневая пункционная биопсия;
- стереотаксическая стержневая биопсия;
- вакуумная биопсия.
При пункционной основной биопсии для взятия образца ткани груди используется полая игла. Образец отправляется в лабораторию для изучения под микроскопом на гистологию. Одновременно можно взять несколько образцов тканей.
Стереотаксическая центральная биопсия . Если проблемный участок можно увидеть только на маммограмме, проводят стереотаксическую биопсию. С применением этого метода берется образец ткани с помощью устройства для игольчатой биопсии, подключенного к маммографическому аппарату и к компьютеру.
Вакуумная биопсия проводится, если:
- предыдущая биопсия не дала определенного результата;
- для постановки диагноза требуется больше ткани молочной железы;
- проблемную область трудно определить.
Эта процедура занимает немного больше времени, чем стержневая биопсия, и проводится с помощью маммографии или ультразвукового исследования.
Особенности гистологии . Гистологически (исследование ткани после биопсии) склерозирующий аденоз часто представляет собой разрастание удлиненных, облитерированных или деформированных желез и канальцев.
Кроме того, происходит затвердевание окружающих тканей коллагена и стромы. Это состояние иногда называют фиброзирующим аденозом или аденофиброз, и, как правило, возникает из-за проблем с лобулярным блоком концевого канала (TDLU).
Лечение склерозирующего аденоза
В большинстве случаев диагноз устанавливается на основе основной биопсии. Лечение требуется не всегда (простые поражения оставляют под динамическим наблюдением). Но если есть сомнения или склерозирующее поражение сложное, проводится эксцизионная биопсия для полного удаления участка.
Иногда вместо эксцизионной используют вакуумную биопсию. Устройство для биопсии используется до тех пор, пока исследуемый участок не будет удален. Проводится без общего наркоза.
Удаленная ткань груди в любом случае отправляется в лабораторию, чтобы подтвердить, что это не рак.
После того как область полностью удалена и подтверждено сложного склерозирующего поражения, назначается повторная маммография.
Профилактика склерозирующего аденоза
Профилактические мероприятия в отношении склерозирующего аденоза общие для всех доброкачественных патологий груди:
- регулярное посещение маммолога;
- профилактический скрининг – регулярное УЗИ молочных желез (после 30 лет обязательно), маммография (после 40 лет);
- прием гормональных противозачаточных средств по назначению гинеколога;
- своевременное лечение патологий эндокринной системы;
- регулярное самообследование груди (причем в разных фазах менструального цикла).
При любых изменениях в молочной железе, обнаруженных при самообследовании, необходимо обязательно обратиться за консультацией к маммологу.
Использование народных (тем более нетрадиционных) средств медицины без назначения категорически противопоказано .
Читайте также:

