Что такое репликация вируса герпеса
Обновлено: 30.04.2024
ГОУ ДПО Российская медицинская академия последипломного образования
ГОУ ДПО Российская медицинская академия последипломного образования, Москва
ФГБУ "Учебно-научный медицинский центр Управления делами Президента РФ"
Герпетическая инфекция: механизмы латентности и реактивации. Возможности управления
Журнал: Клиническая дерматология и венерология. 2014;12(1): 75‑80
Касихина Е.И., Глазко И.И., Чекмарев А.С. Герпетическая инфекция: механизмы латентности и реактивации. Возможности управления. Клиническая дерматология и венерология. 2014;12(1):75‑80.
Kasikhina EI, Glazko II, Chekmarev AS. Herpetic infection: mechanisms of latency and reactivation. Potential to control the infection. Klinicheskaya Dermatologiya i Venerologiya. 2014;12(1):75‑80. (In Russ.).
ГОУ ДПО Российская медицинская академия последипломного образования
Проанализированы возможные механизмы регуляции латентного состояния и ограничения реактивации герпес-вирусов. Описаны взаимоотношения между герпес-вирусами и иммунной системой хозяина. Факторы, способствующие поддержанию латентной инфекции и реактивации вирусной репликации, активно обсуждаются. Одной из стратегий контроля за вирусной репликацией является применение ациклических нуклеозидов, в том числе валацикловира. Под наблюдением находились 10 женщин с рецидивирующим генитальным герпесом с явлениями стойкого генитального зуда. При применении комплексной противовирусной терапии с включением препаратов Вирдел (валацикловир) и Лавомакс (тилорона гидрохлорид) в течение 12 нед клинический эффект (отсутствие зуда) достигнут у 8 пациенток.
ГОУ ДПО Российская медицинская академия последипломного образования
ГОУ ДПО Российская медицинская академия последипломного образования, Москва
ФГБУ "Учебно-научный медицинский центр Управления делами Президента РФ"
В настоящее время для специалистов, занимающихся проблемами терапии инфекционных заболеваний, актуальными являются проблемы, связанные с персистенцией герпес-вирусных инфекций (ГВИ). Объясняется это широким распространением этой группы вирусов в человеческой популяции, несовершенством диагностики и неоднозначностью интерпретации лабораторных данных, внутриклеточной персистенцией возбудителей и их участием в процессах иммуногенеза.
Существуют разные формы взаимодействия ГВИ с организмом хозяина - острого периода с развитием характерных проявлений и последующим развитием инаппарантной (латентной) формы, отражающей хрупкий баланс между репликацией вируса и иммунным ответом хозяина. Механизмы, определяющие переход из острой фазы инфекции, когда вирус (вирус простого герпеса 1-го и 2-го типов - ВПГ-1, ВПГ-2, ВВЗ) не удается обнаружить в гомогенатах ганглия, пока не выяснены. Становление латентной инфекции связано со структурными изменениями в вирусном геноме: в регионарных сенсорных ганглиях вирусная ДНК сохраняется в виде эписом и только один ген транскрибируется постоянно. Это принципиально важное положение было установлено методами рестрикционного анализа и блоттинг-гибридизации и меченными 32Р вирусными ДНК при сравнении вирионной ДНК эталонного ВПГ-1. Уровень реактивации зависит, скорее всего, от количества латентных форм вирусных ДНК, находящихся в ганглиях, а также типоспецифических последовательностей в геноме вируса, которые определяют частоту реактивации и рецидивов в конкретной анатомической области [1]. У инфицированных серопозитивных лиц контроль над вирусной реактивацией осуществляется с помощью пожизненно присутствующих противогерпетических гаплотипоспецифических антител IgG и цитотоксических Т-лимфоцитов 2. Считается, что уровень вируснейтрализующих антител у практически здоровых лиц - величина довольно устойчивая, однако при нарушении стабильности в иммунной системе и вирусной реактивации при серологических исследованиях определяется повышение титров IgG. Примером является возрастзависимое снижение клеточного иммунитета, ассоциируемое с повышением специфических антител к ВПГ, цитомегаловирусной инфекции (ЦМВИ) и вирусу Эпштейна-Барр (ВЭБ) [5, 6]. Кроме того, данные клинико-лабораторных исследований реактивации ГВИ у пожилых людей показали, что рост титра специфических антител сопровождался значительным усилением транскрипции вирусного гена и количественным увеличением вирусной ДНК. При аналогичном исследовании образцов, полученных от молодых пациентов, уровни показателей вирусной активности и специфических антител были значительно ниже, чем у пожилых лиц [7, 8]. Изменение функции цитотоксических CD8 + Т-лимфоцитов может происходить на фоне эмоционального стресса, следствием которого являются репликация вируса и повышение уровня специфических антител [9, 10]. При обследовании астронавтов выявлены повышенные показатели транскрипции вирусного гена, вирусной нагрузки и усиление синтеза противогерпетических антител как результат стресса на космический полет [11, 12]. Как физический, так и психический стресс оказывают влияние на активность CD8 + T-лимфоцитов через высвобождение нейроэндокринных пептидов, а данный механизм может быть связующим звеном, контролирующим реактивацию латентной ВПГ-инфекции в симпатической нервной системе [13].
В настоящее время неизвестно является ли дисрегуляция Т-клеточного иммунитета ключевым моментом взаимоотношения герпетической инфекции и хозяина или могут играть роль иные процессы. Например, любой воспалительный неспецифический процесс, являющийся результатом клеточного стресса - реактивация ЦМВ, инфекция бактериальной этиологии, травма (операция, гипоксия и др.), приводит к активизации гипоталамо-гипофизарно-надпочечниковой системы и, как следствие, репликации ВПГ и появлению симптомов жжения и зуда [14, 15].
Герпес-вирусы рассматриваются как пожизненная инфекция. Для реализации этой цели ими используются разные механизмы манипуляции иммунными механизмами хозяина. Один из типичных примеров - молекулярная мимикрия: кодировка вирусами соответствующих клеточных интерлейкинов, хемокинов или хемокиновых рецепторов [16]. Другая стратегия уклонения от иммунной защиты хозяина осуществляется путем встраивания вирусного антигена в главный комплекс гистосовместимости инфицированных клеток [17]. Герпес-вирусы супрессируют или полностью ингибируют активность молекул I и II классов HLA-системы. Так, кодирование ВЭБ гена BNLF2a ослабляет антигенную презентацию и, следовательно, узнавание CD8 + T-лимфоцитами новых инфицированных клеток [18].
Длительное бессимптомное течение характерно и для ЦМВИ, к которой в настоящее время проявляется живой научный интерес. Источником ЦМВИ является человек, который может инфицироваться в разные периоды жизни. Так, если в возрасте 9 лет приблизительно 36% лиц ЦМВ-серопозитивны, то к 40 годам их число приближается к 60% [19]. Согласно данным литературы [20], женщины наиболее подвержены заражению ЦМВ, при этом процент инфицированных может варьировать от 45 до 100% и зависит от региона, расовой принадлежности и социально-экономического статуса. Иммунопатологические реакции при ЦМВИ весьма разнообразны и во многом определяют течение и исход инфекции. ЦМВ влияет на спектр экспрессии клеточных белков и цитокинов, что позволяет ему оказывать общее иммуносупрессивное воздействие на весь организм. При активной репликации вируса в клетках экспрессия генов ЦМВ вызывает нарушение транспорта и быстрое разрушение HLA-1, тем самым затрудняя презентацию антигена. Снижение активности Т-клеточного пула, в первую очередь цитотоксических СD8 + Т-лимфоцитов, приводит к подавлению нормального иммунного ответа хозяина на антигенный вызов не только ЦМВ, но и других представителей герпес-группы 22. Так, N. Khan и соавт. [22] показано, что Т-клеточный ответ на ВЭБ был существенно хуже у субъектов, инфицированных ЦМВИ. Кроме того, антигенспецифические CD8 + Т-лимфоциты могут продуцировать фактор некроза опухоли-α (ФНО-α) и γ-интерферон (γ-ИФН), способствующие развитию персистенции ЦМВ в макрофагах [24]. Результаты проведенных в последние годы исследований свидетельствуют о том, что реактивация латентной ЦМВИ может ухудшать состояние здоровья в пожилом возрасте [8, 25]. В работах P. Trzonkowski и A. Wikby и соавт. 27 выявлено, что повышение титра антител у пожилых людей к ЦМВ может быть напрямую связано с увеличением продукции цитокинов интерлейкина-6 (ИЛ-6) и ФНО-α. Высокий уровень специфических антител к ЦМВ также был ассоциирован с повышением уровня С-реактивного белка и поражением коронарных артерий [25]. ЦМВ и в большей степени ВЭБ причастны к развитию нарушений коронарного кровотока [29]. В работах последних 10 лет выявлено, что ВПГ-1 и ЦМВ ассоциированы с болезнью Альцгеймера у пожилых людей с нарушениями коронарного кровотока, а также развитием цереброваскулярного атеросклероза и метаболических нарушений 31. A. Aiello и соавт. [33] подтверждена роль латентной ЦМВИ как предиктора когнитивных нарушений наряду с такими факторами, как возраст, образование и состояние здоровья.
Представители герпес-группы не только ухудшают качество жизни, но и серьезно вмешиваются в функционирование репродуктивной системы мужчин и женщин. Сочетанную инфекцию ВПГ-1, ВПГ-2 и ЦМВ рассматривают как один из этиологических факторов хронических вульвовагинитов, цервицитов, эндометритов 35. ГВИ способствуют формированию аутопроцессов в органах малого таза (эндометриоз, хронический эндометрит) [37]. В присутствии ВПГ-2 увеличивается вероятность развития диспластических процессов в многослойном плоском эпителии с формированием внутриэпителиальной цервикальной неоплазии [38].
Асимптоматическое течение чаще характерно для мужчин и людей, имеющих антитела к ВПГ-1. Это может указывать на тот факт, что предшествующее инфицирование ВПГ-1 может снижать вероятность развития симптоматических форм инфекции ВПГ-2. Считается, что в 70% случаев передачи ВПГ-2 связаны с заражением и реактивацией вируса при асимптоматических и субклинических формах заболевания [1]. Одним из вариантов течения генитальной герпетической инфекции у женщин является бессимптомное выделение вируса (ЦМВ, ВПГ-1, ВПГ-2), чередующееся с появлением минимальных клинических проявлений в виде симптомов упорного зуда и раздражения в области наружных половых органов. В настоящее время нет единых трактовки патогенеза и тактики терапии для купирования зуда и жжения, возникающего при вирусном микстинфицировании гениталий.
Лечение больных с рецидивирующим герпесом включает использование аналогов нуклеозидов, в том числе валацикловира в эпизодическом и превентивном (супрессивном) режиме. Эпизодическая терапия подразумевает пероральный прием препарата в момент обострения инфекции. Для большинства больных с частыми рецидивами превентивная профилактическая терапия более целесообразна, чем эпизодическое лечение. Ежедневный прием в непрерывном режиме иногда в течение нескольких лет предусматривает применение валацикловира в связи с самой удобной схемой дозирования. На фоне лечения валацикловиром предотвращаются рецидивы инфекции, вызываемой ВПГ, или задерживается их возникновение на 71-85% (анализ соотношения опасностей) по сравнению с плацебо 40. Валацикловир традиционно используется в мировой практике для лечения инфекций, вызванных ВПГ, ВВЗ и профилактики ЦМВИ, в том числе у иммуносупрессированных лиц [44, 45]. В 2013 г. на отечественном рынке появился новый препарат валацикловира - Вирдел таблетки 500 мг компании STADA. Анализ эффективности супрессивной терапии валацикловиром, проведенный О.И. Летяевой и соавт. [42], показал улучшение иммунологических показателей у 87,5% женщин с хронической рецидивирующей герпетической инфекцией.
Нами были обследованы 10 женщин 27-35 лет с жалобами на жжение и зуд в области гениталий. Большинство пациенток первоначально расценивали данную симптоматику как проявления аллергического контактного дерматита и безуспешно применяли топические глюкокортикостероидные средства. Кроме того, 80% женщин предъявляли жалобы на слабость, головную боль, быструю утомляемость. В анамнезе у 3 пациенток были привычное невынашивание беременности и циститы, у 50% - бактериальный вагиноз, у 1 - эндометриоз, у 2 - остроконечные кондиломы перианальной области.
В комплекс обследования, помимо клинических методов, входило выявление ДНК ВПГ-1 и ВПГ-2, ЦМВИ и вирус папилломы человека (ВПЧ) с помощью полимеразной цепной реакции. В начале исследования 2 раза с интервалом в 2-3 нед с помощью иммуноферментного анализа определяли титр специфических антител. Также проводили микробиологическое исследование на наличие гонореи и трихомонад, диагностику папилломавирусной, микоплазменной и хламидийной инфекций согласно методическим рекомендациям МЗ РФ «Стандартизация медицинской помощи больным гонококковой инфекцией (Приказ №176 от 28.02.05) и Положению МЗ РФ «О мерах по предупреждению распространения заболеваний, передающихся половым путем» (Приказ №291 от 30.07.01). При определении генома вирусов коинфекция ВПГ-1 и ЦМВИ была выявлена у половины обследованных женщин, ВПГ-2 и ВПЧ-16 - у 2 пациенток, моноинфекция ВПГ-2 - у 3. Антитела к ВПГ-2 не были обнаружены у 2 пациенток, при этом интенсивность зуда и тенденция к регрессу на фоне терапии были более выражены у серонегативных, чем у серопозитивных пациенток, что свидетельствует о протективной роли Ig, приводящих к частичной инактивации вирусов [9].
Лечение включало комбинированное использование химиопрепаратов с разыми механизмами противовирусного действия: валацикловир (Вирдел) по 500 мг ежедневно в течение 12 нед и тилорон (Лавомакс 125 мг), согласно рекомендуемой схеме по 1 таблетке первые 2 сут, затем через 1 сут, на курс 20 таблеток. Комплексная терапия также включала препараты магния, растительные адаптогены и интравагинальное применение вагинальных суппозиториев, содержащих фиксированную комбинацию хлоргексидина и декспантенола (Депантол) в течение 10 сут во II фазу менструального цикла в течение 3 циклов.
Применение Лавомакса в сочетании с аналогами нуклеозидов (валацикловиром) позволяет комплексно решать вопросы терапии вирусных микстинфекций, особенно при планировании беременности, невынашивании беременности и обнаружении в крови аутоиммунных маркеров (волчаночного антикоагулянта, антител к хорионическому гонадотропину, антикардиолипиновых и антифосфолипидных антител) [43]. Сочетанное применение противовирусных химиопрепаратов и тилорона обеспечивает аддитивный или синергидный эффект, позволяет воздействовать на патогенетическую основу рецидивирования герпетической инфекции (ВПГ-1, ВПГ-2, ЦМВИ) и обеспечить снижение дозы противовирусного химиопрепарата, уменьшает вероятность возникновения устойчивых к аномальным нуклеозидам штаммов вирусов [44, 45]. Терапевтическая активность тилорона (Лавомакса) достаточно хорошо изучена и связана не только с индукцией продукции ИФН 1-го и 2-го типа, но и с модуляцией выработки других цитокинов (ИЛ-6, ИЛ-12, ФНО-α), приводящих к смещению баланса в системе «повреждение/ответ» в благоприятную для организма зону, в которой выраженность защитных реакций организма обеспечивает контроль над инфекционным процессом, но при этом предотвращает значительное эндогенное повреждение организма [46, 47].
Выводы
Деликатный баланс между латентностью и реактивацией - уникальное достижение эволюции.
У хозяина с нормальным иммунным ответом на присутствие вируса в организме формируются продолжительные взаимоотношения без волнообразного течения процесса. Тем не менее средовые провоцирующие факторы, нарушающие этот баланс, или любая причина, приводящая к иммуносупрессии, обусловливают развитие обострения вирусного заболевания.
Учитывая иммуносупрессивные свойства герпес-вирусов, экспансию штаммов, резистентных к противовирусным препаратам и ускользающих от адаптивных иммунных механизмов хозяина, а также высокую частоту встречаемости вирусных микстинфекций, актуальным становится поиск новых направлений терапии и профилактики герпетических инфекций. В этом отношнии комбинация Вирдела (валацикловир) и Лавомакса (тилорон) представляется средством выбора для достижения и контроля латентной формы заболевания.
Репродукция герпесвирусов. Репликативный цикл герпесвирусов. Поксвирусы. Репродукция поксвирусов.
Основные отличия репродуктивного цикла герпесвирусов от остальных ДНК-вирусов связаны с более сложной структурой генома. Адсорбция вирусов на клетках осуществляется через специфические рецепторы. После взаимодействия с рецепторами вирусная оболочка сливается с клеточной мембраной, а нуклеокапсид высвобождается в цитоплазму. Раздевание (депротеинизация) вирусного генома происходит на ядерной мембране, и вирусная ДНК оказывается в ядре клетки-хозяина. Репродукция включает раннюю и позднюю стадии, однако они разграничиваются нечётко.
Ранняя стадия репродукции герпесвирусов. В ранней стадии синтезируются «ранние белки», кодируемые проксимальной третью молекулы ДНК. Они проявляют регуляторные свойства, включая активацию транскрипции других участков вирусного генома, кодирующих ДНК-полимеразу и ДНК-связывающие белки.
Поздняя стадия репродукции герпесвирусов. В позднюю стадию вирусная ДНК-полимераза индуцирует репликацию материнской ДНК. В результате образуются молекулы ДНК дочерней популяции. Часть дочерней ДНК считывают клеточные полимеразы, что вызывает транскрипцию концевых генов, кодирующих структурные протеины (белки оболочки и гликопротеины шипов).
Сборка дочерних популяций герпесвирусов осуществляется в ядре, где капсидные белки окружают молекулы ДНК, формируя нуклеокапсиды. Финальная стадия морфогенеза герпесвирусов — формирование суперкапсида на внутренней поверхности ядерной мембраны. Зрелые дочерние популяции отпочковываются от модифицированной ядерной мембраны, транспортируются через цитоплазму и выделяются наружу.
Поксвирусы. Репродукция поксвирусов.
Поксвирусы обладают наиболее сложным репродуктивным циклом, при этом синтезируется более 100 различных белков, входящих в состав вирионов (большинство образует наружную оболочку). Репродукция поксвирусов характеризуется следующими особенностями.
• Транскрипция ДНК начинается до полной депротеинизации вируса, так как она полностью осуществляется вирусными полимеразами.
• Репликация происходит только в цитоплазме и полностью независима от клеточных полимераз, так как, в отличие от прочих вирусов, поксвирусы имеют собственную ДНК-зависимую РНК-полимеразу, которая обеспечивает считывание более половины вирусного генома в течение начальной и ранней стадий.
В репродуктивном цикле выделяют три стадии— начальную, раннюю и позднюю.
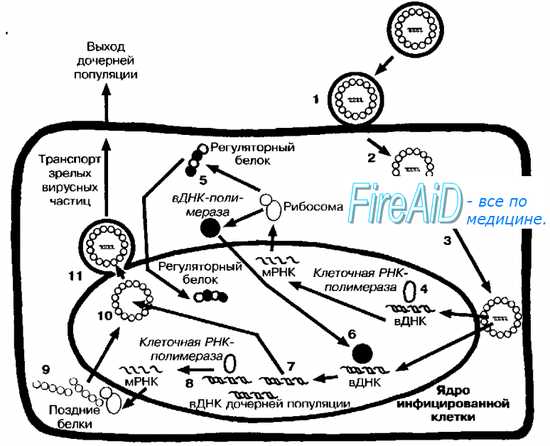
Рис. 5-4. Репликативный цикл ДНК-содержащих вирусов (на примере репродукции вируса герпеса). После адсорбции (1) вирус проникает в клетку путём слияния с мембраной (2). Нуклеокапсид транспортируется к ядерной оболочке (3), и вирусная ДНК (вДНК) проникает в ядро клетки, где начинается её транскрипция клеточной ДНК-зависимой РНК-полимеразой (4). Вначале транскрибируются «ранние гены». В результате трансляции «ранней порции» вирусного генома синтезируются «ранние белки» (5), включая регуляторные, матричные и вирусные полимеразы. Вирусная полимераза проникает в геном клетки (6), где запускает синтез молекул ДНК дочерних популяций (7). Часть вирусной ДНК («поздние гены») дочерних популяций транскрибируется клеточной РНК-полимеразой (8), что приводит к синтезу «поздних белков» (9), необходимых для сборки дочерних популяций (10). Последние покидают ядро, отпочковываясь от его мембраны (11), фрагменты которой содержат в составе своей обопочки.
Начальная стадия репродукции поксвирусов запускается сразу же после раздевания вируса и выхода вирусной ДНК в цитоплазму.
Ранняя стадия репродукции поксвирусов. На этом этапе транскрибируется примерно половина вирусной ДНК. Синтезируются ферменты, кодируемые «ранними генами» и участвующие в репликации вирусной ДНК. Параллельно в небольшом количестве образуются структурные белки.
Поздняя стадия репродукции поксвирусов совпадает с началом репликации ДНК (что переключает механизмы транскрипции на считывание второй половины генома). Регуляторные белки блокируют трансляцию «ранней мРНК» и запускают синтез поздних (структурных) белков. Сборка вирионов осуществляется только в цитоплазме посредством реакций мембранного синтеза. Высвобождение зрелых популяций сопровождается лизисом клетки.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Эпидемиология герпесвирусов. Строение герпесвирусов.
Герпесвирусы могут передаваться от одного поколения хозяев к другому благодаря персистенции, часто латентной инфекции, при которой вирус периодически реактивируется и выделяется из организма. При некоторых герпесвирусных инфекциях выделение вируса может быть фактически непрерывным. Молекулярное филогенетическое изучение подтверждает, что, за небольшими исключениями, каждый вирус является уникальным, потому что он происходит от своего видового хозяина. Латентность позволяет герпесвирусам быть пожизненными даже в очень небольшой изолированной группе хозяев.
Попытки разработать критерии классификации герпесвирусов внутри семейства пока не увенчались успехом. Существующая классификация основана на их естественном паразитизме.
В зависимости от биологических свойств герпесвирусы делятся на 4 подсемейства, 3 из которых имеют названия альфа-, бета-, гаммагерпесвирусы и одно - без названия, объединяющие герпесподобные вирусы.
Подсемейство альфагерпесвирусы включает герпесвирусы 1 и 3 человека, герпесвирус 1 кур и вирус болезни Марека. Большинство альфагерпесвирусов размножаются быстро (цикл репликации меньше 24 ч) и вызывают латентную инфекцию первоначально в сенсорных ганглиях. Подсемейство бетагерпесвирусы представлено цитомегаловирусами многих видов млекопитающих. Прототипным вирусом является герпесвирус человека 5 — цитомегаловирус человека. Вирусы этого подсемейства размножаются медленно (цикл репликации более 28 ч) и вызывают лизис клеток спустя несколько дней. Они могут оставаться латентными в секреторных железах, лимфоретикулярных тканях, почках и других органах. Подсемейство гаммагерпесвирусы представляет лимфотропные вирусы. Прототипом является герпесвирус человека 4 — вирус Эпштейн-Барр. Гаммагерпесвирусы обладают узким хозяинным спектром и находятся латентно в лимфоцитах (лимфома Беркитта и др.), некоторые представители вызывают инфекцию с разрушением клеток эпителия и фибробластоидных клеток.
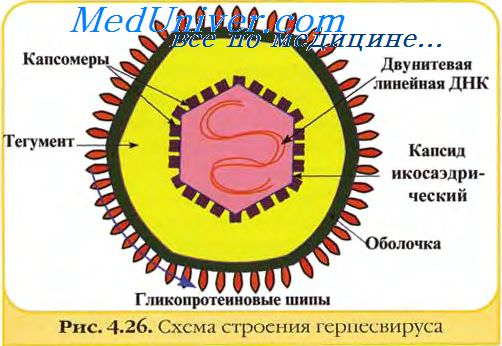
Вирионы герпесвирусов имеют диаметр около 120—150 нм и состоят из 4 структурных компонентов: сердцевины (ядра), содержащей линейную двуцепочечную ДНК размером 125—235 тпн, икосаэдрического нуклеокапсида диаметром 100-110 нм, содержащего 162 капсомера; аморфного материала (тегумент), окружающего капсид и оболочки с небольшими гликопротеиновыми выступами (пепломерами) на поверхности.

Тяжелый гингивостоматит вызванный герпесвирусом
ДНК-геном закручен вокруг волокнистого ядра, имеющего вид катушки, которая прикреплена волокнами к внутренней поверхности окружающего капсида. Вирусный геном в соответствующих экспериментальных условиях обладает инфекционностью.
Сердцевина вириона окружена икосаэдрическим капсидом, содержащим 162 частично полых капсомера (12 пентамеров и 150 гексамеров). Капсомеры высотой 12,5 нм и диаметром 9,5 нм имеют внутренний осевой канал диаметром 4 нм, простирающийся внутрь на половину длинной оси капсомера.
Слой, лежащий между оболочкой вириона и нуклеокапсидом (тегумент), содержит глобулярный материал, часто распределяемый ассиметрично, и выражен неодинаково у разных герпесвирусов. У вируса герпеса простого он развит слабо, тогда как у вирусов болезни Марека (БМ) и чумы уток (ЧУ) он развит отчетливо и его наличие обусловливает крупный размер вирионов. На поверхности герпесвирусов находится двухслойная оболочка с многочисленными небольшими гликопротеиновыми пепломерами, образованными главным образом за счет «бляшек» измененной ядерной мембраны инфицированной клетки.
Количество гликопротеинов в оболочке герпесвирусов варьирует. В оболочке вируса простого герпеса их не менее 11. Число копий индивидуальных гликопротеинов может превышать 1000 на вирион. Содержание полипептидов в вири-оне точно не известно и различается у разных герпесвирусов. В общем, оно колеблется в пределах 35—45 полипептидов.
Все герпесвирусы кодируют широкий набор ферментов, связанных с метаболизмом нуклеиновых кислот, синтезом ДНК и процессингом белков. Синтез вирусных ДНК и сборка вирионов происходят в ядре клетки. Капсиды покрываются оболочкой, проходя через мембрану ядра. Образование инфекционного вирусного потомства сопровождается деструкцией зараженных клеток. Вероятно, что некоторые кодируемые вирусом белки играют заметную роль в патогенезе и иммунитете при герпесвирусной инфекции, не являясь необходимыми для репликации вируса в культуре клеток. Считают, что геномы герпесвирусов в латентном состоянии в клетках хозяина существуют в циркулярной эписомальной (экстрахромосомальной) форме.
Репликация герпесвирусов наиболее детально изучена на примере герпесвируса 1 человека (вирус простого герпеса 1). После прикрепления вириона путем связывания пепломерных гликопротеинов оболочки с рецепторами клетки, одним из которых является гепаринсульфатпротеогликан, нуклеокапсид входит в цитоплазму путем слияния оболочки вириона с мембраной клетки путем эндофагоцитоза. Затем ДНК-белковый комплекс освобождается от нуклеокапсида и быстро останавливает синтез макромолекул клетки.
Геном ВПГ-1 (153 тпн) содержит три области инициации-репликации. Он практически кодирует все гены, необходимые для репликации, кроме ДНК-лигазы и топоизомеразы. На первом этапе репликации функционирует ДНК-полимераза а, а затем функционирует вирусная ДНК-полимераза.
Три класса мРНК — а, (3 и 7-транскрибируются последовательно клеточной РНК полимеразой II. Таким образом а (ранние) РНК в последующем функционируют как мРНК и транслируются в а-белки, которые вызывают транскрипцию (3 (ранних) мРНК, трансляция которых приводит к синтезу (3 (ранних) белков и подавляет дальнейшую транскрипцию а мРНК. Затем начинается репликация вирусной ДН К с использованием тех же самых аир протеинов, так же как протеинов клетки. Транскрипционная программа затем возобновляется, и в результате появляются 7 (поздние) мРНК, которые транслируются в 7 протеины. Более 70 белков, кодируемых вирусом, образуются в цикле его репродукции, многие из а и (3 белков являются ферментами и белками, связанными с вирусной ДНК, тогда как 7 белки являются структурными вирионными компонентами. Сложный контроль регуляции экспрессии осуществляется на уровне транскрипции и трансляции. Вирусная ДНК реплицируется в ядре, и вновь синтезированная ДНК упаковывается в преформированные незрелые капсиды. Созревание вирионов связано с вхождением ДНК в нуклеокапсиды и связыванием нуклеокапсидов с измененным внутренним слоем оболочки ядра и последующим обволакиванием вирионов при почковании. Зрелые вирионы накапливаются внутри вакуолей в цитоплазме и освобождаются экзоцитозом или при цитолизе. Вирусспецифические белки обнаружены также в цитоплазматической мембране, где они участвуют в клеточном слиянии и могут в качестве Fc-рецепторов выступать мишенями в иммунном цитолизе. Герпесвирусная инфекция сопровождается образованием внутриядерных телец включений, которые обычно обнаруживают в фиксированных окрашенных препаратах.
Геном вируса кодирует синтез по меньшей мере четырех гликопротеинов (gB, gC, gD, gE). Имеет место посттрансляционное расщепление или другие модификации вирусных белков. Белок gB обладает фузогенной активностью и ответственен за проникновение вируса в клетку; gD — основной протективный антиген.
Белки gC и gE не играют существенной роли в репродукции вируса, но помогают ему ускользнуть от иммунной системы организма. В отсутствие репликации вирус редко вызывает сплавление клеток, а при наличии специфических условий — агглютинацию эритроцитов. Оболочка вириона играет существенную роль в антигенности и инфекционности вируса. Гликопротеины вирусной оболочки ответственны за прикрепление вирусной частицы к клетке, проникновение вируса в клетку, за индукцию нейтрализующих антител и образование иммунитета. Нейтрализующие антитела реагируют с главными вирусными гликопротеинами, находящимися в оболочке вириона. Мембранные антигены, индуцированные в зараженных клетках, содержат по крайней мере три гликопротеина, обнаруженных в структуре вириона. Эти данные послужили основанием для приготовления вакцин из вирусспецифических компонентов. Однократное введение вакцины из субъединиц приводило к активизации гуморальных и клеточных факторов иммунитета у мышей и кроликов, повышало их резистентность к экспериментальному заражению и снижало количество клеток ганглия тройничного нерва, несущих геном вируса.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
В последние годы в инфекционной патологии все большее значение приобретают герпес-вирусы (от греч. herpes — ползучий). Внимание, которое вирусологи и клиницисты проявляют в последние 25 лет к герпес-вирусным заболеваниям человека, связано
В последние годы в инфекционной патологии все большее значение приобретают герпес-вирусы (от греч. herpes — ползучий). Внимание, которое вирусологи и клиницисты проявляют в последние 25 лет к герпес-вирусным заболеваниям человека, связано с их значительной эпидемиологической ролью и социальной значимостью в современном мире. Неуклонный рост числа герпетических заболеваний у взрослых и детей обусловливает необходимость всестороннего изучения герпетической инфекции и разработки эффективных методов профилактики и лечения разнообразных форм этой инфекции. Среди вирусных инфекций герпес занимает одно из ведущих мест в силу повсеместного распространения вирусов, многообразия клинических проявлений, как правило, хронического течения, а также различных путей передачи вирусов.
Он входит в число наиболее распространенных и плохо контролируемых инфекций человека. Герпес-вирусы могут циркулировать в организме с нормальной иммунной системой бессимптомно, но у людей с иммуносупрессией вызывают тяжелые заболевания со смертельным исходом. По данным ВОЗ, смертность от герпетической инфекции среди вирусных заболеваний находится на втором месте (15,8%) после гепатита (35,8%).
Герпес-вирусы объединены в обширное семейство Herpesviridae и в настоящее время наиболее четко классифицированы. Семейство Herpesviridae включает в себя более 80 представителей, 8 из которых для человека наиболее патогенны (human herpes virus-HHV). Герпес-вирусы — филогенетически древнее семейство крупных ДНК-вирусов — подразделяются на 3 подсемейства в зависимости от типа клеток, в которых протекает инфекционный процесс, характера репродукции вируса, структуры генома, молекулярно-биологических и иммунологических особенностей: α, β и γ (табл. 1, по данным Н. Г. Перминова, И. В. Тимофеева и др., Государственный научный центр вирусологии и биотехнологий).
α-герпес-вирусы, включающие HSV-1, HSV-2 и VZV, характеризуются быстрой репликацией вируса и цитопатическим действием на культуры инфицированных клеток. Репродукция α-герпес-вирусов протекает в различных типах клеток, вирусы могут сохраняться в латентной форме, преимущественно в ганглиях.
β-герпес-вирусы видоспецифичны, поражают различные виды клеток, которые при этом увеличиваются в размерах (цитомегалия), могут вызывать иммуносупрессивные состояния. Инфекция может принимать генерализованную или латентную форму, в культуре клеток легко возникает персистентная инфекция. К этой группе относятся CMV, HHV-6, HHV-7.
Герпес-вирусы ассоциированы с малигнизацией и способны (по крайней мере, EBV и HVS) трансформировать клетки in vitro. Все герпес-вирусы сходны по морфологическим признакам, размерам, типу нуклеиновой кислоты (двухцепочечная ДНК), икосадельтаэдрическому капсиду, сборка которого происходит в ядре инфицированной клетки, оболочке, типу репродукции, способности вызывать хроническую и латентную инфекцию у человека.
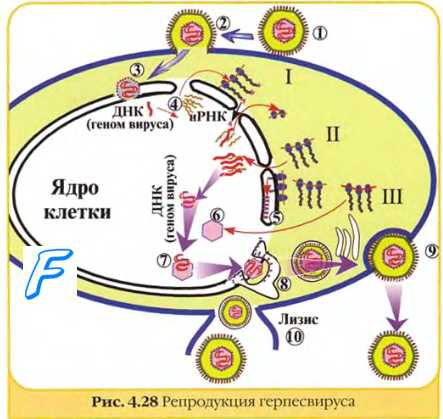
Клонирование герпес-вирусов происходит по следующей схеме: спонтанная случайная адсорбция исходного «материнского» вируса на поверхности клетки-мишени, «раздевание вириона» — расщепление оболочки и капсида, инфильтрация вирусной ДНК в ядро клетки-мишени, формирование и созревание «дочерних» вирионов путем почкования на ядерной мембране. После инфицирования клетки, например вирусом простого герпеса 1 или 2 типов, синтез новых вирусных белков начинается через 2 ч, а число их достигает максимума примерно через 8 ч. В процессе созревания «дочерних» вирионов их оболочки капсиды и ДНК формируются из имеющихся внутри инфицированной клетки аминокислот, белков, липопротеидов и нуклеозидов. Эти молекулы поступают в инфицированную клетку из межтканевых пространств по мере истощения внутриклеточных резервов. В этом отношении вирусы зависят от интенсивности внутриклеточного обмена, который, в свою очередь, определяется природой клетки-мишени. Наиболее высокий темп обмена веществ характерен для короткоживущих клеток эпителиоидного типа, поэтому герпес- вирусы особенно хорошо колонизируют клетки эпителия и слизистых оболочек, крови и лимфатических тканей. Полностью сформированные и готовые к последующей активной репродукции «дочерние» инфекционные вирионы появляются внутри инфицированной клетки через 10 ч, а их число становится максимальным примерно через 15 ч. Количество вирионов в определенной степени влияет на темп распространения инфекции и площадь поражения.
Первая генерация «дочерних» герпес-вирусов начинает поступать в окружающую среду (межклеточные пространства, кровь, лимфу и другие биологические среды) примерно через 18 ч. Это можно пронаблюдать в клинической практике при неконтролируемых процессах (например, при ветряной оспе, опоясывающем герпесе, генерализации цитомегаловирусной инфекции) — элементы герпетической сыпи возникают на коже или слизистых оболочках волнами. В свободном состоянии герпес-вирусы находятся в течение весьма непродолжительного периода (от 1 до 4 ч) — именно такая продолжительность характерна для периода острой интоксикации при герпес-вирусных инфекциях. Срок жизни каждой генерации образовавшихся и адсорбированных герпес-вирусов в среднем составляет 3 сут.
В эпидемиологическом плане наиболее интересны следующие сведения о герпес-вирусах: вирионы чрезвычайно термолабильны — инактивируются при температуре 50–52°С в течение 30 мин, при температуре 37,5°С — в течение 20 ч, устойчивы при температуре 70°С; хорошо переносят лиофилизацию, длительно сохраняются в тканях в 50-процентном растворе глицерина. На металлических поверхностях (монеты, дверные ручки, водопроводные краны) герпес-вирусы выживают в течение 2 ч, на пластике и дереве — до 3 ч, во влажных медицинских вате и марле — до их высыхания при комнатной температуре (до 6 ч).
Уникальными биологическими свойствами всех герпес-вирусов человека является тканевой тропизм, способность к персистенции и латенции в организме инфицированного человека. Персистенция представляет собой способность герпес-вирусов непрерывно или циклично размножаться (реплицироваться) в инфицированных клетках тропных тканей, что создает постоянную угрозу развития инфекционного процесса. Латенция герпес-вирусов — это пожизненное сохранение вирусов в морфологически и иммунохимически видоизмененной форме в нервных клетках регионарных (по отношению к месту внедрения герпес-вируса) ганглиев чувствительных нервов. Штаммы герпес-вирусов обладают неодинаковой способностью к персистенции и латенции и чувствительностью к противогерпетическим препаратам в связи с особенностями их ферментных систем. У каждого герпес-вируса свой темп персистенции и латенции. Среди изучаемых наиболее активны в этом отношении вирусы простого герпеса, наименее — вирус Эпштейна-Барр.
По данным многочисленных исследований, к 18 годам более 90% жителей городов инфицируются одним или несколькими штаммами по меньшей мере 7 клинически значимых герпес-вирусов (простого герпеса 1 и 2 типов, варицелла зостер, цитомегаловирусом, Эпштейна-Барр, герпеса человека 6 и 8 типов). В большинстве случаев первичное и повторное инфицирование происходит воздушно-капельным путем, при прямом контакте или через предметы обихода и гигиены (общие полотенца, носовые платки и т. п.). Доказаны также оральный, генитальный, орогенитальный, трансфузионный, трансплантационный и трансплацентарный пути передачи инфекции.
Герпес-вирусные инфекции широко распространены в мире и имеют тенденцию к неуклонному росту. Особенностью герпес-вирусной инфекции является возможность вовлечения в инфекционный процесс многих органов и систем, чем и обусловлено многообразие вызываемых герпес-вирусами заболеваний, варьирующих от простых кожно-слизистых до угрожающих жизни генерализованных инфекций. Важное свойство герпес-вирусов — это способность после первичного инфицирования в детском возрасте пожизненно персистировать в организме и реактивироваться под влиянием различных экзо- и эндогенных провоцирующих факторов.
Инфицирование человека указанными герпес-вирусами сопровождается клиническими симптомами соответствующего острого инфекционного заболевания в среднем не более чем у 50% людей, в основном у детей: внезапная эритема (вирус герпеса человека 6 типа), афтозный стоматит (вирусы простого герпеса 1 или 2 типов), ветряная оспа (вирус варицелла зостер), инфекционный мононуклеоз (вирус Эпштейна-Барр), мононуклеозоподобный синдром (цитомегаловирус). У остальных пациентов инфекция протекает бессимптомно, что особенно характерно для подростков и взрослых людей. Помимо биологических свойств штамма герпес-вируса, влияние на течение острых и рецидивирующих герпес-вирусных заболеваний оказывают индивидуальные (возрастные, половые, фило- и онкогенетические) особенности иммунного ответа инфицированного человека на многочисленные антигены вируса.
Часто, особенно при снижении иммунореактивности организма, герпес-вирусы выступают в качестве вирусов-оппортунистов, приводя к более тяжелому, с необычными клиническими проявлениями, течению основного заболевания. Вирусы простого герпеса 1 и 2 типов, а также ЦМВ входят в число возбудителей TORCH-инфекций. Они играют важную роль в нарушении репродуктивной функции человека, развитии серьезных заболеваний матери, плода, новорожденного и детей младшего возраста.
Вызываемые вирусами ВПГ, CMV, ВЭБ заболевания рассматриваются как СПИД-индикаторные в связи с их частым обнаружением при данной патологии. В 1988 г. они включены в расширенное определение случаев, подлежащих эпидемиологическому надзору по поводу СПИДа. Результаты исследований последних лет свидетельствуют о роли некоторых герпес-вирусов (ВГЧ-8, ЦМВ, ВЭБ и др.) в развитии ряда злокачественных новообразований: назофарингеальной карциномы, лимфомы Беркитта, В-клеточной лимфомы, рака груди, аденокарциномы кишечника и простаты, карциномы цервикального канала шейки матки, саркомы Капоши, нейробластомы и др.
Наибольшую угрозу для здоровья представляют герпетические нейроинфекции (летальность достигает 20%, а частота инвалидизации — 50%), офтальмогерпес (почти у половины больных приводит к развитию катаракты или глаукомы) и генитальный герпес.
По-видимому, все известные герпес-вирусные инфекции могут рецидивировать, однако порог и причины трансформации острой формы в рецидивирующую для каждого типа герпес-вируса свои. В целом герпес-вирусные инфекции принимают рецидивирующее течение не более чем у 8–20% больных. Рецидивирующие герпес-вирусные заболевания у некоторых людей могут восприниматься как «хронические», когда они развиваются в течение многих лет, не только разрушая физическое здоровье и функции жизненно важных систем, но и психологически крайне неблагоприятно влияя на больного. Поэтому для практических целей герпес–вирусные инфекции классифицируют с учетом одновременно локализации процесса, рецидивирования и этиологии (табл. 2).
Причины рецидивирующего течения герпес-вирусных инфекций многообразны. Одна из них заключается в том, что трансформация острого герпес-вирусного процесса в хронический происходит при явном «попустительстве» иммунной системы. Если приобретенный иммунодефицит в результате химиотерапии или ВИЧ-инфекции легко объясним, то все попытки выяснить, чем обусловлен основной дефект иммунного ответа у иммунологически полноценных людей с рецидивирующим течением герпес-вирусной инфекции, оказались безуспешными. Другая причина заключается, по-видимому, в количественной и качественной особенности персистенции и латенции конкретного штамма герпес-вируса в организме больного.
Диагностика герпетической инфекции
Все методы индикации и идентификации вирусов основаны на следующих принципах:
- выявление вируса per se (электронная микроскопия);
- выявление и идентификация вирусов посредством взаимодействующих с ними клеток (накопление вирусов в чувствительных к ним клетках);
- выявление и идентификация вирусов с помощью антител (МФА, ИФА, РАЛ, ИБ, РН, РСК);
- выявление и идентификация нуклеиновых кислот (ПЦР, МГ).
Электронная микроскопия: быстрая диагностика позволяет обнаружить ГВ или их компоненты непосредственно в пробах, взятых от больного, и дать быстрый ответ через несколько часов. Возбудитель выявляют с помощью электронной микроскопии клинического материала при негативном контрастировании.
Серологические методы уступают по информативности и чувствительности другим способам лабораторной диагностики и не позволяют с достаточной степенью достоверности установить этиологию той или иной формы заболевания. Нарастание титров антител происходит
в поздние сроки (через несколько недель) после заражения или реактивации вируса, и в то же время оно может и не наблюдаться у иммунодефицитных лиц. Для установления 4-кратного нарастания титра антител к герпес-вирусной инфекции (показатель первичной инфекции) необходимо исследование парных сывороток. Серологические реакции (РСК, РН) обладают высокой специфичностью, но относительно низкой чувствительностью, а кроме того, сложны в постановке.
Широкое практическое применение получили иммунофлюоресцентный метод, ИФА, РАЛ, ИБ.
Наиболее точным методом диагностики герпес-вирусной инфекции является выделение вируса из различных клеточных культур.
Для обнаружения вируса герпеса используют молекулярно-биологические методы: полимеразную цепную реакцию и реакцию молекулярной гибридизации, которые позволяют выявить наличие вирусной нуклеиновой кислоты в исследуемом материале. ПЦР может считаться самой чувствительной и быстрой реакцией. Чувствительность метода дает возможность определить одну молекулу искомой ДНК в образцах, содержащих 10 клеток.
Лечение герпетической инфекции
Лечение герпетической инфекции до настоящего времени остается сложной задачей. Хроническое течение процесса приводит к иммунной перестройке организма: развитию вторичной иммунной недостаточности, угнетению реакции клеточного иммунитета, снижению неспецифической защиты организма. Несмотря на разнообразие лекарственных препаратов, использующихся для лечения герпетической инфекции, лекарственных средств, обеспечивающих полное излечение от герпеса, не существует. Герпес-вирусная инфекция относится к трудно контролируемым заболеваниям. Это связано, в первую очередь, с разнообразием клинических поражений, развитием резистентности вируса к лекарственным средствам, наличием у герпес-вирусов молекулярной мимикрии. Поэтому для успешного лечения герпетической инфекции необходимо правильно подобрать противовирусный препарат, его дозу и длительность лечения, использовать комбинацию различных лекарств. В схемы терапии для повышения эффективности лечения необходимо также включать иммунобиологические препараты, способствующие коррекции иммунного статуса, а также патогенетические средства, облегчающие состояние пациента.
В настоящее время все антигерпетические средства подразделяются на 3 основные группы антивирусных препаратов (табл. 3).
Механизм действия химиопрепаратов (аномальных нуклеозидов: валтрекса, вектавира, фамвира, цимевена) связан с угнетением синтеза вирусной ДНК и репликации вирусов путем конкурентного ингибирования вирусной ДНК-полимеразы.
В препаратах-иммуномодуляторах (алпизарин, имунофан, ликопид, полиоксидоний) активно действующие вещества обладают иммуностимулирующими свойствами в отношении клеточного и гуморального иммунитетов, окислительно-восстановительных процессов, синтеза цитокинов.
Препараты-индукторы ИФН (амиксин, неовир, циклоферон) сочетают этиотропный и иммуномодулирующий эффекты действия. Препараты индуцируют образование эндогенных ИФН (α, β, γ) Т- и В-лимфоцитами, энтероцитами, гепатоцитами.
Особое место среди средств антигерпес-вирусной терапии занимает герпетическая вакцина для активации клеточного иммунитета, его иммунокоррекции в фазе ремиссии. Вакцинация преследует 2 цели: предупреждение первичной инфекции и возникновения состояния латентности, а также предупреждение или облегчение течения заболевания.
Однако, несмотря на наличие обширного списка антигерпетических препаратов, герпес остается до сих пор плохо контролируемой инфекцией. Это обусловлено и генотипическими особенностями возбудителя, и длительной персистенцией вируса в организме, и формированием штаммов, устойчивых к антивирусным препаратам. Максимальный клинический эффект может быть получен только при рациональной комплексной терапии лекарственных средств с различным механизмом действия.
Санкт-Петербургской группой ученых вирусологов и инфекционистов во главе с В. А. Исаковым предложена программа лечения и профилактики герпетической инфекции (табл. 4).
Преимущества комплексной терапии ГИ.
- Сочетанное применение противогерпетических химиопрепаратов и иммунобиологических средств обеспечивает синергидный эффект.
- Благодаря снижению дозы противовирусного ХПП уменьшается вероятность развития побочных эффектов, сокращается токсическое воздействие на организм больного.
- Снижается вероятность возникновения устойчивых штаммов герпес-вирусов к данному препарату.
- Достигается иммунокорригирующий эффект.
- Сокращается продолжительность острого периода болезни и сроков лечения.
Таким образом, терапия ГИ является сложной и многокомпонентной задачей.
По вопросам литературы обращайтесь в редакцию.
Т. К. Кускова, кандидат медицинских наук
Е. Г. Белова, кандидат медицинских наук
МГМСУ, Москва

Герпесвирусные инфекции — актуальная проблема современной медицины. Возбудители широко распространены среди населения планеты и способны инфицировать большинство органов человеческого организма, вызывая латентную, острую или хроническую форму инфекции. Из-за большого количества поражаемых клеточных мишеней герпетическая инфекция имеет различные клинические проявления — от кожного высыпания до возникновения злокачественных образований, пораженния органов и систем.
Особая значимость изучения герпесвирусных инфекций связана с появлением ВИЧ-инфицированных людей. Доказано, что вирусы герпеса могут активировать ВИЧ, находящийся в стадии провируса, и являются фактором прогрессирования ВИЧ-инфекции и его перехода в терминальную стадию [6].
При инфицировании герпесвирусами человек является носителем вируса в течение всей жизни. Заражение других людей может происходить в период обострения как вертикальным (трансплацентарно), так и горизонтальным (контактно-бытовым, воздушно-капельным, половым) путем.
Семейство Herpesviridae, насчитывает более 80 представителей, имеющих общее строение и ряд общих антигенов. Для них характерна сферическая форма и наличие 4 структурных компонентов: сердцевины, капсида, внутренней оболочки (tegument), внешней оболочки (envelope). Размер вириона колеблется от 100 до 300 нм. Сердцевина представлена двунитевой молекулой ДНК.
Вирусный геном упакован в капсид правильной икосаэдральной формы, состоящий, в среднем, из 162 капсомеров. Вирус покрыт липидсодержащей оболочкой с определяющимися в ее структуре белковыми выступами. Так же для них характерно наличие суперкапсида, образованного компонентами ядерных мембран и пронизывающих его гликопротеинов — белками ядерной мембраны, зараженных клеток. Между суперкапсидом и нуклеокапсидом расположен покровный слой тегумена, представленный глобулярными белками. Герпесвирусы (ГВ) термонеустойчивы, быстро инактивируются под действием факторов окружающей среды.
В составе вирионов обнаружено более 30 белков (гликопротеидов), семь из которых (gB, gC, gD, gE, gF, gG и gX) находятся на поверхности и вызывают образование вирус-нейтрализующих антител. Шесть гликопротеидов входят в состав капсида. Многие десятки белков, в том числе тимидинкиназа, являются неструктурными и образуются в ходе жизненного цикла вируса, например, ДНК-полимераза [7].
Проникновение ГВ в клетку хозяина является сложным процессом, который включает в себя прикрепление вирионов к клеточным рецепторам, эндоцитоз и слияние мембран вирионов и клетки. В результате капсид освобождается от белков внешней оболочки, а комплекс ДНК-белок вируса проникает в ядро. Вирионная ДНК выходит в нуклеоплазму и транскрибируется клеточной РНК-полимеразой. Различают сверхраннюю, раннюю и позднюю транскрипцию. В результате происходит ряд последовательных процессов: процессинг мРНК, синтез кодируемых продуктов и частичный обратный транспорт их в ядро, репликация ДНК и формирование дочерних молекул. Образовавшиеся в ядрах клеток незрелые капсиды, путем почкования, проникают через ядерную мембрану в цитоплазму. В цистернах эндоплазматического ретикулума заканчивается формирование зрелых капсидов и внешней оболочки вируса, с последующим транспортом к поверхности и выходом их из клетки.
Уникальным биологическим свойством всех ГВ человека является их способность к персистенции и латенции в организме инфицированного человека. Персистенция представляет собой непрерывное и цикличное размножение (репликацию) вируса в инфицированных клетках тропных тканей, что является причиной развития инфекционного процесса. Латенция ГВ клинически себя не проявляет, а диагностируется только при наличии специфических IgG против вируса в невысоких титрах, а сам вирус в этот период в периферической крови не определяется даже таким высоко-чувствительным методом, как ПЦР. В состоянии латенции нарушается полный цикл репродукции вируса, и он находится в клетках хозяина в виде субвирусных структур.
Опираясь на особенности структуры генома, репродукции и действия на клетки вирусы герпеса подразделяют на подсемейства: Alphaherpesvirinae, Веtaherpesvirinae и Gammaherpesvirinae [5].
Alphaherpesvirinae — широко распространенные вирусы, отличающиеся высокой цитопатической активностью для человека. Характеризуются быстрой репликацией (4–8 часов), способностью к цитолизу и бессимптомным персистированием в клетках нервной системы.
Сюда относят вирус герпеса 1-го и 2-го типа (род Simplexvirus) и вирус 3-го типа (род Varicellovirus). Представители рода Simplexvirus являются наиболее изученными среди всех герпесвирусов. Более 90 % населения земного шара инфицировано вирусом простого герпеса (ВПГ), а 20 % из них имеют проявления инфекции. ВПГ-1 типа вызывает герпетический гингивостоматит, герпетический кератит и т. д. ВПГ-2 типа является возбудителем в основном генитального герпеса, герпетического менингоэнцефалита, вызывая демиелинизацию нервных волокон и герпес новорожденных [8,9].
Вирусная инфекция способна протекать как в виде моноинфекции, вызванной ВПГ-1 или ВПГ-2, так и в сочетанной форме. В исследованиях Зубрицкого М. Г. была установлено, что ВПГ-1 и ВПГ-2 играют роль в возникновении сахарного диабета I и II типов, что проявляется наличием признаков хронического воспаления в поджелудочной железе и внутриядерных вирусных включений в ее клетках [4].
Ветряная оспа и опоясывающий лишай — острые инфекционные заболевания, вызываемые вирусом герпеса человека 3-го типа, является ДНК-содержащим вирусом. Первичная инфекция протекает как ветряная оспа (папулезно-везикулярная сыпь, сопровождающаяся лихорадкой), а при персистенции вируса в чувствительных ганглиях, возникают ее рецидивы — в форме опоясывающего лишая, проявляющегося невралгиями и высыпаниями по ходу нервных стволов [6,8].
Веtaherpesvirinae — проявляют менее выраженную цитопатичность, чем другие представители семейства. К патогенным для человека видам относят представителей родов Cytomegalovirus (вирус герпеса 5 типа) и Roseolovirus (вирус герпеса 6 и 7 типов). Отличаются медленной репликацией, основными очагами латенции являются моноциты и их предшественники, эндотелиальные клетки сосудов микроциркуляторного русла, альвеолярные макрофаги, Т-лимфоциты и стромальные клетки костного мозга [9].
Вирус герпеса 5 типа является возбудителем цитомегаловирусной инфекции (ЦМВИ), характеризующейся многообразием форм (от бессимптомных до генерализованных), морфологически проявляющейся образованием в слюнных железах, висцеральных органах и ЦНС цитомегалов — гигантских клеток с типичными внутриядерными и цитоплазматическими включениями.
ЦМВ может поражать практически все органы и ткани, вызывая как выраженные клинические состояния (интерстициальная пневмония, типичные поражения внутренних органов, включая мозг, почки, печень, органы иммунной системы), так и бессимптомное носительство. Особенный тропизм вирус проявляет к иммунокомпетентным клеткам. При персистенции ЦМВ выделяют две стадии: стадию продуктивной репликации и стадию латенции. Обе стадии не являются стабильными в течение жизни человека, сменяя одна другую. Реактивация ЦМВИ обычно не сопровождается какими-либо симптомами и для организма человека протекает незаметно.
Инфекции, вызываемые вирусом герпеса человека 6-го типа (ВГЧ-6), связывают с различными лимфопролиферативными иммуносупрессивными заболеваниями, некоторыми заболеваниями ЦНС. ВЧГ-6 впервые выделен в 1986 из лимфоцитов больных ВИЧ-инфекцией. Заражение ВЧГ-6 происходит преимущественно в первые два года жизни ребенка.
Иммуносупрессия развивается только при сочетанной инфекции с ВИЧ, ВЧГ-7 и ВЭБ, для которых ВЧГ-6 является кофактором, а также у больных СПИДом. У иммунодефицитных больных ВЧГ-6 может быть причиной лихорадки, снижения функции и отторжения трансплантата, пневмонии, гепатита, поражений ЦНС [1].
Отечественными исследователями установлено, что ВГЧ-6 и ВГЧ-7 могут запускать в организме человека аутоиммунные процессы, активировать продукцию противовоспалительных цитокинов: ФНО-альфа, ИЛ-6 и ИЛ-1в, таким образом, играя ведущую роль в патогенезе рассеянного склероза. Установлено, что ВГЧ-6 является кофактором прогрессивной мультифокальной лейкоэнцефалопатии.
Gammaherpesvirinae — патогены для небольшой группы хозяев, способны размножаться в лимфоидных тканях. Способствуют развитию злокачественному перерождению клеток, пожизненно персистируя в В-лимфоцитах или находясь в латентном состоянии. Патогенными для человека являются рода Lymphocryptovirus (вирус герпеса 4 и 8 типов) [9].
Наиболее часто ВГЧ-4 вызывает инфекционный мононуклеоз (вирус Эпштейна-Барра). Заболевание проявляется лихорадкой, ангиной, увеличениями лимфатических узлов, печени, селезенки, редко поражениями в форме гепатита и менингита. С ним связывают развитие лимфомы Беркитта. Предполагается, что вирус может способствовать трансформации В-лимфоцитов и индуцированию образования лимфобластных клеточных линий. Для него характерно пожизненная персистенция, иммунодепрессивная активность, индукция опухолевых и аутоиммунных процессов [3].
В 1995 году был выделен геном, который имел выраженную гомологию к вирусу Эпшетейна-Барра. Данный вирус отнесли к вирусу герпеса 8 типа (ВГЧ-8), который в настоящее время вирус мало изучен. По строению он сходен с другими герпесвирусами. Этот вирус выступает как этиологический агент, провоцирующий развитие одной из форм первичной лимфомы.
Несмотря на многообразие герпесвирусов, патогенными для человека являются 8 основных типов. Они поражают многие системы и органы человеческого организма — центральную нервную систему, вызывая возникновение энцефалитов, энцефаломиелитов, органов зрения (кератит, увеит), печени (гепатит новорожденных), слизистых оболочек (стоматиты, язвы, поражения гениталий) и кожного покрова (экзема, везикулярные сыпи), лимфатическую и т. д., инфицируя их клеточные элементы — глиальные клетки, эритроциты, моноциты, макрофаги, лимфоциты, эпителиальные и дендритные клетки. Это в свою очередь может приводить к таким тяжелым последствиям как — менингоэнцефалит (ВПГ-2), лимфопролиферативные заболевания (ВПГ-4), рассеянный склероз (ВГЧ-6 и -7), саркому Капоши (ВГЧ-8) и др. [2].
Изучение особенностей вирусов герпеса, особенностей строения и физиологии ускоряет диагностику инфекционных заболеваний, способствует правильному подбору противовирусных препаратов.
- Анохин В. А., Сабитова А. М. Инфекции, вызванные вирусами герпеса 6-го типа: современные особенности //Российский вестник перинатологии и педиатрии.-2016. –С. 127–131.
- Гранитов, В. М. Герпесвирусная инфекция. — М.: Мед. книга, 2001. — 81 с.
- Гурцевич В. Э. Роль вируса Эпштейна-Барра в онкогемматологических заболеваниях //Клиническая онкогематология. Фундаментальные исследования и клиническая практика. -2010.-Том 3 № 3.-С.222–233.
- Зубрицкий М. Г., Недзьведь М. К. Морфологические признаки воспалительного процесса в поджелудочной железе при сахарном диабете I и II типа / // Журнал ГГМУ.-2003. № 3.-С.78–83.
- Покровский В. И., Пак С. Г., Брико Н. И., Данилкин Б. К. Инфекционные болезни и эпидемиология: учебник / — 3-е изд., испр. и доп. — 2013. — 1008 с.
- Исаков В. А., Борисова В. В., Исаков Д. В. Герпес: патогенез и лабораторная диагностика. Руководство для врачей /— СПб.: Издательство «Лань», 1999. — 192 с.
- Луценко М. Т., Гориков И. Н. Некоторые сведения о морфологии герпес-вирусов и их свойствах //Бюллетень физиологии и патологии дыхания.-2010.- № 38. -С.74–77.
- Поздеев О. К. Медицинская микробиология: учебное пособие. / Под ред. В. И. Покровского. 4-е изд., испр. -2010.-768с.
- Филатова Т. Г. Герпесвирусная инфекция: учеб. пособие. / Издательство ПетрГУ.-2014.- 53с.
Основные термины (генерируются автоматически): вирус герпеса, вирус, клетка, тип, ветряная оспа, вирус герпеса человека, внешняя оболочка, клетка хозяина, человеческий организм, ядерная мембрана.
Читайте также:

