Что такое рентгенотерапия на коже
Обновлено: 19.04.2024
Глубокопроникающая рентгенотерапия рака века глаза. Эффективность
Глубокопроникающая рентгенотерапия может быть использована в виде одномоментного массивного облучения большими дозами или в виде фракционированного облучения более низкими дробными разовыми дозами, но позволяющими в конечном счете достичь более высоких суммарных доз, чем при однократном', даже гиперинтенсивном облучении.
Метод интенсивного одномоментного облучения находит преимущественное применение при относительно небольших раковых поражениях кожи, не выходящих за пределы 5-15 мм в диаметре и не проникающих в ткани глубже 2—3 мм. Он заключается в применении очень массивного пучка жесткого рентгеновского излучения, фильтруемого различными по толщине фильтрами или же совсем нефильтрованного смешанного пучка. Так как мягкие длинноволновые лучи этого пучка легко поглощаются полностью или в основной своей массе самыми поверхностными слоями кожи, то лечение нефильтрованными лучами допустимо при относительно поверхностно расположенных раковых поражениях кожи.
При пользовании же массивными дозами жестко фильтрованных лучей нельзя облучать больших по площади раковых поражений, поскольку при облучении более крупных участков кожи или больших опухолевых узлов получается очень высокая объемная доза и значительная добавочная доза от рассеянного излучения в толще облучаемой ткани.
М. Н. Бронштейн в поисках более эффективной методики облучения кожного рака разработал способ лечения, исходя из «принципа концентрации максимум лучевой энергии в минимум объема очага поражения». Для этой цели он пользовался одномоментным облучением нефильтрованными лучами, но отпускал на очаг поражения массивную дозу, равную 3000 r, при мощности излучения в 110 r в минуту. Условия облучения: 110 kV, 4 mA, кожно-фокусное расстояние 25 см.
Для защиты интактной окружающей ткани он пользовался локализованным защитным тубусом с диаметром, превышающим не менее чем на 3 мм диаметр поражения. На 187 леченных по этому методу больных автор получил 92% полного излечения со сроком наблюдения от б месяцев до 2 лет.
Все эти виды однократного массивного облучения могут быть с успехом использованы при лечении рака кожных покровов туловища, конечностей, лица, но к ним никоим образом не следует прибегать при раке, локализующемся на веках. Для лечения рака век использование массивных методов облучения недопустимо.
Рекомендуемые разными авторами методы лечения рака век рентгеновыми лучами и применяемые при этом дозы могут быть представлены в несколько схематизированном виде. Для лечения кожного рака, расположенного в ближайшем окружении глаза главным образом в наружном углу глазной щели, целесообразнее пользоваться методом однократного массивного облучения опухоли мягкими или более жесткими рентгеновыми лучами. Рекомендуемая доза — от 1400 до 1800 r. Такое лечение предпочтительнее проводить посредством защитного тубуса локализатора с диаметром, превышающим диаметр опухоли на 0,3—0,5 мм.

Если приходится лечить инфицированную изъязвленную опухоль или эндофитную раковую язву, то лучше пользоваться однократным, массивным облучением без фильтра в дозе от 3000 до 3500 г, отпускаемых сразу в один сеанс. Во избежание повреждения глаза и прилегающей интактной ткани это лечение тоже необходимо проводить посредством тубуса-локализатора.
При такого рода однократном массивном облучении дозы в пределах 2500—3500 r обычно вполне обеспечивают не только хороший непосредственный, но и стойкий отдаленный результат. Рецидивы при таком облучении встречаются лишь в тех случаях, когда доза не достигала указанных высоких границ, когда при этом лечении применялось низкое напряжение, не превышавшее 70—80 kV, и лечение проводилось с фильтром, в особенности тяжелым.
Если лечение проводится не одномоментно, а разбивается на два сеанса через 5— 7 дней, то разовая доза должна быть повышена до 1500—1750 и даже до 2000 г. Тогда и суммарная доза соответственно достигнет уже 3000—4000 r. При более продолжительном дробном облучении, занимающем от 7 до 14 дней, ежедневно отпускаемая разовая доза должна быть еще повышена, а суммарная должна достигать 4000—5000 r, без чего нельзя рассчитывать на достаточно хороший результат от проводимого лечения. Дальнейшее растяжение периода облучения или распределение намеченной дозы на 5—6 сеансов облучений, проводимых с интервалом в 4—6 дней, вызывает необходимость дальнейшего повышения суммарной дозы до 5000—8000 r.
При рентгенотерапии кожного рака области глаза необходимо руководствоваться следующими общими сведениями:
1. Чем меньше облучаемая площадь и чем больше интервал между отдельными сеансами облучения, тем более устойчива кожа к проводимому облучению и потому тем выше может быть применяемая разовая доза, а также общая суммарная доза, отпускаемая при дробном облучении.
2. Суммарная доза не должна лежать ниже канцеродитической, способной обеспечить достаточно полное и стойкое уничтожение данной раковой опухоли и предостеречь от появления скорого рецидива.
3. Чем выше используемая разовая и в особенности суммарная доза, тем и больше опасность лучевого повреждения тканей глаза, возможность деформации века и тем плотнее и грубее оказывается рубец после излечения раковой опухоли. Поэтому лечение должно быть проведено так, чтобы достаточная стойкость излечения была достигнута при использовании минимальной необходимой и допустимой для уничтожения данной опухоли дозы. Это обстоятельство особенно важно учитывать при лечении раковых поражений век и их ближайшего окружения.
4. Деформация века, наступающая после излечения рака века, зависит не столько от погрешности лечения и дозирования, сколько от степени поражения века и деструкции его тарзальной пластинки до лечения, т. е. от распространенности ракового процесса к моменту начала лечения. Поэтому при лечении распространенного рака века следует предупредить возможность дальнейшего разрушения века в период лечения.
5. Площадь облучения обязательно должна превышать визуально и пальпаторно определяемые границы опухоли или опухолевого инфильтрата: при небольших опухолях — не менее чем на 3—5 мм, а при более крупных поражениях, в особенности при интрадермальных инфильтратах, — не менее чем на 7—10 мм. Несоблюдение этих правил и облучение недостаточно широкой зоны интактной ткани вокруг опухоли неизбежно приводит к скорому появлению краевых рецидивов после излечения рака.
Рентгенотерапия рака конъюнктивы века обычно вызывает более сложные терапевтические проблемы, чем лечение рака, расположенного на коже века. Это обусловливается тем, что в таких случаях вместе с конъюнктивой может оказаться пораженной и тарзальная пластинка. А последняя при любых условиях должна быть полностью сохранена. Даже тогда, когда тарзальная пластинка остается интактной, лечение конъюнктивального рака затрудняется тем, что он менее доступен для прямого лучевого воздействия, чем наружный кожный рак.
При лечении же рака конъюнктивы обычным транскутанным методом значительное количество рентгеновского излучения поглощается кожей и тарзальной пластинкой века и лишь меньшее количество в состоянии оказывать разрушающее действие на опухоль.
Для более эффективного воздействия на такую опухоль конъюнктивы века некоторые авторы предложили лучше использовать нефильтрованные рентгеновы лучи для непосредственного облучения такого рака. Данный метод заключается во введении под веки анестезированного глаза защитного просвинцоваипого протеза, после чего пораженное веко инфильтрируют новокаином в двух плоскостях, выворачивают и фиксируют в вывернутом положении двумя шелковыми швами, прошитыми через анестезированный участок кожи щеки или лба. В таком положении опухоль конъюнктивы века становится доступной для прямого рентгеновского облучения.
Лечение проводится посредством тубуса-локализатора или без локализатора после предварительного укрытия окружающей интактной ткани свинцовой фольгой или просвинцованной резиной.
При облучении вывернутого века, в особенности это касается верхнего, необходимо следить за тем, чтобы вся пораженная часть века была хорошо вывернута и во время облучения целиком располагалась перпендикулярно к пучку рентгеновых лучей. Для лечения применяют нефильтрованный пучок рентгеновского излучения при жесткости в 100 kV. Рекомендуемая суммарная доза равна 5000 r. Более высокую дозу, например, 6 000 r, отпускают уже в два сеанса: при первом облучении 3 000 r и через неделю при втором облучении столько же или несколько большую дозу в зависимости от степени поражения и распространения процесса.
Более частые облучения не рекомендуются. В особенности нежелательно прибегать в этих случаях к фракционированному облучению, так как часто повторяемые сеансы связаны с необходимостью частого, повторного введения под веки защитного протеза, что само по себе уже небезразлично для глаза, не говоря уже о том, что в момент введения или извлечения протеза глаз, несмотря на все предпринимаемые предосторожности, легко может быть травмирован. Кроме того, частое повторение лечения связано с необходимостью повторных выворачиваний и прошиваний века.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Когда речь идет о лечении меланомы, большинство представляет кожные новообразования - темного цвета, неправильной формы. Но, во-первых, злокачественная опухоль при меланоме может быть беспигментной, а во-вторых, меланома локализуется не только на коже. Насколько сложной задачей является лечение меланомы, и какое место в нем занимают методы лучевого лечения (радиохирургия и лучевая терапия) - рассказывает сайт МИБС.
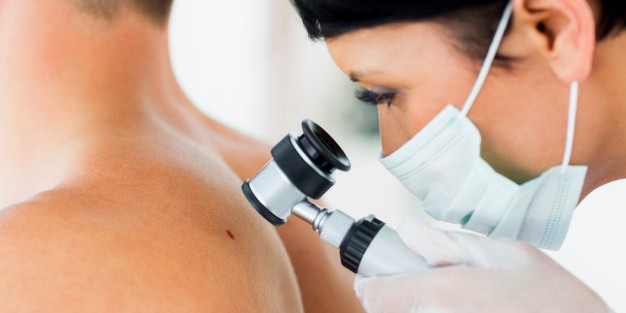
Что такое меланома?
Меланома (иногда встречается название “меланобластома”) - злокачественная опухоль из меланоцитов, клеток, вырабатывающих естественный пигмент меланин, поглощающий УФ-лучи для защиты кожи от ионизирующего воздействия солнечного света. Преимущественно, локализуется в коже, однако меланома может возникнуть в любом органе, в состав тканей которого входят меланоциты (слизистые оболочки и ткани глазного яблока).
Факторы, повышающие риск развития меланомы, хорошо изучены:
- загар;
повышение пигментации кожи, вызванное воздействием ультрафиолетового излучения (как солнечного, так и искусственного - в соляриях), - важнейший фактор риска меланомы; его вес в развитии меланомы настолько высок, что солярии запрещены в некоторых странах, а во многих под запретом находится их использование несовершеннолетними - наследственность;
те, у кого в семейной истории есть случаи меланомы, должны максимально внимательно отнестись к пунктам этого списка - фенотип;
чем светлее волосы и кожа у человека, тем выше вероятность меланомы - солнечные ожоги;
особенно перенесенные в детском и подростковом возрасте могут сыграть роковую роль - именно в этих местах чаще всего возникают злокачественные опухоли кожи - перенесенная меланома;
те, кто прошел через лечение меланомы, должны быть намного внимательнее - иммунитета от этого заболевания нет; наоборот, рецидивы меланомы - частое явление - образования на коже;
невусы (родинки или родимые пятна), особенно в количестве более 50 - серьезный повод регулярно проходить обследование у дерматолога и защищать кожу от избытка ультрафиолета; доброкачественное новообразование меланоформный невус (он же: диспластический меланоцитарный невус, синдром атипического невуса) - дает аналогичный повод; - пигментная ксеродерма;
наследственное заболевание, проявляющееся в повышенной чувствительности кожного покрова к ультрафиолету, также требует более внимательного отношению к любым изменениям на коже
Меланома и ее статистика
Но значительный объем данных о природе меланомы обусловлен не простотой визуальной диагностики (которая, как будет показано в следующем разделе, проста не во всех аспектах), а той агрессивностью, которая делает меланому одним из самых смертельных онкологических заболеваний в мире, и самым смертельным видом рака кожи. Согласно последним статистическим исследованиям, меланома кожи (составляет основную часть всех меланом) встречается в семь раз реже, чем другие виды рака кожи, но количество ежегодных смертей от меланомы выше в 2,5 раза.
Заболеваемость меланомой в семь раз меньше, чем другими видами рака кожи, а смертность - в 2,5 раза выше
Высокие статистические показатели объясняют важность, которое имеет лечение меланомы для человечества. В целом же, меланома занимает 19-е место среди других онкологических заболеваний в мире, немного уступая раку яичников, злокачественным опухолям мозга и нервной системы.
Диагностика меланомы
Лечение меланомы, как и любой опухоли, проходит успешнее, если новообразование выявлено на ранней стадии. В теории, ранняя диагностика меланомы кожи - простая задача. Визуальное изменение существующих невусов (частичная потеря пигментации, “рваные” края, асимметрия, выпадение волос и др.) привлекают внимание человека либо его близких. Пациент обращается к врачу-дерматологу или дерматологу-онкологу, где проходит визуальное неинвазивное обследование - дерматоскопию, которая позволяет буквально “заглянуть” в глубокие слои кожи для оценки распространенности опухоли (зачастую, меланома растет вглубь кожи, что означает более неблагоприятный прогноз, чем рост в горизонтальной плоскости). Стандарт современной диагностики меланомы - применение цифрового дерматоскопа, позволяющего получить снимки интересующего участка кожи в электронном виде для последующего наблюдения в динамике, или для получения срочной консультации либо “второго мнения”.
Однако на практике отсутствие должной онконастороженности приводит к игнорированию ранних симптомов меланомы кожи. А коварство заболевания состоит в том, что меланома может начать метастазировать даже при небольшом размере новообразования. Это приводит к тому, что пациент обращается на поздней стадии, когда требуется не только лечение первичной меланомы, но и ее метастазов.
Особенного подхода требует диагностика увеальной (внутриглазной меланомы). Сосудистая оболочка (хориоидея) и сетчатка глаза также содержат меланоциты, вырабатывающие меланин для защиты этих структур от ультрафиолетового излучения, попадающего внутрь глазного яблока. Опухолевое поражение этих структур, независимо от его природы, обычно имеет специфические симптомы (зоны “выпадения” изображения, вспышки, “молнии” и т.д.), которые должны насторожить и привести к квалифицированному офтальмологу, не только способного идентифицировать меланому, но и обладающего необходимым оборудованием для первичной диагностики новообразования, которое позволит начать лечение без промедления.
Наиболее сложная задача - диагностика меланомы слизистых оболочек. Иногда новообразования видны невооруженным глазом (например, меланома слизистой рта, меланома вульвы). Но меланома в скрытых местах (например, слизистой кишечника) может быть выявлена уже после того, как пациент обратится к врачу по поводу метастазов меланомы и будет начат поиск первичной опухоли. К счастью, меланома слизистых оболочек встречается крайне редко. По современным данным ее доля - не более 5% всех случаев меланомы.
Для окончательного подтверждения диагноза “меланома кожи” должна быть проведена биопсия образца ткани опухоли. Чрезвычайная опасно проводить частичный забора препарата, например, методом соскоба, при котором повышается вероятность распространения опухолевых клеток, - на морфологическое исследование следует направлять препарат тканей, иссеченных с определенным запасом по контуру. Лечение меланомы слизистых оболочек и внутриглазной меланомы следует начинать после всестороннего инструментального обследования, чаще всего УЗИ, КТ и МРТ с контрастом.
Диагностика метастазов меланомы
При подтверждении первичного диагноза, перед тем, как начать лечение первичного очага меланомы, необходимо провести диагностику для выявления возможных метастазов опухоли. Именно вторичная меланома намного чаще становится причиной смерти, чем первичное новообразование. Лимфогенные метастазы меланомы появляются в регионарных лимфатических узлах, а распространяемые с кровотоком гематогенные метастазы меланомы чаще всего отмечаются в печени, легких, костях, и головном мозге. Наиболее опасными являются метастазы в головной мозг.
Диагностика метастазов меланомы может включать:
- биопсию сторожевого лимфоузла;
- УЗИ периферических лимфоузлов, органов брюшной полости, малого таза и забрюшинного пространства;
- компьютерную томографию (КТ) органов грудной полости;
- магнитно-резонансную томографию (МРТ) или КТ органов брюшной полости с контрастированием (при локализации первичной меланомы кожи на нижней половине туловища или на нижних конечностях проводится КТ/МРТ органов малого таза с контрастированием);
- КТ/МРТ головного мозга с контрастом;
- уровень лактатдегидрогеназы (ЛДГ) в крови;
- при подтверждении начала метастазирования может быть проведено ПЭТ или ПЭТ-КТ всего тела.
Целесообразность каждого из видов диагностики определяет лечащий врач исходя из обоснованности подозрений наличия и степени метастатического поражения. Полученные результаты являются важной информацией для правильного подбора тактики лечения меланомы.
Лечение меланомы
Тактика лечения разрабатывается исходя из локализации меланомы и распространенности опухолевого процесса.
Лечение меланомы на ранних стадиях
При отсутствии распространения в другие части организма (I-II стадии), меланома кожи подлежит хирургическому иссечению с обязательным морфологическим исследованием удаленного фрагмента тканей. Также может быть проведено удаление сторожевого лимфоузла для морфологической диагностики на предмет распространения меланомы через лимфатическую систему. Без подтверждения распространенности процесса методы лекарственной терапии применяются редко.
Лучевое лечение меланомы
Лечение меланомы кожи и меланомы слизистых оболочек методами лучевой терапии (в т.ч. радиохирургии и протонной терапии) не демонстрирует должного эффекта, поэтому не получило распространения в клинической практике, уступив хирургии. Однако при меланоме глаза (увеальная меланома) которая представлена меланомой сосудистой оболочки (меланома хориоидеи) и меланомой радужной оболочки, высокоточное подведение высоких доз ионизирующего излучения (радиохирургия и протонная терапия) показывает высокие результаты, сравнимые, по эффективности, с удалением (энуклеацией) глазного яблока.
Протонная терапия является более сложным и более дорогим методом, к тому же лечение меланомы глаза протонами требует длительного курса лечения. Поэтому наиболее широко в мировой практике распространена радиохирургия, при которой высокая разовая доза ионизирующего излучения приводит к остановке биологических процессов в клетках опухоли.
Радиохирургия на Гамма-ноже, выполняемая в Онкологической клинике МИБС, позволяет получить органосохраняющее лечение меланомы глаза с соблюдением высоких международных стандартов. При этом стоимость лечения на Гамма-ноже, как правило, не превышает стоимости операции по удалению глазного яблока или пораженных его участков, при этом качество жизни пациента после радиохирургического лечения опухоли глаза - несоразмеримо выше, т.к. сохраняется не только орган (глазное яблоко), но и, в подавляющем большинстве случаев, его функция (зрение).
Лечение метастазов меланомы
Метастатическая меланома требует комплексного подхода к лечению. В зависимости от особенностей конкретного случая, врачи (именно так - в Онкологической клинике МИБС лечение опухолей проводится с привлечением междисциплинарного консилиума врачей различных специальностей) определят тактику лечения из сочетания таких методов, как иммунотерапия, таргетная терапия, химиотерапия, в т.ч. изолированная перфузия конечности (“прокачивание” высокой дозы химиопрепарата через временно “отключенные” от кровеносной системы сосуды руки или ноги при специфически локализованных вторичных меланомах кожи и мягких тканей), хирургия, лучевая терапия, радиохирургия.
Лучевое лечение метастазов меланомы
Принято считать, что лучевые методы в лечении меланомы и ее метастазов не применяются. Действительно, до того, как современные методики высокоточного воздействия высокими дозами ионизирующего излучения стали доступны в России, пациентам выполнялась паллиативная лучевая терапия при множественном поражении головного мозга, поражении костей, мягких тканей и лимфоузлов, а также лучевая терапия на ложе удаленных единичных метастазов.
При этом богатый клинический опыт ведущих мировых онкоцентров, оснащенных радиохирургическими системами Гамма-нож, в число которых входит и Онкологическая клиника МИБС, доказывает эффективность радиохирургии при олигометастатическом поражении головного мозга. Гамма-нож быстро (обычно, за один сеанс) и эффективно разрушает метастазы меланомы, защищая от повреждения здоровые ткани головного мозга. Радиохирургия также может применяться в качестве паллиативного лечения, разрушая наиболее опасные метастазы в головном мозге, в том числе и у пациентов в относительно тяжелом общем состоянии: радиохирургическое вмешательство неинвазивно, бескровно, безболезненно, не требует анестезии. Такой подход способен продлить жизнь пациента, сохраняя ее качество и давая больше шансов на успех системного лечения метастатической меланомы лекарственными препаратами (иммунотерапия, таргетная терапия, химиотерапия). Аналогичным образом радиохирургия на Кибер-ноже, также доступная в Онкологической клинике МИБС, может применяться для “точечного” лечения наиболее опасных метастазов меланомы, локализованных в других частях тела (чаще - в легких и печени).
Предстоит лечение меланомы? Обратитесь в МИБС сейчас, чтобы узнать о всех возможностях, которые предлагает современная медицина в Вашем случае!

Иванов Павел Игоревич
Заведующий отделением нейрорадиологии.
Нейрохирург высшей категории, кандидат медицинских наук.
Действительный член Всемирного Общества пользователей Гамма-Ножа (LGKS).
Действительный член Европейского Общества функциональной и стереотаксической нейрохирургии (ESSFN).
Действительный член Образовательного комитета Международного Общества Стереотаксической Радиохирургии (ISRS) .
Доцент кафедры нейрохирургии Военно-Медицинской Академии им. С.М. Кирова.
Лучевая терапия опухоли. Значение лучевой терапии в дерматоонкологии.
До настоящего времени не утратила своего значения лучевая терапия эпителиальных новообразований кожи, обеспечивающая гибель опухолевых клеток путем повреждения хромосомного аппарата и торможения митотическои активности. При этом следует учитывать, что большинство пролиферирутощих клеток опухоли радиочувствительны на стадии митоза и сразу после нее, непролиферирующие же клетки отличаются очень низкой радиочувствительностью и легко восстанавливают повреждения, давая рост новым клеткам. Невозможность уничтожения 100% злокачественных клеток из-за нахождения их в разных периодах жизненного цикла требует фракционирования суммарной дозы облучения.
Применяют следующие методы лучевой терапии: использование электронного пучка, низковольтную или ортовольтную рентгенотерапию, а также близкофокусную рентгенотерапию и имплантацию радиевых игл. Показаниями для проведения лучевого лечения являются: плоскоклеточный рак кожи, базалиома (в частности, кистозная и язвенная формы), эритроплазия Кейра, болезнь Боуэна, рецидивные эпителиальные новообразования кожи, возникшие после других методов лечения и локализующиеся вблизи естественных отверстий (глаза, носа, ушные раковины и т.д.). Лучевое лечение проводят больным с наличием противопоказаний к хирургическому лечению, лицам пожилого возраста, а также при диаметре новообразования, не превышающем 20 мм. Оно также проводится в качестве адъювантной герапии при глубоких инвазивных и метастатических раках кожи.
Лучевая терапия обычно безболезненна и хорошо переносится больными. В то же время она сопровождается развитием местных лучевых реакций нормальных тканей в облучаемой зоне. Степень их выраженности зависит как от методики облучения (уровень разовых и суммарных поглощенных доз, ритм облучения, размер полей), так и от распространенности опухоли, состояния нормальных окружающих тканей и др. Существенное влияние на течение лучевых реакций оказывает и общее состояние больного. Острые лучевые реакции кожи, как правило, ограничиваются эритемой и явлениями сухого эпидермита, которые не требуют перерыва в лечении, проходят самостоятельно или купируются 5% метилурациловой или пар-мидиновой мазью. При проведении лучевой терапии нередко имеется и риск развития лучевых осложнений (лучевых дерматитов, конъюнктивитов, катаракты, перихондритов, трофических язв, общей слабости, потери аппетита, головных болей и головокружения, лейко- и лимфопении, тромбоцитопении идр.), наблюдающихся примерно в 18% случаев. Это требует постоянного контроля состояния периферической крови и коррекции осложнений путем назначения гемостимулирующих препаратов, витаминов, дезинтоксикационной терапии, симптоматического лечения и т.д. Лучевая терапия неэффективна при склерозирующих формах опухолей и малоэффективна при наличии фистул и рубцов.
В ряде случаев, особенно в зависимости от площади воздействия, период заживления кожи после лучевой терапии может продлиться до 8 недель. Ограничивает ее применение и развитие неудовлетворительных в косметическом отношении атрофических рубцов с депигментацией и телеангиэктазиями, особенно часто возникающих в области груди и конечностей, а также невозможность повторного использования при развитии рецидива опухоли. Рубец после лучевой терапии существенно затрудняет диагностику рецидива. Важно отметить, что лучевая терапия приводит к нарушению кровоснабжения кожи, костей и мягких тканей, ухудшая заживление ран, в связи с чем рецидив после применения лучевой терапии очень сложно поддается и хирургическому лечению. В таких случаях также затруднено проведение пластических реконструктивных операций.
Для лечения эпителиальных новообразований кожи наиболее широко применяется фракционная близкофокусная рентгенотерапия, которая осуществляется путем ежедневного воздействия на очаг; поглощенная разоваядоза составляет 3-5 Гр (300-500 рад), общая суммарная доза — 50-70 Гр (5000-7000 рад).
При опухолях, расположенных в области губ, ушных раковин, век, с выраженной инфильтрацией подлежащих тканей методом выбора является внутритканевая гамма-терапия.
По данным литературы, косметический эффект после проведения лучевой терапии в 57,2% случаев был хорошим, в 24,8% — удовлетворительным и в 11,1% — плохим; однако частота осложнений варьировала от 4,9 до 80% случаев; рецидивы же после лучевой терапии базалиомы отмечались в 5-20% случаев.
Частота рецидивирования выше при локализации опухоли на волосистой части головы, носу, в периорбитальной области, а также при большей площади очагов поражения.
Суммируя приведенные данные, необходимо отметить, что несмотря на появление новых, более эффективных и более безопасных методов, рентгенотерапия не утратила своего значения при ряде злокачественных новообразований кожи и может явиться методом выбора при лечении некоторых форм базалиомы, плоскоклеточного рака кожи, эритроплазии Кейра, болезни Боуэна.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Лучевая терапия злокачественных лимфом кожи.
Лучевая терапия злокачественных лимфом кожи была впервые применена у больного грибовидным микозом В.П. Красноглазовым в 1902 г. Оказалось, что опухоли лимфопролиферативного характера весьма чувствительны к рентгеновым лучам, в связи с чем указанный метод лечения нередко использовался в комплексной терапии больных ЗЛК. При проведении рентгенотерапии разовая доза облучения равнялась 100-125 Р, суммарная курсовая доза составляла 300-500 Р, при облучении крупных опухолей разовая доза увеличивалась до 200 Р, курсовая - до 600-800 Р.
В настоящее время в России в связи с вытеснением из практики рентгентерапевтических аппаратов, предназначенных для глубокой рентгенотерапии, основное внимание стали уделять работе на гамматерапевтических установках (радиотерапия).
Лучевая терапия применяется как самостоятельно, так и в сочетании с другими видами лечения, чаще с химиотерапией. Используется при различных клинических вариантах ЗЛК, но чаще у больных с солитарными опухолями (Т- или В-лимфопролиферативного характера). Лучевая терапия при единичных опухолевых очагах может избавить больного от необходимости получать массивную полихимиотерапию. При этом следует иметь в виду, что чем более выражена степень злокачественности процесса, тем более эффективно облучение. Кроме того, лучевая терапия может проводиться после завершения курса полихимиотерапии, воздействие производится на очаги, которые оказались нечувствительными к цитостатическим препаратам. В отделении дерматовенерологии МОНИКИ мы наблюдали больного, у которого после проведения курса полихимиотерапии отмечался регресс множественных опухолевых очагов, локализованных в области туловища и конечностей, но оставались массивные инфильтративные разрастания в области ушных раковин которые практически разрешились после проведения лучевой терапии. Более благоприятный терапевтический эффект отмечается при лучевом воздействии на опухолевые, узловатые очаги, которые не подверглись распаду, однако наличие язвенных дефектов на опухолях не является противопоказанием для проведения дистанционной гамматерапии.
В последние годы, особенно за рубежом, в лечении больных злокачественными лимфомами кожи стали использовать электронно-лучевую терапию. Особенностью этого метода является облучение тканей электронным пучком, испускаемым бетатроном или линейным ускорителем мощностью 6-10 МэВ. Такой метод облучения дает возможность подобрать оптимальную дозу для обработки опухоли и щажения близлежащих тканей. В нашей стране метод лечения больных ЗЛК с помощью электронного пучка впервые был применен Н.С. Потекаевым в 1982 г. Лечение проводится как на ограниченные участки опухолевой ткани, так и тотально, если имеет место универсальное поражение кожи. Облучение проводят 1 или 2 раза в неделю курсами. Курсовая доза облучения составляет 24-30 Гр. Всего проводится не более 3 курсов лечения. Лечение электронным пучком очагов поражения на коже может сочетаться с облучением увеличенных лимфатических узлов. После 1-2 курсов лечения клиническая ремиссия достигается в 86% случаев, причем более длительная и стойкая у больных, которым проводилось лечение электронным пучком на ранних стадиях развития ЗЛК.
Устранение опухолевых очагов с помощью лучевой терапии не предотвращает появление новых опухолей, тем более что этот вид терапии обычно проводится в запущенных стадиях заболевания. В отдельных случаях наблюдается рефрактерность опухолей к лучевой терапии.
После применения гамматерапии или электронного облучения в указанных дозах возникают эритема, отечность, шелушение кожи, которые рассматриваются не как осложнение, а как симптомы обычной лучевой реакции, не требующей специального лечения и проходящей самостоятельно. В случае превышения дозы могут развиться явления атрофии, дис-хромии кожи, ангицроза, штопеции, ксероза, лизиса и отслойки ногтевых пластинок.
Ю.В. Сергеев и соавт. предложили новый метод лечения одной из форм ТЗЛК (педжетоидного ретикулеза), основанный на использовании вихревого магнитного поля, которое создается с помощью установки «Магнитотурботрон». Магнитное поле, генерируемое данной установкой, является вращающимся, циклично меняющимся по величине индукции от нуля до заданного максимума. Для лечебного воздействия предложены следующие параметры вихревого магнитного поля: индукция при ее максимальном значении 2 мТл, частота вращения 6000 об/мин, длительность цикла (то есть периода изменения индукции от нуля до максимума и обратно до нуля) 120 с. Продолжительность процедуры (количество циклов) определяется оперативно, непосредственно во время лечебного воздействия, на основании непрерывной регистрации температуры тела больного как интегрального показателя реакции организма. Вихревое магнитное поле оказывает воздействие одновременно на все органы и системы организма. Авторы отмечают выраженный противоопухолевый эффект при применении указанного метода терапии, который проявлялся в улучшении самочувствия больных, уменьшении размеров опухолей, удлинении ремиссии.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Показания к применению радиотерапии расширяются, в том числе и за счет увеличения количества выявленных онкологических заболеваний. Лучевая терапия исторически второй после операции эффективный метод лечения рака. Настоящим прорывом стала комбинация двух методов и возникновение радиохирургии.
Успехи лучевой терапии
Современные установки и методики радиотерапии позволили существенно повысить эффективность и безопасность лечения, а также расширить показания к его проведению, в том числе и за счет увеличения количества онкологических заболеваний.
Настоящим же успехом последних лет стала стереотаксическая радиохирургия. Она решила проблему повреждения клеток тканей и органов, через которые луч проникал к опухоли. Стереотаксическая радиохирургия - это принципиально новый метод лечения. В отличии от традиционной лучевой терапии вся доза излучения приходится непосредственно на опухолевые клетки, не затрагивая при этом через здоровые. Гамма-нож – один из самых известных в нашей стране вариантов такого радиационного лечения.
Доза облучения
Грамотный расчет дозы очень важен. Он позволяет добиться максимального эффекта при минимальном вреде для здоровых клеток организма. При этом учитывают вид опухоли, ее размер, состояние здоровья пациента. В качестве единиц измерения применяют Грей (Гр) или ее производную центигрей (1 цГр=100 Гр). При использовании лучевой терапии как вспомогательной при раке молочной железы, опухолях головы и тела доза составляет 45-60 Гр. Ее называют общей и делят на несколько процедур, которые образуют курс лечения. В среднем у пациента бывает около 5 сеансов в неделю, которые несколько раз повторяют в течении 5-8 недель. Иногда эти маленькие дозы еще дополнительно делят на две процедуры, которые проводят в один день.
Подготовка к лучевой терапии
Любому лечению предшествует беседа с врачом и дополнительные обследования. Лучевая терапия в этом случае не исключение. Лечащий врач расскажет о предстоящей процедуре, возможных результатах, рисках и побочных эффектах.
Радиотерапия может быть губительной для плода. Поэтому беременность в этот период нежелательна. Но если женщина уже ожидает ребенка, врач вместе с пациенткой подберет наиболее оптимальный вариант лечения.
Обязательно нужно сообщить доктору о наличии кохлеарных имплантов, электрокардиостимуляторов.
Во время проведения курса радиотерапии пациент может с трудом справляться с работой и даже с обычными домашними проблемами, поэтому вопрос с помощником по дому и с объемом профессиональных нагрузок лучше решить заранее.
При планировании курса терапии врач определяет оптимальный тип излучения, дозу, направление луча. При этом получают изображения проблемной области и проводят симуляцию лечения, во время которой необходимо найти максимально удобное положение тела на время облучения, чтобы у больного не было потребности двигаться во время процедуры. Для того этого пациента просят лечь на стол и выбрать самую комфортную из нескольких предложенных поз. Ограничители и подушки помогают сохранять неподвижность на протяжении всего сеанса облучения. После того, как удобная позиция найдена, врач отмечает на теле пациента место проникновения луча, используя маркер или нанося крохотную татуировку. Далее переходят ко второй части планирования – получения изображения опухоли, для чего обычно используют метод компьютерной томографию.
Как проводят лучевое лечение?
Лучевая терапия – это широкий арсенал методов, которые можно разделить на две большие группы: внешнюю и внутреннюю (брахиотерапию). В первом случае излучение генерируют специальным аппаратом, который двигается возле проблемной зоны и под разными углами посылает лучи в опухоль. Пациент при этом лежит неподвижно на столе в той позе, которую выбрали на этапе планирования. Время воздействия может быть разным. В среднем один сеанс занимает 10-30 минут. В большинстве случаев пациенту назначают несколько таких процедур. Через некоторое время курс повторяют. Если целью радиотерапии является обезболивание, то ее могут провести однократно.
Сама процедура абсолютно безболезненная, но вызывает у некоторых людей беспокойство. Комнаты для проведения облучения оборудованы аудиоаппаратурой. С ее помощью пациент может сообщить врачам о любой проблеме или просто поговорить, чтобы расслабиться. Сами доктора в это время находятся в соседней комнате.
Брахиотерапия предполагает облучение опухоли радиоактивными веществами, которые вводят непосредственно в новообразование или соседние ткани. Она имеет две разновидности: временная и постоянная. При временном варианте радиоактивные препараты находятся внутри специального катетера, который на некоторое время вводят в опухоль, а затем удаляют. Для постоянной брахиотерапии используют крохотный имплантат, который помещают непосредственно в опухоль, где из него постепенно высвобождаются радиоактивные вещества. Со временем они заканчиваются, а зерно имплантата остается в организме на всю жизнь, не причиняя никаких неудобств.
Возможные риски лучевой терапии
К сожалению, излучение оказывает негативное влияние не только на опухолевые, но и на здоровые клетки. Поэтому у большинства пациентов после лечения возможно развитие побочных эффектов. Проявления и степень тяжести зависят от дозы радиации и области тела, а также от способности здоровых клеток к восстановлению. Организм каждого человека реагирует на лечение очень по-разному. Поэтому точно спрогнозировать побочные эффекты крайне сложно. Некоторые проявляются сразу во время лечения, другие – дают о себе знать недели и месяцы спустя. К счастью, наиболее распространенные побочные эффекты достаточно мягкие, контролируемые и со временем проходят.
Отдаленные побочные эффекты редки, но они могут быть тяжелыми и необратимыми. По этой причине врач обязательно должен их проговорить.
Побочные эффекты
В зависимости от времени появления все побочные эффекты делятся на две группы: те, что проявляются во время или сразу после лечения и отдаленные. К первым относят поражение кожи, усталость, тошнота, понос (диарея), потеря аппетита, выпадение волос, затрудненное глотание (при облучении грудной клетки), эректильная дисфункция у мужчин (при облучении таза), проблемы с суставами и мышцами.
Серьезные отдаленные побочные эффекты отмечают редко, но надо понимать, что возможность их развития существует. Например, у женщин облучение тазовой области может привести к ранней меноупазе и невозможности зачать ребенка. В таких случаях у женщины есть возможность перед лечением заморозить несколько своих яйцеклеток. Мужчина может так поступить с образцами спермы. К другим отсроченным эффектам относится недержание кала, лимфатический отек, утолщение отдельных участков кожи и вторичный рак.
Способы облегчения своей жизни во время лучевой терапии
Лечение онкологических заболеваний – это серьезная нагрузка на организм, которая влияет на общее самочувствие и настроение. Этот сложный период пройдет проще, если к нему готовиться и проговорить с врачом все аспекты лечения. Желательно, чтобы родственники и близкие люди также были готовы прийти на помощь.
Нормально, что заболевший чувствует себя истощённым, уставшим, испуганным, одиноким и брошенным. Огромную помощь больным могут оказать родные люди. Высказанные эмоции облегчают жизнь человека, и пациент может выплеснуть все свои чувства. А близким хорошо бы не забывать сказать больному, что его любят и будут заботиться независимо от того, в каком он настроении.
Пациент при необходимости может обратиться к психологу, который подберет способ борьбы с переживаниями. Это может быть медитация, массаж или даже просто поход на концерт. Некоторым больным помогает общение с людьми, имеющих похожие проблемы, на специально организованных собраниях.
Многие пациентов страдают от проблем с кожей. Их можно облегчить, следуя простым советам:
- на время отказаться от бритья или использовать электробритву вместо обычной;
- остановить свой выбор на мыле без отдушек. Это касается также дезодорантов, кремов и прочих косметических средств, контактирующих с кожей;
- беречь кожу от холодного ветра и использовать солнцезащитный крем с уровнем SPF 15 и выше в солнечные дни;
- выбирать свободную одежду из натуральных материалов, которая не имеет выступающих швов, узлов и других элементов, способных натирать кожу.
Диета
Очень важно во время курса лучевой терапии правильно и регулярно питаться, потребляя достаточное количество калорий и белков и не допуская потери веса. Ведь план лечения и расчет дозы делают исходя из массы тела и объемов человека. При изменении этих параметров необходимо пересматривать весь курс лечения. В рационе человека обязательно должны присутствовать мясо, рыба, яйца, цельное молоко, сыр, бобовые.
Лечащий врач обязательно должен знать о проблемах с аппетитом. Тошнота, апатия, расстройства желудка не делают еду желанной. Но эти неприятные симптомы можно контролировать частым дробным питанием или с помощью препаратов. Если аппетита нет совсем, можно попробовать заменить твердую пищу калорийными напитками: молочными коктейлями, супами-пюре с добавлением протеиновых порошков. Алкогольные напитки разрешается употреблять не во всех случаях. Поэтому по этому вопросу лучше проконсультироваться с врачом.
Нельзя забывать и о воде, рекомендуемый суточный объем составляет 3 л.
Восстановление после курсов лучевой терапии
Усталость после лучевой терапии – это абсолютно закономерное состояние. Врачи считают, что она – результат работы организма над восстановлением. Стремление немного вздремнуть на протяжении всего дня вполне естественно, и такой отдых очень полезен. Причиной усталости в некоторых случаях может быть анемия (недостаточное количество эритроцитов в крови). В зависимости от тяжести состояния таким пациентам может быть назначено переливание крови.
При облучении области таза или живота пациенты еще некоторое время после лечения испытывают тошноту и страдают расстройством желудка. К счастью, сейчас врачи располагают большим количеством средств, которые помогают контролировать эти неприятные симптомы.
Облегчить проблемы с суставами и мышцами помогают регулярные упражнения. Есть также специальная программа для профилактики лимфатического отека.
Читайте также:

