Что такое реактивация вируса герпеса
Обновлено: 17.04.2024
Клиника и диагностика поражений вирусом простого герпеса при иммунодефиците
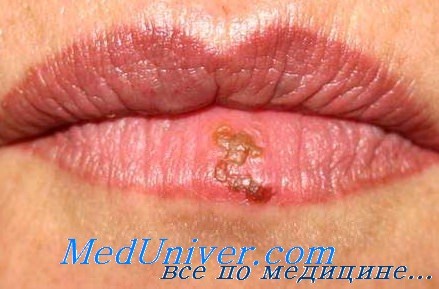
Поражение лица и ротоглотки наиболее типично для реактивации герпесвирусной инфекции. Морфология герпетических высыпаний зависит от типа пораженной эпителиальной ткани. На красной кайме губ и коже лица первичными элементами являются мелкие везикулы, которые возникают последовательно, имеют тенденцию к быстрому слиянию и формированию крупного вялого пузыря. Эти элементы умеренно болезненны, типично ощущение жжения.
После отторжения некротизированного эпителия обнажаются эрозированные кровоточащие поверхности, по краям которых появляются новые мелкие везикулы, и элемент начинает расти от центральной части к периферии.
Суперинфицирование элементов часто приводит к возникновению глубоких некрозов, заживающих с формированием рубца. Поражение лица вирусом герпеса следует дифференцировать от поражения зигомицетами (Absidia, Rhisopus, Mucor) и Aspergillus, которые вызывают тяжелые некрозы тканей лица, расплавление хрящей и костей лицевого скелета с быстрым обезображиванием внешнего облика пациента.
На слизистой оболочке рта наиболее типичным является возникновение нескольких одинаковых поверхностных некротических элементов диаметром 1—3 мм, которые затем углубляются и увеличиваются в размерах, часто сливаются. В самых тяжелых случаях значительная площадь полости рта поражена крайне болезненными глубокими некрозами серого цвета с кровоточащими участками эрозий.
В прошлом, до введения всеобщей профилактики ацикловиром, у больных после ТКМ герпетические поражения ротоглотки нередко становились причиной обструкции верхних дыхательных путей, в связи с чем возникала необходимость в протективной интубации трахеи.
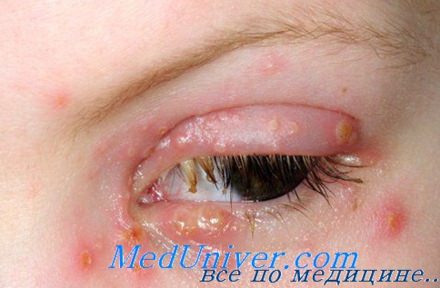
Герпетические элементы практически всегда суперинфицируются разнообразной оральной флорой: грибами рода Candida, стрептококками, фузобактериями и другими анаэробами, реже грамотрицательными бактериями, особенно стремительно в условиях нейтропении. Для практики полезно считать, что при нейтропении не бывает изолированных герпетических поражений полости рта, и стоматиты, объединяемые клиницистами под термином «герпетические», всегда являются результатом комбинированного вирусно-бактериально-грибкового поражения.
Стоматиты чаще всего возникают на фоне тяжелой нейтропении, обратное развитие претерпевают только по выходе из агранулоцитоза, полностью регрессируя через 5—12 дней после нормализации числа гранулоцитов. Заживление элементов всегда происходит от краев к центру — симптом «высыхающей лужи».
Процесс заживления глубоких некрозов часто проходит стадию отторжения фибриновых пленок с обнажением ригидных сосудов десен, что может быть чревато значительной кровопотерей, особенно у детей младшего возраста. Мы наблюдали кровотечения из язв на деснах в объеме до 400 мл в сутки. Кроме того, заживление язв нередко сопровождается обильной саливацией: потерей до 700—900 мл слюны в сутки, что может стать причиной обезвоживания у детей.
Знание закономерностей развития герпетического стоматита позволяет сделать вывод, что при нейтропении лечение его нельзя ограничивать ацикловиром: необходимо назначать препараты, активные в отношении стрептококков, анаэробов, грамотрицательной флоры и грибов. Монотерапии, отвечающей таким требованиям, не существует, поэтому при фебрильной нейтропении, сопровождающейся стоматитом, мы наряду с ацикловиром всегда используем бета-лактам с расширенным спектром антианаэробной активности (пиперациллин/тазобактам, имипенем, амоксициллин/клавуланат) либо к другим бета-лактамам добавляем метронидазол.
Часто драматического улучшения удается добиться при использовании клиндамицина или пенициллина. Кроме того, мы рекомендуем и сами всегда используем системную противогрибковую терапию.
Поражение вирусом простого герпеса пищевода
При распространении инфекции из полости ротоглотки поражается верхний сегмент пищевода. Другой путь — контаминация инфицированной герпес-вирусом слюной эрозированного (в результате желудочно-пищеводного рефлюкса или рвоты) пищевода. В этом случае поражается нижний сегмент пищевода. Клиническая картина среднего и дистального эзофагита очень типична: больные жалуются на ощущение кома за грудиной, сильное жжение и боли, которые значительно усиливаются после глотания и рвоты.
Следует отметить, что последняя локализация — одно из самых опасных проявлений герпесвирусной инфекции, поскольку именно дистальный эзофагит служит воротами для развития инвазивных бактериальных и грибковых инфекций. По морфологической картине (язвенно-некротические элементы, захватывающие все слои пищевода) отличить герпетическое поражение от цитомегаловирусного, бактериального или грибкового не представляется возможным. Без проведения биопсии установить точный микробиологический диагноз невозможно.
Если принято решение выполнить эзофагоскопию и биопсию, то для диагностики герпес-вирусного поражения необходимо получить биоптат эпителия края язвы, а для диагностики ЦМВ-поражения — ее дна. Это связано с тем, что герпес-вирус поражает эпителий, а цитомегаловирус — строму.
При герпетическом эзофагите, как и при герпетическом стоматите, особенно больным с фебрильной нейтропенией, наряду с ацикловиром всегда следует назначать антимикотик системного действия (амфотерицин В внутривенно в дозе 0,3—0,5 мг/кг в сутки, флюконазол внутривенно или внутрь, возможно вориконазол и итраконазол) и системные антибиотики, обладающие антианаэробной активностью.
Важную роль играют антацидная и антирефлюксная (ранитидин или омепразол, дофаминовые антагонисты) терапия и адекватное обезболивание наркотиками.
Поражение бронхиального дерева и легких вирусом простого герпеса
Чаще всего герпетический трахеобронхит развивается у иммунокомпрометированных больных с герпетическим эзофагитом, которые интубированы и находятся на искусственной вентиляции легких. Наблюдаются также фокальные герпетические пневмонии. Диффузные пневмонии с развитием дыхательной недостаточности, напротив, являются следствием диссеминированной герпетической инфекции у больных с глубоким дефицитом клеточного или гуморального иммунитета.
Поражение вирусом простого герпеса центральной нервной системы
Герпетический энцефалит — очень редкое проявление реактивации герпесвирусной инфекции у онкогематологических больных. Он не отличается от энцефалита у иммунокомпетентного хозяина, т. е. характеризуется энцефалитическим синдромом и признаками воспаления и некроза на компьютерных и ядерно-магнитных томограммах. Поражение спинного мозга вирусом герпеса является казуистикой. Описаны случаи восходящего поперечного миелита.
Диагностика поражений вируса простого герпеса
Известно несколько методов быстрой и специфической диагностики герпесвирусной инфекции. Классическим методом является выделение вируса, основанное на его цитопатическом действии на чувствительные культуры клеток млекопитающих. Этот метод достаточно быстрый (90 % позитивных результатов в первые 3 дня, 100% —в первые 7 дней культивирования) и весьма специфичный.
Существует более быстрый метод (комбинация иммуноферментного и культурального методов), которым выявляют наличие вирусных антигенов в чувствительной клеточной культуре, зараженной исследуемым материалом. Этот метод аналогичен описанному ранее методу shell vial для ЦМВ и позволяет получить результаты в течение суток.
Следует отметить, что, как и при ЦМВ-инфекции, серологические данные (наличие специфического IgM или повышение титра IgG) и выделение вируса простого герпеса со слюной не несут полезной оперативной информации. Особенно важно это при диагностике герпесвирусного энцефалита. Нам доводилось наблюдать неадекватную интерпретацию серологических тестов у больных с энцефалитическим синдромом и необоснованное назначение ацикловира в высоких дозах. Единственным надежным методом диагностики является проведение биопсии ткани головного мозга и вирусологического исследования.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
ГОУ ДПО Российская медицинская академия последипломного образования
ГОУ ДПО Российская медицинская академия последипломного образования, Москва
ФГБУ "Учебно-научный медицинский центр Управления делами Президента РФ"
Герпетическая инфекция: механизмы латентности и реактивации. Возможности управления
Журнал: Клиническая дерматология и венерология. 2014;12(1): 75‑80
Касихина Е.И., Глазко И.И., Чекмарев А.С. Герпетическая инфекция: механизмы латентности и реактивации. Возможности управления. Клиническая дерматология и венерология. 2014;12(1):75‑80.
Kasikhina EI, Glazko II, Chekmarev AS. Herpetic infection: mechanisms of latency and reactivation. Potential to control the infection. Klinicheskaya Dermatologiya i Venerologiya. 2014;12(1):75‑80. (In Russ.).
ГОУ ДПО Российская медицинская академия последипломного образования
Проанализированы возможные механизмы регуляции латентного состояния и ограничения реактивации герпес-вирусов. Описаны взаимоотношения между герпес-вирусами и иммунной системой хозяина. Факторы, способствующие поддержанию латентной инфекции и реактивации вирусной репликации, активно обсуждаются. Одной из стратегий контроля за вирусной репликацией является применение ациклических нуклеозидов, в том числе валацикловира. Под наблюдением находились 10 женщин с рецидивирующим генитальным герпесом с явлениями стойкого генитального зуда. При применении комплексной противовирусной терапии с включением препаратов Вирдел (валацикловир) и Лавомакс (тилорона гидрохлорид) в течение 12 нед клинический эффект (отсутствие зуда) достигнут у 8 пациенток.
ГОУ ДПО Российская медицинская академия последипломного образования
ГОУ ДПО Российская медицинская академия последипломного образования, Москва
ФГБУ "Учебно-научный медицинский центр Управления делами Президента РФ"
В настоящее время для специалистов, занимающихся проблемами терапии инфекционных заболеваний, актуальными являются проблемы, связанные с персистенцией герпес-вирусных инфекций (ГВИ). Объясняется это широким распространением этой группы вирусов в человеческой популяции, несовершенством диагностики и неоднозначностью интерпретации лабораторных данных, внутриклеточной персистенцией возбудителей и их участием в процессах иммуногенеза.
Существуют разные формы взаимодействия ГВИ с организмом хозяина - острого периода с развитием характерных проявлений и последующим развитием инаппарантной (латентной) формы, отражающей хрупкий баланс между репликацией вируса и иммунным ответом хозяина. Механизмы, определяющие переход из острой фазы инфекции, когда вирус (вирус простого герпеса 1-го и 2-го типов - ВПГ-1, ВПГ-2, ВВЗ) не удается обнаружить в гомогенатах ганглия, пока не выяснены. Становление латентной инфекции связано со структурными изменениями в вирусном геноме: в регионарных сенсорных ганглиях вирусная ДНК сохраняется в виде эписом и только один ген транскрибируется постоянно. Это принципиально важное положение было установлено методами рестрикционного анализа и блоттинг-гибридизации и меченными 32Р вирусными ДНК при сравнении вирионной ДНК эталонного ВПГ-1. Уровень реактивации зависит, скорее всего, от количества латентных форм вирусных ДНК, находящихся в ганглиях, а также типоспецифических последовательностей в геноме вируса, которые определяют частоту реактивации и рецидивов в конкретной анатомической области [1]. У инфицированных серопозитивных лиц контроль над вирусной реактивацией осуществляется с помощью пожизненно присутствующих противогерпетических гаплотипоспецифических антител IgG и цитотоксических Т-лимфоцитов 3. Считается, что уровень вируснейтрализующих антител у практически здоровых лиц - величина довольно устойчивая, однако при нарушении стабильности в иммунной системе и вирусной реактивации при серологических исследованиях определяется повышение титров IgG. Примером является возрастзависимое снижение клеточного иммунитета, ассоциируемое с повышением специфических антител к ВПГ, цитомегаловирусной инфекции (ЦМВИ) и вирусу Эпштейна-Барр (ВЭБ) [5, 6]. Кроме того, данные клинико-лабораторных исследований реактивации ГВИ у пожилых людей показали, что рост титра специфических антител сопровождался значительным усилением транскрипции вирусного гена и количественным увеличением вирусной ДНК. При аналогичном исследовании образцов, полученных от молодых пациентов, уровни показателей вирусной активности и специфических антител были значительно ниже, чем у пожилых лиц [7, 8]. Изменение функции цитотоксических CD8 + Т-лимфоцитов может происходить на фоне эмоционального стресса, следствием которого являются репликация вируса и повышение уровня специфических антител [9, 10]. При обследовании астронавтов выявлены повышенные показатели транскрипции вирусного гена, вирусной нагрузки и усиление синтеза противогерпетических антител как результат стресса на космический полет [11, 12]. Как физический, так и психический стресс оказывают влияние на активность CD8 + T-лимфоцитов через высвобождение нейроэндокринных пептидов, а данный механизм может быть связующим звеном, контролирующим реактивацию латентной ВПГ-инфекции в симпатической нервной системе [13].
В настоящее время неизвестно является ли дисрегуляция Т-клеточного иммунитета ключевым моментом взаимоотношения герпетической инфекции и хозяина или могут играть роль иные процессы. Например, любой воспалительный неспецифический процесс, являющийся результатом клеточного стресса - реактивация ЦМВ, инфекция бактериальной этиологии, травма (операция, гипоксия и др.), приводит к активизации гипоталамо-гипофизарно-надпочечниковой системы и, как следствие, репликации ВПГ и появлению симптомов жжения и зуда [14, 15].
Герпес-вирусы рассматриваются как пожизненная инфекция. Для реализации этой цели ими используются разные механизмы манипуляции иммунными механизмами хозяина. Один из типичных примеров - молекулярная мимикрия: кодировка вирусами соответствующих клеточных интерлейкинов, хемокинов или хемокиновых рецепторов [16]. Другая стратегия уклонения от иммунной защиты хозяина осуществляется путем встраивания вирусного антигена в главный комплекс гистосовместимости инфицированных клеток [17]. Герпес-вирусы супрессируют или полностью ингибируют активность молекул I и II классов HLA-системы. Так, кодирование ВЭБ гена BNLF2a ослабляет антигенную презентацию и, следовательно, узнавание CD8 + T-лимфоцитами новых инфицированных клеток [18].
Длительное бессимптомное течение характерно и для ЦМВИ, к которой в настоящее время проявляется живой научный интерес. Источником ЦМВИ является человек, который может инфицироваться в разные периоды жизни. Так, если в возрасте 9 лет приблизительно 36% лиц ЦМВ-серопозитивны, то к 40 годам их число приближается к 60% [19]. Согласно данным литературы [20], женщины наиболее подвержены заражению ЦМВ, при этом процент инфицированных может варьировать от 45 до 100% и зависит от региона, расовой принадлежности и социально-экономического статуса. Иммунопатологические реакции при ЦМВИ весьма разнообразны и во многом определяют течение и исход инфекции. ЦМВ влияет на спектр экспрессии клеточных белков и цитокинов, что позволяет ему оказывать общее иммуносупрессивное воздействие на весь организм. При активной репликации вируса в клетках экспрессия генов ЦМВ вызывает нарушение транспорта и быстрое разрушение HLA-1, тем самым затрудняя презентацию антигена. Снижение активности Т-клеточного пула, в первую очередь цитотоксических СD8 + Т-лимфоцитов, приводит к подавлению нормального иммунного ответа хозяина на антигенный вызов не только ЦМВ, но и других представителей герпес-группы 23. Так, N. Khan и соавт. [22] показано, что Т-клеточный ответ на ВЭБ был существенно хуже у субъектов, инфицированных ЦМВИ. Кроме того, антигенспецифические CD8 + Т-лимфоциты могут продуцировать фактор некроза опухоли-α (ФНО-α) и γ-интерферон (γ-ИФН), способствующие развитию персистенции ЦМВ в макрофагах [24]. Результаты проведенных в последние годы исследований свидетельствуют о том, что реактивация латентной ЦМВИ может ухудшать состояние здоровья в пожилом возрасте [8, 25]. В работах P. Trzonkowski и A. Wikby и соавт. 26 выявлено, что повышение титра антител у пожилых людей к ЦМВ может быть напрямую связано с увеличением продукции цитокинов интерлейкина-6 (ИЛ-6) и ФНО-α. Высокий уровень специфических антител к ЦМВ также был ассоциирован с повышением уровня С-реактивного белка и поражением коронарных артерий [25]. ЦМВ и в большей степени ВЭБ причастны к развитию нарушений коронарного кровотока [29]. В работах последних 10 лет выявлено, что ВПГ-1 и ЦМВ ассоциированы с болезнью Альцгеймера у пожилых людей с нарушениями коронарного кровотока, а также развитием цереброваскулярного атеросклероза и метаболических нарушений 32. A. Aiello и соавт. [33] подтверждена роль латентной ЦМВИ как предиктора когнитивных нарушений наряду с такими факторами, как возраст, образование и состояние здоровья.
Представители герпес-группы не только ухудшают качество жизни, но и серьезно вмешиваются в функционирование репродуктивной системы мужчин и женщин. Сочетанную инфекцию ВПГ-1, ВПГ-2 и ЦМВ рассматривают как один из этиологических факторов хронических вульвовагинитов, цервицитов, эндометритов 34. ГВИ способствуют формированию аутопроцессов в органах малого таза (эндометриоз, хронический эндометрит) [37]. В присутствии ВПГ-2 увеличивается вероятность развития диспластических процессов в многослойном плоском эпителии с формированием внутриэпителиальной цервикальной неоплазии [38].
Асимптоматическое течение чаще характерно для мужчин и людей, имеющих антитела к ВПГ-1. Это может указывать на тот факт, что предшествующее инфицирование ВПГ-1 может снижать вероятность развития симптоматических форм инфекции ВПГ-2. Считается, что в 70% случаев передачи ВПГ-2 связаны с заражением и реактивацией вируса при асимптоматических и субклинических формах заболевания [1]. Одним из вариантов течения генитальной герпетической инфекции у женщин является бессимптомное выделение вируса (ЦМВ, ВПГ-1, ВПГ-2), чередующееся с появлением минимальных клинических проявлений в виде симптомов упорного зуда и раздражения в области наружных половых органов. В настоящее время нет единых трактовки патогенеза и тактики терапии для купирования зуда и жжения, возникающего при вирусном микстинфицировании гениталий.
Лечение больных с рецидивирующим герпесом включает использование аналогов нуклеозидов, в том числе валацикловира в эпизодическом и превентивном (супрессивном) режиме. Эпизодическая терапия подразумевает пероральный прием препарата в момент обострения инфекции. Для большинства больных с частыми рецидивами превентивная профилактическая терапия более целесообразна, чем эпизодическое лечение. Ежедневный прием в непрерывном режиме иногда в течение нескольких лет предусматривает применение валацикловира в связи с самой удобной схемой дозирования. На фоне лечения валацикловиром предотвращаются рецидивы инфекции, вызываемой ВПГ, или задерживается их возникновение на 71-85% (анализ соотношения опасностей) по сравнению с плацебо 39. Валацикловир традиционно используется в мировой практике для лечения инфекций, вызванных ВПГ, ВВЗ и профилактики ЦМВИ, в том числе у иммуносупрессированных лиц [44, 45]. В 2013 г. на отечественном рынке появился новый препарат валацикловира - Вирдел таблетки 500 мг компании STADA. Анализ эффективности супрессивной терапии валацикловиром, проведенный О.И. Летяевой и соавт. [42], показал улучшение иммунологических показателей у 87,5% женщин с хронической рецидивирующей герпетической инфекцией.
Нами были обследованы 10 женщин 27-35 лет с жалобами на жжение и зуд в области гениталий. Большинство пациенток первоначально расценивали данную симптоматику как проявления аллергического контактного дерматита и безуспешно применяли топические глюкокортикостероидные средства. Кроме того, 80% женщин предъявляли жалобы на слабость, головную боль, быструю утомляемость. В анамнезе у 3 пациенток были привычное невынашивание беременности и циститы, у 50% - бактериальный вагиноз, у 1 - эндометриоз, у 2 - остроконечные кондиломы перианальной области.
В комплекс обследования, помимо клинических методов, входило выявление ДНК ВПГ-1 и ВПГ-2, ЦМВИ и вирус папилломы человека (ВПЧ) с помощью полимеразной цепной реакции. В начале исследования 2 раза с интервалом в 2-3 нед с помощью иммуноферментного анализа определяли титр специфических антител. Также проводили микробиологическое исследование на наличие гонореи и трихомонад, диагностику папилломавирусной, микоплазменной и хламидийной инфекций согласно методическим рекомендациям МЗ РФ «Стандартизация медицинской помощи больным гонококковой инфекцией (Приказ №176 от 28.02.05) и Положению МЗ РФ «О мерах по предупреждению распространения заболеваний, передающихся половым путем» (Приказ №291 от 30.07.01). При определении генома вирусов коинфекция ВПГ-1 и ЦМВИ была выявлена у половины обследованных женщин, ВПГ-2 и ВПЧ-16 - у 2 пациенток, моноинфекция ВПГ-2 - у 3. Антитела к ВПГ-2 не были обнаружены у 2 пациенток, при этом интенсивность зуда и тенденция к регрессу на фоне терапии были более выражены у серонегативных, чем у серопозитивных пациенток, что свидетельствует о протективной роли Ig, приводящих к частичной инактивации вирусов [9].
Лечение включало комбинированное использование химиопрепаратов с разыми механизмами противовирусного действия: валацикловир (Вирдел) по 500 мг ежедневно в течение 12 нед и тилорон (Лавомакс 125 мг), согласно рекомендуемой схеме по 1 таблетке первые 2 сут, затем через 1 сут, на курс 20 таблеток. Комплексная терапия также включала препараты магния, растительные адаптогены и интравагинальное применение вагинальных суппозиториев, содержащих фиксированную комбинацию хлоргексидина и декспантенола (Депантол) в течение 10 сут во II фазу менструального цикла в течение 3 циклов.
Применение Лавомакса в сочетании с аналогами нуклеозидов (валацикловиром) позволяет комплексно решать вопросы терапии вирусных микстинфекций, особенно при планировании беременности, невынашивании беременности и обнаружении в крови аутоиммунных маркеров (волчаночного антикоагулянта, антител к хорионическому гонадотропину, антикардиолипиновых и антифосфолипидных антител) [43]. Сочетанное применение противовирусных химиопрепаратов и тилорона обеспечивает аддитивный или синергидный эффект, позволяет воздействовать на патогенетическую основу рецидивирования герпетической инфекции (ВПГ-1, ВПГ-2, ЦМВИ) и обеспечить снижение дозы противовирусного химиопрепарата, уменьшает вероятность возникновения устойчивых к аномальным нуклеозидам штаммов вирусов [44, 45]. Терапевтическая активность тилорона (Лавомакса) достаточно хорошо изучена и связана не только с индукцией продукции ИФН 1-го и 2-го типа, но и с модуляцией выработки других цитокинов (ИЛ-6, ИЛ-12, ФНО-α), приводящих к смещению баланса в системе «повреждение/ответ» в благоприятную для организма зону, в которой выраженность защитных реакций организма обеспечивает контроль над инфекционным процессом, но при этом предотвращает значительное эндогенное повреждение организма [46, 47].
Выводы
Деликатный баланс между латентностью и реактивацией - уникальное достижение эволюции.
У хозяина с нормальным иммунным ответом на присутствие вируса в организме формируются продолжительные взаимоотношения без волнообразного течения процесса. Тем не менее средовые провоцирующие факторы, нарушающие этот баланс, или любая причина, приводящая к иммуносупрессии, обусловливают развитие обострения вирусного заболевания.
Учитывая иммуносупрессивные свойства герпес-вирусов, экспансию штаммов, резистентных к противовирусным препаратам и ускользающих от адаптивных иммунных механизмов хозяина, а также высокую частоту встречаемости вирусных микстинфекций, актуальным становится поиск новых направлений терапии и профилактики герпетических инфекций. В этом отношнии комбинация Вирдела (валацикловир) и Лавомакса (тилорон) представляется средством выбора для достижения и контроля латентной формы заболевания.
Все больше пациентов с постковидным синдромом настаивают на изучении причин, по которым проявляются долгосрочные симптомы заболевания. Они считают, что тому виной «спящие» вирусы, которые были реактивированы коронавирусом.
От 10 % до 30 % всех пациентов с Covid-19 страдают от симптомов, которые появляются через несколько недель и даже месяцев после заражения. К ним относятся в том числе молодые, ранее здоровые люди, у которых заболевание Covid-19 проходило без осложнений. Симптомы могут включать когнитивные нарушения, утомляемость, одышку, учащенное сердцебиение и непереносимость физических и умственных нагрузок.
Чиновники здравоохранения по всему миру пытаются выяснить, что вызывает такие долгосрочные симптомы. Национальные институты здравоохранения США представили крупную инициативу по изучению постковидного синдрома при финансовой поддержке в размере 1,15 миллиарда долларов. Тем не менее ученые по-прежнему очень мало знают о причинах этого состояния, а методов лечения предлагают еще меньше.
У большинства людей — независимо от того, переболели они Covid-19 или нет, — в организме есть «спящие», обычно безвредные вирусы, которыми они заразились годами ранее. Среди наиболее распространенных — герпесовирусы. А именно вирус Эпштейна-Барра (ВЭБ), который вызывает мононуклеоз, а также вирус герпеса 6 типа (ВПГ-6), приводящий к 6 наиболее распространенным детским болезням, вирусы простого герпеса (ВПГ-1) и опоясывающий лишай. Такие вирусы могут время от времени реактивироваться в результате стресса, включая инфекции.
Некоторые пациенты с постковидным синдромом и правозащитные организации призывают врачей проводить исследования на реактивированные вирусы. По их словам, при существующем небольшом количестве вариантов лечения постковидного синдрома имеет смысл посмотреть, могут ли противовирусные препараты от герпеса облегчить симптомы. Некоторые врачи говорят, что это стоит дополнительных анализов и дальнейшего изучения. Другие утверждают, что анализы трудно интерпретировать и что даже если латентный вирус реактивируется, неясно, вызывает ли он постковидный синдром.
Авторы исследовании, опубликованного в июне медицинском журнале Pathogens, предположили, что существует связь между реактивацией Эпштейна-Барра и постковидным синдромом. Исследователи обнаружили, что в группе из 30 пациентов с постковидным синдромом примерно у 67 % были положительные тесты на реактивацию ВЭБ. Исследователи проверили реактивацию на основе количества антител, которые, по их словам, связаны с активной или реактивированной инфекцией ВЭБ.
Дэвид Херли, молекулярный микробиолог, изучающий реактивацию вируса Эпштейна-Барра и являющийся соавтором данного исследования, говорит, что латентный ВЭБ может реактивироваться под воздействием стресса. Некоторые люди испытывают усталость, «туман в голове» и другие симптомы, о которых также часто сообщают пациенты с постковидным синдромом, сообщает доктор Херли. У некоторых людей симптомы длятся всего несколько дней, но у других они могут тянуться месяцами и даже дольше, добавляет он.
Нормальная, здоровая иммунная система может держать скрытые вирусы под контролем. Но Covid-19 «дает возможность потерять этот контроль», говорит Эми Проал, микробиолог из PolyBio Research Foundation, которая была первым автором недавней обзорной статьи в журнале Frontiers in Microbiology, в которой изучается, как реактивированные вирусы могут способствовать развитию «постковидного синдрома».
Врачи не проводят тесты на реактивированные вирусы у пациентов с постковидным синдромом на регулярной основе. Лабораторные тесты, покрываемые страховкой и доступные для большинства пациентов, не так точны, как те, которые используют исследователи для тестирования вирусной ДНК, поэтому они вряд ли покажут столько реактиваций, говорит Сьюзен Левин, доктор в центре, изучающем синдром хронической усталости при школе общественного здравоохранения Колумбийского университета и в Корнелльском центре лечения заболеваний нейроиммунной системы.
Доктор Левин лечит около 200 пациентов с постковидным синдромом и проверяет их на реактивированные вирусы, но часто использует дополнительные тесты для подтверждения. Она утверждает, что около 80 % пациентов имеют подтверждение реактивации ВЭБ и небольшой процент также получает положительный результат для реактивированного случая ВПГ-6.
По словам врача, трудно определить, насколько реактивация вирусов способствует развитию постковидного синдрома у пациентов, но она считает, что это играет важную роль.

Лорен Николс — 33-летняя жительница Бостона и добровольный член исполнительного совета Body Politic, где есть группа поддержки людей, перенесших Covid-19 в Slack, насчитывающая более 17 000 участников. Группа настаивает на более «агрессивном» тестировании реактивированных вирусов. Миссис Николс заразилась Covid-19 в марте 2020 года и говорит, что у нее наблюдаются долгосрочные симптомы коронавируса, в том числе усталость и «мозговой туман». По ее словам, в сентябре лабораторные тесты показали высокий уровень ВЭБ, и она начала принимать противовирусные препараты, которые обычно используются для лечения герпетических инфекций. Она считает, что это помогло ей избавиться от утомляемости и «тумана в голове».
«Не существует лечения долгосрочных симптомов ковида, но есть методы лечения этих вирусных заболеваний, которые реактивируются у некоторых из нас, — говорит миссис Николс. — Сейчас на самом деле речь идет о том, чтобы научиться управлять симптомами, чтобы мы могли хоть как-то функционировать».
Потенциальная роль реактивированных вирусов заслуживает изучения, говорит Тимоти Хенрич, профессор медицины Калифорнийского университета в Сан-Франциско, который участвует в исследовании, проводящемся у пациентов с постковидным синдромом. «Мы планируем включить это в наше исследование», — сообщил доктор Хенрич.
Доктор Хенрих уверен, что то, что скрытые вирусы реактивируются вирусом Covid-19, неудивительно. По его словам, вопрос в том, вызывает ли эта реактивация постковидный синдром.
По словам Хенриха, реактивированные вирусы у пациентов с ослабленным иммунитетом могут вызывать симптомы и заболевания, которые поддаются лечению. Но у многих людей могут быть временные, но обнаруживаемые уровни вируса герпеса человека, не вызывающие симптомов. Роль ВЭБ при миалгическом энцефаломиелите / синдроме хронической усталости (МЭ / СХУ) является предметом продолжающихся дискуссий в медицинском сообществе.
Некоторые исследования показали реактивацию ВЭБ у таких пациентов, но это не обязательно доказывает, что она вызывает симптомы «долгосрочного коронавируса», отмечает доктор Хенрих.
Бенджамин Абрамофф, доцент кафедры физической медицины и реабилитации Пенсильванского университета, который принимает пациентов в Клинике оценки и восстановления после коронавируса, говорит, что хотя пациенты иногда поднимают вопрос о реактивации, они не тестируют пациентов дополнительно. «Учитывая, что у них наблюдаются и другие болезни, мы не думаем, что это, вероятно, причина долгосрочных симптомов»,—- говорит доктор Абрамофф.
Патрик Смит, 37-летний инвестиционный консультант из Денвера, в апреле этого года получил положительный результат на Covid-19. Он был госпитализирован с тяжелой пневмонией на четыре дня. Он продолжал испытывать долгосрочные симптомы, в том числе «мозговой туман» и усталость. Он побывал в трех больничных клиниках, занимающихся Covid-19, и посетил врача интегративной медицины в Боулдере. Врач Пьер Бруншвиг проверил его на реактивированные ВЭБ и ВГЧ-6 и сообщил, что тесты были положительными.
Доктор Бруншвиг говорит, что он проверяет всех пациентов с Covid-19, которых видит, на наличие реактивированных вирусов герпеса. «Иммунная система истощена и отвлечена. Это предоставляет возможность для реактивации», — говорит он.
Все восемь различных видов вирусов герпеса могут встречаться у человека. Характерной особенностью этих вирусов является их внедрение после эпизода острой инфекции. Затем, при определенных условиях, вирус «просыпается» из фазы покоя, реплицируется и начинает атаковать клетки организма-хозяина. Такая активация зачастую ассоциирована с симптомами простуды или опоясывающего лишая.
В ходе эволюции вирусы герпеса приобрели важное свойство использования микроРНК по репрограммированию клеток хозяина. Немецким ученым из Баварии впервые удалось показать, как вирусная микроРНК действует в процессе реактивации вируса. Работа опубликована в журнале Nature и демонстрирует прежде неизвестный клеточный механизм вируса герпеса 6 (HHV6).
"Лечащий врач" осваивает новые пространства и форматы. Вся актуальная информация (и даже больше) – в нашем телеграм канале. Подписывайтесь!
Более 90% людей, инфицированных HHV6, не знают о его существовании, поскольку вирус вызывает проблемы только после «пробуждения». Реактивация вируса может быть связана с повреждением функций сердца, реакцией отторжения трансплантата, а также выступать триггером рассеянного склероза или синдрома хронической усталости. Некоторые данные даже указывают на роль в развитии шизофрении, биполярного расстройства и других заболеваний нервной системы.
Вопрос реактивации вируса является ключевым в этой проблеме, а понимание этих процессов может позволить должным образом их регулировать.
Регуляторная микроРНК, miR-aU14, является частью вируса герпеса HHV6. Ее экспрессия сопровождается нарушением метаболизма микроРНК клеток человека, в частности, формирования молекул семейства miR-30. Отсутствие этих микроРНК приводит к запуску сигнального пути miR-30 / p53 / Drp1. Указанный сигнальный путь приводит к повреждению митохондриального аппарата, основной системы органелл, ответственной за выработку энергии, а также за сигналинг противовирусных защитных функций. Таким образом вирусная miR-aU14 нарушает продукцию интерферонов 1 типа – важного элемента иммунной реакции на вирусную инвазию. В отсутствии интерферонов вирусу герпеса удается перейти из фазы покоя в активную фазу.
В дальнейшем авторы исследования намерены улучшить понимание механизмов, благодаря которым микроРНК запускает реактивацию вируса. Это откроет путь к разработке терапевтических превентивных методов, направленных на предотвращение реактивации вируса или, наоборот, к его намеренной дефектной активации для последующей элиминации.
Лечение поражений вирусом простого герпеса. Профилактика реактивации вируса
На практике противогерпетическую терапию назначают на основании только клинических данных. Против этого подхода трудно возражать, ибо в большинстве случаев герпетические поражения можно с достаточной уверенностью диагностировать по внешним проявлениям.
Как мы уже подчеркивали, в условиях нейтропении герпетические поражения всегда суперинфицируются нормальными комменсалами покровов. Этот факт следует учитывать при назначении терапии.
«Золотым стандартом» лечения собственно поражений, вызываемых вирусом простого герпеса, является ацикловир. Его рекомендуется применять при всех клинически значимых проявлениях герпетической инфекции у гематологических больных. Подобно ганцикловиру, ацикловир требует активации в форме фосфорилирования вирусной тимидинкина-зой, после которой он приобретает свойство ингибировать вирусную ДНК-полимеразу.
Вследствие высокой специфичности в отношении вирусной тимидинкиназы ацикловир в отличие от ганцикловира не токсичен для клеток млекопитающих. При тяжелых поражениях (эзофагиты, распространенные стоматиты, экзема Капоши и т. д.) ацикловир следует вводить внутривенно, поскольку биодоступность препарата невысока и, главное, весьма вариабельна (10— 50 %).
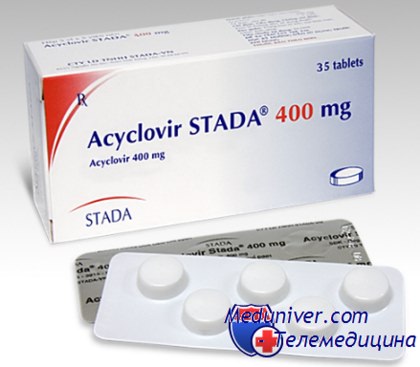
Доза ацикловира составляет 250 мг/м2 каждые 8 ч, время инфузии — не менее 1 ч при адекватной гидратации вследствие опасности острой почечной недостаточности при быстром введении. Больным герпетическим энцефалитом дозу удваивают.
При нетяжелых проявлениях герпесвирусной инфекции ацикловир можно назначать внутрь, но возможность точной дозировки ограничена. В разных источниках рекомендуется доза 250—400 мг/м2 на прием каждые 6—8 ч.
В последние годы коммерциализованы аналоги ацикловира (фамцикловир, пенцикловир, валацикловир), которые обладают предсказуемой фармакокинетикой и при приеме внутрь более надежны, чем ацикловир. Фамцикловир назначают в дозе 250— 500 мг 3 раза в сутки, валацикловир — по 500—1000 мг 3 раза в сутки.
Высокой активностью в отношении вируса простого герпеса обладает также натрия фосфоноформат. Его применяют при резистентности к ацикловиру в дозе 40 мг/кг на одно введение каждые 8 ч или 60 мг/кг каждые 12 ч.
Необходимо упомянуть, что в последние несколько лет в России неожиданно получила популярность ничем не обоснованная практика введения иммуноглобулина при герпетической инфекции. Эффективность терапии герпеса иммуноглобулином никогда не оценивалась и рутинно не показана. В связи с высокой стоимостью препарата его назначают только при тяжелой гипоиммуноглобулинемии (уровень IgG ниже 5000 мг/л).

Профилактика реактивации герпесвирусной инфекции
С учетом дороговизны ацикловира и его аналогов профилактику проводят только при высоком риске развития тяжелых герпетических поражений. К группе риска относятся прежде всего пациенты после трансплантации костного мозга (профилактику начинают за сутки до проведения кондиционирования) и солидных органов, больные СПИДом и с врожденными иммунодефицитами.
Кроме того, следует подумать о необходимости профилактики у больных, которым планируется интенсивная цитотоксическая и иммуносупрессивная терапия, если ранее у них отмечались клинически значимые эпизоды реактивации герпесвирусной инфекции.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

