Что такое лучевое поражение кожи
Обновлено: 24.04.2024
Кожа при общем лучевом воздействии. Заживление лучевых ожогов
Что касается поражения кожи при общем воздействии излучении с большой энергией (гамма-лучи, быстрые нейтроны), то возникновение в таких случаях грубых некробиотических и деструктивных изменений в подкожной клетчатке и скелетных мышцах препятствует формированию оптимальных условий для эпителизацпи и развития грануляционной ткани.
Как было установлено В. В. Шиходыровым (1958, 1960), даже при равномерном облучении рентгеновскими лучами в минимальной смертельной дозе происходит длительное угнетение пролиферации и дифференцировки фибробластов, и тем самым нарушается образование полноценной соединительной ткани.
Особенно неблагоприятные условия для рубцевания и эпителизации создаются при неравномерном гамма-нейтронном или нейтронном облучении в зонах наибольшего непосредственного воздействия излучения. В таких местах, как указывалось выше, наступает полная гибель мягких тканей по типу восковидного некроза, и таким образом полностью исключается трофическая связь вновь, образованного эпителия с подлежащими тканями.
Тем не менее, несмотря на прогрессирование местных структурных изменений и общее глубокое подавление репарационных процессов в облученном организме, пролиферация эпителия по краям некротически-язвенных дефектов кожи начинается уже в период разгара лучевого заболевания. Макроскопически это проявляется в виде возникновения отдельных небольших белесоватых бляшек и валиков по краям язвенного дефекта из вновь образованного эпителия.

Кроме специфических моментов, связанных с особенностями действия того или иного вида ионизирующих излучений и условиями их воздействия, исход лучевых поражений кожи в такой же мере зависит и от общих причин, определяющих заживление кожных дефектов любого происхождения. В частности, немаловажное значение имеют размеры пораженной поверхности тела, как в отношении общего токсического воздействия, так и возможности репарации.
Разбирая вопросы заживления лучевых поражений кожи, нельзя не упомянуть о развитии келоидов в исходе заживления комбинированных ожогов у пострадавших во время взрывов атомных бомб. Как известно, в таких случаях имело место сочетание воздействия на мягкие ткани лучистой энергии, световой вспышки и термического фактора. Через 6 мес после взрыва ожоги зажили у 94% пораженных людей, а спустя 10 мес и позже на месте ожогов образовались келоиды, причем больше всего их возникло у молодых людей [Tsuxuki M., 1956; Ilarda .Т., 1960].
В свое время были высказаны различные мнения о причине образования келоидов. Очевидно, что данную особенность нельзя считать характерной для лучевых ожогов. Достаточно напомнить об образовании обезображивающих рубцов на месте обширных термических ожогов кожи у танкистов или летчиков, полученных в горящих танках или самолетах в Великую Отечественную войну. Вероятнее всего, образование келоидов у пострадавших при атомных взрывах обусловлено длительным течением местного воспалительного процесса, присоединением инфекции, особенностями воспалительной реакции и развития грануляционной ткани в условиях лучевой болезни, неправильным лечением пострадавших.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Введение
Материал и методы
В Центре накоплена информация о 232 больных с МЛП, которые находились на лечении в этом учреждении в остром периоде лучевого поражения, а также наблюдались в отдаленные сроки после радиационной аварии. Длительность наблюдения колебалась от 1 до 43,5 (в среднем 13,3 ± 1,3) лет. Периодом отдаленных последствий считался период, начинавшийся спустя 1 год после лучевого воздействия. 75 человек пострадали в результате воздействия гамма‑ бета‑излучения, 99 – от гамма‑излучения, 16 – от гамма‑нейтронного, 18 – от рентгеновского, 12 – от бета‑излучения, 8 – от воздействия пучка электронов, 4 – от воздействия пучка протонов.
МЛП I (легкой) степени тяжести выявлены у 74 больных, МЛП II (средней) степени – у 132 больных, МЛП III (тяжелой) степени – у 127 больных и МЛП IV (крайне тяжелой) степени – у 49 больных (табл. 1). Необходимо отметить, что у одного больного, как правило, наблюдались очаги поражения разной степени тяжести (например, МЛП I–IV или МЛП I, II степени), поэтому в приводимых таблицах число случаев МЛП различной степени тяжести может превышать количество больных в группе.
Количество случаев МЛП различной степени тяжести в компьютерной базе данных Центра
Из 232 больных у 72 человек наряду с МЛП была диагностирована острая лучевая болезнь (ОЛБ) различной степени тяжести (табл. 1). Среди больных, у которых была диагностирована ОЛБ, наблюдалось 49 случаев МЛП I, 34 – МЛП II, 26 – МЛП III, 17 – МЛП IV степени тяжести. Среди них 45 человек пострадали от гамма‑бета‑, 13 – от гамма‑, 14 – от гамма‑нейтронного воздействия. В работе использованы методы вариационной статистики (программа для ПК Biostat).
Результаты
Клиническая картина МЛП различной степени тяжести в периоде основных клинических проявлений
Клинические признаки МЛП, соответствующие различным степеням тяжести раневого процесса, приведены в табл. 2.
Основные клинические проявления по периодам развития и уровни поглощенных доз (кратковременное гамма-облучение) при МЛП различных степеней тяжести
Минимальные клинические проявления в виде гиперемии и слабого отека характерны для МЛП легкой степени тяжести. При подобном поражении эпителизация наступает всегда. развитие раневого процесса заканчивается сухим шелушением.
При средней, тяжелой и крайне тяжелой степенях МЛП на фоне отёка и гиперемии возникает отслойка эпидермиса и формируются пузыри. Пузыри вскрываются самостоятельно, обнажается язвенная поверхность. Самопроизвольная эпителизация происходит при МЛП средней степени тяжести. При тяжелой и крайне тяжелой степени поражения язвы превращаются в некротические, инфицируются и практически не заживают при консервативном лечении.
В отдаленном периоде на месте бывших острых лучевых язв и эрозий можно наблюдать выраженные рубцово‑атрофические изменения с пигментацией, множественными телеангиоэктазиями, гиперкератозом, поздними лучевыми язвами. В отдельных случаях возможно злокачественное перерождение тканей, особенно при гиперкератозе [5–8]. Однако следует указать, что развитие лучевого рака более характерно для последствий многолетнего хронического переоблучения [9–11].
Отдаленные последствия МЛП
Последствия МЛП являются основной причиной стойкой инвалидизации в отдаленные сроки у пострадавших в радиационных авариях.
Частота и клинические проявления отдаленных последствий МЛП различной степени тяжести (I–IV), вызванных действием различных видов ионизирующего излучения, по данным компьютерной базы данных клиники Центра, представлены на рис. 1–4.
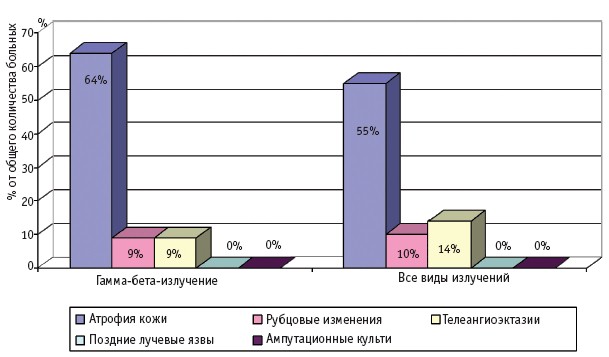
Рис. 1. Отдаленные последствия МЛП I степени тяжести
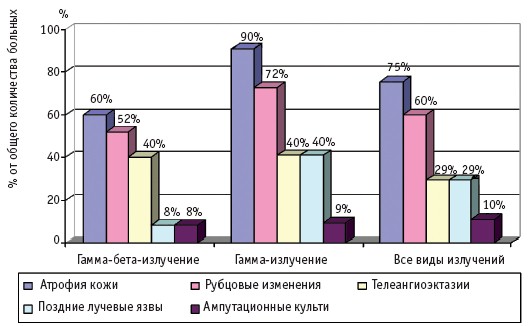
Рис. 2. Отдаленные последствия МЛП II степени тяжести
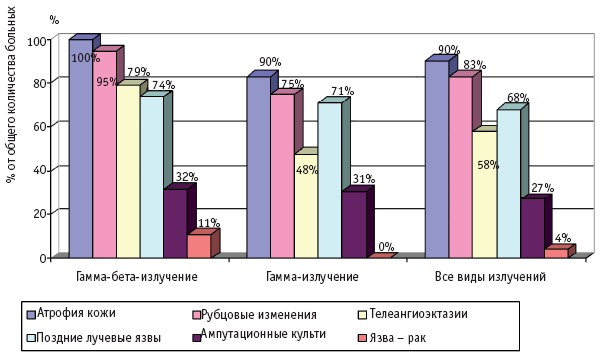
Рис. 3. Отдаленные последствия МЛП III степени тяжести
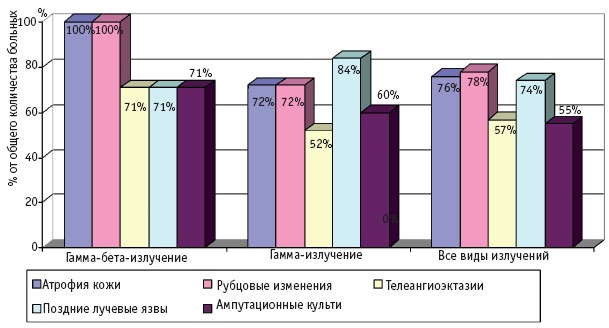
Рис. 4. Отдаленные последствия МЛП IV степени тяжести
Интересной находкой явилось обнаружение в периоде отдаленных последствий новообразований кожи: у 4 больных (у двух больных с МЛП, у двух с сочетанием ОЛБ и МЛП) в области длительно существовавших, не леченных хирургическим путем поздних лучевых язв был обнаружен высокодифференцированный плоскоклеточный рак кожи (рис. 3); у 5 больных – базальноклеточный рак кожи. Базалиомы были обнаружены у больных, перенесших ОЛБ I–IV степени и МЛП IV. Надо отметить, что появление базалиом отмечено на коже вне зоны последствий МЛП, поэтому эта нозология не вынесена на рис. 4.
Лечение МЛП и их отдаленных последствий
Несмотря на более чем столетнюю историю изучения МЛП, вопрос выбора тактики лечения остается очень сложным. С целью оценки эффективности лечения МЛП были проанализированы все группы больных с поражениями различной степени тяжести. Из исследования исключены пострадавшие, которые находились в клинике только в остром периоде и не наблюдались в периоде последствий.
Выбор методов лечения производится в зависимости от локализации МЛП, стадии развития раневого процесса, состояния окружающих тканей и площади МЛП.
Консервативное лечение в той или иной степени проводилось у всех 232 больных. На разных стадиях развития раневого процесса оно включало применение противоожоговых средств (лиоксазоль, пантенол), ингибиторов протеаз (контрикал, гордокс, октреотид), обезболивающих препаратов, антибиотиков, пентоксифиллина, средств, стимулирующих регенерацию (метилурацил, солкосерил, актовегин), антисептических растворов, различных перевязочных средств с нанесенными лекарственными препаратами и др.
Консервативными методами ограничивалось лечение только при МЛП легкой степени тяжести. Проанализированы случаи МЛП I степени тяжести от воздействия различных видов ионизирующего излучения. Условием подбора группы было наличие у пациентов только МЛП легкой степени. При наличии у одного пациента очагов МЛП различной степени тяжести больной включался в группу по максимальной степени тяжести (например, при МЛП II–III степени тяжести – в группу МЛП III степени), так как считалось, что наиболее выраженные последствия МЛП у данного пациента будут следствием острого МЛП наибольшей степени тяжести.
Консервативное лечение при МЛП легкой степени не требовало большой активности и в острой фазе приводило к полной эпителизации дефекта. Хирургическое лечение у этих больных не проводилось. У 16 из 30 пациентов отдаленные последствия МЛП легкой степени тяжести были представлены трофическими изменениями в виде легкой атрофии и сухости кожи, единичных телеангиоэктазий, которые также не требовали никакого лечения. У 14 больных последствия МЛП легкой степени отсутствовали.
Проанализированы медицинские сведения о лечении 59 больных с последствиями МЛП II (средней) степени тяжести. У 47 из 59 больных с МЛП II степени лечение также ограничивалось консервативными средствами. В результате его применения была достигнута полная эпителизация раневой поверхности. Однако у 12 больных в дальнейшем потребовалось проведение оперативного вмешательства, при этом консервативные методы лечения использовались для ускорения заживления раневой поверхности, либо для профилактики развития поздних лучевых язв.
У больных с МЛП III–IV степени тяжести основным видом лечения являлось хирургическое. Консервативная терапия использовалась для ускорения заживления раневой поверхности и для профилактики развития лучевого фиброза и поздних лучевых язв. тяжесть исходов и отдаленных последствий МЛП, несомненно, зависит от дозы лучевого воздействия, площади (табл. 3) и анатомического расположения МЛП. Последнее также определяет возможность использования близко расположенного к очагу поражения аутолоскута.
Большинство больных с МЛП тяжелой степени, пострадавших от всех видов ионизирующего излучения, подвергались хирургическому лечению. Самопроизвольное заживление без развития поздних лучевых язв наблюдалось только при малых площадях МЛП. Среди 41 пострадавшего от гамма‑излучения с МЛП III степени хирургическое лечение не проводилось у 8 (19,5 %) человек. У этих пациентов поражения имели малую площадь – менее 0,25 % поверхности тела. Отдаленные последствия были представлены выраженной атрофией кожи и мягких тканей, лучевым фиброзом, нарушением пигментации, телеангиоэктазиями, рубцами, остеопорозом, наличием контрактур. У остальных 33 больных хирургическое лечение проводилось в связи с появлением незаживающих поздних лучевых язв.
Критерии прогноза непосредственных и отдаленных последствий МЛП (гамма – бета облучения) в зависимости от объема (степени тяжести и площади) поражения
При МЛП IV степени тяжести уже в остром периоде течения раневого про‑ цесса может потребоваться проведение инвалидизирующих больного операций (некрэктомия тканей и инфицированных язв, ампутация пальцев или конечностей, аутодермопластика для закрытия раневого дефекта) с целью удаления очага некроза, инфекции и интоксикации, нередко для спасения его жизни.
Ампутация в области здоровых тканей дает стойкий эффект, профилактируя развитие поздних лучевых язв, но приводит к инвалидизации больного и снижению качества его жизни.
Если некрэктомия и ампутация проводятся не в границах здоровых тканей (II гистологическая зона МЛП [12]), то возникает рецидив поздних лучевых язв с необходимостью реампутаций и повторных аутодерматопластических операций (свободным лоскутом или филатовским стеблем), что требует повторных госпитализаций, перевязок, сопровождается болевым синдромом и приводит к глубокой десоциализации пациентов.
В группе из 6 пациентов с МЛП IV степени тяжести от гамма‑нейтронного излучения у трех больных острые лучевые язвы с большими дефектами самопроизвольно эпителизировались с последующим развитием гиперкератоза, индуративного отека, гиперпигментации, сухого некроза, и рубцов, которые постепенно увеличивались. Через несколько месяцев или год на фоне прогрессирования этих проявлений развились незаживающие поздние язвы, приведшие к необходимости ампутаций двух и более конечностей. У трех пациентов ампутации конечностей были произведены в остром периоде, в некоторых случаях были произведены реампутации конечностей из‑за развития поздних лучевых язв на культях с септическими осложнениями (септический эндокардит, амилоидоз почек и т.д.). таким образом, у всех больных IV ст. МЛП от гамма‑нейтронного излучения были произведены ампутации 2–3 конечностей.
У 5 человек МЛП IV степени тяжести от гамма‑бета‑излучения возникли в результате радиационных аварий, произошедших до 1987 г. раневой процесс у этих больных характеризовался развитием незаживающих острых лучевых язв или медленного заживления язв с последующими дефектами в виде гиперкератоза, лучевого фиброза, нарушения пигментации, телеангиоэктазий, контрактур. Больным проводилось хирургическое лечение в виде повторных некрэктомий, пластики свободным лоскутом, ампутаций и реампутаций пальцев верхних и нижних конечностей, пластики мостовидным лоскутом, ампутации кисти. У одного пациента из этой группы произошла малигнизация длительно существующей поздней лучевой язвы.
После 1988 г. у 10 пострадавших для сохранения целой конечности или ее большего сегмента, оптимального для дальнейшего протезирования, при МЛП III и IV cтепени тяжести, наряду с некрэктомией и ампутациями, кроме аутотрансплантаций свободным лоскутом, сотрудники Центра вместе с коллегами из отделения микрохирургии рЦХ им. Б.В. Петровского начали проводить трансплантации микрохирургическим полнослойным лоскутом на сосудистой ножке или другими васкуляризированными лоскутами, что позволило сократить объем ампутации и некрэктомии и избежать множественных реампутаций.
Если у 13 пострадавших с МЛП IV ст. от гамма‑излучения было проведено от 3 до 12 реампутаций и аутопластических операций свободными и стебельчатыми лоскутами, то среди 10 пострадавших, которым были произведены экономные некрэктомии и микрохирургическая аутодермопластика на сосудистой (питающей) ножке в 1–2 этапа, у одного пациента конечность была полностью сохранена, в других 9 случаях наблюдался стойкий эффект без рецидива поздних лучевых язв и с хорошей функцией конечностей.
Три человека с МЛП IV степени пострадали от рентгеновского излучения во время аварийных ситуаций после 2005 г. Всем пациентам в остром периоде произведены экономные некрэктомии и ампутации отдельных фаланг со сложными пластиками микрохирургическими полнослойными аутолоскутами с сосудистыми питающими ножками или реваскулизированной фасцией (рис. 5). Всем троим пациентам удалось сохранить конечности или большие их фрагменты (рис. 6). Одному – конечность (правую руку) с полной функциональной состоятельностью (9 лет наблюдения). Второму и третьему пациентам удалось сохранить правую и левую кисти, за исключением концевой фаланги I и средней фаланги II пальца и II и III левой кисти с формированием сухожилий разгибателей пальцев правой кисти из разгибателей правой стопы с частичным восстановлением функций (10 лет наблюдения).
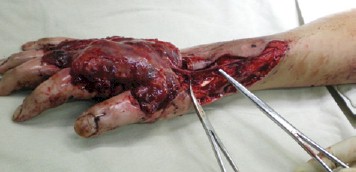
Рис. 5. Хирургическое вмешательство при МЛП III–IV степени тяжести
от рентгеновского облучения

Рис. 6. Восстановление функции правой кисти после хирургического лечения
При сравнении эффективности различных видов операций, применяемых при МЛП, в двух группах больных с аналогичной степенью тяжести и площадью поражения аутотранспланция с применением микрохирургической техники дает явные преимущества перед аутотрансплантацией свободным лоскутом, значительно сокращая число повторных операций (табл. 4). Больные, включенные в это исследование, были подобраны по полу, возрасту, степени тяжести МЛП, площади поражения.
Кроме того, аутопластические операции с применением микрохирургической техники позволяют сохранить большие сегменты конечности, что важно для дальнейшего функционирования ее культи, в том числе и для использования протеза.
Количество повторных оперативных вмешательств при Млп в зависимости от типа первичных операций
Примечания: * – некоторые больные имели МЛП 2 и 3 конечностей
** – отдельным больным проводилось до 20 операций – повторные реампутации с последующей аутопластикой свободным лоскутом
Необходимо отметить, что в связи с закономерными изменениями в последние годы структуры лучевых поражений в виде сокращения доли лиц с ОЛБ и увеличением количества пострадавших с МЛП, меняется и контингент больных. если многие десятилетия основным «поставщиком» пострадавших с лучевыми поражениями была атомная промышленность, то позднее мы стали чаще видеть среди больных работников нефтегазовой отрасли (дефектоскописты). В последнее десятилетие среди наших больных появились пациенты с осложнениями медицинского облучения. тяжелый соматический статус этих больных не позволяет проводить адекватное хирургическое лечение. В связи с этим с 2007 г. в лаборатории успешно применяется методика лечения поздних лучевых язв с помощью мезенхимальных стволовых клеток.
Заключение
Таким образом, правильный и своевременный диагноз при МЛП является очень важным звеном в системе оказания помощи пострадавшим в радиационных авариях, так как от этого зависит выбор адекватной схемы лечения.
Лечение МЛП легкой степени является исключительно консервативным. Может проводиться в любом лечебно‑профилактическом учреждении. Однако, учитывая частое сочетание МЛП с ОЛБ достаточно часто возникает необходимость в проведении обследования и лечения в условиях специализированного стационара.
Хирургическое лечение в комплексе с консервативным применяется у 30 % больных с МЛП средней степени при наличии поздних лучевых язв и практически у всех больных с поздними лучевыми язвами как последствиями МЛП тяжелой степени.
Методом выбора при тяжелых и крайне тяжелых МЛП в остром периоде и при рецидивирующих поздних лучевых язвах в отдаленном периоде являются оперативные вмешательства, основой которых является аутопластика толстыми лоскутами на сосудистой ножке с применением микрохирургической техники, что значительно улучшает исходы и минимизирует тяжелые отдаленные последствия. Кроме того, для профилактики развития поздних лучевых язв больным назначается каждые 6 месяцев внутривенное введение пентоксифиллина и актовегина.
При МЛП крайне тяжелой степени хирургическое лечение является основным методом не только в периоде отдаленных последствий, но уже и в остром периоде течения раневого процесса. Из видов оперативных вмешательств применяются все возможные: некрэктомии, ампутации, аутопластики полнослойным микрохирургическим лоскутом на питающей ножке, сдвижные лоскуты, реваскулизированные лоскуты, свободные для временного закрытия дефекта или на реваскулизированную фасцию, филатовским стеблем, мостовидным лоскутом. Для сохранения больших сегментов, иногда и целой конечности, методом выбора является применение полнослойных лоскутов на питающей ножке, полученных микрохирургическим методом или реваскулизированные лоскуты (фасциальные), т.е. способные нормализовать трофику в области пораженных тканей. Консервативное лечение является вспомогательным.
Лечение МЛП средней и тяжелой степени должно проводиться в специализированном стационаре, обладающим полным арсеналом диагностических и лечебных методов.

Большие дозы ионизирующего излучения могут привести к развитию острой лучевой болезни, угнетающей процессы кроветворения и поражающей пищеварительный тракт.
Очень большие дозы ионизирующего излучения могут также привести к поражению сердца и кровеносных сосудов (сердечно-сосудистой системы), головного мозга и кожи.
Лучевое поражение большими и очень большими дозами называется реакцией тканей. Доза, вызывающая видимое поражение тканей, различается в зависимости от типа ткани.
Ионизирующее излучение может увеличить риск развития онкологических заболеваний.
Облучение сперматозоидов и яйцеклеток несколько повышает риск генетических дефектов у потомства.
Врачи удаляют как можно больший объем внешнего и внутреннего (вдыхаемого или заглатываемого) радиоактивного материала и лечат симптомы и осложнения лучевого поражения.
В общем случае, под ионизирующим излучением понимают высокоэнергетические электромагнитные колебания (рентгеновское и гамма-излучение) и потоки частиц (альфа-частиц, бета-частиц и нейтронов), способные выбивать из атомов электроны (ионизация). Ионизация меняет химические свойства подвергшихся воздействию атомов и состоящих из них молекул. Изменяя молекулы высокоупорядоченной клеточной структуры, ионизирующее излучение повреждает клетки и нарушает их функции. В зависимости от величины дозы, органов, подвергшихся воздействию, и типов радиации, поражение клеток, вызванное ионизирующим излучением, может вызвать острую болезнь, увеличить риск развития рака или и то, и другое.
Источниками ионизирующего излучения являются радиоактивные вещества (радионуклиды), например, уран, радон и плутоний. Кроме того, ионизирующее излучение создают приборы, например, рентгенологическое оборудование и аппараты лучевой терапии.
К электромагнитному излучению также относятся видимый свет и испускаемые сотовыми телефонами и радиопередатчиками на частотах AM и FM радиоволны. Однако эти виды излучения намного слабее и не обладают ионизирующими свойствами, поэтому их воздействие на человека не повреждает клетки. В данной статье под термином «излучение» понимается исключительно ионизирующее излучение.
Измерение радиации
Для оценки радиационного воздействия используют несколько единиц измерения. Рентген (Р) — это единица измерения ионизирующей способности излучения в воздухе, которая часто используется для выражения интенсивности радиационного воздействия. Мощность радиоактивного излучения, которому подвергся человек, может очень сильно отличаться от количества поглощенной его организмом энергии этого излучения. Грей (Гр) и зиверт (Зв) — это единицы дозы ионизирующего излучения, иначе говоря, энергии излучения, поглощенной телом. Доза радиации, которую получил подвергшийся радиоактивному облучению человек, измеряется именно в этих единицах. Грей и зиверт аналогичны друг другу и отличаются лишь тем, что зиверт учитывает эффективность поражающего воздействия разных типов радиоактивного излучения и чувствительность разных тканей организма к радиации. Малые уровни доз измеряются в миллигреях (мГр; 1 мГр = 1 /1000 Гр) и миллизивертах (мЗв; 1 мЗв = 1 /1000 Зв).
Загрязнение и облучение
Индивидуальная доза облучения может увеличиваться двумя способами: посредством радиоактивного загрязнения и облучения. Жертвы большинства наиболее существенных радиационных аварий подвергались воздействию и того, и другого.
Радиоактивное загрязнение подразумевает контакт с радиоактивным материалом, обычно в виде пыли или жидкости, и его накопление. Наружное загрязнение — это радиоактивное загрязнение кожи или одежды, способное передаваться другим людям или предметам при физическом контакте. Внутреннее загрязнение — это попадание радиоактивного материала в организм посредством поглощения, вдыхания либо через порезы на коже. Попав в организм, радиоактивный материал разносится в разные органы, например, в костный мозг, и продолжает испускать радиацию, увеличивая дозу, до выведения из организма либо до полного истощения собственной энергии (распада). Избавиться от внутреннего загрязнения гораздо труднее, чем от наружного.
Облучение — это воздействие радиации, при котором радиоактивный материал-загрязнитель отсутствует. Одним из примеров такого воздействия может служить рентгенологическая диагностика, например, используемая при переломах. Радиоактивное облучение не требует физического контакта человека с источником радиации (например, с радиоактивным материалом или рентгеновским аппаратом). При устранении или выключении источника радиации облучение прекращается. Человек, подвергшийся облучению, но не подвергшийся загрязнению, не радиоактивен, то есть не является источником радиации, и доза излучения, полученная им от источника, не увеличивается.
Знаете ли Вы, что.
Доза излучения, которую среднестатистический житель США получает от воздействия природного излучения, примерно соответствует дозе, получаемой им от изготовленных человеком источников радиации (которые почти всегда используются в медицинских целях, для диагностики и лечения заболеваний).
Источники воздействия радиации
Люди постоянно подвергаются воздействию малых доз естественного излучения (фоновое излучение) и периодически подвергаются воздействию излучения из созданных человеком источников. Естественный радиационный фон значительно варьирует в мире и даже на территории отдельных стран. В США люди получают в среднем около 3 мЗв/год от воздействия природных источников, при этом диапазон экспозиции варьируется от 0,5 до 20 мЗв/год в зависимости от региона, высоты над уровнем моря, а также геологической структуры местности. В среднем люди получают дополнительные 3 мЗв/год из созданных человеком (в основном медицинских) источников, в результате чего общая среднедушевая эффективная доза составляет около 6 мЗв/год.
Фоновое излучение
Источники фоновой радиации включают следующие:
солнечное и космическое излучение;
естественные радиоактивные элементы в почве.
Космическое и солнечное излучение в значительной степени блокируется земной атмосферой и под действием магнитного поля стягивается к северному и южному полюсам. Соответственно, космическое излучение в большей степени воздействует на жителей приполярных и высокогорных районов, а также на авиапассажиров.
Радиоактивные элементы, в частности уран и радиоактивные продукты его распада (такие как газ радон) присутствуют в различных горных породах и минералах. Эти элементы попадают в самые разные субстанции, в том числе в пищу, воду и строительные материалы. Примерно две трети радиационного воздействия природного излучения на человека приходятся на воздействие радона.
Даже суммарные дозы, получаемые в результате воздействия природного фонового излучения, слишком малы, чтобы вызвать лучевое поражение. На сегодняшний день не было продемонстрировано никаких последствий для здоровья в связи с различиями уровней фонового излучения, поскольку риски радиационно-индуцированных эффектов на здоровье на этих низких уровнях дозы либо отсутствуют, либо слишком незначительны.
Антропогенное излучение

В основном воздействие излучения из источников, созданных человеком, сводится к проведению медицинских визуализирующих обследований, в которых используется рентгеновское излучение (в частности, компьютерная томография Компьютерная томография (КТ) При проведении компьютерной томографии (КТ), ранее называемой компьютерной аксиальной томографией (КАТ), рентгеновский источник и рентгеновский детектор вращаются вокруг пациента. В современных. Прочитайте дополнительные сведения [КТ]), или вводится радиоактивное вещество (в частности радиоизотопное сканирование сердца Радиоизотопное сканирование При радиоизотопном сканировании для получения изображения используются радионуклиды. Радионуклид — это радиоактивная форма элемента; это означает нестабильный атом, который стабилизируется. Прочитайте дополнительные сведения ). При онкологической лучевой терапии пациенты могут получать весьма высокие дозы излучения. Тем не менее, при выполнении этой процедуры предпринимаются все возможные меры к тому, чтобы ограничить площадь радиационного воздействия только больными тканями и свести облучение здоровых тканей к минимуму.
Облучение может происходить и из других антропогенных источников — во время радиационных аварий и при выпадении радиоактивных осадков после предшествующих испытаний ядерного оружия. Однако для большинства людей такое облучение представляет крайне малую часть годовой дозы. Как правило, радиационные аварии затрагивают только людей, непосредственно работающих с радиоактивными материалами и источниками рентгеновского излучения, например, с облучателями продуктов питания, промышленными источниками излучения и рентгеновскими аппаратами. Такие работники могут получить значительную дозу излучения. Эти несчастные случаи редки и обычно бывают результатом несоблюдения правил техники безопасности. Известны случаи, когда причиной воздействия радиации была утеря или хищение медицинских или промышленных источников, содержавших большое количество радиоактивного материала. Лучевое поражение развивалось также у пациентов, получавших лучевую терапию и некоторые медицинские процедуры под контролем импульсного рентгеновского излучения, показывающего движущееся рентгеновское изображение на экране (рентгеноскопии). Некоторые из этих эпизодов представляют собой несчастные случаи или обусловлены неверным использованием, но иногда, в более сложных случаях, даже надлежащее применение таких процедур может привести к неизбежным лучевым осложнениям и реакции тканей.
При взрыве ядерного оружия выделяется огромное количество энергии и радиации. Это оружие не применялось против людей с 1945 года. Однако в настоящее время ядерное оружие есть у нескольких стран, его пытаются заполучить или создать террористические группировки, и вероятность его повторного применения растет. Подавляющее большинство жертв ядерного взрыва гибнет от самого взрыва и от термических ожогов. У меньшего (хотя и довольно значительного) числа жертв развивается лучевая болезнь.
Возможность проведения теракта с применением ядерного боеприпаса (см. Радиологическое оружие Радиологическое оружие Воздействие радиации подробно рассмотрено в другой статье. Массовые жертвы радиационного воздействия возможны при подрыве ядерного боеприпаса. Подрыв ядерного боеприпаса приводит не только к. Прочитайте дополнительные сведения ) включает вероятность подрыва устройства, рассеивающего радиоактивный материал на большой территории (устройство, распыляющее радиоактивный материал посредством подрыва обычного боеприпаса, называют «грязной бомбой»). Другие варианты терактов могут подразумевать установку скрытого источника радиации с целью сильного облучения непричастных граждан, нападение на ядерный реактор или хранилище радиоактивных материалов и подрыв ядерного боеприпаса.
Лучевые повреждения кожи, часто называемые лучевым ожогом, могут иметь различное клиническое проявление.

Лучевые повреждения кожи (развитие лучевых ожогов). Рис. 5. Эритема. Рис. 6 — 8. Развитие пузырей. Влажный радиоэпидермит. Рис. 9. Эрозия. Рис. 10. Рубец ; видны дисхромия, телеангиэктазии и каемка гиперпигментации.
Эритема — временное покраснение кожи на месте облучения; развивается на 13—14-й день после однократного и через 2—6 недель после фракционного облучения.
Стойкая эпиляция развивается при однократном или фракционном облучении волосистой части головы. Сухой эпидермит развивается через 7—10 дней после однократного или через 2—3 недели после фракционного облучения. Клинически проявляется эритемой, отечностью кожи с последующим пластинчатым шелушением. Восстановление облученной кожи неполное. Кожа остается атрофированной, сухой, эпилированной. Позднее появляются телеангиэктазии, неравномерная пигментация.
Влажный радиоэпидермит сопровождается резким покраснением и отеком кожи, появлением пузырей, наполненных прозрачной желтоватой жидкостью, которые быстро вскрываются, при этом обнажается базальный слой эпидермиса. Через 1—2 дня начинается эпителизация.
Влажный эпидермит заканчивается стойкой атрофией волосяных фолликулов, сальных и потовых желез, значительным истончением кожи, потерей ее эластичности, депигментацией (дисхромией), появлением телеангиэктазии. Позднее может выявиться гиперкератоз (избыточное ороговение) и склероз подлежащей подкожной жировой клетчатки. После облучения жестким рентгеновским или амма-излучением спустя 6—9 мес. и позже выявляется медленно прогрессирующая атрофия мышечной ткани и остеопороз костей. Наиболее резкая степень атрофии мышц и задержка роста костей наблюдаются у детей.
При лечении злокачественных опухолей влажный радиоэпидермит допустим только на малых по размеру полях облучения.
Лучевая язва может развиваться остро в ближайшие дни и недели после интенсивного однократного облучения, подостро через 6—10 недель, а также через несколько лет после облучения. Острое течение характеризуется интенсивным покраснением кожи вскоре после облучения, сопровождающимся резким отеком, сильными болями, нарушением общего состояния. На отечной, с застойной гиперемией коже появляются крупные пузыри нередко с геморрагическим мутным содержимым. По отторжении эпидермиса обнажается некротизированная поверхность, покрытая неснимающимся налетом, в центре которой образуется язва. В течение длительных сроков происходит отторжение некротизированной ткани, образование вялых и нестойких грануляций и эпителизация язвы. Нередко заживления не происходит. Подостро развивающаяся лучевая язва часто является исходом длительно протекающего влажного эпидермита. В окружающих язву тканях в пределах облученного поля в течение ближайших месяцев развивается резко выраженная лучевая атрофия.
Поздняя лучевая язва обычно развивается на фоне резко атрофированных тканей на месте облучения. Образование язвы происходит по типу острого лучевого некроза тканей в области всего поля облучения, захватывающего не только кожу, но и подлежащие ткани, подкожную клетчатку, мышцы, кости. В ряде случаев на атрофированной коже появляется поверхностная экскориация (ссадина), которая постепенно углубляется и увеличивается в размерах, превращаясь в глубокую язву.
Лучевая атрофия кожи и лучевая язва нередко заканчиваются развитием лучевого рака.
Результатом лучевого воздействия на кожу и подкожную жировую клетчатку нередко является индуративный отек тканей.
Индуративный отек развивается в результате поражения не только кровеносных, но и лимфатических сосудов, что ведет к нарушению оттока лимфы, отеку и склерозу кожи и подкожной клетчатки. Кожа и подкожная клетчатка облученного поля постепенно становятся плотными, возвышаются над уровнем нормальной кожи, при надавливании остается ямка. Кожа гиперпигментирована, покрыта телеангиэктазиями или приобретает красновато-синюшный оттенок, становится болезненной. Под влиянием травмы или без видимой причины в области индуративного отека может возникать некроз кожи, ведущий к образованию глубоких лучевых язв.
Эритема не требует специального лечения; необходима только защита от любого вида раздражения кожи: солнечной инсоляции, теплового, химического и механического воздействия, обмывания, особенно с мылом. Все перечисленные раздражители способствуют увеличению степени повреждения.
Допускается смазывание покраснений поверхности кожи индифферентным жиром, маслами, преднизолоновой мазью.
Влажный эпидермит лечат открытым способом, без повязки. Мокнущую поверхность обрабатывают ежедневно или через день спиртовым раствором генцианвиолета. При необходимости накладывают повязки с линиментом алоэ, тезановой эмульсией, облепиховым маслом, рыбьим жиром. Эпителизация заканчивается через 1 — 2 недели.
Лечение лучевой язвы заключается в радикальном хирургическом удалении язвы и окружающих измененных лучевым воздействием тканей. Нерадикальное вмешательство, т. е. оставление части облученных тканей, ведет к расхождению швов и образованию сначала незаживающего дефекта, позднее вновь превращающегося в язву. После иссечения язв малого размера возможно наложение швов без дополнительной пластики. При больших язвах операция заканчивается пластикой лоскутами из окружающих тканей или лоскутами по Филатову.
Перед операцией необходима длительная подготовка, заключающаяся в борьбе с инфекцией, для чего используются антибиотики; для очищения язвы от некротизированных тканей применяют 5—10% раствор дибунола в линетоле, пелоидин, винилин (бальзам Шостаковского); для стимуляции образования грануляций применяют метациловую мазь, рыбий жир, линол, линимент алоэ. Для улучшения кровоснабжения окружающих язву тканей и увеличения ее подвижности по отношению к подлежащим тканям, а также улучшения нервной трофики применяют циркулярную -новокаиновую блокаду 0,25% раствором.
Мягкие ткани при острой лучевой болезни. Кожа при острой лучевой болезни
Можно выделить три этапа в изучении лучевых поражений кожи: первый этап — с 1896 по 1920 г., когда в основном накапливались фактические клинические и морфологические данные; второй этап — с 1921 по 1945 г., это период углубленного изучения патогенеза лучевых поражений кожи, преимущественно при местном воздействии рентгеновских лучей, и третий этап — с 1946 г. по настоящее время, когда большое внимание уделяется реакции кожи при общем облучении организма от различных источников ионизирующих излучений [Приживойт И. Ф., 1967].
Обширная патологоанатомическая литература о локальных лучевых поражениях кожи систематизирована и проанализирована во многих, трудах, поэтому остановимся на характеристике патологической анатомии поражений кожи при острой лучевой болезни. Судя по накопившимся в литературе сведениям, острая лучевая болезнь, возникающая у людей от взрыва атомных бомб или во время аварий на атомных установках в мирное время, как правило, должна сочетаться с тяжелыми поражениями кожи и подлежащих мягких тканей.
По своему характеру, размерам и исходу такие изменения существенно отличаются от локальных радиационных поражений, развивающихся в результате лучевой терапии, а также при экспериментальной лучевой болезни, вызванной общим равномерным облучением рентгеновскими лучами. Вместе с тем грубые изменения кожи, возникающие в участках тела, подвергшихся непосредственному массивному воздействию ионизирующего излучения при общем неравномерном облучении, могут играть существенное и даже решающее значение в исходе заболевания.

Судя по литературным материалам, облучение человека в чрезвычайных условиях обычно бывает очень неравномерным, и поэтому на участках тела, обращенных в момент поражения к источнику излучения, изменения мягких тканей существенно отличаются по характеру и тяжести от поражения их в остальных частях тела. В таких случаях имеется сочетание очаговых, наиболее грубых повреждений с общими, более легкими изменениями кожи и подлежащих тканей, сходными с наблюдаемыми при равномерном облучении организма в минимально смертельных дозах.
Весь процесс развития патологоанатомических изменений в облученной коже состоит из трех основных периодов с характерными для каждого из них особенностями изменений и механизмами их возникновения. Во втором периоде продолжается длительное восстановление первичных лучевых нарушений, а в третьем — развиваются отдаленные последствия в виде вторичных дистрофических изменений, образования вторичных язв, грубых рубцов и местных новообразований.
Продолжительность, тяжесть и значение каждого периода или фазы в исходе местных нарушений и лучевого заболевания в целом во многом определяется местной дозой облучения, видом ионизирующего излучения, тяжестью общего поражения, размерами пораженного участка кожи и его локализацией.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

