Что такое легочная эпителия
Обновлено: 24.04.2024
Авторы: Геппе Н.А. 1 , Озерская И.В. , Малявина У.С.
1 Клинический институт детского здоровья им. Н.Ф. Филатова ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет), Москва, Россия
Для цитирования: Геппе Н.А., Озерская И.В., Малявина У.С. Цилиарный эпителий при респираторных вирусных инфекциях у детей. Влияние лекарственных препаратов. РМЖ. 2012;24:1222.
Болезни органов дыхания относятся к числу наиболее распространенных заболеваний человека. Респираторные заболевания у детей составляют до 90% всех инфекционных болезней. Среди болезней органов дыхания львиная доля приходится на острые респираторные вирусные инфекции (ОРВИ). Наиболее высокие показатели заболеваемости отмечаются у детей раннего возраста. Дети младшего возраста в среднем болеют ОРВИ 6–8 раз в год, а 10–15% детей – не менее 12 раз в год. Высокие показатели заболеваемости ОРВИ в детском возрасте делают эту проблему крайне актуальной для педиатрии.
Таким образом, указанные изменения функции цилиарного эпителия могут поддерживать нарушения МЦК, что требует своевременной коррекции. Учитывая влияние компонентов препарата Аскорила (в частности, сальбутамола) на ЧБР цилиарного эпителия, а также влияние амброксола (как активного метаболита одного из компонентов препарата) на восстановление сурфактанта и реологию секрета дыхательных путей, можно предположить, что препарат может оказывать положительное действие на стабилизацию и восстановление МЦК при ОРВИ у детей.
Литература
1. Herzon F.S. Nasal ciliary structural pathology // Laryngoscope. 1983. Vol. 93(1). P.63–67.
2. Sleigh M.A. Movement and coordination of tracheal cilia and the relation of these to mucus transport //Cell. Motil. (Suppl.) 1982. Vol. 1. P.19–24.
3. Fawcett D.W., Porter K.R. A study of the fine structure of ciliated epithelia // J. Morphol. 1954. Vol. 94. P. 221–281.
4. Buchdahl R.M. et al. Ciliary abnormalities in respiratory disease //Archives of Disease in Childhood. 1988. Vol. 63. P. 238–243.
5. Bertrand B., Collet S., Eloy P. et al Secondary ciliary dyskinesia in upper respiratory tract //ActaOtorhinolaryngol. Belg. 2000. Vol. 54(3). P. 309–316.
6. Chilvers M.A., Rutman A., Callaghan C.O’. Functional analysis of cilia and ciliated epithelial ultrastructure in healthy children and young adults // Thorax. 2003. Vol. 58. P. 333–338.
7. Hermens W.A., Merkus F.W. The influence of drugs on nasal ciliary movement // Pharm. Res. 1987. Vol. 4(6). P. 445–449.
8. Stetinova V., Herout V., Kvetina J. In vitro and in vivo antioxidant activity of ambroxol // Clin. Exp. Med. 2004. Vol. 4(3). P. 152–158.
9. Fraschini F., Scaglione F., Scarpazza G. et al. Effect of mucolytic agent on the bioavailability of antibiotics in patients with chronic respiratory diseases // Cur. Ther. Res. 1988. Vol. 13 P. 734–742.
10. Sisson J.H., Yonkers A.J., Waldman R.H. Effects of guaifenesin on nasal mucociliary clearance and ciliary beat frequency in healthy volunteers // Chest. 1995. Vol.107(3). P. 747–751.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Респираторный отдел легких. Строение респираторного отдела легких.
Структурно-функциональной единицей респираторного отдела легких является ацинус. Этим термином обозначают систему, состоящую из респираторных бронхиол 1-3-го порядков, альвеолярных ходов и альвеолярных мешочков. Между воздухом внутри альвеол и кровью, находящейся в капиллярах, оплетающих альвеолярную стенку, происходит газообмен.
Ацинус начинается респираторной бронхиолой 1-го порядка, которая в свою очередь дихотомически делится на респираторные бронхиолы 2-го, а затем 3-го порядков. Последние разветвляются на альвеолярные ходы, заканчивающиеся двумя-тремя сферическими альвеолярными мешочками. Численность альвеол последовательно возрастает и, если в стенках репираторных бронхиол еще имеются участки, состоящие из однослойного кубического эпителия и тонкой прослойки коллагеновых волокон и гладких миоцитов, где не происходит газообмен, то альвеолярные мешочки имеют стенку, сплошь состоящую из альвеол. По форме ацинус напоминает пирамиду или конус, в вершину, которого входит респираторная бронхиола. 12-18 ацинусов образуют легочную дольку. Ацинусы отделены друг от друга соединительнотканными прослойками.
Важнейшим структурным элементом легочного ацинуса является альвеола. Средний диаметр альвеол у взрослого человека 260-290 мкм. Альвеолы тесно прилежат друг к другу. Между ними определяются тонкие межальвеолярные перегородки, по которым проходят кровеносные капилляры. Имеются также эластические и ретикулярные волокна, оплетающие альвеолы, и придающие им упругость. В перегородках между альвеолами обнаруживаются отверстия диаметром 10-15 мкм. Это так называемые альвеолярные поры Кона, создающие возможность проникновения воздуха из одной альвеолы в другую. Эластический каркас и гладкие мышечные клетки в легочных ацинусах участвуют в регуляции поступления воздуха в альвеолы.
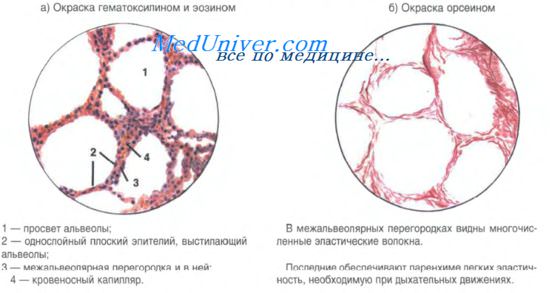
Изнутри альвеолы выстланы однослойным плоским эпителием. Альвеолярная выстилка включает несколько клеточных дифферонов. Респираторные плоские эпителиоциты (альвеолоциты 1-го типа) — это полигональной формы клетки. В них различают две части: более толстую ядросодержащую и тонкую безъядерную (пластинчатую). Околоядерная часть имеет толщину около 5 мкм. Толщина пластинчатой части не более 0,2 мкм. Органеллы располагаются около ядра. Через пластинчатую часть цитоплазмы происходит газообмен, и в ней много пиноцитозных пузырьков. Респираторные эпителиоциты лежат на тонкой базальной мембране. Своей пластинчатой частью они прилежат к базальным участкам эндотелиальных клеток кровеносных капилляров. В этих участках базальные мембраны альвеолярного эпителия и эндотелия могут сливаться, благодаря чему аэрогематический барьер (барьер "воздух-кровь") оказывается чрезвычайно тонким (около 0,5 мкм). Это благоприятствует газообмену. Обмен газов между альвеолярным воздухом и кровью происходит путем диффузии в связи с разницей парциального давления О2 и СО2 в альвеолярном воздухе и в крови. Респираторные эпителиоциты являются высокоспециализированными клетками, утратившими способность делиться митозом.
Аэрогематическим барьером называется комплекс элементов стенки альвеолы и кровеносного капилляра, который преодолевают газы (О2и СО2 в процессе внешнего дыхания. В его состав входят слой сурфактанта, цитоплазматические пластинчатые части респираторных эпителиоцитов, общая с эндотелиоцитами базальная мембрана, аблюминальная и люминальная поверхности эндотелиоцитов гемокапилляра, стенка эритроцита (если слияния базальных мембран нет, то структура барьера усложняется — между двумя базальными мембранами располагается тонкая соединительнотканная прослойка).
Большие эпителиоциты являются одновременно секретирующими и пролиферирующими клетками. Между респираторными и большими эпителиоцитами образуются межклеточные соединения типа плотных контактов. Кроме описанных выше клеток, в стенке альвеол и в гипофазе обнаруживаются альвеолярные макрофагоциты. Это производные моноцитов. Очищая вдыхаемый воздух, альвеолярные макрофаги выполняют функцию защиты.
Иннервация легких. К бронхиальному дереву подходят симпатические и парасимпатические нервы. Нервные импульсы, идущие по парасимпатическим нервным проводникам (ветви блуждающего нерва), вызывают сокращение гладких мышц бронхов, а раздражение симпатических волокон, напротив, вызывает расслабление мышц.
Возрастные изменения. В постнатальном периоде прогрессирующе увеличивается дыхательная поверхность легких. В пожилом возрасте происходит снижение газообменной функции в связи с постепенным разрастанием соединительнотканной стромы легких.
Регенерация легких связана в основном с явлениями компенсаторной гипертрофии клеток альвеолярной выстилки. Показано, что большие эпителиоциты 2-го типа могут делиться митозом. Регенерация легких связана также с пролиферацией и миграцией клеток бронхиального эпителия, который врастает в зону повреждения и участвует в формировании альвеолоподобных структур.
- Вернуться в оглавление раздела "гистология"
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Эпителиальные клетки и воспаление легких.
Рассматривая роль эпителия дыхательного тракта в системе защиты организма, необходимо выделить следующие его функции: барьерную, эффективный мукоцилиарный клиренс, модуляцию эпителия под влиянием секреторных продуктов как самих эпителиальных клеток, так и других типов клеток, участвующих в воспалении. Эффективное сочетание всех этих функций обеспечивает нормальное функционирование эпителиального слоя легких.
Легочный эпителий является морфологическим и функциональным барьером. Гистологически в альвеолярном эпителии определяется наличие комплексов, состоящих из клеточных молекул адгезии и многочисленных специфических белков. Наличие таких комплексов обеспечивает непроницаемость эпителиального барьера для макромолекул и инфекционных агентов, и существенно ограничивает диффузию ионов. Эпителий дыхательных путей является эффективным барьером, препятствующим микробной инвазии, основным этапом которой является контакт микроба с эпителием. Очень мало известно микроорганизмов, способных к адгезии,к нормальному эпителию бронхов и легких.
Представителями таких микроорганизмов являются Mycoplasma pneumoniae и Bordetella pertussis. Однако поражение эпителия в результате его механического повреждения (например, при эндотрахеальной интубации) или вирусного инфицирования делает доступным этот процесс для большинства бактерий.
Функция мерцательного эпителия находится в тесной зависимости от различных гуморальных факторов, в том числе клеточного происхождения. Основные из них перечислены в таблице.
Кроме того, нижние отделы респираторного тракта содержат многочисленные факторы, продуцируемые эпителиальными клетками. Большая часть этих факторов обладает прямым антибактериальным действием.
Ключевая роль эпителиальных клеток в развитии воспаления бронхов и легких определяется их тесным взаимодействием с другими клетками воспаления. Клетки дыхательного эпителия в ответ на стимуляцию обладают способностью продуцировать хемоаттрактанты: IL-8 и RANTES. Эти хемотаксические факторы активируют нейтрофилы, моноциты (или макрофаги), эозинофилы и лимфоциты. Факторы роста (G-CSF; GM-CSF), продуцируемые эпителиальными клетками, могут также индуцировать дифференцировку моноцитов и тучных клеток. Кроме того, эпителиальные клетки участвуют в подавлении воспалительных клеток. Эпителиальные клетки, так же как макрофаги, способны продуцировать TGF-p, который угнетает IL-2-зависимую пролиферацию Т-клеток и продукцию макрофагами других цитокинов. Противовоспалительным эффектом обладают также PGE2 и IL-6, продуцируемые эпителиальными клетками. Выявлено наличие иммуносупрессивной активности альвеолярного эпителия по отношению к Т-лимфоцитам.
Эпителиальные клетки продуцируют белок с мол.весом 70кЕ)а, который блокирует пролиферацию Т-лимфоцитов между G1 и S фазами клеточного цикла. Сурфактант также модулирует активность клеток воспаления: подавляет функцию лимфоцитов (цитотоксичность, пролиферацию, синтез иммуноглобулинов) и повышает активность макрофагов. Антилимфоцитарная активность сурфактанта ассоциирована с его липиднои фракцией, в то время как стимуляция макрофагов - с SP-A, который повышает миграционную активность макрофагов, фагоцитоз, внутриклеточный киллинг Staphylococcus aureus и опухолевых клеток. Эпителиальные клетки также способны модулировать функцию гладкомышечных клеток дыхательных путей. Например, PGE2 приводит к бронходилятации, а нейтральная эндопептидаза (NEP) - к бронхоконстрикции. Эпителиальные клетки также влияют на функцию эндотелиальных клеток и выраженность отека дыхательных путей при помощи различных факторов: фермента, разрушающего гистамин (N-метилтрансфераза), 15-липоксигеназы, N0. Эпителиальные клетки могут модулировать рост фибробластов, их пролиферацию. Фибронектин и TGF-(3, секретируемые эпителиальными клетками, непосредственно действуют на миграцию фибробластов, a TGF-(3 и PGE2 модулируют секрецию фибробластами матричных белков. На этот процесс оказывают также влияние и другие факторы, экспрессированные эпителиальными клетками: инсулиноподобный фактор роста (IGF-1), IL-1 и IL-6.
Легочный эпителий, без сомнения, участвует в развитии большинства заболеваний дыхательной системы. Повреждение альвеолоцитов I типа - обязательная характеристика многих острых и хронических заболеваний легких, а повреждение дыхательного эпителия - обязательный признак инфекционных процессов, токсических поражений, иммунопатологических процессов и различных хронических заболеваний (БА и хронический бронхит). Повреждение эпителиальных клеток повышает предрасположенность к развитию вторичной инфекции дыхательных путей.
- Вернуться в оглавление раздела "Пульмонология."
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
а) Дыхательные пути:
• Трубчатые структуры
• Проводят воздух через просвет
• Анатомические отделы (от проксимальных к дистальным):
о Трахея
о Бронхи
о Бронхиолы
о Терминальные бронхиолы
о Респираторные бронхиолы
о Альвеолярные протоки
о Альвеолярные мешочки
о Альвеолы
б) Ветви дыхательных путей:
• Порядки дыхательных путей:
о Образуется 23 порядка дихотомически ветвящихся бронхов ниже киля трахеи
о Между терминальными бронхиолами и альвеолярными мешочками располагается 2-12 порядков (обычно 6-8)
о В каждом альвеолярном мешочке расположено 4-29 (обычно 10) альвеол
• Типы дыхательных путей:
о Бронхи:
- >1 мм в диаметре
- Сужаются и ветвятся
- Отдают бесхрящевые бронхиолы
о Бронхиолы:
- - Наиболее дистальные бронхиолы, выстланные дахательным эпителием, являются терминальными бронхиолами
о Терминальные бронхиолы:
- Наиболее дистальные воздухопроводящие пути
- Отдают - три порядка альвеолярных протоков
о Респираторные бронхиолы:
- Повышается число альвеол в их стенках
- Отдают три порядка альвеолярных протоков
о Альвеолярные протоки:
- Несколько расположенных рядом альвеол
- Оканчиваются альвеолярными мешочками
о Альвеолярные мешочки:
- Группы или скопления наиболее дистальных альвеол
о Альвеолы
в) Функция дыхательных путей:
• Проведение воздуха через просвет
• Газообмен между вдыхаемым воздухом и кровью:
о Доставка кислорода к альвеолам
о Выведение углекислого газа в атмосферу
На рисунке показаны 24 порядка дихотомического ветвления дыхательных путей от трахеи к наиболее дистальным отделам дыхательных путей, составляющим вторичную легочную дольку. Вторичная легочная долька—наиболее мелкая структурная единица легкого, окруженная соединительной тканью и имеющая многогранную форму. Каждая вторичная легочная долька содержит дистальные ветви долевой бронхиолы и сопровождающую ее легочную (дольковую) артерию. Ацинус состоит их дыхательных путей дистальнее терминальных бронхиол, каждая вторичная легочная долька содержит до 12 ацинусов. Терминальные бронхиолы отдают 2-3 респираторных бронхиолы, в свою очередь отдающих три альвеолярных протока, каждый из которых заканчивается альвеолярным мешочком или альвеолой. Респираторные бронхиолы характеризуются альвеолами в их стенке. Стенки альвеолярных протоков покрыты альвеолами. Альвеолярные мешочки оканчиваются скоплениями альвеол. Телескопический вид дыхательных путей, демонстрирующий размер и структурные особенности стенки различных типовдыхательных путей в виде уменьшения числа и размеров хрящевых пластинок. Хрящевые пластинки, наблюдаемые в дыхательных путях крупного и среднего калибра (трахея и бронхи), в бронхах среднего калибра постепенно уменьшаются в размерах и количестве. Стенки мелких дыхательных путей (бронхиол) не содержат хрящевой ткани. Дистальные скопления альвеол и альвеолярные мешочки образуют ацинус — функциональную единицу газообмена в легочной ткани. Ацинусами называют дыхательные пути, сосуды и поддерживающие структуры расположенные дистальнее терминальной бронхиолы. Микроскопическая структура крупных дыхательных путей, содержащих хрящевую ткань. Эти дыхательные пути выстланы псевдополосатым реснитчатым столбчатым (респираторным) эпителием, лежащим на базальной мембране. Реснички участвуют в мукоцилиарном транспорте, продвигающем лежащую выше слизь в краниальном направлении и обеспечивающем клиренс секрета и частиц. Подслизистая рыхлая соединительная ткань ниже базальной мембраны содержит пучки гладкомышечных волокон и серозно-слизистые железы. Хрящевые пластинки расположены ниже подслизистого слоя. Микроскопическая структура бронхиол, выстланных респираторных эпителием. Бокаловидные клетки участвуют в выработке слизи дыхательных путей и вставлены между реснитчатыми столбчатыми клетками. Пучки гладкомышечных волокон в подслизистом слое формируют спираль. Хрящевая ткань и бронхиальные железы отсутствуют. Первое из четырех изображений, полученных при КТ крупных дыхательных путей. Трахея — наиболее крупный сегмент дыхательных путей. Ее тонкие стенки поддерживаются переднебоковыми хрящами С-образной формы с мембранозной задней стенкой. Хрящевые кольца определяют округлую форму трахеи при вдохе. Правый и левый главные бронхи начинаются от трахеи в области киля трахеи. Главные бронхи отдают долевые бронхи. Правый главный бронх отдает правые верхнедолевые бронхи и промежуточный бронх. Левый главный бронх отдает левые верхнедолевые и нижнедолевые бронхи. Каждый долевой бронх отдает сегментарные бронхи, в свою очередь ветвящиеся на субсегментарные бронхи и, наконец, на бронхиолы. Наиболее мелкие дыхательные пути, визуализируемые в норме—бронхиолы. Мелкие дыхательные пути дистальнее мышечных бронхиол не визуализируются. КТ с высоким разрешением: изменения структуры крупных дыхательных путей. Хрящевые пластинки обеспечивают поддержку переднебоковой стенки дыхательных путей и определяют особенности формы нормальных дыхательных путей. КТ с высоким разрешением: изменения формы крупных дыхательных путей при дыхании. КТ с высоким разрешением: изменения формы крупных дыхательных путей при выдохе. Хрящи трахеи С-образной формы оказывают поддержку переднебоковым стенкам дыхательных путей при выдохе. Поскольку хрящевая ткань отсутствует в задней стенке трахеи, она изгибается в сторону просвета дыхательных путей. КТ с высоким разрешением: изменение формы дыхательных путей при выдохе. Схожие особенности отмечаются в главных бронхах, их задняя стенка при выдохе выглядит плоской. Эти морфологические изменения крупных дыхательных путей позволяют различить фазы вдоха и выдоха при КТ. Первое из четырех изображений, полученных при исследовании пациента старшего возраста с обычной кальцификацией трахеи. Рентгенография органов грудной клетки в ЗП проекции, изображение урезано: определяются кальцифицированные хрящи трахеи и бронхов, визуализируемые в виде тонких белых линий, лучше всего наблюдаемых по ходу стенок дыхательных путей. Рентгенография органов грудной клетки в боковой проекции, изображение урезано: определяются кальцификаты стенки дыхательных путей, визуализируемые в виде тонкой белой линии, лучше всего видимой по ходу передней стенки трахеи. «Волнистое» отображение кальцификатов соответствует прерывистому характеру расположения отдельных хрящей трахеи С-образной формы на всем протяжении дыхательных путей. КТ с контрастированием (мягкотканное окно), ограниченное областью средостения, аксиальный срез: определяется кальцификация хрящей главных бронхов. КТ с контрастированием (мягкотканное окно), аксиальный срез, изображение урезано до средостения: кальцифицированные хрящи главных бронхов. Кальцификация хрящей трахеи и бронхов может наблюдаться у здоровых лиц старшего возраста, что улучшает визуализацию стенок дыхательных путей при рентгенографии и позволяет определить отдельные кальцифицированные хрящи на КТ.
г) Функциональные и структурные зоны дыхательных путей:
• Проводящая зона:
о Функция:
- Только проведение воздуха
о Компоненты:
- Трахея
- Бронхи
- Бронхиолы
о Характер ветвления:
- Дихотомический: деление на два ствола
- Асимметричный: различный диаметр
о Структура:
- Нет альвеол в стенках дыхательных путей
- В эпителии газообмен не происходит
• Переходная зона:
о Функция:
- Проведение воздуха
- Дыхание
о Компоненты:
- Респираторные бронхиолы
- Альвеолярные протоки
о Характер ветвления:
- Дихотомичный
- Симметричный
- Часто деление на три или четыре ствола
о Структура:
- В стенках дыхательных путей содержатся альвеолы
- Позволяют осуществлять газообмен
• Респираторная зона:
о Функция:
- Только дыхательная
- Газообмен
о Компоненты:
- Альвеолы
- Альвеолярные мешочки
о Характер ветвления:
- Дихотомический
о Структура:
- Тонкие стенки
- Контактирует с капиллярной мембраной
Строение дыхательных путей
а) Трахея:
• Соединяет гортань с главными бронхами
• Микроскопическая анатомия:
о Эпителий:
- Псевдополосатый реснитчатый столбчатый эпителий
- Бокаловидные клетки
о Структуры подслизистого слоя:
- Подслизистые серозно-слизистые железы
о Пристеночные незамкнутые хрящевые кольца в виде лошадиной подковы (16-20)
о Сзади располагается мембранозный отдел с поперечными пучками мышечных волокон
• Функциональная анатомия:
о Реснички продвигают слизь ко входу в гортань
о Подслизистые серозно-слизистые железы секретируют воду, электролиты и слизь в просвет дыхательных путей
б) Бронхи:
• Соединяют трахею с мышечными бронхиолами
• Микроскопическая анатомия:
о Эпителий:
- Псевдополосатый реснитчатый столбчатый эпителий
- Бокаловидные клетки
о Структуры подслизистого слоя:
- Серозно-слизистые железы
- Пучки гладкомышечной ткани
о Скопления хрящевой ткани в виде полумесяца
в) Мышечные бронхиолы:
• • Микроскопическая анатомия:
о Эпителий:
- Псевдопополосатый реснитчатый столбчатый эпителий, переходящий в реснитчатый кубовидный эпителий
о Структуры подслизистого слоя:
- Расположенные в виде спирали гладкомышечные волокна
- Соединительная ткань
о Отсутствие хрящевой ткани
г) Терминальные бронхиолы:
• Последние проводящие бронхиолы
• Тонкие стенки, сниженный диаметр
• Микроскопическая анатомия:
о Выстланы реснитчатым столбчатым эпителием, переходящим в кубовидный эпителий
о Бокаловидные клетки отсутствуют
о В стенках содержится гладкомышечная и соединительная ткань
д) Респираторные бронхиолы:
• Между терминальными бронхиолами и альвеолярными протоками
• Микроскопическая анатомия:
о Выстланы реснитчатым простым кубовидным эпителием (в дистальных отделах ресничек нет)
о В стенках содержится гладкомышечная и соединительная ткань
о Стенки прерываются мелкими воздушными карманами (альвеолами)
е) Альвеолярные протоки:
• Между респираторными бронхиолами и проксимальными альвеолами/альвеолярными мешочками
• Прямые трубчатые пространства, полностью ограниченные альвеолами
• Микроскопическая анатомия
о Пучки гладкомышечных волокон в стенках отличает их от альвеол
ж) Альвеолы и альвеолярные мешочки:
• Мелкие чашевидные структуры:
о Выпячивание стенок респираторных бронхиол, альвеолярных протоков и альвеолярных мешочков
о Разделены тонкими стенками (перегородками)
• Легкие взрослых содержат - 300 миллионов альвеол
• Микроскопическая анатомия альвеолярных перегородок:
о Продолжается уплощенный плоский эпителий:
- Эпителлиальные клетки 1 типа (плоские пневмоциты) покрывают 93% поверхности альвеол
- Клетки 2 типа (круглоядерные) производят сурфактант
о Альвеолярные макрофаги:
- Межальвеолярные мигрирующие клетки
- Часть защитного механизма легких
о Прилежащие капилляры
о Промежуточная интерстициальная ткань
Основные единицы структуры легочной ткани
а) Первичная легочная долька:
• Все альвеолярные протоки, альвеолярные мешочки и альвеолы дистальнее последних респираторных бронхиол:
о Включает кровеносные сосуды, нервы и соединительную ткань
о В легких человека содержится 20-25 миллионов первичных легочных долек
• Не имеют клинического или визуализационного значения
б) Ацинус:
• Часть легкого дистальнее терминальных бронхиол, включающая:
о Респираторные бронхиолы
о Альвеолярные протоки
о Альвеолярные мешочки
о Альвеолы
о Сопутствующие сосуды и соединительная ткань
• Функциональная единица газообмена в легких
• Диаметр ацинуса составляет 6-10 мм
• В легком объемом 5,25 л содержится 25000 ацинусов
в) Вторичная легочная долька:
• Мелкие обособленные единицы легкого, окруженные соединительной тканью и междолевыми перегородками
• Структура:
о Приток воздуха обеспечивается долевыми бронхиолами, предтерминальными бронхиолами отдают:
- Более мелкие предтерминальные бронхиолами
- Терминальными бронхиолами
- Респираторными бронхиолами
о Кровоснабжаются долевыми артериями и их ветвями
о Ограничены междолевыми перегородками, содержащими легочные вены и лимфатическими сосудами
• Морфология:
о Неравномерная многогранная форма
о 1,0-2,5 см в диаметре
Топографические особенности визуализации
а) Трахея:
• Конфигурация задней стенки на КТ зависит от фазы дыхания:
о Изгибается наружу при задержке дыхания
о Уплощается и изгибается внутри во время выдоха
б) Бронхи/бронхиолы:
• Бронхи • Бронхиолы редко визуализируются в пределах 1 см от плевральной поверхности на КТ с высоким разрешением
в) Вторичная легочная долька:
• У здоровых людей в норме не визуализируется
• Наиболее развиты и лучше всего визуализируются в периферических отделах легких
• Междолевые перегородки на нижних пределах КТ в тонкосрезовом разрешении:
о Субплевральные перегородки имеют толщину около 0,1 мм
о Наиболее часто наблюдаются на верхушках, передней поверхности и вблизи средостенной плевры
о Локализацию можно предположить по определению перегородочных вен
• Толщина дольковых бронхиол соответствует наиболее низкому разрешению тонкосрезовой КТ:
о В норме не визуализируются
о Дольковые бронхиолы имеют диаметр - 1 мм
о Визуализизация зависит от толщины стенки
о Расположение можно определить по положению центральной долевой артерии
г) Ацинус:
• В норме ацинусы не визуализируются
• В эксперименте с наполнением одного ацинуса он приобрел вид розетки, затем приобретает сферический вид:
о Ацинарный/воздушный узелок
Аномалии при визуализации
а) Центродолевые узелки: инфекционный бронхиолит:
• КТ признаки:
о Мелкие узелки:
- Различная плотность
- Размер варьирует от нескольких мм до 1 см
о Центродолевое расположение:
- Расположены в 5-10 мм от плевральной поверхности
• Наблюдается при заболеваниях:
о Воспалительный (клеточный) бронхиолит:
- Воспаление/инфильтрация центролобулярных бронхиол
- Вовлечение окружающей интерстициальной ткани и альвеол
о Этиология:
- Бактериальная
- Микобактериальная
- Микотическая
- Вирусная
б) Тени по типу «дерева в почках»: инфекция мелких дыхательных путей:
• КТ:
о Линейное ветвление на периферии
о Ассоциированные центролобулярные узелки:
- Различная плотность
- Скопления узелков
- Расположены в нескольких миллиметрах от плевральной поверхности
о Картина напоминает «дерево с почками»
• Патологические сочетания:
о Инфекция мелких дыхательных путей
о Расширенные центролобулярные бронхиолы:
- Наполнение просвета бронхиол воспалительным экссуда-том/кпетками
о Околобронхиальное воспаление
о Этиология:
- Микобактериальная инфекция
- Бронхопневмония
- Инфекционный бронхиолит
в) Низкая плотность в центролобулярной области: центролобулярная эмфизема:
• КТ:
о Центролобулярные очаги (3-10 мм) низкой плотности
о Низкая плотность расположенной вблизи центролобулярной артерии
о Невыраженная стенка
• Наблюдается при заболеваниях:
о Центролобулярная (проксимальная ацинарная, центроацинарная) эмфизема:
- С вовлечением проксимального отдела ацинуса
- Растяжение и разрушение респираторных бронхиол
- Увеличенное воздушное пространство в центральном ацинусе с относительно нормальным дистальным отделом ацинуса
о Сильнее поражаются верхние доли и верхний сегмент нижних долей
г) Низкая плотность доли легкого: панлобулярная эмфизема:
• КТ:
о Диффузная широкая область низкой плотности
о Сниженный размер легочных сосудов
• Возникает при заболеваниях:
о Панлобулярная (панацинарная) эмфизема:
- Поражается весь ацинус и все ацинусы во вторичной легочной дольке
- Диффузное или с преимущественным поражением нижних долей
- Ассоциировано с недостаточностью α-1-антитрипсина
д) Низкая плотность доли легкого: парасептальная эмфизема:
• КТ:
о Кистозные области вблизи междолевых перегородок и плевры, крупных сосудов и бронхов
о Часто сочетается с центролобулярной эмфиземой
• Наблюдается при заболеваниях:
о Поражение периферических отделов легочного ацинуса и субплевральных вторичных легочных долек
о Расширенные альвеолярных ходы
о Преимущественно поражение верхней доли
о Ассоциировано с буллезной болезнью
е) Низкая плотность доли легкого: констриктивный бронхиолит:
• КТ:
о Мозаичная плотность, мозаичная перфузия
о Неоднородное распределение
о Воздушные ловушки на КТ при выдохе
• Возникает при заболеваниях:
о Концентричное сужение мембранозной части бронхиол за счет фиброза с нарушением тока воздуха в легких:
- Воздушные ловушки
- Мозаичная плотность/перфузия
ж) Ацинарные узелки: инфекция:
• КТ:
о Узелковые дымчатые тени от 6 до 10 мм
• Возникает при заболеваниях:
о Воспаление терминальных и респираторных бронхиол
о Щажение дистальных воздушных пространств
о Диссеминация инфекции по дыхательным путям:
- Туберкулез
- Ветряночная пневмония на ранних стадиях
ГБУЗ Ярославской области «Клиническая онкологическая больница», Ярославль
ФГБУ «Московский научно-исследовательский онкологический институт им. Герцена» — филиал ФГБУ «НМИРЦ» МЗ РФ, Москва, Россия, 125284
Военная медицинская часть, Голицыно, Московская область, Россия, Московский научно-исследовательский онкологический институт им. П.А. Герцена, филиал ФГБУ «Национальный медицинский исследовательский центр радиологии» Минздрава России, Москва, Россия
Московский научно-исследовательский онкологический институт им. П.А. Герцена, Москва
Диагностики эндобронхиальной предопухолевой патологии и ранних форм рака легкого
Журнал: Онкология. Журнал им. П.А. Герцена. 2016;5(5): 66‑71
ГБУЗ Ярославской области «Клиническая онкологическая больница», Ярославль
В настоящее время в мире рак легкого на протяжении последних десятилетий лидирует в структуре заболеваемости и смертности у мужчин. Однако при использовании стандартных рентгеноэндоскопических методов диагностики более 70—80% впервые выявленных больных раком легкого имеют III—IV стадию заболевания, когда радикальное хирургическое лечение невозможно. Развитие центрального рака легкого имеет ступенчатый процесс: трансформация нормального эпителия в гиперпластический, формирование очагов метаплазии, дисплазии, рак in situ (CIS) и микроинвазивный рак. Диагностика рака легкого включает флюорографию, рентгенографию органов грудной клетки, рентгеновскую компьютерную томографию, цитологическое исследование мокроты. Однако ведущую роль в диагностике центрального рака легкого играет эндоскопический метод, который благодаря современным методикам (узкоспектральная эндоскопия, аутофлюоресцентная эндоскопия, увеличительная эндоскопия) позволяет быстро и эффективно выявлять изменения слизистой оболочки трахеобронхиального дерева на разных стадиях канцерогенеза.
ГБУЗ Ярославской области «Клиническая онкологическая больница», Ярославль
ФГБУ «Московский научно-исследовательский онкологический институт им. Герцена» — филиал ФГБУ «НМИРЦ» МЗ РФ, Москва, Россия, 125284
Военная медицинская часть, Голицыно, Московская область, Россия, Московский научно-исследовательский онкологический институт им. П.А. Герцена, филиал ФГБУ «Национальный медицинский исследовательский центр радиологии» Минздрава России, Москва, Россия
Московский научно-исследовательский онкологический институт им. П.А. Герцена, Москва
Рак легкого в мире на протяжении последних десятилетий остается на первом месте в структуре заболеваемости и смертности у мужчин [1, 2].
Современная медицина располагает новой аппаратурой и высокотехнологичными методиками диагностики рака легкого. В то же время, при использовании стандартных рентгеноэндоскопических методов диагностики более 70—80% впервые выявленных больных раком легкого имеют III—IV стадию заболевания [2, 3]. По данным научно-исследовательских онкологических центов России, Великобритании и Америки смертность при злокачественных опухолях легкого крайне высокая и достигает 87% от числа заболевших [1—4].
Выделяют две основные клинико-морфологические формы рака легкого, отличающиеся степенью злокачественности, частотой и характером метастазирования: 1) немелкоклеточный рак легкого (НМРЛ) и 2) мелкоклеточный рак легкого (МРЛ). К НМРЛ относятся плоскоклеточный, крупноклеточный рак и аденокарцинома. Многие авторы и сейчас пользуются этой терминологией [2, 5, 6]. Но в последних публикациях, в том числе морфологической классификации Всемирной организации здравоохранения (ВОЗ) 2015 г., каждый гистологический тип рассматривается отдельно, понятие НМРЛ не используется, хотя остается легитимным [7, 8].
Считается, что при развитии очага центрального рака легкого эпителий трахеобронхиального дерева проходит следующие ступени канцерогенеза: трансформацию нормального эпителия в гиперпластический, формирование очагов метаплазии, дисплазии, рак in situ (CIS) и микроинвазивный рак [9].
Характеристика интраэпителиальных новообразований бронхиального дерева
Очаги тяжелой дисплазии и CIS слизистой оболочки бронхов, как правило, имеют весьма незначительные размеры: 1—10 мм по плоскости и 200—300 мкм по толщине и не имеют статистически достоверного риска метастазирования [10, 11].
Микроскопические различия интраэпителиальных предраковых новообразований легких представлены в табл. 1.

Таблица 1. Микроскопические признаки плоскоклеточной дисплазии эпителия бронхов различной степени и CIS (W. Travis и соавт. [7])
В случаях формирования очагов дисплазии виде папиллярных структур, с образованием протрузий, приподнятых эпителиальных образований используется понятие ангиогенная плоскоклеточная дисплазия, которая является более агрессивной в динамике своего развития по сравнению с плоскими очагами [12].
Анализ работ, посвященных естественному развитию преинвазивных неоплазий, показал, что уровень прогрессии CIS до инвазивной опухоли оценивали от 39 до 69%, в зависимости от исследуемой группы и длительности наблюдения [13, 14]. В исследовании R. Breuer и соавт. [15] опубликованы результаты, согласно которым 32% очагов тяжелой дисплазии и 9% случаев легкой/средней дисплазии прогрессировали до CIS или инвазивной карциномы за период наблюдения от 11 до 21 мес, но при этом наблюдалась регрессия в 54% преинвазивных неоплазий разных типов.
Начальные формы инвазивного рака легкого
Согласно данным ВОЗ (2015 г.) диагноз микроинвазивная карцинома устанавливается в случае [16], когда:
— размер опухоли ≤3 см ;
— инвазивный компонент ≤5 мм.
К понятию ранний центральный рак легкого относится: рентгеннегативная опухоль, определяемая при бронхоскопии, доступная для верификации с помощью щипцовой биопсии; рост опухоли ограничен внутренними слоями стенки бронха; отсутствуют отдаленные метастазы и не вовлечены медиастинальные лимфатические узлы [17, 18].
Лучевые методы диагностики
Среди основных лучевых методов исследования для выявления рака легкого используются флюорография, рентгенография органов грудной клетки, рентгеновская компьютерная томография (КТ). Главным недостатком флюорографии легких при диагностике рака легкого является низкий уровень чувствительности и точности, а доля ложноположительных и ложноотрицательных заключений достигает 30% [19].
Согласно последним рекомендациям AJCC, рентгенография органов грудной клетки из-за низкой эффективности не рекомендована для скрининга рака легкого [20]. Для скринингового исследования в группах риска развития рака легкого рекомендуется проведение низкодозированной спиральной компьютерной томографии (СКТ) органов грудной клетки [21].
Однако центральные, поверхностно-распространяющиеся опухоли, рост которых происходит без сужения и деформации просвета, даже с помощью КТ, чаще всего выявляют уже в стадии специфической лимфаденопатии.
Цитологическое исследование мокроты
Классическим недорогим и неинвазивным методом скрининга центрального рака легкого является цитологическое исследование мокроты. Образец мокроты считается адекватным при наличии в ней макрофагов или бронхиальных альвеолярных клеток [23]. Однако большим недостатком этого метода является низкая чувствительность, которая в среднем не превышает 65% [24], из-за ошибки забора материала, технических трудностей подготовки материала, а также значительной вариабельности согласованности между специалистами. Вероятность обнаружения атипичных клеток в мокроте увеличивается при центральной локализации рака легкого, большом размере опухоли, более прогрессивных стадиях рака, плоскоклеточном раке (в отличие от аденокарциномы) [25].
Эндоскопические методы диагностики
Еще в 460—370 гг. до нашей эры Гиппократ пытался интубировать дыхательные пути пациентам, нуждающимся в экстренной нормализации дыхания. В 1895 г. отоларинголог Г. Киллиан впервые доложил об удалении инородного тела из правого главного бронха пациента с помощью ригидного бронхоскопа Я. Микулича [26].
Современное бронхологическое исследование является основным методом выявления и диагностики скрытых, ранних, рентгеннегативных форм центрального рака легкого [27, 28].
Последние десятилетия стремительно развиваются эндоскопические методики, такие как бронхоскопия с высоким разрешением изображения, аутофлюоресцентная (autofluorescence bronchoscopy (AFB)) и узкоспектральная эндоскопия (narrow band imaging (NBI)). Параллельно в разных странах идет разработка стандартов трактовки эндоскопического изображения, получаемого с помощью этих методик [29].
Бронхоскопия в белом свете
Бронхоскопия в белом свете (white light bronchoscopy (WLB)) является стандартной современной эндоскопической методикой исследования дыхательных путей, которая имеет наибольшую доказательную базу. Согласно последним (2013) клиническим рекомендациям [31] Американского Колледжа Торакальных Врачей (American College of Chest Physicians), WLB рекомендована для обследования:
— при подозрении на центральный рак легкого по результатам лучевых методов диагностики;
— при выявлении атипических клеток в цитологическом анализе мокроты;
— для динамического наблюдения при преинвазивной неоплазии бронхиального дерева;
— для обследования пациентов с инвазивным центральным раком легкого с целью уточнения границ опухоли и выявления мультифокальных дополнительных очагов рака легкого.
Несмотря на очевидные преимущества WLB в диагностике раннего центрального рака легкого по сравнению с КТ, бронхоскопия в белом свете лимитирована в идентификации интраэпителиальных очагов рака малого размера [30, 31]. Многочисленные исследования подтверждают, что сочетание WLB и новых эндоскопических технологий, таких как AFB и NBI улучшают диагностику предопухолевой патологии и ранних, малоинвазивных форм рака легкого [32—34].
Аутофлюоресцентная бронхоскопия
Спектроскопические диагностические методики исследования принято делить на фотодинамическую диагностику, при которой используются экзогенные и эндогенные фотосенсибилизаторы, и аутофлюоресцентную диагностику, основанную на регистрации флюоресцентной активности эндогенных флюорофоров и изменения оптических свойств очагов неоплазии слизистой оболочки бронхов за счет изменения концентрации в ткани аминокислот, коллагена, эластина и дыхательных ферментов (НАДН и др.) [35, 36]. Изменения аутофлюоресценции ткани связаны со многими факторами: с изменением концентрации и глубины распределения эндогенных флюорофоров; с нарушением тканевой микроархитектоники с увеличением толщины слизистой оболочки и нарушением структуры ее слоев; с изменением степени васкуляризации (концентрации гемоглобина); с изменением уровня обмена веществ в патологически измененной ткани [37, 38].
В современных эндоскопических системах в режиме аутофлюоресценции при освещении слизистой оболочки используется свет длиной волны 395—475 нм для индукции феномена аутофлюоресценции и узкий зеленый спектр света (G-спектр, 500 нм) для фиксирования отраженного изображения. Естественная собственная флюоресценция тканей и отраженный зеленый свет фиксируются специальной сверхчувствительной ПЗС-матрицей, которая располагается на дистальном конце эндоскопа. При этом электронная система искусственно окрашивает аутофлюоресцентное изображение нормальной ткани в зеленый цвет, очаги неоплазии и рака — в пурпурный цвет, синий цвет или в виде темного пятна. Полученные изображения суммируются и отображаются на экране [39].
Большинство авторов считают, что применение AFB повышает частоту выявления скрытых очагов интраэпителиальной неоплазии [40—46].
Основным недостатком AFB является ее низкая специфичность. Выявление значительного количества ложнопозитивных очагов приводит к большому количеству бесполезных гистологических исследований [47].
Узкоспектральная бронхоскопия
NBI — это сравнительно новая эндоскопическая диагностическая методика, которая представлена как альтернативная технология для оценки бронхиального эпителия и выявления раннего рака легкого [48].
Обычно при эндоскопическом исследовании используется весь видимый световой спектр от 400 до 800 нм. Для NBI-режима применяется освещение с использованием двух световых волн длиной 415 и 540 нм в диагностике сосудистых структур слизистой оболочки, так как эти световые волны хорошо поглощаются гемоглобином. Это позволяет получить детальное изображение сосудистого рисунка тканей, его изменений, характерных для патологических участков воспалительного генеза, а также для предраковых заболеваний и ранних форм рака [49].
Основоположник классификации сосудистого рисунка патологических новообразований бронхиального эпителия — K. Shibuya. В 2010 г. К. Shibuya и соавт. [49] опубликовали классификацию, в которой выделили 4 типа патологического сосудистого рисунка: извитые сосуды, точечные сосуды, спиралевидные и штопорообразные сосуды. При этом были измерены диаметры сосудов в патологическом очаге. Авторы показали, что сочетание вышеуказанных типов сосудистого рисунка соответствует неоплазии различной степени злокачественности (табл. 2).

Таблица 2. Распределение типов сосудистого рисунка при разных центральных новообразованиях легких [49]
Была доказана высокая чувствительность и специфичность NBI-режима в сочетании с бронхоскопией высокого разрешения в белом свете для выявления патологии сосудистого рисунка и подтверждена связь степени злокачественности образования с увеличением диаметра сосудов слизистой оболочки.
Другие авторы [50—52] провели исследования по изучению возможностей NBI для анализа изменений сосудистого рисунка (архитектоники) слизистой оболочки бронхиального дерева при проведении дифференциальной диагностики воспалительных и неопластических изменений.
Существует только одно проспективное исследование F. Herth и соавт. [53] по сравнению эффективности WLI, NBI и AFB. Авторы считают, что NBI может существенно увеличить специфичность в диагностике и идентификации эндобронхиальных очагов. В будущем методики NBI и AFI должны дополнять друг друга при комплексном обследовании пациентов с онкологической патологией легких.
Не решенной на данный момент задачей остается отсутствие единой валидизированной NBI-классификации сосудистых рисунков новообразований трахеобронхиального дерева.
Увеличительная бронхоскопия
Увеличительная бронхоскопия — это новейшая эндоскопическая методика, которая позволяет получить изображение поверхности слизистой оболочки бронхов с 100—110-кратным увеличением, благодаря чему возможна детальная оценка микрососудистой сети [49]. Она не является скрининговой и не имеет широкого распространения. Однако в крупных научных центрах уже ведутся работы по изучению и внедрению методики увеличительной бронхоскопии.
Таким образом, в настоящее время существует большой арсенал диагностических методик для выявления предопухолевой патологии и рака легкого на ранних стадиях. Ведущую роль в диагностике центрального рака легкого играет эндоскопический метод, который, благодаря современным методикам, позволяет быстро и эффективно выявлять изменения слизистой оболочки трахеобронхиального дерева на разных стадиях опухолевого процесса. Одним из перспективных направлений в совершенствовании современных эндоскопических методик является разработка автоматизированных систем поддержки принятия клинического решения, которые помогают врачу в интерпретации многофакторного эндоскопического исследования при использовании сложных эндоскопических оптических технологий.
Читайте также:

