Что такое кожное депо
Обновлено: 24.04.2024
В представленной статье обобщены современные данные о строении и функции эпидермального барьера, рассмотрены вопросы его роли в развитии атопического дерматита.
This article summarizes current data on the structure and function of the epidermal barrier, we also considered its role in development of atopic dermatitis.
С тех пор как наземная жизнь стала угрожать млекопитающим обезвоживанием, все более становятся актуальными исследования структурных, клеточных, биохимических и регуляторных механизмов организма, участвующих в поддержании гомеостаза проницаемости эпидермального барьера [1].
Кожа обеспечивает жизненно важную функцию, защищая позвоночных от повседневных и экстремальных влияний факторов внешней среды, таких как воздействие антигенов, ультрафиолетового света, моющих средств, микроорганизмов, токсинов, наночастиц и иных повреждений [2]. Таким образом, эпидермальный барьер, являясь физическим барьером [3], обеспечивает защиту организма на границе двух сред, ограничивая как потерю воды из организма, так и попадание патогенных микроорганизмов в организм [4].
Важнейшая составная часть эпидермального барьера, от которой зависит проникновение раздражителей и аллергенов, находится в нижней части рогового слоя [5]. Несмотря на минимальные размеры (толщина около 7–35 мкм), он играет определяющую роль в формировании защитного барьера и способствует предотвращению чрезкожного проникновения патогенов. Кроме роли физического барьера, роговой слой участвует в терморегуляции, газообмене, гидратации, обеспечении врожденного иммунитета, а создавая определенную pH поверхности кожи (слегка кислую), обеспечивает дополнительную защиту от болезнетворных микроорганизмов [6].
Во время терминальной дифференцировки кератиноциты зернистого слоя «заменяют» свою клеточную мембрану на нерастворимый белковый слой — роговую оболочку [7]. Она придает прочность корнеоцитам и является «платформой» для прикрепления липидов. Роговая оболочка в основном сформирована структурными белками, такими как лорикрин, инволюкрин, филаггрин (ФЛГ) и малыми пролин-богатыми белками. Особенно важен филаггрин, объединяющий кератиновые волокна клеток, «скручивая» кератиноциты в уплощенные диски с большой площадью поверхности [8].
Вокруг корнеоцитов расположены холестерин, фосфолипиды и церамиды, создавая многослойную мембрану из липидных пластинок [3, 9]. Последние играют важную роль в регуляции водного гомеостаза кожи, помогают сохранять воду в организме, а также предотвращают проникновение патогенных микроорганизмов и аллергенов [10].
На границе между роговым и зернистым слоями происходит секреция ламеллярных телец, содержащих предшественники липидов, а также необходимые ферменты для переработки этих прекурсоров в зрелые составляющие липидной матрицы [11]. Перед секрецией происходит сборка ламеллярных телец в пластинчатом комплексе, посредством дифференцированной их упаковки с различным содержимым [12]. Кроме вышеупомянутых метаболитов липидов, липидные тельца доставляют в межклеточное пространство рогового слоя протеолитически активные ферменты, такие как сериновые протеазы семейства калликреина, а также их ингибиторов, в том числе и лимфоэпителиальный ингибитор сериновых протеаз типа Kazal-5 (LEKTI) [13].
Единство между корнеоцитами рогового слоя зависит прежде всего от корнеодесмосом. Подобно десмосомам, они поддерживают целостность тканей посредством молекул межклеточной адгезии с помощью кальций-зависимых взаимодействий между двумя представителями семейства кадгерина, внеклеточных трансмембранных гликопротеинов — десмоглеина и десмоколлина. Внутри корнеоцитов десмоглеин и десмоколлин соединяют кератиновые филламенты корнеодесмосом посредством «соединительной бляшки», состоящей из плакоглобина, десмоплакина и плакофиллина. Десмоглеин и десмоколлин перемещаются от оболочки корнеоцитов в липидную пластину между корнеоцитами и связывают воедино белки соседних клеток. Кроме того, в процессе кератинизации эпителия экспрессируется специфический белок с молекулярной массой 52 кДа — корнеодесмосин [8, 14]. После секреции в экстрацеллюлярное пространство корнеодесмосин перемещается в область между зернистым и роговым слоями и проникает в десмосому. Появление корнеодесмосина знаменует переход от десмосом к корнеодесмосомам [3, 12].
Во время «нормальной» десквамации рогового слоя самые поверхностные корнеоциты «уходят» с поверхности кожи, замещаясь кератиноцитами, подвергшимися терминальной дифференцировке [14, 15]. Таким образом, существует «тонкий» баланс между базальной клеточной пролиферацией и десквамацией рогового слоя. Это обеспечивает постоянное обновление клеток эпидермиса, а также способствует поддержанию одинаковой толщины эпителия [14, 16]. Caubet и соавт. [15] описали несколько деградационных протеаз, которые разрушают внеклеточные корнеодесмосомальные адгезивные белки, связывающие корнеоциты вместе.
В роговом слое среди протеаз, вовлеченных в процесс десквамации, присутствуют хемотрипсиновые (SCCE) и трипсиновые ферменты (SCTE), которые экспрессируются кератиноцитами зернистого слоя и находятся во внеклеточном пространстве рогового слоя [14]. Данные протеазы гидролизуют корнеодесмосин и десмоколлин [15]. Их активность контролируется семейством специфических ингибиторов, в которое входит LEKTI [17]. При этом скорость десквамации коррелирует с количеством ингибиторов протеаз, поступивших из ламеллярных телец [3].
На барьерную функцию эпидермиса влияют структура, дифференцировка, функциональная активность кератиноцитов, качественный и количественный состав липидов рогового слоя эпидермиса, наличие веществ, относящихся к естественному увлажняющему фактору, а также рН поверхности кожи [18]. При изменении каких-либо из перечисленных показателей барьерная функция эпидермиса нарушается, что приводит к усиленному испарению воды через роговой слой. У человека эпидермальный барьер восстанавливается на 60% через 12 часов, а полное восстановление занимает 72 часа [19]. Полагают, что быстрое восстановление эпидермального барьера происходит за счет массового выброса из клеток готовых ламеллярных телец. В медленную фазу восстановления усиливается синтез жирных кислот, холестерина, церамидов, а также образование новых ламеллярных гранул. Нарушение восстановления кожного барьера приводит к обезвоживанию эпидермиса и развитию выраженной сухости кожи, что и наблюдается при развитии атопического дерматита (АД) [20].
Повреждение эпидермального барьера способствует проникновению через кожу микробов, аллергенов и различных поллютантов (токсины, раздражающие и загрязняющие вещества). Проникновение агентов с антигенными свойствами увеличивает риск сенсибилизации, поскольку взаимодействие аллергенов и аллерген-представляющих клеток кожи инициирует воспаление [14]. Степень дисфункции барьера коррелирует со степенью воспаления и тяжестью АД [11]. Впервые Y. Werner и M. Lindberg (1985 г.) привели доказательства нарушений барьерной функции кожи, измерив трансэпидермальную потерю воды (ТЭПВ) у лиц с АД. Авторам удалось показать, что у больных АД нарушения эпидермального барьера отмечаются не только в очагах активного воспаления, но и на клинически неизмененной коже [10, 21].
Изменения в свойствах эпидермального барьера, которые наблюдаются при АД, включают увеличение ТЭПВ, изменения рН поверхности кожи, повышение ее проницаемости, увеличение бактериальной колонизации, изменение в экспрессии антимикробных пептидов, а также нарушение его целостности. При аномалии эпидермального барьера аллергены, раздражающие и другие вещества могут проникать через кожу, способствуя обострению АД [6].
В настоящее время нарушение функции кожного барьера является одним из ведущих этиопатогенетических факторов АД. По данным разных авторов у 30–66% больных АД протекает без изменения уровня общего IgE в сыворотке крови и специфичных IgE к аллергенам. Полагают, что именно у этих пациентов нарушение функции кожного барьера играет ведущую роль в развитии и прогрессировании заболевания [22].
В последние годы определен ряд генетических мутаций, приводящих к изменениям в роговом слое эпидермиса. Так, у больных АД определяются мутации гена профилаггрина [23], способствующие нарушению синтеза белка ФЛГ — одного из компонентов цитокератинового скелета, обеспечивающего ороговение кератиноцитов. В результате изменения терминальной дифференцировки кератиноцитов развивается их функциональная несостоятельность [24]. Кроме того, снижение экспрессии гена ФЛГ уменьшает уровень «натурального увлажняющего фактора» [25]. Дефицит ФЛГ и/или продуктов его деградации способствует сухости кожи, что коррелирует с клинической картиной нарушения эпидермального барьера при АД [26]. Более того, при уменьшении ФЛГ усиливается «раздражающий» эффект аллергенов на дендритные клетки, понижая при этом порог их чувствительности к воспалению, что демонстрирует важность этого белка в предотвращении пенетрации аллергенов [27].
Кроме того, у больных АД выявлены полиморфные варианты гена SPINK5, приводящие к дизрегуляции синтеза ингибитора сериновой протеазы LEKTI, который в норме блокирует избыточную продукцию SCCE [28]. Активность деградационных протеаз также значимо связана с дефектом кожного барьера при АД [23]. Разбалансировка функционирования этих ферментов ведет к усиленному отшелушиванию клеток и истончению рогового слоя, увеличивая проницаемость эпидермального барьера [14]. Установлено, что у больных АД изменена липидная мантия рогового слоя, предупреждающая ТЭПВ. Отмечается низкий уровень церамидов первого и третьего типов в сочетании с повышением уровня свободного холестерола [29]. Повышение уровня рН на поверхности кожи приводит к снижению синтеза липидов и активизации ферментов (в частности, SCCE), повреждающих корнеодесмосомы. Уменьшение количества веществ, относящихся к «натуральному увлажняющему фактору», также способствует нарушению функционирования эпидермального барьера [30].
Таким образом, у больных АД отмечается комплекс нарушений, приводящих к дисфункции кожного барьера, усилению ТЭПВ и обезвоживанию кожных покровов [14]. Из вышеуказанного следует, что пациенты с АД могут иметь дефект кожного барьера, в основе которого лежат как генетические, так и приобретенные механизмы. Этот дефект способны спровоцировать внешние факторы, такие как царапины, использование моющих средств, микробная колонизация, а также воздействие протеаз различных аллергенов (в частности, протеаз клещей домашней пыли) [10]. Распознание конкретных механизмов, участвующих в патогенезе воспалительных заболеваний кожи, в частности, АД, безусловно, будет способствовать поиску и разработке новых, более эффективных методов воздействия на патологический процесс с минимальным количеством системных эффектов [8].
Литература
- Elias P. M. The skin barrier as an innate immune element // Semin. Immunopathol. 2007. Vol. 29 (1); р. 3–14.
- De Benedetto A., Kubo А., Beck L. A. Skin barrier disruption — a requirement for allergen sensitization? // J. Invest. Dermatol. 2012. Vol. 132 (3); р. 949–63.
- Danby S. G., Cork M. J. New understanding of atopic dermatitis: the role of epidermal barrier dysfunction and subclinical inflammation. // J. Clin. Dermatol. 2010. Vol. 1 (2); р. 33–46.
- Котлуков В. К., Кузьменко Л. Г., Антипова Н. В. Наружные дерматологические средства серии «Бепантен» в практике педиатра // Медицинский совет. 2012. Т. 5; с. 81–85.
- Madison K. С. Barrier function of the skin: «la raison d’etre» of the epidermis // J. Invest. Dermatol. 2003. Vol. 121; р. 231–241.
- Lorena S. T., Morello III A. P., Mack Correa M. C. et al. The infant skin barrier: can we preserve, protect, and enhance the barrier? // Dermatol. Res. Pract. 2012. Doi: 10.1155/2012/198789.
- Candi E., Schmidt R., Melino G. The cornified envelope: a model of cell death in the skin // Nat. Rev. Mol. Cell Biol. 2005. Vol. 6; р. 328–340.
- Michael J. C., Simon G. D., Yiannis V. et al. Epidermal barrier dysfunction in atopic dermatitis // J. Invest. Dermatol. 2009. Vol. 129; р. 1892–908.
- Ревякина В. А. Современные тенденции в комплексной наружной терапии атопического дерматита у детей // Лечащий Врач. 2014. № 6, с. 38.
- De Benedetto А., Agnihothri R., McGirt L. Y. et al. Atopic dermatitis: a disease caused by innate immune defects? // J. Invest. Dermatol. 2009. Vol. 129; р. 14–30.
- Roelandt T., Thys B., Heughebaert C. et al. LEKTI-1 in sickness and in health // Int. J. Cosmetic Sci. 2009. Vol. 31 (4); р. 247–254.
- Ishida-Yamamoto A., Simon M., Kishibe M. et al. Epidermal lamellar granules transport different cargoes as distinct aggregates // J. Invest. Dermatol. 2004. Vol. 122; р. 1137–1144.
- Ishida-Yamamoto A., Deraison C., Bonnart C. et al. LEKTI is localized in lamellar granules, separated from KLK5 and KLK7, and is secreted in the extracellular spaces of the superficial stratum granulosum // J. Invest. Dermatol. 2005. Vol. 124; р. 360–366.
- Cork M. J., Robinson D. A., Vasilopoulos Y. et al. New perspectives on epidermal barrier dysfunction in atopic dermatitis: gene-environment interactions // J. Allergy Clin. Immunol. 2006. Vol. 118; р. 3–21.
- Caubet C., Jonca N., Brattsand M. et al. Degradation of corneodesmosome proteins by two serine proteases of the kallikrein family, SCTE/KLK5/hK5 and SCCE/KLK7/hK7 // J. Invest. Dermatol. 2004. Vol. 122; Р. 1235–1244.
- Goldstein A. M., Abramovits W. Ceramides and the stratum corneum: structure, function, and new methods to promote repair // Int. J. Dermatol. 2003. Vol. 42; р. 256–59.
- Chavanas S., Bodemer C., Rochat A. Mutations in SPINK5, encoding a serine protease inhibitor, cause Netherton syndrome // Nat. Genet. 2000. Vol. 25; р. 141–142.
- Мурашкин Н. Н. Нарушения дермального барьера как фактор хронизации дерматозов в детском возрасте, подходы к терапии: теоретические и практические инновации // Лечащий Врач. 2014. № 6, с. 19.
- Эрнандес Е., Марголина А., Петрухина А. Липидный барьер кожи и косметические средства // Косметика и медицина. 2005. Т. 6; с. 35–38.
- Тамразова О. Б. Синдром сухой кожи // Дерматология. Приложение к журналу Consilium Medicum. 2014. Т. 3; с. 25–31.
- Хлебникова А. Н. Увлажняющие средства в терапии хронических дерматозов // Клиническая дерматология и венерология. 2010. Т. 4; с. 32–39.
- Palmer C. N., Irvine A. D., Terron-Kwiatkowski A. et al. Common loss-of-function variants of the epidermal barrier protein filaggrin are a major predisposing factor for atopic dermatitis // Nat. Genet. 2006. Vol. 38 (4); р. 441–446.
- Молочков А. В., Тамразова О. Б. Ксероз кожи — основной патогенетический фактор развития атопического дерматита // Дерматология. Приложение к журналу Consilium Medicum. 2014. Т. 4; с. 48–54.
- Vasilopoulos Y., Cork M. J., Murphy R. et al. Genetic association between an AACC insertion in the 3’UTR of the stratum corneum chymotryptic enzyme gene and atopic dermatitis // J. Invest. Dermatol. 2004. Vol. 123; р. 62–66.
- Smith F. J., Irvine A. D., Terron-Kwiatkowski A. et al. Loss-of-function mutations in the gene encoding filaggrin cause ichthyosis vulgaris // Nat. Genet. 2006. Vol. 38 (3); р. 337–342.
- Nemoto-Hasebe I., Akiyama M., Nomura T. et al. Clinical severity correlates with impaired barrier in? laggrin-related eczema // J. Invest. Dermatol. 2009. Vol. 129 (3); р. 682–689.
- Fallon P. G., Sasaki T., Sandilands A. et al. A homozygous frameshift mutation in the mouse Flg gene facilitates enhanced percutaneous allergen priming // Nat. Genet. 2009. Vol. 41 (5); р. 602–608.
- Kato A., Fukai K., Oiso N. et al. Association of SPINK5 gene polymorphisms with atopic dermatitis in the Japanese population // Br. J. Dermatol. 2003. Vol. 148; р. 665–669.
- Пампура А. Н., Чусляева А. А. Современные подходы к терапии атопического дерматита у детей // Медицинский вестник Башкортостана. 2014. Т. 9 (1); с. 93–98.
- Eberlein-Konig B., Schafer T., Huss-Marp J. et al. Skin surface pH, stratum corneum hydration, transepidermal water loss and skin roughness related to atopic eczema and skin dryness in a population of primary school children // Acta Dermatol. Venereol. 2000. Vol. 80; р. 188–191.
С. В. Левашева 1 , кандидат медицинских наук
Э. И. Эткина, доктор медицинских наук, профессор
Л. Л. Гурьева, кандидат медицинских наук
Л. И. Бабенкова, кандидат медицинских наук
Л. Я. Данилова
С. Э. Якута
10 лет назад исполнилось двести лет, со дня введения в клиническую практику метода лекарственного электрофореза. Несмотря на многолетнюю историю и наличие большого количества различных физических методов лечения. ЭЛФ сегодня широко и повсеместно применяется, более того, это динамически развивающийся физиотерапевтический метод, который пополняется новыми частными методиками и новыми оригинальными техниками.
Лекарственный электрофорез (ионофорез) – особый электрофармакотерапевтический метод, в основе которого лежит сочетанное действие на организм постоянного электрического тока и вводимых с его помощью лекарственных средств.
- Кожное депо ионов - это длительная задержка вводимых лекарств в коже, что приводит:
- к созданию высокой локальной концентрации лекарственных веществ, что важно для лечения местных патологических процессов;
- длительное действие вводимых препаратов и лечебного эффекта;
- нет необходимости часто вводить лекарственные препараты.
- Вводимые вещества поступают в организм в «активной» форме, в виде ионов.
- Строгая локализация действия лекарственного вещества (воздействие непосредственно на патологический очаг).
- Практически отсутствие побочного воздействия и аллергических реакций на вводимые препараты.
- Безболезненное введение лекарственных веществ.
Особые методики ЭЛФ:
- Внутритканевой лекарственный электрофорез.
- Электродрегинг.
- Пролонгированный электрофорез.
- Микроэлектрофорез.
- Аэроэлектрофорез.
- Лабильный электрофорез.
Одновременно с электрофорезом можно проводить и грязевые процедуры (грязеэлектрофорез) – сочетанное воздействие постоянного электрического тока и разносторонним многокомпонентным составом лечебной грязи.
Для электрогрязелечения наряду с нативной грязью, могут использоваться фармакопейные препараты:
- ФиБС - биогенный стимулятор из отгона лиманной грязи;
- Пелоидодистиллят – также продукт лиманной грязи;
- пелоидин – экстракт из сульфидной иловой грязи (в т.ч. Биоль);
- гумизоль – препарат из морской лечебной грязи.
Криоэлектрофорез – новый сочетанный физиотерапевтический метод, использующий плюсы ЭЛФ и эффекты криотерапии: обезболивающий, миорелаксирующий, противовоспалительный и спазмолитический.
Электростимуляция
Электростимуляция – функциональная терапия, метод применения импульсного тока, в целях укрепления и развития определенных органов или систем.
Чаще всего данный физиотерапевтический метод применяется при двигательных нарушениях мышц и нервов. Впрочем, данный метод используют и для стимуляции работы ослабленных внутренних органов.
Противопоказания: общие для физиотерапевтических процедур.
Институт биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова РАН, Москва, 117997, Российская Федерация
ФГОУ Институт повышения квалификации Федерального медико-биологического агентства РФ, Москва
Роль липидов в барьерных свойствах кожи
Институт биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова РАН, Москва, 117997, Российская Федерация
Кожа обеспечивает защиту от механических, тепловых, химических повреждений; имеет собственную иммунную систему; регулирует количество воды в организме; помогает вырабатывать витамин D и ряд гормонов. Все эти функции обеспечиваются различными механизмами, ключевым из которых является целостность барьера, в значительной степени опосредованная структурой рогового слоя эпидермиса. Кожа состоит из слоев эпидермиса, дермы и подкожной жировой клетчатки и пронизана потовыми и жировыми железами и порами, сосудами, нервными волокнами и волосяными мешочками. Верхний слой формируют мертвые клетки (корнеоциты), что обеспечивается дифференцировкой и гибелью кератиноцитов зернистого слоя. В процессе ороговения в кератиноцитах включается синтез ряда белков, уплотняется мембрана клеток, агрегируют промежуточные кератиновые филаменты, высвобождаются во внеклеточное пространство липиды и белки в составе ламеллярных телец (тельца Одланда), выбрасываются органеллы, что обусловливает уплощение клеток, связанных между собой прослойкой липидов, как клеем, и обеспечивает дополнительный непроницаемый для воды барьер. В норме липидная прослойка состоит на 50% из церамидов, на 30% — из холестерина, 20% составляют свободные жирные кислоты (в том числе омега-3, -6 и -9), а также ферменты и белки. При различных заболеваниях нарушается баланс липидов ламеллярных телец, что сопровождается повышенной потерей воды, нарушением процесса ороговения, воспалением. Топические препараты, содержащие аналоги природных липидов, такие как сенсодерм, не только восстанавливают гомеостаз кожи, но и снижают побочные эффекты, вызванные терапевтическими кортикостероидными препаратами.
Институт биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова РАН, Москва, 117997, Российская Федерация
ФГОУ Институт повышения квалификации Федерального медико-биологического агентства РФ, Москва
В настоящее время имеются научные доказательства о генетически детерминированных нарушениях барьерных свойств кожи, что облегчает проникновение аллергенов в глубь кожи, повышает склонность к воздействию раздражающих факторов и, в конечном итоге, способствует воспалению. Дефицит филаггрина — наиболее изученная аномалия, в результате которой возрастает трансэпидермальная потеря воды (ТЭПВ). Помимо этого, дефицит межклеточных липидов в роговом слое и нарушенное соотношение между холестерином, незаменимыми жирными кислотами и церамидами усиливает ТЭПВ, что обусловливает образование эпидермальных микротрещин. Нарушение целостности барьерного слоя кожи ведет к нарушению метаболизма кожи и воспалению, что является ключевым промежуточным звеном патогенеза атопического дерматита (АтД) и ряда других дерматологических заболеваний. Базовым элементом терапии АтД, помимо устранения контакта со специфическими и неспецифическими провоцирующими факторами, является восстановление нарушенной барьерной функции кожи путем применения топических гидратирующих и защитных средств. Наружное применение смягчающих средств — одна из важных стратегий лечения АтД и многих других дерматозов для восстановления барьерной функции кожи.
Структура и свойства кожи
Кожа — самый большой орган человека; ее масса составляет 11—15% от массы тела. Кожа обеспечивает несколько важнейших функций: является барьером, отделяющим окружающую среду от внутренней; защищает от механических, тепловых, химических повреждений; регулирует количество воды в организме; обеспечивает осязание; защищает от инвазии патогенов, обеспечивает персистенцию симбиотических микроорганизмов; помогает вырабатывать витамин D и ряд гормонов.

Кожа состоит из слоев эпидермиса, дермы и подкожной жировой клетчатки (см. рисунок, Структура кожи. а — тонкий слой кератиноцитов (эпидермис), дерма и подкожная жировая клетчатка, составляющие основную массу кожи; б, в — кератиноциты в процессе дифференцировки уплощаются и формируют роговой слой, состоящий из мертвых клеток; г — слущивание верхнего слоя; д, е, ж — кератиноциты шиповатого слоя вырабатывают липидную смазку, состоящую из молекул церамидов, холестерина и СЖК (в том числе омега-3, -6, -9), для удержания клеток рогового слоя. Примечание. Церамиды в области полярной части, прикрепленной к мертвым кератиноцитам, формируют малоподвижную псевдокристаллическую решетку; средняя часть липидной прослойки формируется хвостами жирных кислот и холестерином и имеет текучесть (зона текучести отмечена линиями), что обеспечивает эластичность рогового слоя. а). Дерма пронизана потовыми и жировыми железами и порами, сосудами, нервными волокнами и волосяными мешочками. Эпидермис состоит из многослойного ороговевающего эпителия, представленного кератиноцитами. Верхний слой формируют «мертвые» клетки (роговой слой), называемые корнеоцитами. Формирование рогового слоя обеспечивается дифференцировкой и гибелью кератиноцитов верхнего слоя по типу апоптоза, называемой ороговением (cornification). В процессе ороговения в кератиноцитах включается синтез ряда белков (кератины, лорикрин, инволюкрин, филаггрин); уплотняется мембрана клеток; агрегируют промежуточные кератиновые филаменты; высвобождаются во внеклеточное пространство липиды и белки в составе ламеллярных телец (тельца Одланда); выбрасываются органеллы, что в результате обусловливает уплощение клеток, связанных между собой прослойкой липидов, обеспечивающей дополнительный не проницаемый для воды барьер (см. рисунок, б, в) [1, 2].
Одним из наиболее важных белков, участвующих и регулирующих ороговение, является филаггрин. В процессе дифференцировки кератиноцитов в корнеоциты филаггрин формируется из предшественника белка — профилаггрина, который сохраняется в кератогиалиновых гранулах. Высвобождение и модификация профилаггрина в филаггрин вызывают агрегацию кератиновых филаментов и гибель клеток. Мутации в гене филаггрина часто выявляют у больных при АтД, астме и других дерматологических заболеваниях [3, 4].
Поверхностный слой эпидермиса состоит уже из частиц, которые постепенно отшелушиваются (см. рисунок, г). Для удержания чешуек вместе и сохранения целостности барьера кожа вырабатывает липидный клей, состоящий преимущественно из церамидов.
Церамиды и другие липиды рогового слоя
Липидная прослойка между «мертвыми» клетками состоит на 50% из молекул, называемых церамидами, на 30% из холестерина, 20% составляют свободные жирные кислоты (СЖК; в том числе омега-3, -6, -9), а также ферменты (протеазы, фосфатазы, глюкозидазы, липазы), а также белки (корнеодесмозин, катепсин D). Мембрана ламеллярных телец имеет контакт с аппаратом Гольджи [5]. Липиды ламеллярных телец (ЛТ) рогового слоя значительно отличаются от липидов мембран живых клеток. В них содержатся фосфолипиды и сфинголипиды, из которых под действием фосфолипазы А2 и бета-глюкоцереброзидазы синтезируются церамиды.
Структурно церамид состоит из двух молекул: сфингозидного полярного основания и жирной гидрофобной кислоты, соединенных амидной связью (см. рисунок, д).
Сфингозид через систему мембран аппарата Гольджи связан с клетками рогового слоя; жирные кислоты заполняют межклеточное пространство перпендикулярно пластам клеток (см. рисунок, е, ж). Красной линией отмечено расположение липидов между слоями клеток. Церамиды в области полярной части, прикрепленной к «мертвым» кератиноцитам, формируют малоподвижную псевдокристаллическую решетку; средняя часть липидной прослойки образована хвостами жирных кислот, имеющих меньший объем, чем сфингозиды, что обеспечивает их большую подвижность. Между ними пространство заполняется холестерином и СЖК, не связанными с церамидами, что обеспечивает текучесть (см. рисунок, е, ж) среднего пласта липидов. Таким образом, церамиды обеспечивают плотность рогового слоя, а средняя зона обеспечивает его эластичность.

Анализ структуры церамидов методом обращенно-фазовой жидкостной хроматографии в сочетании с квадрупольной времяпролетной масс-спектрометрией высокого разрешения показал, что вариантов комбинаций сфингозинов с жирными кислотами может быть более 1000 [6, 7]. В целом церамиды получаются комбинацией вариантов сфингозиновой полярной части и жирных кислот с разным числом атомов углерода (см. таблицу). Строительные блоки церамидов рогового слоя кожи млекопитающих В настоящий момент используют буквенную номенклатуру церамидов, где сфингозин обозначается S, фитосфингозин — Р, 6-гидроксисфингозин — Н и дигидросфингозин — dS (см. таблицу). Жирные кислоты, выявленные в составе церамидов, также представлены четырьмя типами: кислоты, не содержащие гидроксил в α позиции (N), содержащие гидроксил в положении α или ω атома углерода (А и О соответственно) и этерифицированный гидроксил в положении ω (ЕО), что в сумме дает 16 классов церамидов. В каждом классе длина хвоста жирной кислоты может быть различной.
Синтез церамидов
В состав церамидов чаще всего входят длинноцепочечные насыщенные жирные кислоты, содержащие от 14 до 26 атомов углерода. Церамиды в организме образуются тремя различными путями, а именно синтезируются de novo в эндоплазматическом ретикулуме клеток из серина и пальмитата в результате гидролиза сфингомиелинидазой сфингомиелина, являющегося составной частью клеточных мембран, и из остаточного сфингозина [8]. Синтез церамидов прямо зависит от количества жировых отложений в организме. Так, уровень сывороточных церамидов С16:0, С18:0, С24:0 и С24:1 достоверно повышен у людей с ожирением [8].
Характеристика липидного состава при заболеваниях
Впервые церамиды были открыты в головном мозге, откуда и получили свое название (cerebrum). Церамиды также являются компонентами липопротеидов крови. Концентрация церамидов в мозге и крови значительно ниже, чем в коже. Изменение количества церамидов в крови часто имеет диагностическое значение, например при болезни Альцгеймера [8—11].
В норме соотношение церамидов, холестерина и СЖК составляет 3:1:1. С возрастом снижается продукция липидов кожи, но соотношение не меняется [12]. При различных метаболических нарушениях концентрация липидов кожи, а также церамидов крови может служить прогностическим и диагностическим маркерами сердечно-сосудистых заболеваний, ожирения, сахарного диабета, инсулинорезистентности и неалкогольной жировой болезни печени [13—16].
При АтД нарушение состава липидов кожи ассоциировано с расстройством синтеза как церамидов, так и СЖК. M. Danso и соавт. [17] показали, что при АтД снижаются количество насыщенных и доля длинноцепочечных (С22—С28) СЖК, а также изменяется баланс церамидов разных классов. Так, повышается доля AS и NS церамидов и снижается доля ЕОН и ОН церамидов. Изменения в составе СЖК и церамидов ассоциированы с нарушением функциональной активности ферментов стеарол CoA десатуразы (церамиды) и элонгазы 1 (СЖК). Аналогичное повышение доли AS и NS церамидов выявляют также у детей с АтД [18].
Нарушение в составе и количестве церамидов кожи наблюдается также при акне. В целом разнообразие церамидов в коже больных не нарушено. Так, Pappas и соавт. идентифицировали 283 типа церамидов при снижении общего количества липидов и доли NH, AH, EOS и EOH церамидов [19]. При акне (так же, как и при АтД) наблюдают снижение количества длинноцепочечных (>С18) СЖК. Авторы заключили, что NH и AH церамиды наиболее важны для формирования нормального барьера кожи [19].
Имеются ограниченные данные по изменению состава и количества церамидов при псориазе. Показано снижение церамида EOS [20]. В то же время состав церамидов на не пораженных псориазом и АтД участках кожи не отличается от такового у здоровых доноров [21]. Данных по составу и количеству церамидов в коже больных розацеа нет. По-видимому, при розацеа липиды кожи находятся в пределах нормы. В большинстве случаев нарушение состава липидов кожи ассоциировано с повышенной ТЭПВ. Имеются ограниченные сведения, что при розацеа ТЭПВ повышается только в области лица, что может являться в большей степени результатом патологического процесса, чем генерализованного дисбаланса липидов кожи [22]. Этими же авторами показано, что при АтД повышенная ТЭПВ является генерализованной.
Компенсаторные механизмы при нарушении барьерной функции эпидермиса
При нарушении эпидермального барьера (травмы, воспаление, аутоиммунные процессы) в течение минут начинаются репаративные процессы. В первую очередь высвобождаются ЛТ из клеточных депо и начинается синтез de novo СЖК, а затем церамидов [23]. При наложении непроницаемой мембраны наблюдается подавление синтеза ЛТ, что препятствует восстановлению эпидермального барьера [24]. Процесс репарации стимулируется изменением градиента кальция в эпидермисе, вызванного локальной потерей воды [25]. Нанесение на кожу топических препаратов, содержащих СЖК, ускоряет восстановление барьерных свойств кожи за счет включения экзогенных СЖК в липидный слой эпидермиса [26]. Аналогичное действие оказывают и синтетические церамиды [27]. Однако в состав топических средств входит несколько компонентов, создающих на коже пленку. В большей степени они служат окклюзивным барьером, помогающим удерживать воду и снижать ТЭПВ, уменьшать зуд и обеспечивать экзогенными липидами и церамидами [28].
Терапия кожи увлажняющими средствами
Известно, что увлажняющие кожу средства оказывают положительный эффект при АтД, акне, псориазе, розацеа и многих других дерматологических заболеваниях. Ряд топических средств оказывает терапевтическое действие, снижая потерю воды, что приводит к частичному восстановлению барьерных свойств эпидермиса [29]. Включение в топические средства аналогов или природных церамидов, холестерина, омега-3, -6, -9, СЖК позволит ускорить репарацию кожи. Показано, что экзогенные компоненты ЛТ проникают через роговой слой в клетки зернистого слоя эпидермиса; проходят через эндоплазматический ретикулум в сеть аппарата Гольджи, где формируются ЛТ.
Показано, что использование увлажняющих препаратов замедляет прогрессию АтД и снижает тяжесть заболевания [30, 31]. K. Mori и соавт. [30] оценивали эффект геля на основе синтетических церамидов и экстракта эвкалипта в слепом клиническом исследовании 27 больных из Японии с умеренным АтД. Авторы показали, что в сухой летний период использование геля значительно улучшало состояние кожи, снижало покраснение, зуд, улучшало самочувствие больных по сравнению с больными, не использовавшими гель. Аналогичные данные были получены у больных себорейным дерматитом [31]. Этот же состав увлажняющего средства в сочетании с умеренной очисткой лица оказывал достоверный протективный эффект при акне средней тяжести у подростков с сухой и чувствительной кожей [32]. Авторы показали увеличение общего количества церамидов кожи, доли длинноцепочечных церамидов NS и NP в результате обработки кожи.
Использование топических средств, содержащих компоненты ЛТ, позволяет снизить побочные эффекты кортикостероидных препаратов. Так, короткий курс 0,05% клобетазола замедлял регенерацию эпидермального барьера; при одновременном нанесении крема, содержащего СЖК, холестерол и церамиды, снижались побочные эффекты кортикостероида и ускорялась репарация кожи [33]. Аналогичные данные были получены S. Ahn и соавт. [34] в модели на мышах.
Иммуносупрессивные препараты, влияющие на физиологические процессы кожи, подавляют репарацию: так, ингибиторы кальциневрина пимекролимус и такролимус задерживают восстановление барьерной функции и снижают количество липидов в эпидермисе [35]. Использование топических препаратов, включающих физиологические липиды в сочетании с пимекролимусом, улучшает репарацию кожи и состав липидов эпидермиса.
Применение в качестве наружной терапии воспалительных дерматозов комбинации топических кортикостероидов или ингибиторов кальциневрина с препаратами, содержащими физиологические липиды, позволяет улучшить восстановление эпидермального барьера и снизить побочные эффекты противовоспалительных агентов на барьерную функцию кожи.
В России разработан комбинированный препарат, содержащий 0,1% метилпреднизолона ацепонат и керамиды (Комфодерм К крем, патент 2011120522.15), который позволяет расширить возможности терапии стероидчувствительных дерматозов у взрослых и детей.
На рынке имеется большое количество кремов, содержащих церамиды. Чаще всего в косметические кремы вводятся церамиды NP и EOS, что способствует снижению ТЭПВ. В увлажняющие препараты и терапевтические кремы для лечения псориаза могут добавляться церамиды AP, AS и EOS. В настоящее время в основном используют синтетические церамиды, которые по действию идентичны природным. Несмотря на известное соотношение церамидов, холестерина и СЖК в нормальной коже, применение увлажняющих кремов, содержащих большое количество церамидов разных классов, может быть нецелесообразным. Так, значительный клинический эффект при умеренном АтД получен при использовании крема РС-104 на основе смеси амидов пальмитиновой кислоты, глицирретиновой кислоты и экстракта виноградных косточек [36]. Раннее начало использования эмолиентов с церамидами значительно снижает частоту заболеваемости АтД у младенцев из группы риска [37, 38]. Синтетические фитоцерамиды NP и EOP эффективны также при псориазе [39].
Практикующим врачам будет интересна новая косметическая линия эмолентной дерматологической косметики Сенсодерм на основе физиологических липидов омега-3, -6, -9, а также препарат комбинированного действия Комфодерм К. Сенсодерм может применяться для увлажнения сухой и атопической кожи взрослых и детей с рождения, обладает благоприятным соотношением цена/качество. С помощью средств линии Сенсодерм можно подобрать оптимальную программу ухода за сухой кожей с учетом индивидуальных потребностей пациента.
Заключение
Эффективная стратегия лечения и профилактики дерматологических заболеваний с помощью кремов, гелей, сывороток с церамидами и физиологическими липидами имеет социоэкономическое значение. Применение смягчающих и увлажняющих средств с физиологическими липидами омега-3, -6, -9 позволит уменьшить явления ксероза, зуда и воспаления, что в свою очередь будет способствовать удлинению продолжительности ремиссии и профилактике обострений у пациентов с дерматологическими заболеваниями.
Сведения об авторах
Рассказывает Шеворыкина Ольга Юрьевна
Врач-педиатр, физиотерапевт, заведующий отделением детского медицинского центра «ОННИ»
Электротерапия включает в себя ряд процедур с использованием постоянного электрического тока для уменьшения боли, улучшения кровообращения, восстановления тканей, укрепления мышц и стимулирования роста костей, что приводит к улучшению физического функционирования.
Методы электротерапии, такие как гальванизация и лекарственный электрофорез часто используется для физиотерапевтического лечения мышечной слабости, гипертонуса и болевых синдромов, вызванных различной неврологической патологией. Воздействие электрического тока само по себе и совместно медикаментами позволяют уменьшить боль и отек, ускорить заживление или положительно повлиять на мышечный тонус. Происходит это потому, что электростимуляция может напрямую блокировать передачу болевых сигналов по нервам. Кроме того, воздействие электрического тока способствует высвобождению эндорфинов, естественных болеутоляющих веществ, вырабатываемых организмом.
Применение электротерапии дает следующие преимущества:
Контроль и уменьшение боли
Облегчение восстановления мышц и других тканей тела
Повышение эффективности введения лекарств (электрофорез)
Не все методы электротерапии подходят для детей, поэтому врач физиотерапевт сможет подобрать наиболее подходящее лечение. Тип электротерапии, которая будет назначена, также будет зависеть от стадии заживления и вида травмы или патологии. Считается, что электротерапия дает наилучшие результаты в сочетании с другими методами, такими как лечебная гимнастика и массаж.
Показания для электротерапии
Симптоматическое облегчение хронической, трудноизлечимой боли.
Устранение боли, связанной с посттравматическими или послеоперационными состояниями.
Расслабление мышечных спазмов
Профилактика или замедление атрофии
Увеличение местного кровообращения
Немедленная послеоперационная стимуляция икроножных мышц для предотвращения венозного тромбоза
Сохранение или увеличение диапазона движений
Гальванизация
Гальваническая стимуляция или гальванизация наиболее полезна при восстановлениии после острых травм, сопровождающихся отеком. В отличие от устройств чрескожной электрической стимуляции, которые используют переменный ток, гальванические стимуляторы используют постоянный ток. Электроды могут быть прикреплены к разным частям тела, включая спину и, даже, уши. Постоянный ток создает электрическое поле на обрабатываемой области, которое изменяет кровоток. Положительный полюс (анод) действует как лед, вызывая уменьшение кровообращения в области под электродом и уменьшая отек. Отрицательный электрод (катод) действует как тепло, вызывая усиление кровообращения и улучшая заживление.
Гальванизация используется при реабилитации после травм и операций, при заболеваниях опорно-двигательного аппарата и неврологических заболеваниях.
Лекарственный электрофорез
Лекарственный электрофорез – метод лечения при одновременном воздействии на организм постоянного тока и вводимого с его помощью через кожу лекарственного вещества. Непрерывный постоянный электрический ток низкой интенсивности позволяет вводить через кожу с помощью растворов на водной основе лекарственные вещества. Эти растворы известны как электролиты. Они содержат кислоты и соли, которые увеличивают электрическую проводимость и помогают создавать химические изменения на поверхности кожи, пока через них проходит гальванический ток. При растворении в воде электролиты частично расщепляются и образуют ионы, которые несут либо положительный заряд (катионы), либо отрицательный заряд (анионы). Когда электроды, несущие постоянный ток, вводятся в раствор электролита, ионы в растворе начинают двигаться и притягиваются либо к положительному полюсу (анод), либо к отрицательному полюсу (катод). Положительный полюс используется для:
Введения кислотных препаратов
Уменьшения покраснение кожи
Закрытия пор и укрепления тканей
Отрицательный полюс используется для:
Введения щелочных препаратов
Улучшение кровообращения за счет расширения сосудов
Удаления омертвевших участков кожи и избытка кожного жира
Вещества, вводимые с помощью электрофореза, влияют на физиологические процессы, поступая в кровь и лимфу, разносятся по всему организму. При этом доза лекарственного вещества, проникающего в организм при помощи электрофореза, составляет всего 5—10 % от используемого количества при проведении процедуры. При этом лекарственные средства могут накапливаться в коже, образуя так называемое кожное депо. В результате лекарство действует более продолжительное время. Проведение лекарственного электрофореза у детей возможно с 1 месяца. Для назначения лечения надо обязательно обратиться к физиотерапевту, который определит параметры лечебного воздействия для конкретного заболевания и выявит противопоказания. Также физиотерапевт выписывает рецепт на лекарственное вещество, с которым будет проводиться процедура.
Электрофорез используется при всем спектре возможных заболеваний от хирургических, до урологических, гинекологических и ЛОР-заболеваний.
Как устроены аппараты для электротерапии?
Аппараты электротерапии обычно состоят из устройства с батарейным питанием, соединенного проводами с клейкими подушечками электродов, которые размещаются на коже. После присоединения электродов и включения устройства через электрод к коже подается слабый электрический ток. Источником постоянного электрического тока, применяемого с лечебными и реабилитационными целями, являются аппараты для гальванизации. В нашей клинике используется аппарат «Элфор-проф» компании «Неватон» (Санкт-Петербург).
При проведении процедур гальванизации и электрофореза могут использоваться многоразовые или одноразовые электроды, которые смачиваются водой или раствором лекарственного вещества. Все процедуры проводят с использованием одноразовых электродов, закрепляемых эластичными лентами. В процессе проведения процедуры возможно ощущение небольшого равномерного покалывания или жжения в месте наложения электродов. Продолжительность самой процедуры у детей составляет 10-15 мин. Курс лечения, как правило, состоит из 10-20 процедур, проводимых ежедневно или через день.
Побочные эффекты электротерапии
Наиболее частым побочным эффектом гальванизации и электрофореза является раздражение кожи или сыпь, вызванная электродами или лентой, удерживающей электроды на месте. Чрезмерное использование электротерапии может вызвать чувство жжения на коже. Во избежание проблем следует строго соблюдать указания относительно продолжительности терапии. Электростимуляцию не следует применять на кожных новообразованиях, участках с поврежденной кожей или инфекциями.
Будьте здоровы!
СВЕЖИЕ ЗАПИСИ

Именно с такой жалобой чаще всего приходят обеспокоенные родители. — рассказывает врач-кардиолог детского медицинского центра «ОННИ» Зайналова Хайбат Зайналовна. Большую популярность приобрели смарт – часы, наделенные функцией.

Сахарный диабет — это заболевание у ребенка, при котором его организм неправильно контролирует уровень глюкозы («сахара») в крови — рассказывает врач-педиатр высшей квалификации, детский эндокринолог.

Многие девочки сталкиваются с нарушениями менструального цикла, особенно первое время после менархе, то есть прихода первых месячных — рассказывает детский гинеколог, врач УЗИ, специалист по.
Анатомия и физиология кожи
Кожа – наш самый большой орган, составляющий 15% от общей массы тела. Она выполняет множество функций, прежде всего защищает организм от воздействия внешних факторов физической, химической и биологической природы, от потери воды, участвует в терморегуляции. Последние научные данные подтверждают, что кожа не только обладает собственной иммунной системой, но и сама является периферическим иммунном органом.
Структура кожи
Кожа состоит из 3 слоев: эпидермиса, дермы и подкожной жировой клетчатки (ПЖК) (рис. 1). Эпидермис – самый тонкий из них, представляет собой многослойный ороговевающий эпителий. Дерма – средний слой кожи. Главным образом состоит из фибрилл структурного белка коллагена. ПЖК содержит жировые клетки – адипоциты. Толщина этих слоев может значительно варьировать в зависимости от анатомического места расположения.
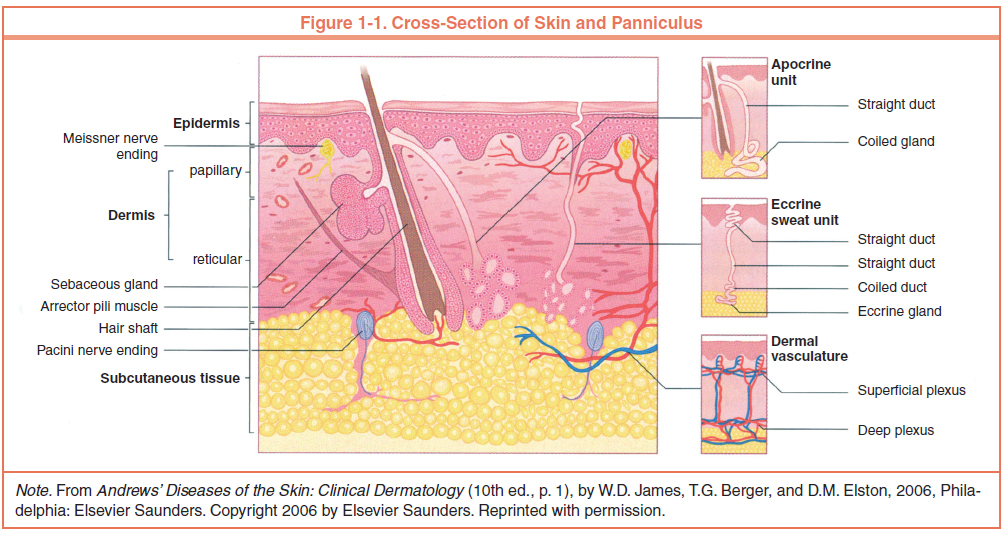
Рис.1. Структура кожи
Эпидермис
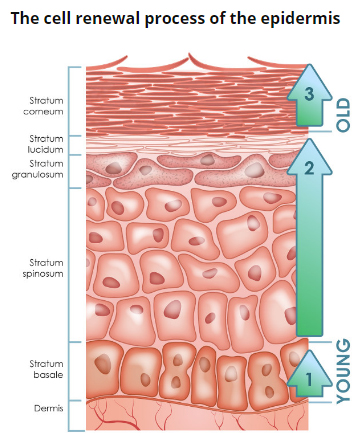
Рис. 2. Эпидермис
Эпидермис – постоянно слущивающийся эпителиальный слой кожи, в котором представлены в основном из 2 типа клеток – кератиноциты и дендритные клетки. В небольшом количестве в эпидермисе присутствуют меланоциты, клетки Лангерганса, клетки Меркеля, внутриэпидермальные Т-лимфоциты. Структурно эпидермис разделяется на 5 слоев: базальный, шиповатый, зернистый, блестящий и роговой , различающиеся положением и степенью дифференцировки кератиноцитов, основной клеточной популяции эпидермиса (рис. 2).
Кератинизация. По мере дифференцировки кератиноцитов и продвижения от базального слоя до рогового происходит их кератинизация (ороговевание) – процесс, начинающийся с фазы синтеза кератина кератиноцитами и заканчивающийся их клеточной деградацией. Кератин служит строительным блоком для промежуточных филаментов. Пучки из этих филаментов, достигая цитоплазматический мембраны, формируют десмосомы, необходимые для образования прочных контактов между соседними клетками. Далее, по мере процесса эпителиальной дифференцировки, клетки эпидермиса вступают в фазу деградации. Ядра и цитоплазматические органеллы разрушаются и исчезают, обмен веществ прекращается, и наступаетапоптозклетки, когда она полностью кератинизируется (превращается в роговую чешуйку).
Базальный слой эпидермиса состоит из одного ряда митотически активных кератиноцитов, которые делятся в среднем каждые 24 часа и дают начало новым клеткам новым клеткам вышележащих эпидермальных слоев. Они активируются только в особых случаях, например при возникновении раны. Далее новая клетка, кератиноцит, выталкивается в шиповатый слой, в котором она проводит до 2 недель, постепенно приближаясь к гранулярному слою. Движение клетки до рогового слоя занимает еще 14 дней. Таким образом, время жизни кератиноцита составляет около 28 дней.
Надо заметить, что не все клетки базального слоя делятся с такой скоростью, как кератиноциты. Эпидермальные стволовые клетки в нормальных условиях образуют долгоживущую популяцию с медленным циклом пролиферации.
Шиповатый слой эпидермиса состоит из 5-10 слоев кератиноцитов, различающихся формой, структурой и внутриклеточным содержимым, что определяется положением клетки. Так, ближе к базальному слою, клетки имеют полиэдрическую форму и круглое ядро, но по мере приближения клеток к гранулярному слою они становятся крупнее, приобретают более плоскую форму, в них появляются ламеллярные гранулы, в избытке содержащие различные гидролитические ферменты. Клетки интенсивно синтезируют кератиновые нити, которые, собираясь в промежуточные филаменты, остаются не связанными со стороны ядра, но участвуют в образовании множественных десмосом со стороны мембраны, формируя связи с соседними клетками. Присутствие большого количества десмосом придает этому слою колючий вид, за что он и получил название «шиповатый».
Зернистый слой эпидермиса составляют еще живые кератиноциты, отличающиеся своей уплощенной формой и большим количеством кератогиалиновых гранул. Последние отвечают за синтез и модификацию белков, участвующих в кератинизации. Гранулярный слой является самым кератогенным слоем эпидермиса. Кроме кератогиалиновых гранул кератиноциты этого слоя содержат в большом количестве лизосомальные гранулы. Их ферменты расщепляют клеточные органеллы в процессе перехода кератиноцита в фазу терминальной дифференцировки и последующего апоптоза. Толщина гранулярного слоя может варьировать, ее величина, пропорциональная толщине вышележащего рогового слоя, максимальна в коже ладоней и подошв стоп.
Блестящий слой эпидермиса (назван так за особый блеск при просмотре препаратов кожи на световом микроскопе) тонкий, состоит из плоских кератиноцитов, в которых полностью разрушены ядра и органеллы. Клетки наполнены элейдином – промежуточной формой кератина. Хорошо развит лишь на некоторых участках тела – на ладонях и подошвах.
Роговой слой эпидермиса представлен корнеоцитами (мертвыми, терминально-дифференцированными кератиноцитами) с высоким содержанием белка. Клетки окружены водонепроницаемым липидным матриксом, компоненты которого содержат соединения, необходимые для отшелушивания рогового слоя (рис. 3). Физические и биохимические свойства клеток в роговом слое различаются в зависимости от положения клетки внутри слоя, направляя процесс отшелушивания наружу. Например, клетки в средних слоях рогового слоя обладают более сильными водосвязывающими свойствами за счет высокой концентрации свободных аминокислот в их цитоплазме.
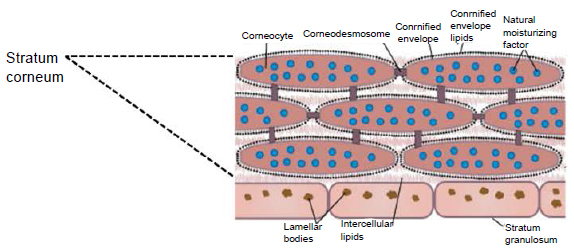
Рис. 3. Схематичное изображение рогового слоя с нижележащим зернистым слоем эпидермиса.
Регуляция пролиферации и дифференцировки кератиноцитов эпидермиса . Являясь непрерывно обновляющейся тканью, эпидермис содержит относительно постоянное число клеток и регулирует все взаимодействия и контакты между ними: адгезию между кератиноцитами, взаимодействие между кератиноцитами и мигрирующими клетками, адгезию с базальной мембраной и подлежащей дермой, процесс терминальной дифференцировки в корнеоциты. Основной механизм регуляции гомеостаза в эпидермисе поддерживается рядом сигнальных молекул – гормонами, факторами роста и цитокинами. Кроме этого, эпидермальный морфогенез и дифференцировка частично регулируются подлежащей дермой, которая играет критическую роль в поддержании постнатальной структуры и функции кожи.
Дерма
Дерма представляет собой сложноорганизованную рыхлую соединительную ткань, состоящую из отдельных волокон, клеток, сети сосудов и нервных окончаний, а также эпидермальных выростов, окружающих волосяные фолликулы и сальные железы. Клеточные элементы дермы представлены фибробластами, макрофагами и тучными клетками. Лимфоциты, лейкоциты и другие клетки способны мигрировать в дерму в ответ на различные стимулы.
Дерма, составляя основной объем кожи, выполняет преимущественно трофическую и опорную функции, обеспечивая коже такие механические свойства, как пластичность, эластичность и прочность, необходимые ей для защиты внутренних органов тела от механических повреждений. Также дерма удерживает воду, участвует в терморегуляции и содержит механорецепторы. И, наконец, ее взаимодействие с эпидермисом поддерживает нормальное функционирование этих слоев кожи.
В дерме нет такого направленного и структурированного процесса клеточной дифференцировки, как в эпидермисе, тем не менее в ней также прослеживается четкая структурная организация элементов в зависимости от глубины их залегания. И клетки, и внеклеточный матрикс дермы также подвергаются постоянному обновлению и ремоделированию.
Внеклеточный матрикс (ВКМ) дермы , или межклеточное вещество, в состав которого входят различные белки (главным образом коллаген, эластин), гликозаминогликаны, самым известным из которых является гиалуроновая кислота, и протеогликаны (фибронектин, ламинин, декорин, версикан, фибриллин). Все эти вещества секретируются фибробластами дермы. ВКМ представляет собой не беспорядочное скопление всех компонентов, а сложноорганизованную сеть, состав и архитектоника которой определяют такие биомеханические свойства кожи, как жесткость, растяжимость и упругость. К белкам ВКМ прикрепляются кератиноциты эпидермиса, которые тесно состыкованы друг с другом. Именно они и формируют плотный защитный слой кожи. Структура ВКМ также способна оказывать регулирующее влияние на погруженные в него клетки. Регуляция может быть как прямой, так и косвенной. В первом случае белки и гликозаминогликаны ВКМ непосредственно взаимодействуют с рецепторами клеток и инициируют в них специфические пути передачи сигнала. Косвенная регуляция осуществляется посредством действия цитокинов и ростовых факторов, удерживаемых в ячейках сети ВКМ и высвобождаемых в определенный момент для взаимодействия с рецепторами клеток. Структурная сеть ВКМ подвергается ремоделированию ферментами из семейства матриксных металлопротеиназ (ММР). В частности, ММР-1 и ММР-13 инициируют деградацию коллагенов I и III типов. Плотность сети ВКМ дермы неравномерна – в папиллярном слое она более рыхлая, в ретикулярном - значительно плотнее как за счет более близкого расположения волокон структурных белков, так и за счет увеличения диаметра этих волокон.
Коллаген – один из главных компонентов ВКМ дермы. Синтезируется фибробластами. Процесс его биосинтеза сложный и многоступенчатый, в результате которого фибробласт секретирует в экстрацеллюлярное пространство проколлаген, состоящий из трех полипептидных α-цепей, свернутых в одну тройную спираль. Затем мономеры проколлагена ферментивным путем собираются в протяженные фибриллярные структуры различного типа. Всего в коже не менее 15 типов коллагена, в дерме больше всего I, III и V типов этого белка: 88, 10 и 2% соответственно. Коллаген IV типа локализуется в зоне базальной мембраны, а коллаген VII типа, секретируемый кератиноцитами, играет роль адаптерного белка для закрепления фибрилл ВКМ на базальной мембране (рис. 4). Волокна структурных коллагенов I, III и V типов служат каркасом, к которому присоединяются другие белки ВКМ, в частности коллагены XII и XIV типов. Считается, что эти минорные коллагены, а также небольшие протеогликаны (декорин, фибромодулин и люмикан) регулируют формирование структурных коллагеновых волокон, их диаметр и плотность образуемой сети. Взаимодействие олигомерных и полимерных комплексов коллагена с другими белками, полисахаридами ВКМ, разнообразными факторами роста и цитокинами приводит к образованию особой сети, обладающей определенной биологической активностью, стабильностью и биофизическими характеристиками, важными для нормального функционирования кожи. В папиллярном слое дермы волокна коллагена располагаются рыхло и более свободно, тогда как ее ретикулярный слой содержит более крупные тяжи коллагеновых волокон.
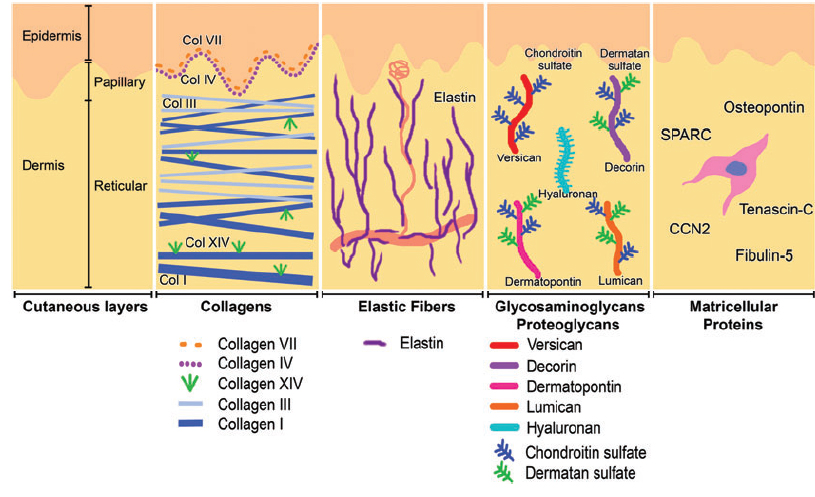
Рис. 4. Схематичное представление слоев кожи и распределения коллагенов разных типов.
Коллаген постоянно обновляется, деградируя под действием протеолитических ферментов коллагеназ и замещаясь вновь синтезированными волокнами. Этот белок составляет 70% сухого веса кожи. Именно коллагеновые волокна «держат удар» при механическом воздействии на нее.
Эластин формирует еще одну сеть волокон в дерме, наделяя кожу такими качествами, как упругость и эластичность. По сравнению с коллагеном эластиновые волокна менее жесткие, они скручиваются вокруг коллагеновых волокон. Именно с эластиновыми волокнами связываются такие белки, как фибулины и фибриллины, с которыми, в свою очередь, связывается латентный TGF-β-связывающий белок (LTBP). Диссоциация этого комплекса приводит к высвобождению и к активации TGF-β, самого мощного из всех факторов роста. Он контролирует экспрессию, отложение и распределение коллагенов и других матриксных белков кожи. Таким образом, интактная сеть из волокон эластина служит депо для TGF-β.
Гиалуроновая кислота (ГК) представляет собой линейный полисахарид, состоящий из повторяющихся димеров D-глюкуроновой кислоты и N-ацетилглюкозамина. Количество димеров в полимере варьирует, что приводит к образованию молекул ГК разного молекулярного веса и длины - 1х10 5 -10 7 Да (2-25 мкм), оказывающих, соответственно, различный биологический эффект.
ГК - высокогидрофильное вещество, влияющее на движение и распределение воды в матриксе дермы. Благодаря этому ее свойству наша кожа в норме и в молодости обладает высоким тургором и сопротивляемостью механическому давлению.
ГК с легкостью образует вторичные водородные связи и внутри одной молекулы, и между соседними молекулами. В первом случае они обеспечивают формирование относительно жестких спиральных структур. Во втором – происходит ассоциация с другими молекулами ГК и неспецифическое взаимодействие с клеточными мембранами, что приводит к образованию сети из полимеров полисахаридов с включенными в нее фибробластами. На длинную молекулу ГК, как на нить, «усаживаются» более короткие молекулы протеогликанов (версикана, люмикана, декорина и др.), формируя агрегаты огромных размеров. Протяженные во всех направлениях, они создают каркас, внося вклад в стабилизацию белковой сети ВКМ и фиксируя фибробласты в определенном окружении матрикса. В совокупности все эти свойства ГК наделяют матрикс определенными химическими характеристиками – вязкостью, плотностью «ячеек» и стабильностью. Однако сеть ВКМ является динамической структурой, зависящей от состояния организма. Например, в условиях воспаления агрегаты ГК с протеогликанами диссоциируют, а образование новых агрегатов между вновь синтезированными молекулами ГК (обновляющимися каждые 3 дня) и протеогликанами блокируется. Это приводит к изменению пространственной структуры матрикса: увеличивается размер его ячеек, меняется распределение всех волокон, структура становится более рыхлой, клетки меняют свою форму и функциональную активность. Все это сказывается на состоянии кожи, приводя к снижению ее тонуса.
Помимо регуляции водного баланса и стабилизации ВКМ, ГК выполняет важную регуляторную роль в поддержании эпидермального и дермального гомеостаза. ГК активно регулирует динамические процессы в эпидермисе, включая пролиферацию и дифференцировку кератиноцитов, окислительный стресс и воспалительный ответ, поддержание эпидермального барьера и заживление раны. В дерме ГК также регулирует активность фибробластов и синтез коллагена. Ремоделируя матрикс, ГК управляет функционированием клеток в матриксе, влияя на их доступность для различных факторов роста и изменяя их функциональную активности. От действия ГК зависит миграция клеток и иммунный ответ в ткани. Таким образом, изменения в распределении, организации, молекулярном весе и метаболизме ГК имеют значимые физиологические последствия.
Фибробласты представляют собой основной тип клеточных элементов дермы. Именно эти клетки отвечают за продукцию ГК, коллагена, эластина, фибронектина и многих других белков межклеточного матрикса, необходимых для формирования соединительной ткани. Фибробласты в различных слоях дермы различаются и морфологически, и функционально. От глубины их залегания в дерме зависит не только количество синтезируемого ими коллагена, но и соотношение типов этого коллагена, например I и III типов, а также синтез коллагеназы: фибробласты более глубоких слоев дермы производят меньшее ее количество. Вообще, фибробласты – очень пластичные клетки, способные менять свои функции и физиологический ответ и даже дифференцироваться в другой тип клеток в зависимости от полученного стимула. В роли последнего могут выступать и сигнальные молекулы, синтезированные соседними клетками, и перестройка окружающего ВКМ.
Подкожно-жировая клетчатка
Подкожно-жировая клетчатка , или гиподерма, - самый нижний слой кожи, располагается под дермой. Состоит из жировых долек, разделенных между собой соединительнотканными септами, содержащими коллаген и пронизанными крупными сосудами. Главными клетками жировых долек являются адипоциты, количество которых варьирует в различных областях тела. В настоящее время ПЖК рассматривают не только как энергетическое депо, но и как эндокринный орган, адипоциты которого участвуют в выработке ряда гормонов (лептина, адипонектина, резистина), цитокинов и медиаторов, оказывающих влияние на метаболизм, чувствительность к инсулину, функциональную активность репродуктивной и иммунной систем.
Читайте также:


