Что такое кожно резорбтивное действие
Обновлено: 25.04.2024
Поражение глаз боевыми отравляющими веществами (БОВ). Слезоточивые отравляющие вещества (лакриматоры)
Во время первой мировой войны БОВ оказались в ряду наиболее эффективных боевых средств. Боевые отравляющие вещества справедливо относят к средствам массового поражения. Профилактика этих поражений, а также правильно поставленная первая помощь и лечение пораженных могут иметь большое значение в уменьшении количества санитарных потерь и в снижении процента инвалидности.
Отравляющие вещества (ОВ) могут действовать на глаз непосредственно (извне) при прямом контакте с его оболочками. Однако имеются и другие пути действия ОВ на органы зрения:
а) всасывание ОВ в кровь и действие его через кровяной ток;
б) всасывание из полости носа и решетчатого синуса в глазницу через разделяющую их тонкую стенку и действие ОВ непосредственно на зрительный нерв.
В некоторых случаях страдание глаза является вторичным, так как оно развивается в результате страдания почек, вызванного действием ОВ. Наконец, очень значительную роль в страдании глаза играет нередко вторичная инфекция, развивающаяся в глазу, когда защитные свойства его тканей ослаблены действием ОВ.
Принято делить боевые отравляющие вещества по их тактическим свойствам на стойкие (СОВ) и нестойкие (НОВ). К стойким ОВ относятся иприт и люизит, к нестойким — прочие отравляющие вещества. По действию на организм все БОВ делят на пять групп:
1) слезоточивые ОВ (лакриматоры),
2) ОВ раздражающего действия,
3) ОВ удушающего действия,
4) ОВ кожно-резорбтивного (кожно-нарывного) действия и
5) ОВ общетоксического действия.

Почти все известные до сего времени боевые отравляющие вещества поражают в числе прочих органов также и орган зрения. Это относится к 100% пораженных слезоточивыми и раздражающими ОВ, к 70—75% пораженных удушающими ОВ и OB кожно-нарывного действия, а также к преобладающему большинству пораженных ОВ общетоксического действия.
Представляют интерес сравнительные данные американских авторов о частоте поражения ОВ органов дыхания и органа зрения и об исходах этих поражений во время первой мировой войны.
При очень высоком и почти одинаковом проценте поражения дыхательных органов (80) и органа зрения (75) последствия этих поражений весьма несходны. Процент инвалидности после поражений органа зрения относительно очень невелик (2,75) по сравнению с огромным процентом инвалидности (70) после поражений дыхательных путей.
Эти данные указывают на относительную доброкачественность течения и исхода столь грозного на первый взгляд страдания, как поражение глаз отравляющие вещества (ОВ).
Слезоточивые отравляющие вещества (ОВ) (лакриматоры)
Наиболее известны из отравляющие вещества (ОВ) этой группы хлорацетофенон и бромбензилцианид. Будучи применены в малых концентрациях, они вызывают в первые же секунды действия резко выраженное раздражение конъюнктивы (чувство жжения, сильное слезотечение, спазм век, резкую гиперемию конъюнктивы).
При более высокой концентрации лакриматоры вызывают также отек век и лица, отек конъюнктивы, помутнение и даже изъязвление (некроз) роговицы; наблюдаются также явления раздражения слизистой носа и верхнего отдела дыхательных путей (насморк, кашель, одышка), покраснение кожи и образование пузырей, симптомы общей интоксикации (головная боль, общая слабость, рвота и др.). При отравлении бромбензилцианидом в большой концентрации иногда наблюдаются симптомы угнетения центральной нервной системы и тканевого дыхания, характерные для действия цианистых соединений.
В легких случаях все явления раздражения глаз, вызванные лакриматорами, проходят через несколько часов, реже держатся 1—2 дня, а в наиболее тяжелых случаях болезнь затягивается до 2—4 недель. Помутнения роговицы могут рассасываться бесследно, и лишь в крайне редких случаях некроза роговицы образуется бельмо и стойкая потеря зрения вплоть до слепоты.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Необходимость использования комбинированных химиотерапевтических средств определяется двумя важнейшими задачами химиотерапии - уменьшением доз препаратов, а следовательно, затрат на лечение и возникновение нежелательных побочных эффектов, и снижением выработки устойчивости патогенной микрофлоры к антимикробным препаратам, что продлевает срок их использования в практике. Сочетанное применение антимикробных средств является одним из эффективных приемов, замедляющим этот процесс в микробных популяциях (В. Д. Соколов с соавт., 1992).
Изыскивая новые эффективные сочетания антимикробных средств, нельзя забывать о том, что новое сочетание из двух или более известных и изученных препаратов является новым лекарственным средством, с новыми, не всегда предсказуемыми превращениями в организме. Отсюда непременное условие - каждый новый комбинированный препарат, кроме апробации на эффективность, должен быть обязательно проверен на безвредность для организма, изучены его токсические свойства (В.Д. Соколов, 1997).
Задачей настоящего исследования являлось изучение раздражающего, кожно-резорбтивного действия и аллергизирующих свойств инъекционной лекарственной формы нового антибактериального препарата на основе энрофлоксацина и колистина.
Методы исследований
Исследования по изучению кожно-резорбтивного действия препарата выполнены на белых мышах и крысах.
Аллергенность определяли с помощью конъюнктивальной и кожно-провокационной пробы (О. Л. Алексеева, Л. А. Дуева, 1978).
Результаты исследований
Изучение раздражающего действия на кожу проведено на 12 кроликах массой 2,22,4 кг. Количество животных в опытной и контрольной группах составляло по 6 особей. Исследуемый препарат наносили в чистом виде. Площадь нанесения составляла 80-82 см2 (5% от общей поверхности тела животных). За два дня до эксперимента тщательно выстригали шерсть на спине, избегая механических повреждений кожных покровов. Лекарственное средство равномерно распределяли по поверхности участка в дозах от 20 до 100 мг/см2 (соответственно 0,02-0,10 мл/см2). Экспозиция - 4 часа, после чего кожу аккуратно протирали ватным тампоном, смоченным дистиллированной водой.
Реакцию кожи на воздействие препарата оценивали через 1 и 16 часов после однократного нанесения.
Животным контрольной группы проводили аппликации лекарственной основы препарата.
Результаты опыта по изучению раздражающего действия на кожные покровы приведены в таблице 1.
Местно-раздражающее действие препарата при однократном воздействии на кожные покровы кроликов Таблица 1 .
МЕТОДЫ ИСПЫТАНИЯ ПО ВОЗДЕЙСТВИЮ ХИМИЧЕСКОЙ ПРОДУКЦИИ НА ОРГАНИЗМ ЧЕЛОВЕКА
Кожно-резорбтивное действие: метод in vivo
Methods of testing the chemicals of health hazard. Skin absorption: in vivo method
Предисловие
Цели, основные принципы и общие правила проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены"
Сведения о стандарте
1 ПОДГОТОВЛЕН Федеральным бюджетным учреждением здравоохранения "Российский регистр потенциально опасных химических и биологических веществ" Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (ФБУЗ "Российский регистр потенциально опасных химических и биологических веществ" Роспотребнадзора), Федеральным государственным унитарным предприятием "Всероссийский научно-исследовательский центр стандартизации, информации и сертификации сырья, материалов и веществ" (ФГУП "ВНИЦСМВ")
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 14 ноября 2013 г. N 44)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97
Сокращенное наименование национального органа по стандартизации
Минэкономики Республики Армения
Госстандарт Республики Казахстан
4 Приказом Федерального агентства по техническому регулированию и метрологии от 22 ноября 2013 г. N 775-ст межгосударственный стандарт ГОСТ 32371-2013 введен в действие в качестве национального стандарта Российской Федерации с 1 августа 2014 г.
5 Настоящий стандарт идентичен международному документу OECD, Test N 427:2004* "Кожно-резорбтивное действие: метод in vivo" ("Skin Absorption: In Vivo Method", IDT).
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - Примечание изготовителя базы данных.
Наименование настоящего стандарта изменено относительно наименования указанного международного стандарта для приведения в соответствие с ГОСТ 1.5 (подраздел 3.6).
В настоящий стандарт внесено следующее редакционное изменение: раздел "Термины и определения" из приложения перенесен в текст стандарта (раздел 2) для удобства пользования
6 ВВЕДЕН ВПЕРВЫЕ
7 ПЕРЕИЗДАНИЕ. Апрель 2019 г.
Информация о введении в действие (прекращении действия) настоящего стандарта и изменений к нему на территории указанных выше государств публикуется в указателях национальных стандартов, издаваемых в этих государствах, а также в сети Интернет на сайтах соответствующих национальных органов по стандартизации.
В случае пересмотра, изменения или отмены настоящего стандарта соответствующая информация будет опубликована на официальном интернет-сайте Межгосударственного совета по стандартизации, метрологии и сертификации в каталоге "Межгосударственные стандарты"
Введение
Многие химические вещества в производственных и бытовых условиях попадают на кожу и могут проникать через нее, в то время как в большинстве токсикологических исследований на лабораторных животных используется пероральный путь введения. Исследования абсорбции веществ через кожу в опытах in vivo позволяют установить связь между результатами исследований, полученными при пероральном введении и оценке безопасности воздействия на кожу.
Вещество должно проникнуть через большое число клеточных слоев кожи, прежде чем попадет в организм. Проникновение вещества в организм через кожу зависит от его липофильности и толщины внешнего слоя эпидермиса, а также от таких факторов, как молекулярная масса и концентрация вещества.
Кожа крыс и кроликов более проницаема, чем кожа человека, в то время как проницаемость кожи морских свинок, свиней и обезьян более близка к проницаемости кожи человека.
Методы для оценки способности химических веществ проникать через кожу делятся на две категории: in vivo и in vitro. В последнее время разработаны методы in vitro, которые описаны в Руководящих документах ОЭСР по изучению абсорбции кожи. Руководящий документ ОЭСР [2] позволяет выбрать наиболее подходящий метод: in vivo либо in vitro.
Метод in vivo позволяет получить полную информацию о кожно-резорбтивном действии с использованием различных лабораторных животных, а также определить степень проникновения исследуемого вещества через кожу в организм.
Преимуществом методов in vivo является то, что они используют физиологически и метаболически интактную систему, а также стандартные виды животных, для проведения испытаний по определению токсичности и могут быть модифицированы с учетом использования других видов.
Недостатками является использование теплокровных животных, необходимость применения радиоактивной метки для получения достоверных результатов, а также сложности в определении ранней фазы абсорбции и различия в проницаемости кожи предпочтительных видов лабораторных животных (крыс) и человека.
Главное правило проведения данного испытания в том, что едкие/коррозионные вещества не должны тестироваться на животных.
1 Область применения
Настоящий стандарт устанавливает процедуру испытания кожно-резорбтивного действия химической продукции методом in vivo.
Исключением являются едкие/коррозионные вещества, которые не должны тестироваться на животных.
2 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
2.1 исследуемое вещество: материал, чьи абсорбционные характеристики должны быть изучены. В идеальном случае, вещество должно быть с радиоактивной меткой.
2.2 непоглощенная доза (unabsorbed dose): вещество, смытое с поверхности кожи после экспозиции или присутствующее на негерметичной повязке, а также количество вещества, которое испарилось с кожи во время экспозиции.
2.3 поглощенная доза (in vivo) (absorbed dose): вещество, присутствующее в моче, смывах из клетки, экскрементах, выдыхаемом воздухе (в случае проведения замеров), крови, тканях (при сборе образцов) и остатках тела, после удаления кожи в месте нанесения вещества.
2.4 поглощаемая доза (in vivo) (the absorbable dose): вещество, присутствующее на или в коже после промывки.
2.5 продолжительность экспозиции: временной интервал между нанесением и удалением исследуемой пробы путем промывки кожи.
3 Принцип метода проведения испытаний
Исследуемое вещество, как правило, с радиоактивной меткой, наносят на подготовленный участок кожи животных одно- или многократно в репрезентативной для использования форме. Тестируемое вещество оставляют на поверхности кожи в течение определенного периода времени под соответствующей повязкой (негерметичной, полугерметичной и герметичной) для предотвращения слизывания вещества животными. По окончании времени экспозиции повязку удаляют, и кожу очищают подходящим моющим средством. Повязку и моющие средства сохраняют для анализа, и накладывают свежую повязку. До, во время и после экспозиции животных содержат в индивидуальных клетках (для исследования метаболизма), их выделения и выдыхаемый воздух собирают для анализа. Сбор выдыхаемого воздуха может не производиться, когда существует достаточно информации, что вещество содержится в выдыхаемом воздухе в небольшом количестве или образуется нелетучий радиоактивный метаболит. В каждом исследовании, как правило, используют несколько групп животных, которым наносится исследуемое вещество. Одну группу по окончании периода экспозиции умерщвляют. Другие группы животных умерщвляют в определенные временные интервалы после экспозиции. По окончании времени проведения наблюдений оставшихся животных умерщвляют, их кровь собирают для анализа, место нанесения пробы также удаляют для дальнейшего анализа, а остатки тела животного анализируют на наличие невыделенного вещества. Образцы анализируют соответствующими способами и оценивают степень перкутанной абсорбции.
4 Описание метода проведения испытаний
4.1 Выбор экспериментальных видов
Наиболее часто используемым видом являются крысы, но могут использоваться безволосые группы животных и виды, имеющие скорость абсорбции вещества кожей близкую к скорости абсорбции человеческой кожей. Необходимо использовать молодые, взрослые, здоровые особи одного пола (по умолчанию мужские) обычно используемых лабораторных видов. На начальной стадии испытания различия в массе тела животных не должны превышать ±20% от средней массы.
Пример - Самцы крыс массой тела 200-250 г, предпочтительны с большей массой в данном диапазоне.
4.1.1 Количество и пол животных
Для каждого исследования и для каждого момента умерщвления должна использоваться группа, как минимум, из четырех животных одного пола. Каждую группу животных умерщвляют в различных временных интервалах.
Пример - По окончании периода экспозиции (6 или 24 ч) и последующие периоды (например, 48 и 72 ч).
Если существуют данные, демонстрирующие значительные различия в кожной токсичности у женских и мужских особей, для исследования должны быть выбраны животные наиболее чувствительного пола. Если таких данных не существует, тогда может использоваться любой пол.
4.1.2 Условия содержания и кормления
Температура в лабораторной комнате для животных должна составлять (22±3)°С.
Относительная влажность должна составлять как минимум 30% и не превышать 70%, за исключением времени уборки комнаты. Оптимальное значение относительной влажности составляет 50-60%. Освещение должно быть искусственным в последовательности 12 часов - свет, 12 часов - темнота. Громкие кратковременные шумы должны быть минимизированы. При кормлении может быть использована обычная лабораторная диета с неограниченным количеством питьевой воды. Во время испытания, а также во время адаптации, животные должны содержаться в индивидуальных клетках. Утечка воды или еды, которая может повлиять на результаты, должна быть минимизирована.
4.1.3 Подготовка животных
Животных помечают для индивидуальной идентификации и содержат в клетках в течение, как минимум, пяти дней до начала испытания для адаптации к лабораторным условиям.
Вслед за периодом адаптации, приблизительно за 24 ч до начала эксперимента, у каждого животного должен быть выстрижен участок кожи в области плеч и спины. Поскольку проницаемость поврежденной и неповрежденной кожи различна, необходимо избегать повреждений кожи. После того, как выстрижен участок кожи, приблизительно за 24 ч до нанесения исследуемого вещества, поверхность кожи должна быть обработана ацетоном для удаления кожного жира. Дополнительное мытье мылом и водой не рекомендуется, поскольку любые мыльные остатки могут стимулировать абсорбцию вещества. Область кожи должна быть достаточной для достоверного вычисления поглощенного количества исследуемого вещества на 1 см кожи, предпочтительно, как минимум, 10 см. Данная площадь используется для крыс массой 200-250 г. После обработки животных возвращают в клетки.
4.1.4 Подготовка исследуемого вещества
Проба исследуемого вещества (например, чистый, разбавленный или смешанный препарат, содержащий исследуемое вещество, который будет наноситься на кожу) должна быть такой же, какой человек или другие потенциальные целевые виды могут подвергаться в реальных условиях воздействия. Любые отклонения в составе исследуемой пробы должны быть обоснованы. При необходимости исследуемое вещество растворяют или суспендируют в подходящем растворителе. Для растворителей (в случае, если это не вода) должны быть известны абсорбционные характеристики и возможность потенциального взаимодействия с исследуемым веществом.
4.1.5 Нанесение исследуемого вещества
На поверхности кожи выбирают место определенной площади для нанесения исследуемого вещества. Известное количество исследуемого вещества равномерно наносят на выстриженный участок кожи. Количество нанесенного вещества должно соответствовать потенциальной экспозиции для человека, обычно 1-5 мг/см твердого вещества или до 10 мкл/см жидкости. Любые другие количества должны быть обоснованы ожидаемыми условиями использования, целью эксперимента или физическими характеристиками пробы. После нанесения вещества обработанное место должно быть защищено от слизывания. Пример типичного устройства приведен на рисунке.

А - фильтр из активированного угля или марлевая повязка; Б - насадка с резьбой; В - основа с резьбой; Г - кожа; Д - цианоакрилатный клей
Рисунок 1 - Пример стандартного устройства, используемого для ограничения и защиты места нанесения вещества во время исследований перкутанной абсорбции in vivo
Место нанесения защищается негерметичной повязкой (например, проницаемой нейлоновой марлевой повязкой).
При неограниченном числе нанесений вещества место нанесения должно герметично закрываться. В случае испарения полулетучего исследуемого вещества его уровень воздействия (проникновения) снижается в недопустимой степени, поэтому необходимо улавливать испаряющееся вещество угольными фильтрами, покрывающими устройство для нанесения вещества (рисунок).
Используемые приборы не должны повреждать кожу, поглощать или реагировать с исследуемой пробой.
После эксперимента животных возвращают в индивидуальные клетки для сбора выделений.
МЕТОДЫ ИСПЫТАНИЯ ПО ВОЗДЕЙСТВИЮ ХИМИЧЕСКОЙ ПРОДУКЦИИ НА ОРГАНИЗМ ЧЕЛОВЕКА
Кожно-резорбтивное действие: метод in vitro
Testmethods for chemicals of health hazard. Skin absorption: in vitro method
Предисловие
Цели, основные принципы и общие правила проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены"
Сведения о стандарте
1 ПОДГОТОВЛЕН Федеральным бюджетным учреждением здравоохранения "Российский регистр потенциально опасных химических и биологических веществ" Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (ФБУЗ "Российский регистр потенциально опасных химических и биологических веществ" Роспотребнадзора), Федеральным государственным унитарным предприятием "Всероссийский научно-исследовательский центр стандартизации, информации и сертификации сырья, материалов и веществ" (ФГУП "ВНИЦСМВ") на основе собственного перевода на русский язык англоязычной версии документа, указанного в пункте 5
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 14 ноября 2013 г. N 44)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97
Сокращенное наименование национального органа по стандартизации
Минэкономики Республики Армения
4 Приказом Федерального агентства по техническому регулированию и метрологии от 22 ноября 2013 г. N 774-ст межгосударственный стандарт ГОСТ 32435-2013 веден в действие в качестве национального стандарта Российской Федерации с 1 августа 2014 г.
5 Настоящий стандарт идентичен международному документу OECD, Test N 428:2004* "Кожно-абсорбционное действие: метод in vitro ("Skin Absorption: In Vitro Method", IDT).
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - Примечание изготовителя базы данных.
Наименование настоящего стандарта изменено относительно наименования указанного международного документа для приведения в соответствие с ГОСТ 1.5 (подраздел 3.6)
6 ВВЕДЕН ВПЕРВЫЕ
7 ПЕРЕИЗДАНИЕ. Апрель 2019 г.
Информация о введении в действие (прекращении действия) настоящего стандарта и изменений к нему на территории указанных выше государств публикуется в указателях национальных стандартов, издаваемых в этих государствах, а также в сети Интернет на сайтах соответствующих национальных органов по стандартизации.
В случае пересмотра, изменения или отмены настоящего стандарта соответствующая информация будет опубликована на официальном интернет-сайте Межгосударственного совета по стандартизации, метрологии и сертификации в каталоге "Межгосударственные стандарты"
Введение
Данный экспериментальный метод был разработан для получения информации об абсорбции исследуемого вещества, нанесенного на удаленную кожу. Исследование может проводиться в сочетании с исследованием кожно-резорбтивного действия in vivo по ГОСТ 32371 или отдельно. При подготовке исследования, основанного на данной методике, рекомендуется использовать [1].
Методы для оценки способности химических веществ проникать через кожу делятся на две категории: in vivo и in vitro. В последнее время разработаны методы in vitro, которые описаны в Руководящем документе OECD [2]. Руководящий документ OECD [2] позволяет выбрать наиболее подходящий метод: in vivo либо in vitro.
Методы in vitro оценивают диффузию химических веществ в кожу и через нее, и могут использовать нежизнеспособную кожу только для измерения диффузии, или свежую метаболически активную кожу для одновременного измерения диффузии и кожного метаболизма. Такие методы нашли широкое применение для сравнительной оценки наличия вещества в коже и проницаемости различных препаратов через нее, а также могут обеспечивать модели для оценки перкутанной абсорбции у людей.
1 Область применения
Настоящий стандарт устанавливает процедуру испытания кожно-резорбтивного действия химической продукции методом in vitro.
2 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
2.1 исследуемое вещество: Материал, чьи абсорбционные характеристики должны быть изучены. В идеальном случае, вещество должно быть с радиоактивной меткой.
2.2 непоглощенная доза (Unabsorbed dose): Вещество, смытое с поверхности кожи после экспозиции или присутствующее на негерметичной повязке, а также количество вещества, которое испарилось с кожи во время экспозиции.
2.3 поглощенная доза (in vitro) (Absorbed dose): Масса испытуемого вещества, достигшая в течение определенного времени приемного раствора или кровотока.
2.4 поглощаемая доза (in vitro) (The absorbable dose): Вещество, присутствующее на или в коже после промывки.
3 Принцип метода испытаний
Исследуемое вещество, возможно с радиоактивной меткой, наносят на поверхность кожного образца, разделяющего две камеры диффузионной ячейки (клетки). Вещество оставляют на коже на определенное время при определенных условиях, до удаления вещества с использованием соответствующей процедуры очистки. Приемную жидкость собирают в различные периоды времени в течение эксперимента и анализируют на присутствие вещества и/или его метаболитов.
При использовании метаболически активных систем метаболиты исследуемых веществ следует анализировать соответствующими методами. По окончании эксперимента, при необходимости, количественно оценивают распределение исследуемого вещества и его метаболитов.
При соответствующих условиях, рассмотренных в данной методике и руководящем документе [2], абсорбцию исследуемого вещества в течение данного периода времени измеряют путем анализа приемного раствора и обработанной кожи.
Исследуемое вещество, оставшееся на коже, рассматривают, как абсорбированное, если только не показано, что абсорбция может определяться только по величинам приемного раствора. Анализ других компонентов (вещество, смытое с кожи или оставшееся в кожных слоях) позволяет проводить дальнейшую оценку данных, включая полное распределение и процентное содержание исследуемого вещества.
Для правильной постановки и достоверности тестовой системы в испытательной лаборатории, результаты для соответствующих контрольных веществ должны быть доступны и адекватны данным, опубликованным в литературе по использованию этого метода. Указанное требование может быть удовлетворено тестированием контрольного вещества (предпочтительно с липофильностью, близкой к исследуемому веществу) параллельно с исследуемым веществом или путем сравнения полученных ранее данных для ряда контрольных веществ с различной липофильностью (например, кофеин, бензойная кислота или тестостерон).
4 Описание метода испытаний
4.1 Диффузионная ячейка
Диффузионная ячейка состоит из донорской камеры и приемной камеры, между которыми помещается кожа (пример типичного устройства приведен на рисунке 1).
А - фильтр из активированного угля (для летучих исследуемых веществ);
Б - донорская камера ячейки;
В - кожная оболочка, 2,54 см;
Г - поддерживающая сетка;
Д - стеклянная диффузионная ячейка;
Е - магнитный вращающийся стержень;
Ж - приемная камера/раствор с температурой (32±1)°С, поддерживаемой с помощью водяной бани;
З - автоматический пробоотборник, запрограммированный для отбора проб в определенное время; пипетка/шприц для отбора проб в люминесцентные или ВЭЖХ сосуды; объем, поддерживаемый путем добавления свежего приемного раствора.
Рисунок 1 - Пример типичного устройства статической диффузионной ячейки для проведения исследований перкутанной абсорбции in vitro
Ячейка должна обеспечивать герметичность вокруг кожи, способствовать легкому приготовлению образцов и хорошему перемешиванию приемного раствора в контакте с обратной стороной кожи, оптимальный температурный контроль ячейки и ее содержимого. Для проведения эксперимента подходят как статические, так и проточные диффузионные ячейки.
Донорские ячейки оставляют открытыми во время экспозиции определенной дозой экспериментальной пробы. Для неопределенных видов и некоторых сценариев применения для определенных доз ячейки могут быть закрыты.
4.2 Приемный раствор
Предпочтительно использовать физиологически проводящий приемный раствор, однако, могут использоваться и другие растворы при условии, что их применение обосновано.
Необходимо знать точный состав приемного раствора.
Исследуемое вещество должно быть растворимо в приемном растворе таким образом, чтобы это не мешало абсорбции.
Приемный раствор не должен оказывать влияния на целостность кожного образца.
В проточных системах скорость потока не должна мешать диффузии исследуемого вещества в приемный раствор. В статических системах приемный раствор должен постоянно перемешиваться и регулярно обновляться. При изучении метаболизма приемный раствор должен поддерживать жизнеспособность кожи на протяжении всего эксперимента.
4.3 Подготовка кожи
В эксперименте может использоваться кожа человека или животных. Предпочтительно использовать жизнеспособную кожу, нежизнеспособная кожа также может использоваться при условии, что подтверждена ее целостность. Пригодными для применения являются, как эпидермальные оболочки (разделенные обработкой энзимами, теплом или химическим способом), так и расщепленные кожные образцы (обычно от 200 до 400 мкм толщиной), подготовленные с помощью дерматома. Может использоваться кожа обычной толщины, но избыточной толщины кожи (приблизительно >1 мм) следует избегать, если только это не является специальным требованием для определения вещества в слоях кожи.
Подбор видов, анатомическое место и техника препарирования должны быть обоснованы. Необходимо получение достоверных данных, как минимум, четырех воспроизведений для каждой экспериментальной пробы.
4.4 Целостность кожного образца
Результатом неправильной подготовки может явиться повреждение роговой оболочки, поэтому целостность подготовленной кожи должна быть проверена. При исследовании кожного метаболизма свежесрезанная кожа должна быть использована, как можно быстрее при условиях, поддерживающих метаболическую активность. Свежесрезанная кожа должна быть использована в течение 24 часов, но приемлемый период хранения кожи может изменяться в зависимости от системы энзимов, вовлеченных в метаболизм, и температур хранения. Когда пробы кожи хранятся до использования, необходимо убедиться, что поддерживается барьерная функция.
4.5 Подготовка исследуемого вещества
Проба исследуемого вещества (например, чистый, разбавленный или смешанный материал, содержащий исследуемое вещество, который наносится на кожу) должна быть подготовлена в той же форме (или в форме соответствующего суррогата), в которой человек или другие потенциальные целевые виды могут подвергаться ее воздействию. Любые другие формы используемой пробы должны быть обоснованы.
4.6 Состав и концентрации исследуемого вещества
Обычно используется более одной концентрации исследуемого вещества в диапазоне реальных воздействий на человека. Также должен быть рассмотрен экспериментальный диапазон типичных составов.
4.7 Нанесение вещества на кожу
Нанесение вещества, имитирующее воздействие на человека, составляет от 1 до 5 мг/см кожи для твердых веществ и до 10 мкл/см для жидкостей. Количество должно быть обосновано ожидаемыми условиями проведения испытания, целями исследования и физическими характеристиками пробы. Например, нанесения на кожу могут быть неопределенными, в случае, если используются большие количества вещества на единицу поверхности.
Поражение глаз отравляющими веществами кожно-резорбтивного действия. Особенности
К отравляющим веществам кожно-резорбтивного действия относятся вещества типа иприта (иприт сернистый, трихлортриэтиламин), люизит и оксимы (фосгенокеим). Сернистый иприт изучен лучше других отравляющих веществ кожно-резорбтивного действия, так как он применялся в войне 1914—1918 гг. в большом количестве.
Иприт (дихлордиэтилсульфид) является стойким отравляющими веществами, плохо растворим в воде, но легко растворяется в жирах, керосине, бензине. Иприт разрушается и теряет свои токсические свойства также под влиянием окислителей (перекись водорода, марганцовокислый калий, хлорная известь и др.).
Первые признаки отравления парами иприта обнаруживаются обычно со стороны глаз. После 2—6, а иногда и более часов так называемого скрытого периода появляется ощущение инородного тела в глазах. Вскоре к нему присоединяется резкая светобоязнь, слезотечение, блефароспазм.
Одновременно развивается картина поражения слизистых носа, дыхательных путей, органов пищеварения, появляются характерные для иприта изменения со стороны кожи; резко страдает также общее состояние отравленного (апатия, сонливость).
По тяжести поражения глаз различают случаи:
а) легкие,
б) средней тяжести и
в) тяжелые.
Большинство поражений глаз парами иприта (75—80%) составляют легкие случаи. При этом наблюдаются лишь явления раздражения конъюнктивы: гиперемия, набухлость ее, блефароспазм, слезотечение. Инъекция сосудов более выражена в той части конъюнктивы глазного яблока, которая соответствует открытой глазной щели.
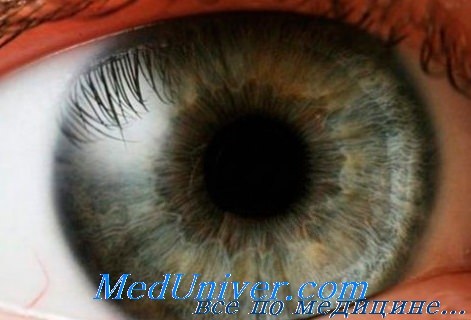
В случаях средней тяжести раздражение конъюнктивы выражено гораздо сильнее. Она резко гиперемирована и отечна (хемоз). Кроме того, отмечается краснота и припухлость век, иногда изъязвление краев век. В роговице появляется истыканность эпителия, а иногда дефекты его на отдельных участках и более или менее густые помутнения в поверхностных слоях. Узкий зрачок и цилиарная инъекция указывают на то, что имеются также явления ирита.
В сомнительных случаях, чтобы убедиться, имеются ли нарушения эпителиального покрова роговицы, следует произвести пробу с 2% щелочным раствором флюоресцина.
В случаях тяжелого поражения глаз ипритом (туман иприта и особенно капелыю-жидкий иприт) наблюдается сильнейший отек конъюнктивы глазного яблока. Она выступает из глазной щели красным валиком. Если открыть глазную щель пошире, то видно, что конъюнктива глазного яблока вблизи роговицы находится в состоянии плотного отека и имеет белый цвет (ишемия из-за сильного отека). Наиболее заметно это в области открытой глазной щели. Здесь же видна полоса густого помутнения в роговице, иногда приобретающая фарфорово-белый оттенок (некроз ткани роговицы). Вскоре развивается изъязвление роговицы и тяжелейший иридоциклит. Нередко язвы прогрессируют вглубь и приводят к прободению роговицы. Возможно развитие панофталмита.
Тяжесть ипритных поражений глаз зависит не только от концентрации вещества и длительности его действия, но и от индивидуальных особенностей пораженного. Отмечено, что более тяжело страдают глаза при действии иприта на людей, у которых и раньше глаза болели (трахома, хронический конъюнктивит, фликтены).
Весьма существенно также, были ли глаза после контакта с ОВ закрыты или открыты. У лиц, заснувших вскоре после этого контакта, поражение глаз было, как правило, тяжелее, чем у лиц, имевших в часы «скрытого периода» возможность нормальных мигательных движений век.
Заболевания глаз после ипритных поражений в легких случаях продолжается 7—15 дней и заканчивается обычно полным выздоровлением. В случаях средней тяжести симптомы болезни нарастают в течение первых 3—4 дней, а затем острые явления начинают стихать, и через 3—4 недели болезнь может закончиться либо полным восстановлением зрения, либо некоторым понижением его вследствие стойкого помутнения какого-либо участка роговицы.
Очень тяжелые исходы имеют место преимущественно в случаях поражения глаз капельно-жидким ипритом. У таких больных нередко наблюдалось образование сплошных или почти сплошных бельм роговых оболочек, а также атрофия глаз после прободения ипритных язв роговицы.
В результате язвенного поражения кожи век капельно-жидким ипритом образуются рубцы, вызывающие деформацию век и особенно краев век.
Особую опасность для глаз, пораженных ипритом и другими ОВ кожно-нарывного действия, представляет вторичная инфекция. Исследования показали, что в первые часы после нанесения на глаз животного капли иприта (или люизита) микробы вовсе исчезают из конъюнктивального мешка, посев остается стерильным. Это указывает, по-видимому, на бактерицидное действие упомянутых ОВ. Однако, уже начиная со второго дня и далее, посевы из конъюнктивального мешка на чашки Петри обнаруживают быстро прогрессирующее увеличение числа колоний, во много раз превосходящее исходное количество колоний при посевах из глаз до поражения их ОВ.
Ослабленная действием ОВ ткань конъюнктивы является хорошей почвой для размножения микробов. Тем серьезнее опасность вторичной инфекции для ипритированных глаз. Гибель таких глаз, по-видимому, связана не столько с первичным действием ОВ, сколько с разрушительными влияниями наслоившейся инфекции.
При поражении глаз люизитом все явления развиваются (в условиях лабораторного эксперимента) гораздо быстрее и протекают более тяжело, чем при ипритных поражениях. Скрытый период при действии на глаз паров люизита почти отсутствует. Отек век и конъюнктивы, а также помутнение роговицы появляется уже через 15—20 минут.
Особенно тяжело протекают поражения глаз, вызванные капельно-жидким люизитом (некроз и изъязвление кожи век, конъюнктивы и роговицы, прободение роговицы, нередко панофталмит).
Фосгеноксим действует как мощное кожно-нарывное отравляющее вещество и одновременно как удушающее ОВ. Характерным для фосгеноксима является отсутствие скрытого периода.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

