Что такое гранулированный рубец
Обновлено: 25.04.2024
Время чтения: 3 мин.
Грануляция — это разрастание ткани вокруг стомы. Как только в стому вставляют трубку или катетер, организм старается зарастить пространство вокруг инородного объекта. Из-за этого вокруг стомы образуется грануляционная ткань, красного или розового цвета. Она может болеть, воспаляться и подкравливать.
Из-за чего возникают грануляции вокруг стом, что будет, если об этом не заботиться и как лечить, рассказывает Наталья Савва , кандидат медицинских наук, доцент, директор по научно-методической работе Благотворительного фонда «Детский паллиатив».
Грануляция вокруг гастростомы
Грануляция вокруг гастростомического отверстия — одно из осложнений установки, периода заживления раны, длительного стояния трубки. Она не опасна и не указывает на инфекционные процессы, но за ней нужно внимательно следить.
Врачи предлагают поставить ребенку гастростому, а я боюсь Почему родители боятся — разбираемся вместе со специалистами и теми, кто уже прошел через процедуру
Будет ли расти грануляция вокруг гастростомы, зависит от ухода и обработки: держите трубку и кожу в чистоте и сухом состоянии, мойте водой с мылом, промывайте чистой водой, хорошо просушивайте на воздухе, следите, чтобы не сдавливались края стомы. Держать кожу в сухом состоянии и без сдавления (расстояние от наружного фиксатора до кожи 0,3-0,5 см) принципиально важно, чтобы грануляция не росла.
Если вовремя не лечить грануляцию, то она разрастается, превращается в сочащееся объемное образование, которое не дает коже плотно обхватить трубку. Поэтому содержимое желудка начинает подтекать, раздражает кожу, она краснеет и болит. Иногда может присоединяться инфекция и развиваться целлюлит подкожно-жировой клетчатки вокруг гастростомы.
Из-за чего вокруг стомы появляются грануляции?
Грануляция может развиться, если обрабатывать место вокруг стомы перекисью водорода, спиртовыми антисептиками, подкладывать салфетки, которые сдавливают и нарушают воздухообмен, способствуют росту анаэробной и грибковой флоры. Также этому способствует плотное прижатие наружного фиксатора к коже, подтекание.
Необходимо насторожиться, если ткань меняет текстуру или цвет, подкравливает.
Как лечить грануляцию вокруг гастростомы?
Чем раньше вы выявите грануляцию, тем эффективнее и легче будет ее лечить.
Грануляция вокруг трахеостомы
Грануляции в области трахеостомы образуются как снаружи, так и под ней, в подсвязочном пространстве. Они могут появиться, если есть хроническая инфекция, постоянно подтекает мокрота, кожа травмируется во время операции и от хронического ношения трубки, если края стомы сдавливаются салфетками и шейным ремешком, жесткой трахеостомической трубкой.
Жизнь с трахеостомой Ребенку поставили трахеостому. Рассказываем, как и кто может ухаживать. Что можно делать, а что нельзя? Какие ошибки иногда совершают родители?
Как лечить наружную грануляцию вокруг трахеостомы?
- Часто меняйте трубку и салфетки: минимум дважды в месяц, а лучше еженедельно, потому что на трубке образуется биопленка из микроорганизмов.
- Используйте серебряные салфетки: они помогают быстрее убрать грануляцию и профилактировать ее появление.
- На область грануляции наносите крем со стероидами и крем с антибиотиками/противогрибковыми, делайте ингаляции бекламетазона.
- Если грануляция растет, а гормональные препараты не помогают, используйте нитрат серебра.

Как лечить внутреннюю грануляцию в области трахеостомы?
Если происходит обтурация (закупоривания просвета трахеи на 50-75%) или подкравливание, трудности с заменой трубки, нужно пройти эндоскопическое обследование трахеи, чтобы найти внутреннюю грануляцию. Если она есть, хирург ее удаляет, потому что грануляция может начать кровить, мешать разговаривать (продуцировать голос), может вызвать респираторный дистресс (дыхательную недостаточность).
Если внутренняя грануляция маленькая и не закупоривает просвет трахеи, ее не удаляют, потому что высок риск рецидива. Наиболее эффективный метод лечения внутренней грануляции и ее удаления порекомендует ЛОР-врач.
Если этих симптомов нет, проходите обследование ежегодно.
Создано с использованием гранта Благотворительного фонда «Абсолют-Помощь»
Гипертрофический рубец – это избыточное разрастание фиброзной соединительной ткани при патологическом заживлении кожной раны. Косметический дефект образуется при обширных поражениях кожи с неровными краями, врожденной предрасположенности, неадекватной хирургической помощи и чрезмерном натяжении тканей. Рубец выступает на несколько миллиметров над кожей, имеет багровый или розовый цвет, по форме и размерам соответствует ране. Диагностика проводится путем осмотра, в сомнительных ситуациях назначается патоморфологическое исследование. Коррекцию гипертрофических шрамов выполняют инъекциями, методами крио- и лазерной деструкции, пластической хирургии.
МКБ-10


Общие сведения
Физиологическая регенерация должна завершаться образованием нормотрофического рубца, который не выступает над уровнем кожи и со временем становится почти незаметным. Однако у многих пациентов наблюдаются нарушения регенераторных процессов, поэтому гипертрофические рубцы – серьезная проблема для всех направлений современной хирургии. Видимый эстетический недостаток и сложности в коррекции объясняют высокую актуальность гипертрофических шрамов, требуют от врачей разработки новых методов их эффективной маскировки и удаления.

Причины
Характер рубцевания и внешний вид зажившей раны во многом определяется этиологией кожного повреждения. По причинам появления рубцы бывают посттравматические, послеоперационные, образовавшиеся на месте патологических кожных элементов или вследствие лучевой терапии. Формированию патологического гипертрофического шрама на месте раны способствуют следующие факторы:
- Характер повреждения. Патологические рубцы чаще возникают при рваных, разможженных и укушенных ранах, когда травматизация кожи не соответствует линиям Лангера. Предрасполагающим фактором является заживление вторичным натяжением, нагноение и воспаление места травмы.
- Избыточное натяжение тканей. Такая ситуация встречается при ушивании и пластической коррекции рубца без пересадки кожи, когда собственные ткани пациента стягиваются для закрытия дефекта. В месте натяжения нарушается образование структурной соединительной ткани, возникают гипертрофические явления.
- Опасная локализация. Патологические рубцы в основном образуются по передней поверхности шеи, в области мочки уха. Это объясняется различными механическими свойствами кожи на разных участках тела, что оказывает значимую роль на процессы регенерации.
- Склонность к патологическому рубцеванию. Доказаны генетические и иммунные варианты предрасположенности к образованию гипертрофических и келоидных рубцов. У таких пациентов патологические шрамы образуются даже при отсутствии других провоцирующих факторов.
Патогенез
Классическое заживление раны длится до 1 года, завершается образованием рубца. В первые 10 суток наблюдается острое воспаление, которое в последующий месяц приводит к активному фибринолизу и образованию рыхлой соединительной ткани. На протяжении 2-3 месяцев после кожного повреждения ткани уплотняются, образуется прочный шрам. Окончательная перестройка рубца происходит 4-12 месяцев, именно в этот период появляются гипертрофические изменения.
При гипертрофическом процессе незрелая соединительная ткань располагается в субэпидермальном слое. Патоморфологически она представлена тонкими пучками коллагена, отдельными эластиновыми волокнами, избыточным количеством внеклеточного матрикса. Наблюдается большое число плазматических клеток, однако гигантские фибробласты отсутствуют. Сверху образование покрыто ровным слоем эпидермиса.

Классификация
Гипертрофический рубец – один из классических вариантов шрамов, согласно клинико-морфологической систематизации. В практической дерматологии используются и другие виды классификации, чтобы наиболее точно описать особенности кожной регенерации и подобрать методы коррекции патологических случаев. Существует несколько критериев систематизации рубцовых изменений:
- По возрасту: незрелые (до 3 месяцев), умеренно зрелые (3-12 месяцев), зрелые (старше 1 года).
- По конфигурации: линейные, дугообразные, зигзагообразные, звездчатые и другие варианты неправильной формы.
- По цвету: розовые, багрово-красные, цианотичные, белесоватые, пигментированные.
- По размеру: малые (до 1 см), средние (1-2 см), крупные (до 4,5 см), обширные (более 4,5 см).
Симптомы гипертрофического рубца
Такой тип шрама начинает расти спустя 3-4 недели после травмы, его увеличение в размерах продолжается в среднем 5-6 месяцев. Гипертрофический рубец имеет красноватый или синюшный оттенок, по размеру и форме соответствует границам раны, возвышается над поверхностью здоровой кожи не более чем на 4 мм. Со временем образование приобретает светло-розовый или телесный оттенок, спустя 12-18 месяцев возможна его частичная спонтанная регрессия.
Поверхность гипертрофического рубца неровная с выступающими участками, кожа над ним матовая. Его контуры четко очерчены, однако края плавно переходят на окружающие кожные покровы и постепенно сливаются с ними. В местах постоянного трения шрам покрывается ороговевшими наслоениями и небольшими язвами. При этом пациента беспокоит болезненность, сильный зуд, мокнутие или выделение сукровицы.
Осложнения
Гипертрофические рубцы не угрожают жизни и здоровью человека. Их основной проблемой является косметический дефект, особенно при локализации на лице и открытых участках тела. Крупные и заметные шрамы сказываются на психологическом состоянии пациентов, вызывают проблемы с социализацией, становятся препятствием для построения отношений с противоположным полом.
Неприятные последствия наблюдаются при расположении рубца в месте постоянной травматизации. Вследствие механического трения на его возвышающейся поверхности возникают раны и язвы, которые могут инфицироваться с развитием вторичных бактериальных осложнений. Также возникают явления гиперкератоза, которые усугубляют неэстетичный вид рубцовой ткани.
Диагностика
При образовании гипертрофических рубцов показано обследование у врача-дерматолога и хирурга. В большинстве ситуаций диагноз устанавливают на основании физикального осмотра: определяются внешние характеристики шрама, условия его появления, наличие субъективной симптоматики. При согласии пациента проводится фотографирование пораженной области тела для отслеживания динамики изменений. Дополнительные методы диагностики:
- УЗИ мягких тканей. Сонография назначается, чтобы оценить толщину и глубину залегания рубцовой ткани, исследовать характер и полноту заживления раны, исключить осложнения.
- Патоморфологическое исследование. Для изучения структуры гипертрофического рубца проводится световая и электронная микроскопия, микроскопическая морфометрия. Исследования необходимы при трудностях дифференцировки разных видов шрамов, необходимости исключить другие кожные патологии.
Дифференциальная диагностика
В клинической практике необходимо отличать гипертрофические и келоидные рубцы, которые имеют большое внешнее сходство и патоморфологические признаки. На келоидный тип шрама указывает распространение соединительной ткани за пределы повреждения, продолжающийся рост в течение многих месяцев и даже лет, интенсивные субъективные ощущения (зуд, жжение, болезненность). Патоморфологически келоид характеризуется атипичными гигантскими фибробластами.

Лечение гипертрофического рубца
Консервативная терапия
Не существует общепринятого протокола коррекции патологической рубцовой ткани. Программа лечения подбирается индивидуально для каждого пациента, основываясь на клинических особенностях, локализации, давности образования и других характеристиках гипертрофического рубца. Небольшие образования удается скорректировать нехирургическими методиками, самые эффективные из которых:
- Локальная компрессионная терапия. Давящие силиконовые пластины и эластичные бинты замедляют разрастание рубцовых тканей, способствуют образованию шрамов нормотрофического типа.
- Инъекции кортикостероидов. При маленьких свежих шрамах гормоны угнетают чрезмерное образование фибробластов и коллагена, замедляют темпы роста соединительной ткани. Уколы глюкокортикоидов проводятся, пока рубец не сравняется по высоте с поверхностью кожи.
- Физиотерапия. Для сокращения объема соединительнотканных волокон применяются фибринолитические ферменты (лидаза, коллагеназа), которые вводятся методами электрофореза и ультрафонофореза.
- Криодеструкция. Для неинвазивного удаления гипертрофического рубца применяется жидкий азот, который наносится на очаг поражения, замораживает патологические ткани и разрушает их. Для достижения хорошего косметического эффекта проводится несколько сеансов.
- Лазерная шлифовка. Коррекция гипертрофических разрастаний выполняется абляционными лазерами, которые удаляют неструктурную соединительную ткань и сглаживают контуры шрама. В основном применяется фракционный метод лазерной шлифовки, который отличается коротким периодом реабилитации.
Хирургическое лечение
Оперативная коррекция рубцовых тканей показана при неэффективности лекарственных и малоинвазивных методов лечения. Хирургическое вмешательство направлено на иссечение патологических разрастаний соединительной ткани, ликвидацию чрезмерного натяжения кожи. Вторичные раневые дефекты закрываются с помощью местных или перемещенных кожных лоскутов, дермотензии с применением тканевых эспандеров.
Прогноз и профилактика
Небольшие по размеру гипертрофические рубцы успешно корректируются инъекционными, аппаратными или хирургическими методиками. При крупных шрамах и генетической склонности к патологической регенерации прогноз менее благоприятный: комплексная терапия уменьшает размеры и бугристость рубца, однако достичь нормотрофии и полностью скрыть дефект зачастую не удается.
Профилактика патологического рубцевания заключается в своевременной и квалифицированной помощи хирургов при серьезных травмах, адекватной иммобилизации в раннем периоде заживления, соблюдении этапности хирургического лечения. При обширных повреждениях кожного покрова с самого начала лечения требуется консультация пластического хирурга для выбора оптимального метода закрытия дефектов, чтобы минимизировать формирование шрамов.
3. Лечение гипертрофических и келоидных рубцов/ Г.Э. Карапетян// Фундаментальные исследования. – 2013. – №3.
4. Применение ферментов при лечении больных с гипертрофическими рубцами/ Б.А. Парамонов, И.И. Турковский, С.В. Бондарев// Вестник хирургии. – 2007.
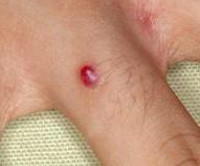
Пиогенная гранулема – это доброкачественное новообразование кожи или слизистых оболочек сосудистой природы. Внешне представляет собой округлое образование (папулу) диаметром до 1,5 сантиметров ярко-красного, вишневого или черно-коричневого цвета. Объем опухоли заполнен мелкими сосудами и капиллярами, окруженными соединительной тканью. Поверхность легко травмируется и обильно кровоточит. Определить вид новообразования врачу помогает внешний осмотр, дерматоскопия, данные гистологического исследования. Если уплотнение не подвергается обратному развитию самопроизвольно, показано хирургическое лечение (электро-, крио- или лазеркоагуляция).
МКБ-10
Общие сведения
В практической дерматологии пиогенная гранулема встречается под названием ботриомикома, телеангиэктатическая гранулема, гемангиома грануляционного типа, эруптивная ангиома. Внутри опухолевого узла соединительная ткань образует прослойки, что определяет наиболее подходящее с точки зрения гистологии определение патологии «дольчатая капиллярная гемангиома». Встречается у подростков, взрослых до 30 лет. Одинаково часто диагностируется у пациентов обоих полов. Гормональные перестройки вызывают частое развитие заболевания у беременных (примерно 5% случаев). Описаны случаи множественной ботриомикомы, ее подкожного или подслизистого расположения, формирования сосудистых образований на внутренней поверхности пищевода и кишечника.

Причины
Этиология заболевания до конца не изучена. Предположения о микотическом генезе патологии, высказываемые в XIX в., в дальнейшем не получили своего подтверждения. Несостоятельными оказались теории, согласно которым заболевание имеет воспалительную или вирусную природу. Теперь ботриомикому относят к числу ангиом, развивающихся как реактивный процесс на месте микротравм. В генезе заболевания основное значение имеют:
- Механическое повреждение слизистых и кожи. Ведущий фактор в развитии заболевания. Об этом свидетельствует локализация новообразований на наиболее подверженных травмам и микроповреждениям участках тела: пальцах рук, стопах, губах, деснах, слизистой оболочке носа и рта. Для запуска образования гранулемы достаточно незначительного воздействия: укола, занозы, небрежной обработки кутикулы ногтя.
- Гормональный дисбаланс. По статистике, большинство случаев сосудистых новообразований выявляется у подростков, беременных женщин. Значимый провоцирующий фактор - прием гормональных контрацептивов, эндокринная патология. Значение имеет повышение сальности кожи под воздействием гормонов и чрезмерное ее обезжиривание в пубертатном периоде, повышение уровня фактора роста сосудов у беременных.
- Лекарственное воздействие. Вероятность появления грануляционной гемангиомы повышается при приеме ингибиторов протеазы, некоторых противовирусных препаратов, ретиноидов, используемых для лечения угревой сыпи. Значение имеют препараты как системного (в таблетках, капсулах, инъекциях), так и местного действия (кремы, лосьоны, мази).
- Кожные заболевания. Пациенты с дерматозами, пламенеющим невусом, телеангиэктатической ангиомой страдают ботриомикомой чаще, чем люди без дерматологических проблем. Множественные поражения развиваются на месте термических и химических ожогов. Раздражение слизистой роговицы и конъюнктивы химическими веществами, непереносимость определенных компонентов косметики, конъюнктивиты и блефариты могут стать причиной появления сосудистых папул на веках. Гигантские гранулемы развиваются у лежачих больных в местах пролежней.
Патогенез
В основе развития папулы лежит реактивное разрастание грануляционной ткани под влиянием внешних и внутренних воздействий. Грануляции состоят из новообразованных сосудов и соединительной ткани, обеспечивают быстрое заживление раны. Они создают условия для последующей эпителизации раневой поверхности, формирования рубца. Гранулема является следствием нарушения нормального процесса формирования грануляций, чрезмерного развития сосудов, активного деления фибробластов, избыточной продукции волокон соединительной ткани при травме. Нормальная толщина грануляционного слоя составляет 1-2 мм. Диаметр патологического образования может достигать полутора сантиметров.
Развитие пиогенной гранулемы во многом повторяет процесс заживления раны. Папула состоит из артериол, венул, капилляров, небольшого количества фибробластов, соединительнотканных волокон. Чем дольше существует новообразование, тем больше в нем становится соединительной ткани. Завершающая стадия – выраженный фиброз папулы, сопровождающийся эпителизацией ее поверхности.
Симптомы пиогенной гранулемы
В 75% случаев рост узла начинается на неизмененной коже. Микротравмы, которые могут привести к появлению ботриомиком, часто остаются незамеченными пациентом. Помимо пальцев и слизистой полости рта, папулы могут появиться на коже лица, тыле кистей, ладонях, шее, груди, верхней части спины. У беременных уплотнения образуются преимущественно на слизистой десен верхней челюсти, внутренней поверхности губ.
Папула растет несколько недель. Максимальный диаметр – 1,5 см, средний – 6 мм. Имеет округлую или дольчатую форму, насыщенный цвет за счет большого количества сосудов, широкое основание, реже - короткую ножку. По консистенции мягкая, эластичная. Поверхность папулы легко травмируется, часто эрозирована или покрыта корками, может быть окружена белой каймой отслоившегося эпителия. Узел безболезненный, т.к. не имеет нервных окончаний. Дискомфорт вызывает наличие выступающего образования на руках, шее, плечах и других частях тела, которое цепляется за одежду, предметы, дает обильное кровотечение при повреждении. Ботриомикома в области ногтевого ложа во время активного роста может отслаивать ногтевую пластинку.
Достигнув определенного размера, папула начинает постепенно уплотняться за счет активного развития соединительнотканных прослоек вплоть до полного фиброза. Тромбозы, запустевание сосудов приводят к очаговым некрозам пиогенной гранулемы. При устранении причинного фактора образование может исчезнуть самостоятельно. Обратное развитие гранулемы может занять несколько месяцев.
Осложнения
Единственное значимое осложнение пиогенной гранулемы – обильное кровотечение, которое открывается при повреждении уплотнения. При длительном истечении крови из множественных узлов у пациента существует риск развития анемии. При наружной локализации образований источник кровопотери можно легко установить. Заподозрить кровотечение из желудочно-кишечного тракта бывает намного сложнее. Трудности может вызвать проведение дифференциальной диагностики ботриомикомы и кровоточащей язвы желудка или кишечника.
Диагностика
Доброкачественную пиогенную гранулему необходимо отличать от целого ряда других патологических образований. Здесь решающее значение имеют внешний вид узла, его микроскопическое строение, любые другие данные, которые помогают дерматологу поставить точный диагноз: скорость роста новообразования, наличие провоцирующих факторов, эффективность проводимого ранее лечения, сопутствующие заболевания. Ценную информацию позволяют получить:
- Дерматоскопия. Исследование папулы при помощи дерматоскопии позволяет выявить признаки, характерные для ангиоматозного новообразования (однородный узел красноватого цвета, окруженный белым венчиком). Как правило, визуальных признаков достаточно для проведения дифференциальной диагностики заболевания с рядом доброкачественных и злокачественных патологических изменений кожных покровов, внешне похожих на ботриомикому.
- Биопсия узла. Забор ткани для проведения гистологического исследования часто проводится прямо во время операции по удалению новообразования. Это позволяет подтвердить диагноз ботриомикомы, определить объем хирургического вмешательства. При патоморфологическом исследовании определяется разрастание капилляров и фибробластов, инфильтрация стромы лейкоцитами.
Сложные диагностические случаи могут потребовать осмотра дерматоонколога, хирурга. На ботриомикому внешне похожа беспигментная меланома, плоскоклеточный рак кожи, кожные метастазы опухолей костей, внутренних органов, ряд других злокачественных новообразований. Расположение очагов между лопатками может быть одним из проявлений болезни Ходжкина, что требует внимания гематолога.
Лечение пиогенной гранулемы
Врачебная тактика в отношении новообразования определяется рядом факторов: давностью существования, расположением, обильностью кровотечений, наличием у женщины беременности. Периодически кровоточащий узел пальца придется удалить сразу же, чтобы облегчить пациенту выполнение повседневных дел. Образование слизистой рта, которое появилось во время беременности, рекомендуется наблюдать несколько месяцев после родов. Если пиогенная гранулема не регрессирует самопроизвольно, ее удаляют во время небольшой амбулаторной операции. Методы хирургического лечения включают:
- Электрокоагуляцию. Позволяет удалить патологически измененные ткани быстро, с минимальной кровопотерей. Вероятность рецидива ботриомикомы после электрокоагуляции ниже по сравнению с другими хирургическими методами. Обязательно обезболивание с применением местных анестетиков. При помощи электрода уплотнение отсекается от поверхности кожи в основании. Полученный фрагмент ткани отправляется на гистологию.
- Удаление жидким азотом. Криотерапия применяется только в тех случаях, когда другие методики недоступны. Низкая температура также способствует уменьшению кровотечения, однако не так хорошо, как электрокоагуляция. В связи с этим для обезболивания рекомендуется смесь лидокаина с эпинефрином. Эпинефрин вызывает резкое сужение сосудов в месте инъекции, продлевает срок действия местного анестетика.
- Лазерное удаление. Лазеркоагуляция - практически бескровный метод, после которого при грамотном проведении процедуры не остается заметных рубцов. Клетки крови содержат пигмент гемоглобин, который поглощает энергию лазерных импульсов намного активнее окружающих тканей. Это позволяет лазерному лучу воздействовать на область расположения папулы дифференцированно. Сосудистое образование удаляется, а здоровые клетки остаются неповрежденными.
Независимо от того, какой хирургический метод применялся, в месте проведения манипуляции остается ранка округлой формы, покрытая плотной темной корочкой. Под ней создаются оптимальные условия для эпителизации. Корочку нельзя удалять до полного заживления ранки, иначе есть риск развития рубца. Это единственное ограничение послеоперационного периода. Назначение консервативного лечения целесообразно только при первых признаках рецидива. В этом случае местно применяется мазь, содержащая 5% имиквимод.
Прогноз и профилактика
В случае установленного и подтвержденного диагноза пиогенной гранулемы прогноз для жизни и выздоровления благоприятный. Регресс уплотнения без лечения наблюдается в каждом втором случае. Хирургическая операция дает полное излечение, однако всегда существует риск рецидива. Молодая папула может появиться на том же месте, где располагался удаленный узел. Упорное течение требует более внимательного отношения к причинным факторам появления пиогенной гранулемы, их устранения по мере возможности. Способы профилактики ботриомикомы ввиду отсутствия точных данных об этиологии заболевания не разработаны; следует избегать травмирования кожи и слизистых, своевременно лечить дерматозы.
1. Особенности ангиогенеза при пиогенной гранулеме/ Гуськова О.Н., Скарякина О.Н.// Вестник новых медицинских технологий. – 2018 - Т. 25, №3.
2. Пиогенная гранулема как междисциплинарная проблема/ Ефанова Е.Н., Русак Ю.Э., Васильева Е.А., Лакомова И.Н., Кельдасова Р.Р. – 2017.
3. Пиогенная гранулема в практике врача дерматолога/ Тарасенко Г.Н., Тарасенко Ю.Г., Бекоева А.В., Процюк О.// Российский журнал кожных и венерических болезней. – 2017.
4. Дерматовенерология. Национальное руководство/ под ред. Бутова Ю.С., Скрипкина Ю.К., Иванова О.Л. — 2013.
Рассказываем о механике формирования рубцовой ткани, приводим типологию рубцов и описываем оптимальные методы коррекции каждого из них.
Введение
Нет ни одного человека на Земле, не знающего, что такое шрамы. Начиная с детского возраста, с момента нашего знакомства с внешним миром, открытия новых горизонтов и начала физической активности, неизбежны травмы, которые так или иначе ведут к рубцеванию. Этот процесс обеспечивает быстрое и качественное закрытие дефектов, препятствуя нарушению функции органа, распространению воспаления и присоединения инфекции.
За миллионы лет эволюции природа обеспечила нас эффективными механизмами заживления ран, однако не всегда для нас они приемлемы, учитывая частую эстетическую значимость объекта. Иногда и вовсе они принимают патологическую сторону, приводя к гиперкоррекции дефекта, вызывая неприятные ощущения, нарушение работы различных структур.
Механика возникновения и анатомия
Согласно определению, «рубец» (cicatrix) — это соединительная ткань, возникшая вследствие регенерации тканей после повреждения или воспаления. При повреждениях кожи восстановление происходит за счёт наиболее активного — базального — слоя эпидермиса. Сохранившиеся вблизи дефекта кератиноциты, через нейрогуморальные механизмы получив информацию о повреждении, начинают активно делиться и устремляются на дно раны, наползают с краёв, создавая сначала монослой клеток, а затем и многослойный пласт, под которым идёт завершение процесса репарации кожного дефекта и восстановление кожи.
При поражении кожи на данной глубине, под воздействием солнечного излучения, возможно появление гиперпигментаций. Особенно это касается кожи III и IV фототипов по Фитцпатрику. Возникающая при поражении петель капилляров воспалительная реакция, приводит к стимуляции тучных клеток, выделению большого количества биологически активных молекул, медиаторов воспаления, гистамина, стимулирующих синтетическую активность меланоцитов. В них образуется большее количество меланина, который передаётся кератиноцитам и вызывает очаговую посттравматическую гиперпигментацию.
При отягощающих обстоятельствах (присоединение инфекции, снижении иммунитета и др.) происходит углубление кожного дефекта ниже базальной мембраны, где располагаются меланоциты. В этих случаях после заживления дефекта на его месте может остаться депигментированное пятно или атрофичная кожа, а при полном отсутствии базальных кератиноцитов на базальной мембране — рубец.
Также депигментация кожи возможна: при I и II фототипах, химических травмах, наличии в анамнезе витилиго, дефиците микроэлементов (меди, железа, цинка, селена, тирозина и др.). Травмы кожи ниже гребешков эпидермиса на границе сосочкового и сетчатого слоёв дермы практически всегда заканчиваются рубцеванием.
В том случае, если на месте раны много придатков кожи с сохранившимися эпителиальными клетками, реактивность организма высокая, хорошее кровоснабжение, травма может заканчиваться без образования выраженных рубцов, но кожа при этом может быть тонкой, атрофированной, с депигментированными участками.
В случае вторичной инфекции, наличия сопутствующих отягощающих факторов, снижающих реактивность организма, возможно затяжное воспаление с неадекватной воспалительной реакцией, расширением и углублением площади деструкции и появлением гипертрофических и келоидных рубцов.
Рубцовая ткань — это «заплатка» из волокон коллагена, которая отличается от окружающей кожи: она менее эластична, более подвержена ультрафиолетовому излучению, в ней не восстанавливаются потовые, сальные железы и волосяные фолликулы.
Продукция коллагена — один из наиболее важных процессов в ранозаживлении, так как именно коллагеновыми волокнами замещается глубокий раневой дефект.
Синтез коллагена зависит не только от функциональной активности фибробластов, но и от биохимических процессов в ране, микроэлементного состава. Межклеточное вещество также выполняет не последнюю роль, так как обеспечивает межклеточное взаимодействие. Это своеобразный «суп», в котором «варятся» вышеуказанные ингредиенты, обеспечивая репаративные процессы.
Основным компонентом межклеточного матрикса является гликопротеид фибронектин. Фибробласты и макрофаги раны активно секретируют фибронектин для ускорения контракции раны и восстановления базальной мембраны.
Типы рубцов и методы их коррекции
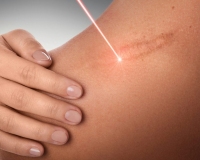
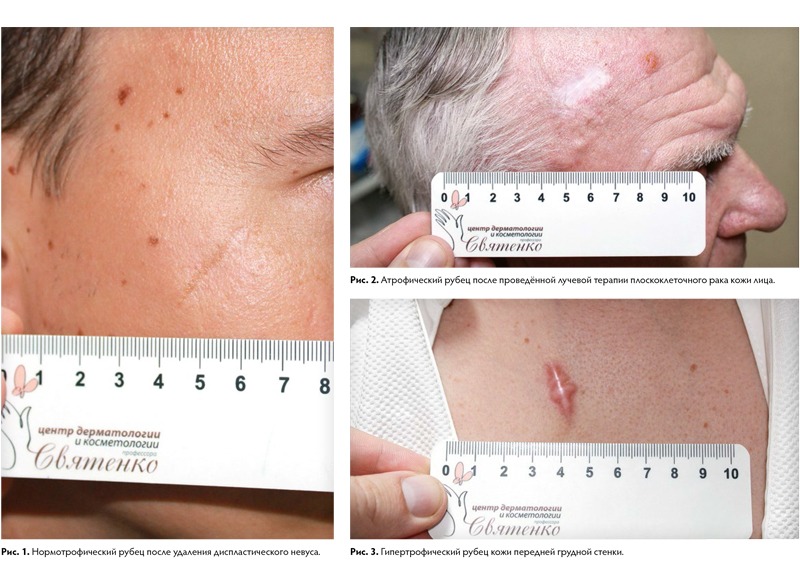
По объёму образования тканей выделяют три формы нормального рубца: атрофический, нормотрофический и гипертрофический.
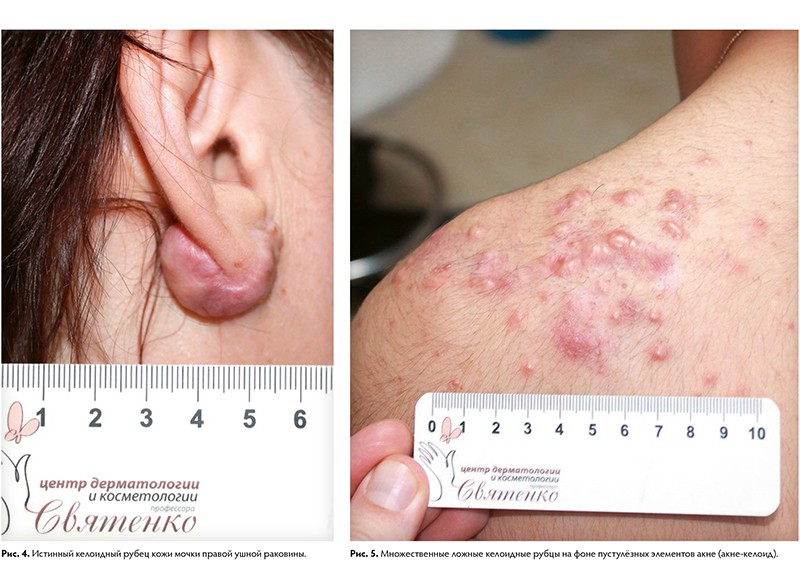
Атрофические — это рубцы, объём которых снижен по сравнению с окружающими тканями. Они тонкие, имеют молочно-белый или бледно-розовый окрас, часто на их поверхности находятся множественные телеангиэктатические сосуды, субъективных ощущений не вызывают. Учитывая особенность строения кожи, наиболее частые локализации для их возникновения — это кожа спины, передней грудной и брюшной стенок. Также атрофические рубцы возникают после перенесённой ветряной оспы, в местах везикулёзных высыпаний, вследствие их расчесывания, при пустулёзных высыпаниях угревой болезни (постакне), после проведения лучевой терапии при раке коже.
Для лечения данного вида рубцов могут быть использованы:
- биоревитализанты — с целью волюмизации,
- методы светолечения, включая Nd: Yag-лазер, IPL — для коагуляции сосудов на поверхности,
При формировании рубца молекулы клеточного фибронектина связываются друг с другом с помощью дисульфидных связей и вместе с коллагеном, эластином, гликозамингликанами заполняют межклеточный матрикс.
- различные методики дермабразии, при больших площадях поражения возможно применение методик пластической хирургии.
Нормотрофические — рубцы, которые не изменяют рельеф кожи, белесоватого цвета, со сниженной чувствительностью и нормальной эластичностью. В большинстве случаев они не требуют лечения. Возможно применение:
- различных вариантов дермабразии (механическая, лазерная),
- химических пилингов (TCL, миндальный, Джесснера) для оптимизации текстуры рубца, границы перехода на здоровую кожу.
Для каждого вида рубцов характерны особенности локализации, причины формирования. Несмотря на отсутствие патологических изменений, они могут вызывать эстетические дефекты, доставлять беспокойство пациенту. Для каждого вида рубцов также существуют оптимальные методы коррекции.
Гипертрофическим рубец будет вследствие избытка продукции коллагена, однако при увеличенном объёме площадь такого рубца не будет превосходить площадь зоны повреждения. Гипертрофические рубцы могут иметь тенденцию к регрессии, как ранняя стадия формирования нормотрофического рубца, так и являться пограничным состоянием, если речь идёт о длительном временном периоде (более 6‑ти месяцев).
Чаще всего гипертрофические рубцы формируются на коже туловища, при массивных повреждениях. Инфицирование раны, трение, повторная травма в месте рубцевания могут провоцировать гипертрофию рубца.
С целью профилактики гипертрофии применяют силикон, который обеспечивает реполяризацию заряда на поверхности нитей коллагена, обеспечивая структурную организацию рубца. Также силикон препятствует испарению эндогенной воды с поверхности, улучшая трофику.
Основным методом лечения гипертофического рубца является внутрирубцовое введение депонированных кортикостероидов. Препаратом выбора в данном случае является триамцинолона ацетонид. Инъекции выполняются с интервалом в 4 – 5 недель, курс лечения, как правило, составляет 1 – 6 введений.
При возникновении контрактур, усиленного натяжения тканей рубца используют протеолитические ферменты.
Также для коррекции объёма рубца хорошо себя зарекомендовал эрбиевый лазер.
Последнее время для лечения различных рубцовых процессов активно используется инъекционная карбокситерапия: конкурентное замещение кислорода в нестабильной молекуле оксигемоглобина на углекислый газ. Процесс приводит к образованию стойкой молекулы карбоксигемоглобина и высвобождению кислорода, что положительно сказывается на трофике тканей, снижает показатель pH, стабилизирует мембраны клеток, препятствует активации воспалительных цитокинов.
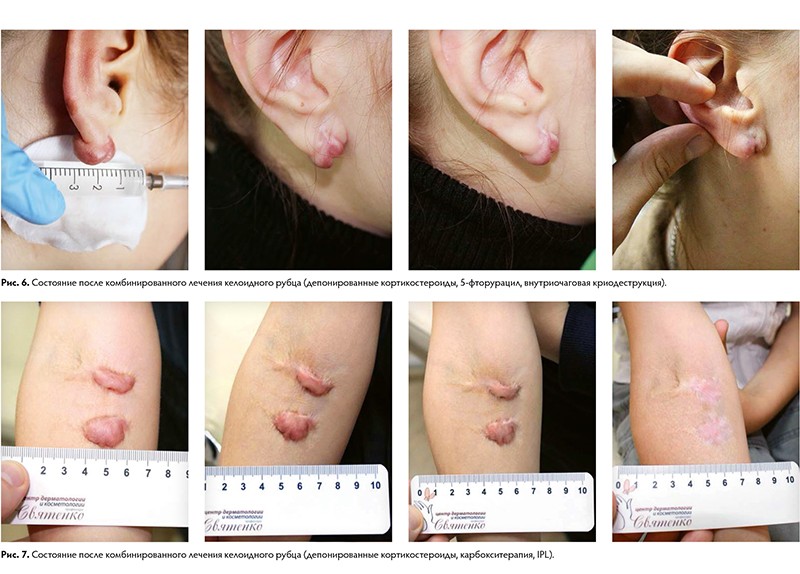
Существуют также виды патологических рубцов: истинные и ложные келоидные рубцы. Келоидный рубец — опухолевидное разрастание грубой волокнистой соединительной ткани кожи. Развитие келоидов связывают с мутацией коллагена 7‑го типа и атипичной активностью фибробластов.
Для келоидных рубцов характерен быстрый, импульсный, безудержный рост, выходящий за пределы имеющегося повреждения и не зависящий от степени повреждения. Рост наблюдается в ранний период рубцевания и стабилизируется, как правило, к 3 – 6‑му месяцу от момента начала формирования. Для истинных келоидов характерно появление на неизменённой коже, без инициирующей травмы или воспалительного процесса. Излюбленной локализацией для возникновения у европеоидной расы является лицо, ушные раковины, область верхней половины туловища. Для лиц монголоидной и негроидной рас прослеживается тенденция их формирования на коже конечностей.
Ткань келоидных рубцов содержит незначительное количество капиллярных сосудов, тучных и плазматических клеток. Такие рубцы зачастую вызывают жалобы на зуд, жжение, покалывание, различные болевые ощущения, что и служит поводом для обращения к врачу.
Наряду с инъекциями депонированных кортикостероидов для лечения келоидных рубцов используют:
- внутриочаговую криодеструкцию,
- лучевую терапию (близкофокусная рентгенотерапия),
- иммунотерапию (имиквимод, интерферонотерапия, пиротерапия),
- инъекции цитостатиков (5‑фторурацил, блеомицин).
Учитывая крайне агрессивное течение, применение хирургических методик в монорежиме не оправдано и ведёт к рецидивам до 100 % случаев.
Заключение

Photo: Karolina Gac / Unsplash

Photo: Karolina Gac / Unsplash
Пролежни – это постоянно функционирующие ворота для раневой инфекции. У каждого четвертого пациента с пролежнями развивается поражение подлежащих костных тканей и значительно возрастает риск летального исхода. Основные осложнения пролежней – это боль, психические изменения и раневая инфекция.
Современная международная классификации содержит четыре стадии пролежней в зависимости от глубины поражения – начиная с первой стадии сосудистых изменений, когда кожного дефекта еще нет, и заканчивая четвертой стадией. Последняя касается всех подлежащих тканей и приводит к максимальному ущербу для здоровья вследствие высокого риска развития местной и общей инфекции в организме. Когда врачи и медсестры сталкиваются с пролежнями на четвертой стадии, они оказываются безоружными по отношению к таким ранам.
Общие факторы задержки заживления ран: нарушение питания, очаги инфекции, различные заболевания, в том числе и психические (например, депрессия, приводящая к социальной изоляции). Эти факторы могут привести к элементарным нарушениям и каскаду отрицательных изменений обмена веществ, то есть, к разрушению или катаболизму тканей. На их фоне даже незначительное давление в течение короткого времени может привести к появлению пролежневой раны.
Далеко не все, что используется нами в рамках традиционного лечения, безусловно полезно при лечении хронических ран и пролежней. Во-первых, общее лечение может существенно затруднять заживление. Кортикостероиды, седативные средства, цитостатики, иммуносупрессоры, которые хорошо знают врачи, широко используются при лечении многих тяжелых заболеваний. Поэтому необходимо принимать во внимание, что на фоне такого лечения в течение нескольких месяцев заживляемость ран может значительно снизиться, что увеличит вероятность формирования длительно незаживающей или, иными словами, хронической раны. Так, для пациентов с пролежнями традиционные методы лечения и длительный прием препаратов из выше перечисленных групп будет снижать эффективность заживления.
Местные цитотоксические средства, то есть средства, способные повреждать мембраны клеток здоровых тканей, например, антисептики группы окислителей, такие как марганцовка, перекись водорода, способны нанести непоправимый вред живым тканям и значительно задержать заживление.
Если у пациента в ране показались уже здоровые ткани, то в перекиси водорода нет никакого практического смысла. Она выжигает новообразованную сосудистую (грануляционную) ткань и задерживает раневой процесс. Поэтому лучше всего применять раствор Рингера или антисептики из числа современных, обладающие низкой цитотоксичностью.
Марля может принести больше вреда, чем пользы
При лечении пролежней, как правило, осуществляется комплексное лечение, но здесь я хотел бы сделать акцент именно на местном лечении, которое в зависимости от используемых средств может быть хирургическим или консервативным. Хирургический способ лечения – это одномоментное или этапное иссечение ткани с последующей санацией и пластическим закрытием. Консервативный способ – это уход за раной или, другими словами, лечение под повязкой.
Первый этап лечения любой раны как при хирургическом, так и консервативном подходе – очищение от нежизнеспособных тканей, а второй этап – стимуляция образования грануляционной ткани и эпителизации раны. Все это достаточно длительный и серьезный процесс, который следует проводить с учетом современных знаний.
Повязка как средство лечения ран прошла очень длительный путь совершенствования от полотняных бинтов древнего Египта до современных многослойных повязок, которые работают на принципе влажного заживления. Давно было отмечено, что повязка может либо дополнить эффект хирургического воздействия, либо уменьшить его в зависимости от своих свойств. В настоящее время марлю нельзя признать надежным средством лечения пролежней по целому ряду свойств. Даже в комбинации с современными препаратами на мазевой основе, марля может принести больше вреда, чем пользы, так как приводит к повреждению тканей при каждой перевязке в результате врастания грануляций в ее сетчатую структуру. У пациентов с исходно медленным заживлением марля плохо поддерживает рост и восстановление, а также травмирует новообразованную ткань. Это объясняет необходимость использования более современных и эффективных средств местного лечения хронических ран.
Принцип влажного заживления ран
Термин «влажное заживление ран» (на англ. moist wound healing) стал известен в начала 1960-х годов после публикации в печати ряда научных статей по эффективному использованию влагосохраняющих адгезивных пленочных покрытий для лечения ран. Принцип влажного заживления позволяет на современном этапе эффективно реализовывать лечение хронических ран, в том числе пролежней. Некоторые повязки работают по этому принципу, и их достаточно много.
Кроме того, увеличились требования к повязкам. Уже недостаточно положить впитывающий материал на хроническую рану, чтобы надеяться на ее заживление. Повязка должна обеспечивать эффективность по многим направлениям: создавать влажную среду, защищать рану от внешнего инфицирования и, что особенно важно при лечении пролежней, удаляться максимально безболезненно.
У пациентов, вынужденных многократно получать перевязки, из-за постоянной боли ухудшается психическое состояние. Боли при перевязках быть не должно.
Смена материала на продолжительно впитывающий и гипоаллергенный, работающий на принципе влажной терапии раны, позволяет серьезным образом изменить сценарий местного лечения и ухода с больным. Кроме того, современным принципом лечения хронических ран и пролежней является полный отказ от обязательного использования цитотоксичных антисептиков, например, перекиси водорода при осуществлении ухода и местного лечения. В регионах и в крупных городах центральной России имеются различные условия материального обеспечения лечебно-профилактических учреждений, поэтому ожидать полного отказа от устаревших технологий местного лечения ран не представляется возможным, однако к этому следует стремиться. Для начала следует приобрести современные знания и определить какие из современных средств могут быть использованы.
Существует большое количество современных повязок. В том числе интерактивные повязки, способные эффективно контролировать раневую среду, увлажнять раневое ложе, сохранять каркас клеток и межтканевой каркас – экстрацеллюлярный матрикс. Современные повязки способны уменьшать протеазную активность тканей раны, то есть ее ферментативное саморазрушение, и, кроме того, стимулировать выработку сигнальных молекул белковой природы – факторов роста тканей. Таким образом, современные повязки способны глубоко воздействовать на раневой процесс как на клеточном, так и на молекулярном уровне.
Система последовательного воздействия на рану получила название TIME (от англ. time – время), так как экономит время и, дополнительно, материальные средства. Эта система тоже была основана на опыте применения повязок для лечения во влажной среде. Использование некоторых традиционных методов лечения пролежней превращает само лечение в некую фикцию, и не может претендовать на успех даже при грамотной разгрузке зон образования пролежней. Поэтому позвольте призвать вас к тому, чтобы обращать внимание на инновации в местном лечении, которые позволяют с минимальными осложнениями быстро и эффективно стимулировать заживление хронических ран.
Некоторые исследователи считают, что даже при идеальном профилактическом уходе до 5% пролежней не могут быть излечены из-за воздействия неизменяемого мощного внутреннего фактора. Например, возраста или полной денервации вследствие повреждения спинного мозга. Однако в остальных 95% случаев адекватный профилактический уход, современные знания и правильно подобранное местное лечение позволяют добиться необходимого клинического успеха.
Современные гидроактивные повязки воздействуют на раневую ткань на молекулярном уровне, предотвращая развитие хронического воспаления в ране, связанного с высокой протеазной активностью тканей и низкой активностью факторов роста, что характерно для хронических ран. Вместе с тем, они позволяют предотвратить дальнейшую хронизацию раневого процесса и добиться перехода раны из хронической формы в острую, при этом эффективно и быстро очищая рану от некрозов. При лечении пролежней мы всегда наблюдаем исходное «застревание» пролежневой раны на этапе воспаления и дальнейший переход ее в хроническую стадию заживления.
Из хронического типа заживления – в острый
Современные повязки могут изменять тип заживления раны с хронического на острый, поглощая избыточные протеазы и стимулируя выработку факторов роста. Последние синтезируются макрофагами и другими клетками тканей, участвующими в заживлении, поддерживают процесс правильного формирования грануляционной ткани из прилежащих к ране капилляров. На следующем этапе заживления достаточная концентрация факторов роста ‒ абсолютно необходимое условие для полноценного деления и миграции кожных клеток по поверхности раны. Таким образом, происходит эпителизация раневой поверхности и закрытие раны. Использование повязок, длительно создающих и поддерживающих сбалансированную влажную раневую среду, способствует ускорению образования грануляционной ткани. Применять повязки необходимо в течение всего периода эпителизации.
В наши дни по меньшей мере две технологические платформы изготовления повязок позволяют рассчитывать на полноценное заживление хронических ран – это суперабсорбирующие полимеры (САПы) и повязки на основе гидроактивного геля. Сейчас появились гидроактивные повязки, представляющие собой гидрофильные губки, защищенные гидроактивным гелевым слоем. Это мощное средство для воздействия на пролежни не только у взрослых, но и у детей. Повязки, содержащие САПы и гидрофильные (активно впитывающие) губки с гидроактивным гелевым слоем позволяют в 8 из 10 случаев реализовать полноценное поэтапное лечение хронической раны вплоть до полного ее закрытия.
Например, если традиционные средства лечения раны не помогли, и рана находится в состоянии стагнации, то современные повязки – лучший выбор для продолжения лечения такой раны. М ы исходим из того, что каждая рана, которую мы лечим, должна быть в итоге закрыта.
За счет инновационного метода производства и наукоемкости современных защищенных гидроактивных губчатых повязок достигается максимальная простота и высокая эффективность при уходе за пациентами с пролежнями. При этом перевязка гранулирующей раны выполняется с частотой один раз в 3-5 суток, а на этапе эпителизации – один раз в 5-7 дней.
Очищение хронических ран – в 2,5 раза быстрее
Многие современные повязки имеют многослойное строение. Их рабочая поверхность – всегда белая, без маркировки. Также существуют разновидности повязки с полной рабочей поверхностью для лечения глубоких ран. Для уменьшения боли при перевязке на ее рабочей поверхности могут размещаться дополнительные структуры, уменьшающие прилипание повязки к раневому ложу, например, силиконовые рельефные полоски. Внутри повязки может содержаться антисептик, инактивирующий всю флору, захваченную в течение всего периода функционирования.
«Прорывная боль» – новый термин, не новая проблема Об эволюции термина, характеристиках боли, диагностике и вариантах терапии
Как показывают современные исследования, более, чем в 80% случаев современные повязки на основе САПа эффективны при очищении хронических ран даже у необследованных пациентов. Применяются повязки на основе САПа, если в ране некроз и инфицированные ткани. С помощью этих повязок происходит медленное непрерывное отмывание раневой поверхности от нежизнеспособных тканей. При этом удаляются биологические факторы, препятствующие заживлению. Количество матриксных металлопротеиназ снижается на 87%. В рану непрерывно выделяется стерильный раствор Рингера, стимулирующий образование грануляционной ткани. При этом сохраняется экстрацеллюлярный матрикс – соединительнотканный клеточный каркас тканей, необходимый для поддержания клеточной миграции и образования новых тканей. Процесс эрозивного разрушения ткани прекращается, хронический процесс переходит в острый, хроническая рана начинает заживать более активно.
Применять современные гидроактивные повязки очень легко: необходимо предварительно подготовить рану, положить на нее повязку рабочей стороной и закрепить. Все это при необходимости может сочетаться с активной хирургической тактикой – крупные некрозы могут быть удалены острым путем, далее лечение может быть продолжено консервативным способом.
Научные данные позволяют утверждать, что современные повязки на основе САПа очищают хроническую рану в 2,5 раза быстрее по сравнению с увлажняющим гелем, а количество грануляционной ткани, которая формируется в течение первых четырех недель лечения превышает в 4 раза количество грануляционной ткани в контрольной группе, где, например, используется увлажняющий гель.
Инновационные перевязочные материалы позволяют существенно изменить сценарий раневого заживления с хронического на более активный и острый, если имеется достаточный для получения клинического результата временной ресурс. И как правило, в уходе за больным в течение нескольких недель мы можем существенно изменить прогноз течения раневого процесса к лучшему. Если раневой дефект обширный, мы с помощью современных повязок можем подготовить его к дальнейшему хирургическому лечению.
Используя современные гидроактивные повязки, мы получаем значительные преимущества. Если рана сухая, то она увлажняется, если раневое ложе содержит жидкое отделяемое, то его избыток может поглощаться одной и той же гидрофильной губчатой повязкой, защищенной гидроактивным гелевым контактным слоем. Баланс жидкости отлажен настолько, что такие повязки могут применяться не только на этапе грануляции, но и до момента полной эпителизации раневого дефекта.
Мы не должны забывать о том, что существуют и другие инновационные технологии при лечении пролежней. В том числе, технология воздействия отрицательным давлением, когда для ран большого размера используется индивидуально формируемая из специальных расходных материалов вакуум-ассистированная повязка. Если ваше учреждение профессионально занимается проблемами лечения пролежней, то сконцентрировав подобные технологии, у вас появится мощный инструмент повышения эффективности в достижении результатов лечения и профилактики инфекционно-гнойных осложнений.
Читайте также:

