Что такое эпителий в горле
Обновлено: 17.04.2024
Авторы: Геппе Н.А. 1 , Озерская И.В. , Малявина У.С.
1 Клинический институт детского здоровья им. Н.Ф. Филатова ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет), Москва, Россия
Для цитирования: Геппе Н.А., Озерская И.В., Малявина У.С. Цилиарный эпителий при респираторных вирусных инфекциях у детей. Влияние лекарственных препаратов. РМЖ. 2012;24:1222.
Болезни органов дыхания относятся к числу наиболее распространенных заболеваний человека. Респираторные заболевания у детей составляют до 90% всех инфекционных болезней. Среди болезней органов дыхания львиная доля приходится на острые респираторные вирусные инфекции (ОРВИ). Наиболее высокие показатели заболеваемости отмечаются у детей раннего возраста. Дети младшего возраста в среднем болеют ОРВИ 6–8 раз в год, а 10–15% детей – не менее 12 раз в год. Высокие показатели заболеваемости ОРВИ в детском возрасте делают эту проблему крайне актуальной для педиатрии.
Таким образом, указанные изменения функции цилиарного эпителия могут поддерживать нарушения МЦК, что требует своевременной коррекции. Учитывая влияние компонентов препарата Аскорила (в частности, сальбутамола) на ЧБР цилиарного эпителия, а также влияние амброксола (как активного метаболита одного из компонентов препарата) на восстановление сурфактанта и реологию секрета дыхательных путей, можно предположить, что препарат может оказывать положительное действие на стабилизацию и восстановление МЦК при ОРВИ у детей.
Литература
1. Herzon F.S. Nasal ciliary structural pathology // Laryngoscope. 1983. Vol. 93(1). P.63–67.
2. Sleigh M.A. Movement and coordination of tracheal cilia and the relation of these to mucus transport //Cell. Motil. (Suppl.) 1982. Vol. 1. P.19–24.
3. Fawcett D.W., Porter K.R. A study of the fine structure of ciliated epithelia // J. Morphol. 1954. Vol. 94. P. 221–281.
4. Buchdahl R.M. et al. Ciliary abnormalities in respiratory disease //Archives of Disease in Childhood. 1988. Vol. 63. P. 238–243.
5. Bertrand B., Collet S., Eloy P. et al Secondary ciliary dyskinesia in upper respiratory tract //ActaOtorhinolaryngol. Belg. 2000. Vol. 54(3). P. 309–316.
6. Chilvers M.A., Rutman A., Callaghan C.O’. Functional analysis of cilia and ciliated epithelial ultrastructure in healthy children and young adults // Thorax. 2003. Vol. 58. P. 333–338.
7. Hermens W.A., Merkus F.W. The influence of drugs on nasal ciliary movement // Pharm. Res. 1987. Vol. 4(6). P. 445–449.
8. Stetinova V., Herout V., Kvetina J. In vitro and in vivo antioxidant activity of ambroxol // Clin. Exp. Med. 2004. Vol. 4(3). P. 152–158.
9. Fraschini F., Scaglione F., Scarpazza G. et al. Effect of mucolytic agent on the bioavailability of antibiotics in patients with chronic respiratory diseases // Cur. Ther. Res. 1988. Vol. 13 P. 734–742.
10. Sisson J.H., Yonkers A.J., Waldman R.H. Effects of guaifenesin on nasal mucociliary clearance and ciliary beat frequency in healthy volunteers // Chest. 1995. Vol.107(3). P. 747–751.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Кафедра оториноларингологии, кафедра клинической фармакологии, бактериологии, аллергологии и иммунологии Ставропольской государственной медицинской академии
Кафедра оториноларингологии, кафедра клинической фармакологии, бактериологии, аллергологии и иммунологии Ставропольской государственной медицинской академии
Кафедра оториноларингологии, кафедра клинической фармакологии, бактериологии, аллергологии и иммунологии Ставропольской государственной медицинской академии
Кафедра оториноларингологии, кафедра клинической фармакологии, бактериологии, аллергологии и иммунологии Ставропольской государственной медицинской академии
Кафедра оториноларингологии, кафедра клинической фармакологии, бактериологии, аллергологии и иммунологии Ставропольской государственной медицинской академии
Микрофлора небных миндалин при хроническом тонзиллите
Кафедра оториноларингологии, кафедра клинической фармакологии, бактериологии, аллергологии и иммунологии Ставропольской государственной медицинской академии
Цель исследования - разработка стандартных подходов к фармакотерапии обострений хронического тонзиллита (ХТ) на основании данных о региональной специфике микробного пейзажа миндалин. Методы исследования: бактериологические исследования мазков со слизистой оболочки глотки у 668 пациентов с разными формами ХТ. В половине случаев ХТ определен Streptococcus pyogenes, в 24,5% - Mycoplasma pneumoniae. Наличие сопутствующей патологии респираторного и пищеварительного трактов у пациентов увеличивает вероятность идентификации энтеробактерий, энтерококков и стафилококков в ассоциации со стрептококками и микоплазмами. Для обоснованного выбора тактики антибиотикотерапии рекомендовано оценивать отягощающий анамнез и проводить бактериологическую диагностику с выделением и определением чувствительности к противомикробным средствам всех возможных патогенов.
Кафедра оториноларингологии, кафедра клинической фармакологии, бактериологии, аллергологии и иммунологии Ставропольской государственной медицинской академии
Кафедра оториноларингологии, кафедра клинической фармакологии, бактериологии, аллергологии и иммунологии Ставропольской государственной медицинской академии
Кафедра оториноларингологии, кафедра клинической фармакологии, бактериологии, аллергологии и иммунологии Ставропольской государственной медицинской академии
Кафедра оториноларингологии, кафедра клинической фармакологии, бактериологии, аллергологии и иммунологии Ставропольской государственной медицинской академии
Кафедра оториноларингологии, кафедра клинической фармакологии, бактериологии, аллергологии и иммунологии Ставропольской государственной медицинской академии
Хронический тонзиллит (ХТ) — инфекционно-аллергическое заболевание всего организма с наибольшими проявлениями патологического процесса в лимфоидном аппарате глотки. Выраженность проявлений ХТ обусловлена множественными факторами: индивидуальной реактивностью организма, вирулентностью возбудителей, особенностями окружающей среды, длительностью заболевания и т.д.
Одним из основных факторов, определяющих характер клинических проявлений ХТ, являются микробный пейзаж небных миндалин и вирулентность инфекции. Единого мнения о составе микрофлоры в лакунах небных миндалин в настоящее время нет. Это обусловлено, по-видимому, в первую очередь региональными особенностями микрофлоры, поражающей верхние отделы респираторного тракта, способами ее забора и использованием различных методов исследования патологического содержимого небных миндалин.
Исследования, проведенные в различных регионах России [1—3], подтверждают ведущую роль β-гемолитического стрептококка группы А (БТСА) в этиологии ХТ. Вместе с тем при хронической форме патологии в качестве сопутствующей микрофлоры выявляются различные виды сапрофитных и условно-патогенных микроорганизмов.
Разнообразие микрофлоры в лакунах миндалин у больных, страдающих ХТ в различных климатогеографических регионах, затрудняет выработку стандартных подходов к лечению этого весьма распространенного заболевания.
Цель исследования — разработка стандартных подходов к фармакотерапии ХТ на основании данных о региональной специфике микробного пейзажа миндалин.
Материал и методы
Обобщены результаты бактериологических анализов отделяемого лакун небных миндалин 668 больных Ставрополя, страдающих ХТ. Отделяемое получали из лакун при помощи специальных наконечников с ватным тампоном, который после забора материала помещали в специальный транспортный контейнер со средой. Выделение возбудителей и определение их чувствительности к противомикробным препаратам (ПМП) производились в соответствии с установленными правилами [4]. Кроме того, клинический материал исследовался с помощью тест-систем для выделения и определения чувствительности к ПМП Mycoplasma pneumoniae (НПО «Иммунотэкс», Россия). Тест-системы позволяют улавливать специфическую ферментативную активность микоплазм путем визуальной оценки цвета питательной среды, связанной с изменением pH раствора. Изменение цвета среды происходит лишь в случае наличия в материале не менее 10 4 КОЕ/мл Mycoplasma pneumoniе. Кроме того, тест-система комплектуется планшетом, с помощью которого в сроки от 24 до 72 ч можно получить результат по оценке резистентности респираторных микоплазм к эритромицину, кларитромицину, азитромицину, тетрациклину, доксициклину, ципрофлоксацину, офлоксацину с использованием фармакокинетических/фармакодинамических характеристик препаратов и значений МПК. Специфичность выявления жизнеспособных форм микоплазм определяется наличием в среде необходимых для них ростовых субстанций и ингибиторов роста частых возбудителей респираторных инфекций.
Для проведения бактериологических исследований использовались расходные материалы производства «Becton Dickinson», США; «Sigma», США; «BioMerieux», Франция; «COPAN», Италия; «Аквапаст», Россия; НПО «Иммунотэкс», Россия.
Результаты и обсуждение
Бактериологический диагноз был подтвержден у 425 (63,6%) обследованных. У остальных пациентов обострение процесса, видимо, было связано с вирусной инфекцией. Стрептококковый процесс выявлен у 53% пациентов, причем в подавляющем большинстве случаев выделен ЮГСА, а на долю пневмококка пришлось лишь 7,8% случаев обострений. В 24,5% выделены Mycoplasma pneumoniae. Необходимо отметить, что у 98 (23,1%) пациентов были идентифицированы ассоциации микроорганизмов: в ассоциациях с микоплазмами и стрептококками присутствовали Staphylococcusaureus (26,8% всех случаев ХТ), Enterococcus faecalis (3,5%) и представители Enterobacteriaceae spp. (15,3%).
В зависимости от стадии и выраженности воспалительного процесса в лимфаденоидном аппарате глотки заметно менялся и состав микрофлоры в небных миндалинах. Так, в стадии ремиссии ХТ при стихании воспалительного процесса БГСА составляли 27%, а преобладали микоплазмы, энтеробактерии и стафилококки. При катаральной, фолликулярной и лакунарной ангине удельный вес БГСА заметно повышался и достигал 65% при формировании паратонзиллярного абсцесса. Необходимо отметить, что в ранее проведенном исследовании выявлена корреляция частоты персистенции в миндалинах Mycoplasma pneumoniae с частотой обострений у больных с ХТ [3]. Энтерококки и различные виды энтеробактерий выявлялись только у пациентов с сопутствующей патологией желудочно-кишечного тракта (гастроэзофагеальная рефлюксная болезнь, язвенная болезнь).
При оценке чувствительности микроорганизмов к противомикробным средствам установлено, что БГСА в 100% случаев чувствительны к β-лактамным антибиотикам (пенициллин, амоксициллин и др.), левофлоксацину. Резистентными к эритромицину оказалось 12,4%, а к левомицетину — 38% штаммов БГСА. 33% штаммов Mycoplasma pneumoniae оказались резистентными к эритромицину, по 19,4% — к азитромицину и кларитромицину, 8,3% — к тетрациклинам, 16,3% — к офлоксацину/левофлоксацину и всего 5,6% — к ципрофлоксацину. Все штаммы Staphylococcusaureus оказались β-лактамо-продуцирующими, а резистентных к оксациллину, а значит и ко всем β-лактамным антибиотикам, выделено 7,6%.
Таким образом, основными возбудителями обострений при ХТ остаются БГСА, которые выявляются у большинства пациентов, причем с увеличением тяжести процесса доля стрептококков только увеличивается. Частое выявление стафилококков, продуцирующих β-лактамазы, заставляют рассматривать в качестве стартовой терапии назначение защищенных аминопенициллинов. Заметную роль в формировании воспалительного процесса, по-видимому, играет Mycoplasma pneumoniae, а у пациентов с сопутствующей патологией желудочно-кишечного тракта — энтерококки, энтеробактерии. Различный уровень резистентности микроорганизмов позволяет рекомендовать проведение бактериологической диагностики отделяемого из лакун миндалин перед выбором рациональной тактики антибактериальной терапии.
По результатам бактериологической диагностики выбор терапии рекомендуется строить на основании выявленного характера микроорганизмов и уровня их резистентности к противомикробным препаратам. В частности, стрептококковый процесс требует 10-дневной терапии феноксиметилпеницилином или амоксициллином. В случае выявления ассоциации стрептококков со стафилококками, энтерококками или энтеробактериями стартовым следует рассматривать амоксициллин/клавуланат. При микоплазмозах рекомендуется использовать макролидные антибиотики либо фторхинолоны.
Выводы
1. В обязательный перечень диагностических процедур у больных с ХТ следует включать бактериологическое исследование с выявлением всех возможных возбудителей обострений (включая стрептококки, микоплазмы).
2. Выбор тактики антибиотикотерапии (амоксициллин либо амоксициллин/клавуланат, макролиды или фторхинолоны), рекомендованной стандартами, должен строиться с учетом индивидуального микробного пейзажа в каждом случае ХТ.
Злокачественная опухоль образуется из неороговевающих клеток эпителия на участке от мягкого неба до подъязычной кости.
Анатомическое строение
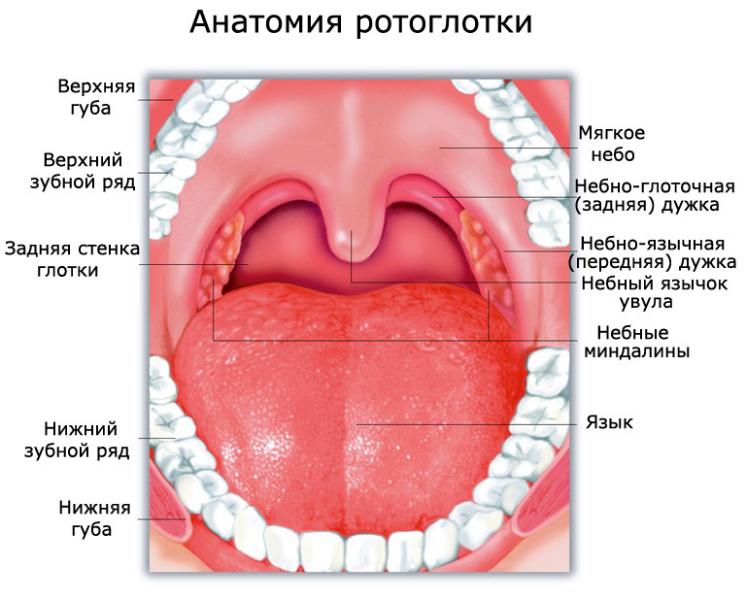
Ротоглотка – это продолжение носоглотки, средний отдел гортани. Она начинается от твердого неба и заканчивается у входа в гортань. Орган соединяется с полостью рта зевом, а отделяется небными дужками, мягким небом и спинкой языка. В этом отделе перекрещиваются пищеварительные и дыхательные пути. В состав ротоглотки входит:
- задняя треть языка (его корень);
- миндалины;
- задние и боковые стенки глотки. Задняя стенка находится на уровне третьего шейного позвонка. Боковые стенки соединяются с евстахиевыми трубами ушей.
Классификация
Опухоль в ротоглотке делится на три вида:
| Доброкачественные новообразования | Неопасные, но причиняют дискомфорт. Устраняются хирургически | Остеохондрома |
| Лейомиома | ||
| Эозинофильная гранулема | ||
| Остроконечная кондилома | ||
| Фиброма | ||
| Одонтогенные опухоли | ||
| Верруциформная ксантома | ||
| Гранулярно-клеточная опухоль | ||
| Пиогенная гранулема | ||
| Рабдомиома | ||
| Нейрофиброма | ||
| Шваннома | ||
| Кератоакантома | ||
| Папиллома | ||
| Липома | ||
| Предраковые состояния | Есть риск малигнизации, но иногда дисплазия самостоятельно регрессирует | Лейкоплакия. На слизистой возникают белесые или серые точки. Они выпячивают над поверхностью или остаются плоскими |
| Эритроплакия. Образуются красные пятна, которые кровоточат при легком прикосновении | ||
| Раковая опухоль, образующаяся из клеток неороговевающего эпителия | Врач индивидуально подбирает схему лечения | Карцинома, прорастающая только из поверхностного слоя эпителия. Диагностируется в 90% случаев, причем 60% связано с выявлением ВПЧ 16 или 18 штамма |
| Полиморфная низкосортная аденокарцинома | ||
| Аденоидная кистозная карцинома | ||
| Мукоэпидермальная карцинома | ||
| Лимфома |
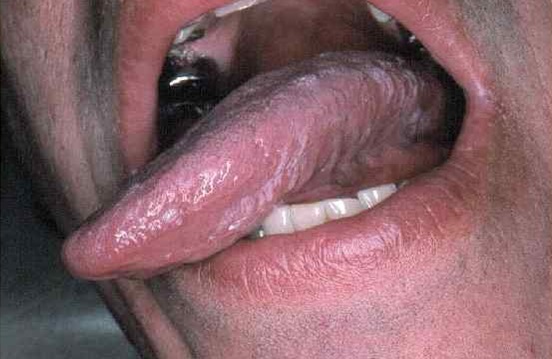
Рисунок 1. Лейкоплакия
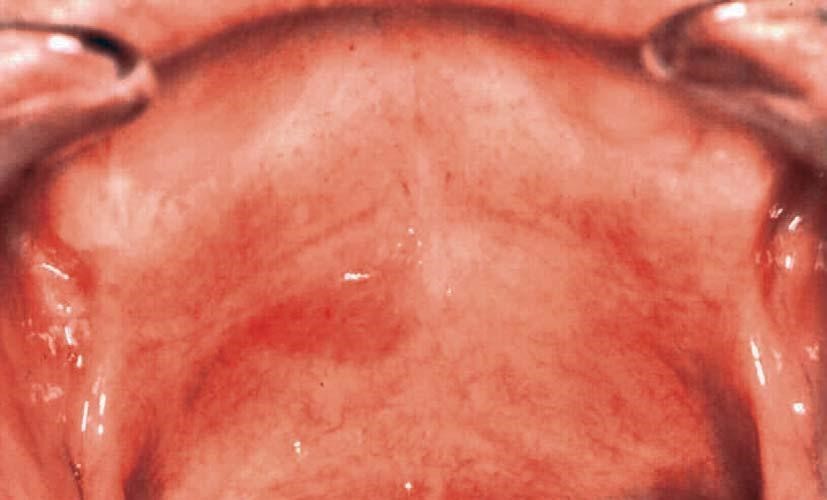
Рисунок 2.1. Эритроплакия
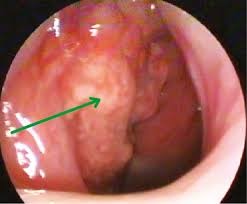
Рисунок 2.2. Эритроплакия
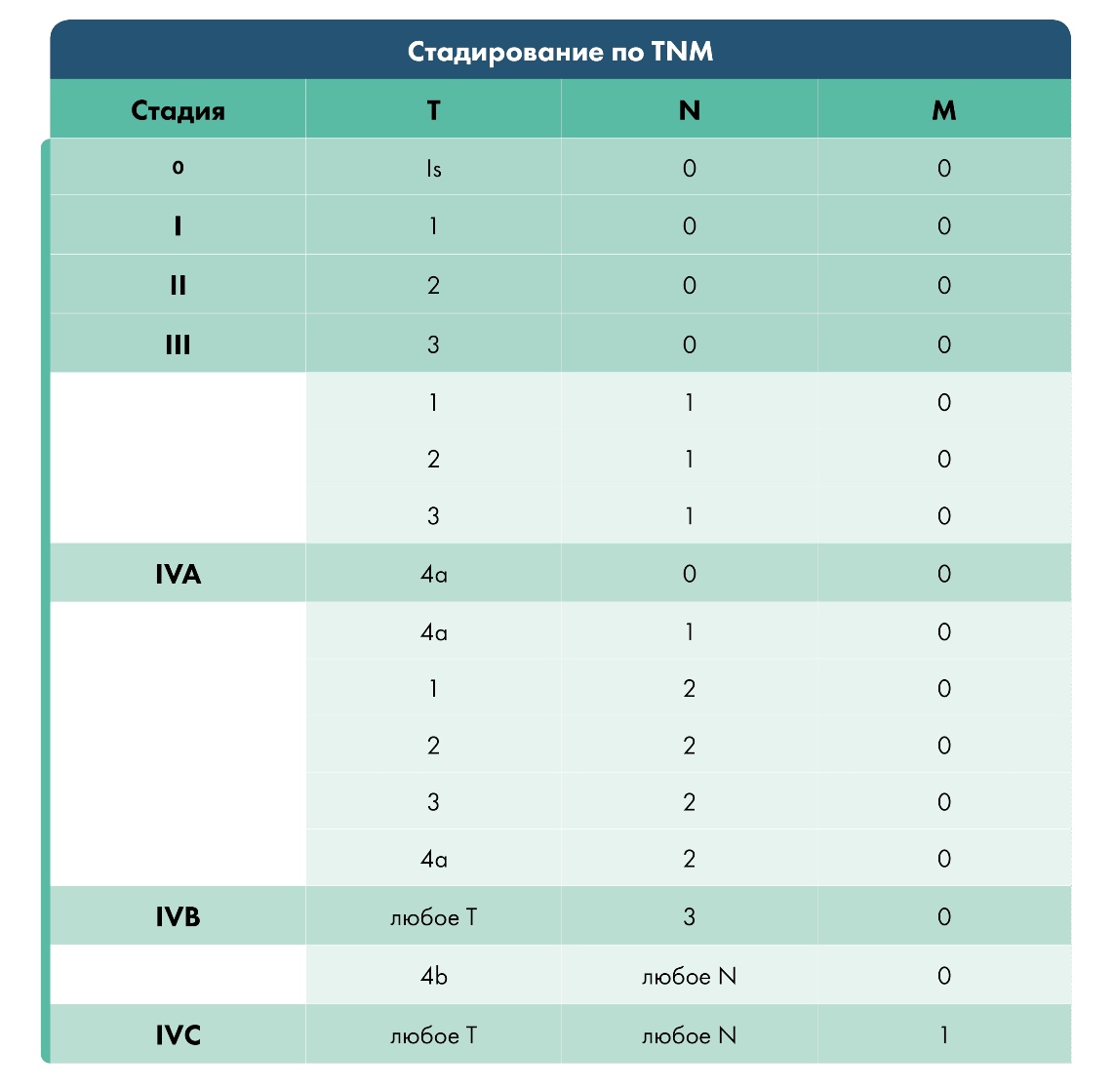
Классификация TNM

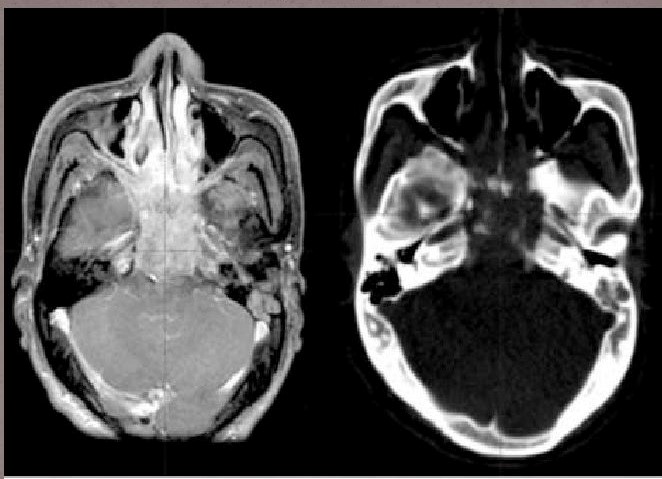
Причины возникновения
Заболеваемость раком ротоглотки достигла пика в 2015-2016 году. Диагноз ставился 13% заболевших от общего числа онкологических больных, при этом процент смертности достигал 7,5%. Смертность каждого второго больного обусловлена распространением раковых клеток в полости рта и глотки, а каждого третьего – распространением рака в гортани. На сегодняшний день заболеваемость снизилась и составляет 8,7%, но смертность остается по-прежнему высокой.
Основная причина рака ротоглотки – курение и употребление крепких спиртных напитков. Каждый третий больной является курильщиком со стажем. Токсические вещества в первую очередь проникают в глотку, систематически раздражая слизистую оболочку, разрушая костные структуры.
В группу риска входят:
- больные ВПЧ. Образование папиллом на слизистой рта и глотки может перерасти в онкологию, особенно при вирусе папилломы 16 штамма;
- пожилые люди;
- люди, которые подвергались мощному ультрафиолетовому излучению;
- ослабленный иммунитет. В эту группу относят ВИЧ-инфицированных, а также людей, которые длительное время проходили курс лечения иммуносупрессивными препаратами;
- больные врожденным дискрератозом и анемией Фанкони.
Симптомы
К сожалению, специфических признаков развития злокачественного новообразования в ротоглотке нет. Пациента должны насторожить следующие симптомы:
- длительно непроходящая боль в горле;
- ощущение инородного предмета в горле;
- дискомфорт при глотании пищи или слюны;
- сложность при пережевывании;
- белесые пятна на слизистой с красной каймой;
- онемение корня языка;
- шарик при пальпировании шеи;
- огрубевший или сиплый голос;
- неприятный запах изо рта;
- необоснованная потеря веса.
Коварство заболевания в латентном течении на первой стадии. Болезнь никак себя не проявляет, поэтому человек не обращается за медицинской помощью. Уже на 2-3 стадиях пальпируемый узелок на шее начинает болеть, ощущаться сильнее. Увеличиваются шейные лимфатические узлы. На 4 стадии рака ротоглотки нарушается дыхательный и глотательный процесс, опухоль распространяется на окружающие ткани. Болезнь обостряется кровохарканьем, стремительной потерей веса, истощением и анорексией. Иногда изо рта идет кровь. Если опухоль сдавила жевательные мышцы или нервные сплетения, движения мышц ограничивается.
Метастазы развиваются быстрее, чем сама опухоль.
Диагностика
После осмотра онколога и стоматолога назначается ряд обследований:
- анализ крови на ВПЧ. Исследование проводится методом ПЦР, секвенирования или ферментного анализа. Подтверждение вируса папилломы человека изменяет тактику лечения опухоли;
- эндоскопический осмотр гортани и ротоглотки методом ларинго- и фарингоскопии;
- цитологическое исследование. При ларингоскопии врач берет соскоб со слизистой и отправляет на анализ. Определяется клеточный состав опухоли;
- биопсия. Изъятый участок окрашивается эозином и гематоксилином, а затем наблюдается реакция на препарат;
- КТ/МРТ. Томография уточняет локализацию и размер опухоли;
- ПЭТ. Показывает распространенность опухоли на окружающие органы, а также метастазирование в органы грудной клетки.
Лечение
В зависимости от стадии заболевания и состояния больного врач назначает химиотерапию, лучевую терапию, операцию, таргетную терапию, иммунотерапию в комбинации друг с другом или отдельно.
Как правило, при операции врачи стараются сохранить орган, если раковые клетки не метастазировали. Если выявлены метастазы в лимфатических узлах, сосудах или клетки проросли в нервный ствол, проводится химиотерапия совместно с облучением. Таргетная терапия используется при раке ротоглотки, вызванном ВПЧ-ассоциированным плоскоклеточным раком. Исходя из практики, в этом случае результаты благоприятные.
После окончания курса лечения пациенты наблюдаются у онколога и стоматолога. Посещение врачей обязательно каждые 3-6 месяцев в течение первых двух лет. Следующие пять лет осмотр проводится раз в полгода-года. Последующие пять лет пациент посещает врача раз в год или чаще при недомогании. Во время посещения доктор анализирует состояние больного, учитывая результаты фиброскопии, ежегодной рентгенографии органов грудной клетки, УЗИ лимфатических узлов, органов малого таза и органов брюшной полости.
Профилактика
Предотвратить онкологию можно, выполняя ряд рекомендаций специалистов. Прежде всего, важно правильно ухаживать за полостью рта и своевременно посещать стоматолога. Врач дважды в год поддерживает чистоту зубов и следит за состоянием десен и мягких тканей.
Поскольку ВПЧ – весомый фактор в развитии рака ротоглотки, важно снизить риск заражения. Для этого необходимо исключить беспорядочные половые связи и ставить вакцину.
Специалисты рекомендуют отказаться от вредных привычек и полностью бросить курить. Сразу после еды необходимо ополаскивать полость рта, а зубы чистить дважды в день. Рациональное питание – залог здоровья, поэтому ежедневно следует потреблять больше овощей и фруктов, кушать цельнозерновой хлеб, а от переработанного мяса, бобовых и курятины лучше отказаться.
Список литературы:


Авторская публикация:
Керимова С. Н.
Ординатор отделения опухолей головы и шеи
НМИЦ онкологии им Н.Н. Петрова

Под научной редакцией:
Раджабова З.А.
Заведующий отделением опухолей головы и шеи
НМИЦ онкологии им. Н.Н. Петрова,
врач-онколог, научный сотрудник, кандидат медицинских наук, доцент
Шейные лимфатические узлы являются частым местом метастазирования злокачественных опухолей, первичный очаг которых располагается в области головы и шеи. К ним, например, относятся плоскоклеточный рак верхних отделов дыхательных путей, а также метастазы рака слюнных желез и щитовидной железы.
Наиболее распространенным клиническим признаком является увеличивающееся образование шеи, которое обычно обнаруживается пациентом или его врачом. При подозрении на метастатическое поражения лимфатических узлов шеи для диагностики и определения наилучшей тактики лечения потребуется осмотр врачом-онкологом, инструментальные методы и биопсия.
Иногда новообразования вне области головы и шеи могут неожиданно метастазировать в шейные лимфатические узлы, что требует особенно тщательной диагностики для выявления первичного очага.
Лечение будет зависеть от типа и локализации первичной опухоли, которая распространилась в лимфатические узлы шеи, и, скорее всего, будет включать в себя комбинацию хирургического вмешательства, лучевой терапии и/или химиотерапии.

Иммунофлюоресцентная визуализация метастатических клеток меланомы (красные) внутри лимфатических сосудов (зеленые). Масштабная линейка: 100 мкм
(Science Advances/Michael Detmar Group ©)
Из чего состоит лимфатическая система шеи
Лимфатическая система шеи включает в себя сосуды и узлы.
Лимфатические капилляры — это тонкостенные структуры, состоящие из одного слоя эндотелиальных клеток. Они находятся во всех тканях организма и, объединяясь друг с другом, способствуют оттоку лимфатической жидкости в более крупные лимфатические сосуды.
Стенка лимфатических сосудов состоит из трех слоев: внутреннего слоя эндотелиальных клеток, среднего мышечного слоя и внешнего слоя соединительной ткани. В лимфатических сосудах гораздо больше клапанов, чем в венозных, при этом циркуляция лимфы полностью зависит от сжатия сосудов окружающими мышцами. Лимфатические сосуды дренируют лимфу в лимфатические узлы.
В среднем на каждой стороне шеи расположено до 75 лимфатических узлов. Снаружи узел покрывает капсула, под которой располагается субкапсулярные синусы – место куда попадает лимфатическая жидкость из приносящих лимфатических сосудов. Жидкость проходит сквозь ткань лимфатического узла, которая состоит из коркового и мозгового вещества, а затем выходит через ворота лимфатического узла и попадает в отводящие лимфатические сосуды. В итоге лимфа попадает в венозную систему в месте соустья внутренней яремной и подключичной вены.

Анатомическая структура лимфатического узла (Alila Medical Media/ Shutterstock ©)
Классификация лимфатических узлов шеи
На данный момент во всем мире рекомендована к использованию классификация Американского объединенного комитета по раку (American Joint Committee on Cancer (AJCC)) 8 издания от 2018 года:
- Уровень I (IA и IB): подбородочные и поднижнечелюстные лимфатические узлы;
- Уровень II (IIA и IIB): верхняя яремная группа (делится на 2 подуровня, границей между которыми является добавочный нерв);
- Уровень III: средняя яремная группа;
- Уровень IV: нижняя яремная группа;
- Уровень V (VА и VB): лимфатические узлы заднего треугольника шеи;
- Уровень VI: передние шейные лимфатические узлы;
- Уровень VII: верхние медиастинальные лимфатические узлы.

Уровни лимфатических узлов шеи (Tenese Winslow LLC ©)
Диагностика
Осмотр
При пальпации шеи врач обращает внимание на расположение, размер, плотность и подвижность каждого узла. Особое внимание уделяется узлам, которые кажутся фиксированными к подлежащим сосудисто-нервным структурам и внутренним органам. Описание каждого узла становится важной частью медицинской документации, которая в дальнейшем может использоваться для оценки эффекта лечения.
Лучевые методы
Преимуществами УЗИ перед другими методами визуализации являются цена, скорость исследования и низкая лучевая нагрузка на пациента.
Ультразвуковыми признаками метастатического поражения лимфатических узлов может быть образование сферической формы, нарушение структуры, нечеткие границы, наличие центрального некроза и др.
Поскольку не всегда по УЗИ можно с уверенностью сказать является лимфатический узел пораженным или нет, иногда одновременно выполняют тонкоигольную аспирационную биопсию под ультразвуковым контролем с последующим цитологическим исследованием материала из этого узла. Результат цитологического исследования зависит от навыков врача УЗИ и качества образца (т.е. наличия достаточного количества репрезентативных клеток).
С появлением систем высокого разрешения и специальных контрастных веществ КТ позволяет обнаруживать лимфатические узлы, которые могли быть пропущены при иных методах диагностики.
Ценность МРТ – превосходная детализация мягких тканей. МРТ превосходит КТ в качестве предпочтительного исследования при оценке ряда новообразований головы и шеи, таких как основание языка и слюнные железы. Размер, наличие нескольких увеличенных узлов и центральный некроз – критерии, общие для протоколов исследования КТ и МРТ.
Этот новый метод визуализации все чаще используется для определения стадии опухолей головы и шеи. Метод основан на поглощении 2-фтор-2-дезокси-D-глюкозы (ФДГ) метаболически активными тканями. Исследование также может быть объединено с КТ, чтобы улучшить разрешение получаемого изображения и более точно определить расположение образования.
Биопсия
Биопсия — это удаление небольшого кусочка ткани для исследования под микроскопом или для тестирования в лаборатории на предмет наличия признаков злокачественности. В подавляющем большинстве случаев проводится тонкоигольная аспирационная биопсия. Врач, выполняющий биопсию, может использовать УЗИ или КТ для выполнения процедуры. Иногда тонкоигольная аспирационная биопсия не позволяет поставить окончательный диагноз, и требуются другие виды биопсии, такие как трепан-биопсия или эксцизионная биопсия.
 |  |
| Процесс приготовления предметных стекол для цитологического исследования. Материалом служит содержимое шприца после выполнения тонкоигольной аспирационной биопсии | |
План лечения
После определения диагноза и проведения всех диагностических исследований врач порекомендует оптимальный для пациента курс лечения. В конечном итоге лечение метастатического поражения лимфатических узлов зависит от типа и локализации первичной опухоли.
Существует три различных варианта лечения, которые могут быть использованы отдельно или в комбинации:
- хирургическое вмешательство,
- лучевая терапия,
- химиотерапия.
Хирургическое лечение
Хирургическое лечение обычно включает удаление лимфатических узлов шеи (лимфодиссекция) и последующее гистологическое исследование для точного определения стадии, так как это может существенно повлиять на дальнейшую тактику лечения. Хоть и не всегда, но чаще всего лимфодиссекция выполняется одновременно с удалением первичной опухоли.
Существуют различные виды лимфодиссекций:
- радикальная лимфодиссекция: удаление всех лимфоузлов, удаление внутренней яремной вены, удаление мышц и нервов;
- модифицированная радикальная лимфодиссекция: удаление всех лимфоузлов с сохранением мышц. Нервы и/или внутренняя яремная вена могут быть удалены;
- селективная лимфодиссекция: удаление только определенных групп лимфоузлов.
Лучевая терапия
Лучевая терапия может быть назначена в качестве самостоятельного метода лечения в послеоперационном периоде, чтобы снизить вероятность рецидива либо в комбинации с химиотерапией в качестве самостоятельного или адъювантного лечения. Обычно адъювантная лучевая терапия необходима, если по результатам гистологического исследования обнаруживается несколько пораженных лимфатических узлов.
Химиотерапия
Химиотерапия обычно добавляется к лучевой терапии в качестве самостоятельного или адъювантного (послеоперационного) лечения. В некоторых случаях может использоваться индукционная химиотерапия с целью уменьшения объема образования и последующего хирургического вмешательства.

Иммунофлюоресцентная визуализация метастатически пораженного лимфатического узла с окраской на Цитокератин (красный) – маркер характерный для опухолевых клеток эпителиального происхождения. Масштабная линейка: 50 мкм
(Science Advances/Michael Detmar Group ©)
Прогноз
Метастазы в лимфатические узлы шеи могут возникать при онкологических заболеваниях различных локализаций, поэтому давать прогностические оценки для этой группы пациентов следует только после выявления первичной опухоли.
Факторы, влияющие на прогноз:
- стадия заболевания,
- локализация первичной опухоли,
- гистологический подтип и степень дифференцировки,
- количество и размер пораженных лимфатических узлов,
- характеристика края резекции опухоли.
Наблюдение после лечения
Пациенты должны регулярно посещать своего специалиста по опухолям головы и шеи для оценки состояния на предмет любых признаков рецидива заболевания.
Стандартный график наблюдения
В первые 1–2 года осмотр и сбор жалоб рекомендуется проводить каждые 3–6 месяца, на сроке 3–5 лет – один раз в 6–12 месяцев. После 5 лет с момента операции посещать врача необходимо один раз в год или при появлении жалоб. У пациентов с высоким риском рецидива перерыв между обследованиями может быть сокращен.
Список литературы:
- RUSSCO Практические рекомендации по лечению злокачественных опухолей головы и шеи. 2020г
- NCCN Clinical Practice Guidelines in Oncology Head and Neck Cancers Version 1.2021 — November 9, 2020
- DeVita, Hellman, and Rosenberg’s Cancer: Principles & Practice of Oncology (Cancer Principles and Practice of Oncology) 11th Edition 2019
- AJCC (American Joint Committee on Cancer). Cancer Staging Manual – 8th Edition. New York, NY: Springer; 2018
- Pisani, Paolo et al. “Metastatic disease in head & neck oncology.” Acta otorhinolaryngologica Italica 2020
- Van den Brekel MW. Lymph node metastases: CT and MRI. Eur J Radiol. 2000
- Chen ZW, Zhu LJ, Hou QY, Wang QP, Jiang S, Feng H. Clinical application of positron-emission tomography for the identification of cervical nodal metastases of head and neck cancer compared with CT or MRI and clinical palpation. Chinese journal of stomatology. 2008
- Qiaoli Ma et al. Unexpected contribution of lymphatic vessels to promotion of distant metastatic tumor spread. ScienceAdvances 08 Aug 2018
- Sun, J et al. Computed tomography versus magnetic resonance imaging for diagnosing cervical lymph node metastasis of head and neck cancer: a systematic review and meta-analysis. OncoTargets and therapy. 2015
- Robbins KT, Shaha AR, Medina JE, et al. Consensus statement on the classification and terminology of neck dissection. Arch Otolaryngol Head Neck Surg. 2008
- López, Fernando et al. Cervical lymph node metastases from remote primary tumor sites. Head&neck 2016

Авторская публикация:
Амиров Николай Сергеевич
Клинический ординатор НМИЦ онкологии им. Н.Н. Петрова

Под научной редакцией:
Раджабова З.А.
Заведующий отделением опухолей головы и шеи
НМИЦ онкологии им. Н.Н. Петрова,
врач-онколог, научный сотрудник, кандидат медицинских наук, доцент

Онкопатология гортани представлена в виде таких заболеваний:
- плоскоклеточный рак гортани;
- аденокарцинома;
- саркома.
Подавляющее число злокачественных опухолевых процессов в горле обусловлено развитием плоскоклеточного рака. Однако уточнение природы атипичных клеток, из какой ткани они образуются, является важным условием выбора корректного лечения.
Классификация рака гортани
Плоскоклеточный рак гортани – наиболее распространенное онкологическое заболевание, поражающее эпителиальный слой органа. Злокачественный процесс поражает плоский эпителий на разных стадиях его развития, вызывая мутацию клеток, что и проявляется различными гистологическими формами заболевания. По степени ороговевания эпителиального слоя различают плоскоклеточный ороговевающий рак гортани и неороговевающий рак.
Такое разделение определяется только по результатам биопсии, которую проводит специалист. Выделить участок пораженного участка ткани можно при ларингоскопии или непосредственно при оперативном вмешательстве. Заключается процедура в извлечении сомнительного участка и дальнейшее исследование его под микроскопом.
Для достоверности диагностики наиболее благоприятным местом для забора материала является пограничный участок между патологически измененным и нормальным эпителием. Проведение исследования является необходимым для уточнения злокачественного образования и его гистологической формы.
Выбор лечебной тактики и прогнозы зависят от полученных результатов биопсии.
Неороговевающая форма плоскоклеточного рака характеризуется быстрым ростом, распространением на близлежащие ткани, ранним развитием метастазов, то есть, более злокачественным течением. Ороговевший эпителий, характеризующий другую разновидность плоскоклеточного рака, свидетельствует о более благополучном течении заболевания.
Стадии процесса
Большое значение для прогноза жизни имеет стадия заболевания, на которой начато его лечение. Уточнение диагноза на ранних сроках заболевания способствует более оптимистичным прогнозам. Эффективность проводимого лечения в этом случае будет значительно выше.
Рак горла в своем развитии проходит четыре стадии, характеризующиеся клиническими отличиями. Существует международная классификация заболевания по системе TNM, где T характеризует собой размеры и границы прорастания опухоли, N – распространение метастазов в региональные лимфоузлы, M – вовлечение в процесс всего организма и наличие метастатического поражения удаленных органов.

Первая стадия характеризуется наличием незначительного участка поражения, локализующегося в строго ограниченном месте.
Окружающие ткани при этом не изменены. Лимфатические региональные узлы не увеличены. Симптоматика заболевания на этой стадии является абсолютно скудной, маскируется воспалительными заболеваниями горла. Пациент может жаловаться на неприятные ощущения в горле, ощущение инородного тела при глотании, поперхивание. По системе TNM первая стадия соответствует T1N0M0.
При проведении регулярного медосмотра на этой стадии чаще всего обнаруживается рак глотки, а также надсвязочного отдела гортани. При данной локализации процесса предварительный диагноз может быть выставлен с помощью ларингоскопии и фарингоскопии, доступной в любом медицинском учреждении. В связи с этим, своевременное обращение к отоларингологу позволит начать лечение на ранних сроках, что будет способствовать улучшению прогноза. Наиболее эффективные лечебные мероприятия, применяемые на данном этапе, - хирургическое удаление опухоли и проведении лучевой терапии.
Прогноз при своевременно проведенном лечении рака горла первой стадии является благоприятным.
Вторая стадия заболевания характеризуется дальнейшим ростом опухоли, затрагивающим прилегающие области.
Может отмечаться увеличение региональных лимфоузлов. Они мягкие, легко смещаются, их пальпация безболезненна. Диагностическая биопсия позволяет определить отсутствие в них метастазов.
В связи с прорастанием нервных окончаний, на этой стадии возможно уже развитие болевого синдрома. При поражении голосовых связок нарастает изменение тембра голоса. Он становится осипшим. Отмечается быстрое утомление от разговора. Удаление опухоли хирургическим путем является необходимым условием, способствующим улучшению прогноза. Своевременное проведение лечебных мероприятий на этой стадии гарантирует продление жизни на 5 лет для 80% пациентов.
Третья стадия рака горла характеризуется усугублением симптоматики.

- недомогание;
- слабость;
- потеря в весе;
- боль в горле;
- ощущение инородного тела в горле;
- сухой кашель;
- затруднение дыхания, возможно развитие удушья;
- изменение голоса, вплоть до беззвучия.
Важным диагностическим и прогностическим фактором является увеличение лимфоузлов. Они становятся плотными, спаянными с окружающими тканями. В некоторых случаях лимфоузлы выглядят в виде плотных пакетов.
Диагностическая биопсия устанавливает наличие в них атипичных клеток, что свидетельствует о развитии метастазов. В то же время, проведенные аппаратные исследования позволяют исключить развитие метастазов и поражение других органов и систем. Чаще всего для диагностики используют УЗИ, КТ, МРТ, рентгенологическое исследование органов грудной клетки.
На данном этапе лечение должно носить только комплексный характер, включая все возможные средства, предложенные современной медициной, хирургическое удаление опухоли, лучевую терапию, применение химиотерапевтических препаратов. В этой стадии допускается лечение плоскоклеточного рака гортани народными средствами. Основные требования, предъявляемые к таким методам лечения, заключаются в том, чтобы они применялись совместно с традиционным лечением, не заменяя его. Кроме того, средство, рекомендуемое альтернативной медициной, должно быть безопасным для пациента.
Четвертая стадия рака горла характеризуется дальнейшим распространением опухолевого процесса.
При этом атипичные клетки в процессе своей жизнедеятельности оказывают токсическое действие на весь организм, приводя к развитию раковой интоксикации. Наиболее типичными симптомами в данном случае являются
- резкая слабость;
- недомогание;
- исхудание;
- повышение температуры тела;
- боль в горле;
- болезненность при попытках произношения звуков;
- афония;
- сухой кашель;
- приступы удушья;
- кровохарканье;
- неприятный запах изо рта.
На этой стадии отмечается вовлечение в процесс различных органов и систем. При раке горла метастазы могут обнаруживаться в бронхах, легких, головном мозге, позвоночнике, реже – печени и почках, что также сказывается на клинической картине.
Лечебные мероприятия направлены исключительно на продление жизни пациента. Отдаленные прогнозы неблагоприятны. В этой стадии пациенты активно обращаются к средствам нетрадиционной медицины.
Зависимость течения заболевания от локализации опухоли
Течение рака горла и прогнозы во многом зависят от локализации процесса. Несмотря на возможность ранней диагностики, рак гортани надсвязочного отдела характеризуется злокачественным течением. Обусловлено это тем, что данная область оснащена широкой сетью лимфатических сосудов, способствующих распространению опухолевого процесса.
Локализация процесса в области голосовых связок характеризуется более выраженной симптоматикой, когда у пациента отмечается прогрессирующее нарушение голоса, что и вынуждает его обращаться к специалистам. Кроме того, в области голосовых связок лимфатическая и капиллярная сеть развита недостаточно, что и предотвращает быстрое распространение опухоли. Таким образом, опухоль связочного отдела гортани характеризуется медленным ростом, что создает предпосылки для более оптимистичных прогнозов.
Рак подсвязочного отдела гортани характеризуется поздней диагностикой, что обусловлено скудностью симптоматики, которая маскируется хроническим ларингитом, ларинготрахеитом. Кроме того, сухой кашель и некоторый дискомфорт в горле являются постоянными признаки курильщиков. В течение длительного времени такие пациенты не обращаются к специалистам, считая, что наличие симптоматики обусловлено вредной привычкой. При такой локализации процесса могут возникнуть сложности и с уточнением диагноза, так как визуальное обнаружение опухоли с помощью непрямой ларингоскопии может быть затруднено.
Поскольку ранняя диагностика заболевания играет существенную роль в дальнейших прогнозах, то для всех категорий пациентов при длительном наличии симптомов поражения горла рекомендовано обращаться на консультацию к отоларингологу.
Охриплость голоса, ощущение инородного тела в горле, сухой кашель свыше трех недель является поводом посетить лечебное учреждение и пройти ларингоскопию.
Пациенты с отягощенным анамнезом, имеющие вредные привычки, а также сотрудники вредных производств должны осуществлять плановое посещение ЛОР-врача дважды в год.
Читайте также:

