Что такое эпителиальный компонент
Обновлено: 01.05.2024
ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова»
ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова»
ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова»;
ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России
Классификация эпителиальных опухолей желудка ВОЗ 2019 г., 5-е издание
Журнал: Архив патологии. 2020;82(4): 58‑69
ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова»
Классификация эпителиальных новообразований желудка 2019 г. частично изменена по сравнению с изданием 2010 г.: выделены новые гистологические подтипы дисплазий (зубчатая дисплазия, дисплазия желудочных ямок/крипт), изменилась структура классификации доброкачественных новообразований (термин аденоматозный полип вновь вводится в обращение и представляет собой группу доброкачественных опухолей, ранее относимых к аденомам желудочного типа), раздел злокачественных эпителиальных опухолей расширен за счет карциномы из париетальных клеток, микропапиллярной и мукоэпидермоидной карцином, рака из клеток Панета. Факторы риска рака желудка разделены на две группы в зависимости от уровня доказательности их участия в канцерогенезе. Наиболее значимыми признаны: выявленная инфекция Helicobacter pylori, работа, связанная с производством резины, курение табака, рентгеновское и гамма-излучение. Изменены подходы к градации раков желудка по степени дифференцировки: подчеркивается предпочтительное использование двухступенчатой градации (low grade/ high grade). Нововведения также коснулись стадирования рака желудка. Раздел, посвященный нейроэндокринным опухолям, существенных изменений не претерпел. В целом новая классификация содержит более подробные данные по каждому из разделов, однако она не является интуитивно понятной. Пункты классификационной таблицы не соответствуют названиям разделов в тексте, что затрудняет понимание структуры и навигацию.
ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова»
ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова»
ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова»;
ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России
Дата принятия в печать:
В июле 2018 г. в Лионе состоялось заседание рабочей группы по опухолям пищеварительной системы под эгидой Международного агентства по изучению рака (International Agency for Research on Cancer, IARC). В результате классификация опухолей была пересмотрена и издана в 2019 г. в составе серии «WHO Classification of Tumors», 5-е издание [1]. Следует отметить, что разделы, посвященные отдельным локализациям, включают в себя только эпителиальные опухоли. Мезенхимальные опухоли и лимфомы представлены в виде отдельных глав. Другой особенностью новой классификации является наличие кодов классификации МКБ-11, которая официально вводится в России с 01.01.21, и отдельной главы, посвященной генетическим опухолевым синдромам желудочно-кишечного тракта. Разделы классификации 2019 г. (табл. 1) выглядят более структурированными, в каждый раздел добавлена чрезвычайно важная информация о необходимых и желательных диагностических критериях каждой конкретной опухоли, что упрощает работу с изданием для практического врача.
Таблица 1. Классификация эпителиальных опухолей желудка
Доброкачественные эпителиальные опухоли и предраковые поражения
Железистая интраэпителиальная неоплазия, low grade
Железистая интраэпителиальная неоплазия, high grade
Дисплазия зубчатая, low grade
Дисплазия зубчатая, high grade
Дисплазия кишечного типа
Дисплазия фовеолярного (желудочного) типа
Дисплазия желудочных ямок/крипт**
Аденома кишечного типа, low grade
Аденома кишечного типа, high grade
Аденома желудка кишечного типа, спорадическая
Аденома желудка кишечного типа, синдромная
Аденоматозный полип, low grade
Аденоматозный полип, high grade
Злокачественные эпителиальные опухоли
Карцинома из париетальных клеток
Папиллярная аденокарцинома NOS***
Микропапиллярная карцинома NOS***
Медуллярная карцинома с лимфоидной стромой
Карцинома клеток Панета
Плоскоклеточная карцинома NOS***
Крупноклеточная карцинома с рабдоидным фенотипом
Карцинома с остеокластоподобными гигантскими клетками
Нейроэндокринная опухоль NOS***
Нейроэндокринная опухоль, G1
Нейроэндокринная опухоль, G2
Нейроэндокринная опухоль, G3
Карциноид из энтерохромаффинных клеток
Злокачественный карциноид из ECL-клеток
Нейроэндокринная карцинома NOS***
Крупноклеточная нейроэндокринная карцинома
Мелкоклеточная нейроэндокринная карцинома
Смешанная нейроэндокринная и ненейроэндокринная опухоль (MiNEN)
Примечание. * — новые коды для МКБ-O; ** — см. пояснения в тексте статьи; *** — NOS — not otherwise specified (без дополнительных уточнений).
В 5-м издании классификации значительно увеличены разделы, касающиеся фоновых и предопухолевых поражений, а также доброкачественных эпителиальных опухолей желудка.
К фоновым состояниям относят:
— атрофию и кишечную метаплазию,
— полипы фундальных желез,
— гиперпластические полипы желудка.
Большое внимание уделяется гастриту, вызванному Helicobacter pylori, стадированию атрофических изменений по системе OLGA [2—4], а также различным видам кишечной метаплазии.
Предопухолевые изменения слизистой оболочки желудка (дисплазия /железистая интраэпителиальная неоплазия) определены как неопластические изменения эпителия слизистой оболочки без признаков стромальной инвазии. Наиболее часто дисплазия встречается в антруме, однако может наблюдаться в любых отделах желудка [5]. В 5-м издании, как и в 4-м, выделяется два основных вида дисплазии: кишечного и фовеолярного (желудочного) типа. При этом в 5-м издании выделяют также подтипы дисплазий желудка: зубчатую дисплазию высокой степени, зубчатую дисплазию низкой степени, дисплазию желудочных ямок/крипт. Однако, несмотря на то что эти подтипы вынесены в классификационную таблицу, в тексте обозначено, что их клиническое значение определено нечетко и приводятся крайне короткие описания. Таким образом, решение составителей классификации о внесении редких подтипов дисплазии с неясной клинической значимостью в основную классификационную таблицу остается труднообъяснимым.
Дисплазия/железистая интраэпителиальная неоплазия желудка может представлять собой плоский, втянутый или полиповидный участок поражения слизистой оболочки. Градация дисплазии желудка предусматривает выделение дисплазии низкой степени (low grade) и дисплазии высокой степени (high grade) [6, 7].
Дисплазия кишечного типа описывается как очаг, состоящий из тубулярных, тубулярно-ворсинчатых или ворсинчатых структур, выстланных высоким цилиндрическим эпителием с увеличенными, удлиненными, гиперхромными ядрами, расположенными в эпителиальном пласте в несколько рядов. Часто встречается терминальная дифференцировка в виде наличия бокаловидных или нейроэндокринных клеток, иногда клеток Панета. Выявляется экспрессия MUC2, CD10, CDX2 [8].
Дисплазия фовеолярного типа описывается как очаг из тубулярно-ворсинчатых и/или зубчатых железистых структур, выстланных кубическим или низким цилиндрическим эпителием, напоминающим фовеолярный эпителий. Ядра круглые или овальные, с четко различимыми ядрышками. Цитоплазма клеток бледно-эозинофильная. Выявляется положительное иммуногистохимическое окрашивание с маркерами MUC5AC, MUC6.
Дисплазия желудочных ямок/крипт. В оригинальном тексте классификации употреблен термин «ямки/крипты», в связи с чем обращаем внимание, что использование термина «крипты» для слизистой оболочки желудка не соответствует международной гистологической номенклатуре. Такой тип дисплазии наблюдается в базальных отделах желудочных ямок, где железистые структуры демонстрируют созревание до поверхностных эпителиальных клеток. В 49—72% случаев встречается по периферии традиционной неоплазии и считается независимым предиктором прогрессии в инвазивный рак [9], однако в тексте классификации не указано, чем она отличается от дисплазии фовеолярного типа.
Зубчатая дисплазия локализуется только в желудочных ямках, характеризуется наличием микропапиллярных структур, экспрессирующих MUC5AC. Подобные гистологические изменения в литературе иногда называют зубчатой аденомой желудка [10].
Классификация доброкачественных эпителиальных опухолей значительно изменена. Если ранее понятия «аденома кишечного типа» и «аденоматозный полип» являлись синонимами, то в новой редакции аденомы кишечного типа стоят особняком, а к аденоматозным полипам относят образования, ранее находившиеся в группе аденом желудочного типа (аденомы фовеолярного типа, аденомы из пилорических желез). К группе аденоматозных полипов в новой классификации также относят аденомы из кислотообразующих желез (oxyntic gland adenoma), не упоминавшиеся в предыдущей классификации. Полипы фундальных желез (fundic gland polyps) более не рассматриваются как истинные опухоли и не имеют кода МКБ-О. Итак, к доброкачественным эпителиальным опухолям относят аденомы кишечного типа и аденоматозные полипы (аденомы фовеолярного типа, аденомы из пилорических желез, аденомы из кислотообразующих желез (oxyntic gland adenoma). Причем каждая из этих категорий может сопровождаться дисплазией высокой или низкой степени. Аденомам кишечного типа соответствуют коды МКБ-О 8144/0 и 8144/2 в зависимости от степени дисплазии, а для всех разновидностей аденоматозных полипов предусмотрены единые коды 8210/0 и 8210/2.
Аденома кишечного типа является третьим по частоте встречаемости образованием среди полиповидных новообразований желудка (после гиперпластических полипов и полипов фундальных желез), локализуется преимущественно в тех отделах желудка, где распространена кишечная метаплазия (в 60% случаев поражаются дистальные отделы желудка) [11]. Пациенты обычно старше 60 лет. Аденомы кишечного типа часто сочетаются с атрофическим гастритом и выраженной кишечной метаплазией. Выделяют два подтипа аденом кишечного типа: спорадические и синдромные. Синдромные аденомы иногда являются одним из проявлений семейного аденоматозного полипоза. Размеры аденом не превышают 2 см. Гистологически аденомы кишечного типа представляют собой совокупность тубулярных структур, выстланных пролиферирующим эпителием с признаками дисплазии, которые формируют полиповидное образование. Аналогичная картина на плоской слизистой оболочке без формирования полиповидного образования обозначается как дисплазия (интраэпителиальная неоплазия). Большинство клеток имеют цилиндрическую форму, вытянутое вдоль длинной оси ядро, присутствуют бокаловидные клетки и клетки Панета. При наличии дисплазии высокой степени аденомы кишечного типа стадируются как Tis.
Аденома фовеолярного типа — доброкачественная опухоль из фовеолярного эпителия. Локализуются обычно в теле или дне желудка, развиваются без предшествующих фоновых процессов в виде гастрита или атрофии/метаплазии [12]. Спорадические опухоли крайне редки [13], обычно аденомы фовеолярного типа возникают при семейном аденоматозном полипозе и других наследственных синдромах. Гистологически опухоли состоят из сосочковых и тубулярных структур, покрытых цилиндрическим эпителием фовеолярного типа с удлиненными ядрами и признаками дисплазии (чаще всего низкой степени). Поверхностный эпителий содержит нейтральные (ШИК-позитивные) муцины, что отличает аденому фовеолярного типа от аденомы из пилорических желез. Отмечается выраженная диффузная экспрессия MUC5AC и локальная слабая экспрессия MUC6; реакции с MUC2 и CDX2 отрицательные. Однако ориентироваться при постановке диагноза необходимо в первую очередь на окраску гематоксилином и эозином и ШИК-реакцию, нежели чем на иммуногистохимию.
Аденома из пилорических желез — доброкачественная опухоль из эпителия пилорических желез, возникающая обычно в теле и дне желудка [14]. Большинство таких аденом выявляется у пациентов 60—70 лет и сочетается с атрофией/метаплазией слизистой оболочки дна и тела желудка, вызванной аутоиммунным или H. pylori-ассоциированным гастритом [14]. Размер от 0,3 до 10 см (средний — 2 см). Аденомы из пилорических желез представлены плотно лежащими железами пилорического типа, выстланными кубическим или низким цилиндрическим эпителием. Клетки со светлой или слегка эозинофильной цитоплазмой, ядра расположены базально, округлые или овоидные, со слабо различимыми ядрышками. Поверхностный эпителий не содержит нейтральные (ШИК-позитивные) муцины. В крупных опухолях железы могут быть кистозно-расширены. В 40—50% случаев в аденомах из пилорических желез встречаются дисплазия высокой степени и фокусы аденокарциномы, однако только в 10% случаев наблюдается инвазия в подслизистый слой [15]. Риск прогрессии в аденокарциному увеличивается с размером аденомы, при наличии тубуловорсинчатых структур. В связи с высоким риском прогрессии в рак желудка рекомендовано тотальное удаление образования.
Аденома из кислотообразующих желез (oxyntic gland adenoma) — доброкачественная опухоль из главных (зимогенных) и/или обкладочных (париетальных) клеток с высоким риском прогрессии в инвазивный рак. Локализуется в верхней трети желудка, точная частота встречаемости не установлена. Опухоль состоит из тубулярных структур, выстланных цилиндрическими клетками со светлой эозинофильной цитоплазмой, слабой ядерной атипией, похожих на клетки фундальных желез (преимущественно главные). Может находиться на поверхности, однако чаще встречается внутрислизистое расположение. Дифференцировку клеток можно подтвердить иммуногистохимически с помощью окраски на пепсиноген I (главные клетки) и Н+/К+ АТФазу (обкладочные клетки) [16]. Иногда в опухоли формируются солидные структуры и анастомозирующие тяжи, что может симулировать картину нейроэндокринной опухоли (NET) [17]. В таких случаях полезно определение экспрессии хромогранина А, в аденомах из кислотообразующих желез желудка данный маркер не выявляется.
Рак желудка занимает в мире 3-е место по уровню смертности [27], несмотря на снижение заболеваемости, ежегодно в мире выявляется около 1 млн новых случаев рака желудка [18, 19]. Наиболее высокий уровень заболеваемости отмечается в центральной и восточной Азии, восточной Европе и Южной Америке [18].
Рак желудка развивается под воздействием комбинации различных неблагоприятных факторов, в 90% случаев является спорадическим и только у 10% пациентов связан с наследственными/врожденными причинами. Факторы риска для развития рака желудка перечислены в табл. 2. В новом издании эти факторы разделены на две группы в зависимости от различного уровня доказательности. Следует отметить, что авторы придают большое значение инфекционным (H. pylori, вирус Эпштейна—Барр) и химическим агентам [20], а также особенностям диеты [19, 21—24], в то время как рефлюкс желчи больше не выносится как значимый фактор риска.
Таблица 2. Факторы риска возникновения рака желудка
Факторы, для которых имеются достаточные доказательства участия в канцерогенезе рака желудка у человека:
Что такое дисплазия шейки матки? Причины возникновения, диагностику и методы лечения разберем в статье доктора Игнатенко Татьяны Алексеевны, гинеколога со стажем в 14 лет.
Над статьей доктора Игнатенко Татьяны Алексеевны работали литературный редактор Елена Бережная , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
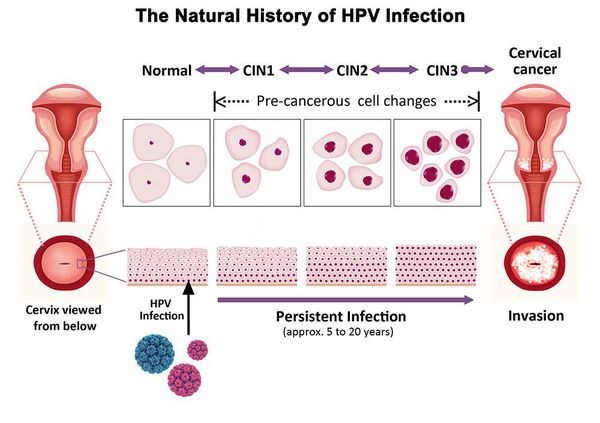
Дисплазия шейки матки, или цервикальная интраэпителиальная неоплазия (ЦИН), или Cervical Intraepithelial neoplasia (CIN) — это патологический процесс, при котором в толще клеток, покрывающих шейку матки, появляются клетки с различной степенью атипии (неправильного строения, размера, формы).
Причины дисплазии шейки матки
Папилломавирусная инфекция (ВПЧ) — основная причина дисплазии и рака шейки матки. К болезни приводит длительное персистирование именно ВПЧ высокого канцерогенного риска. У женщин с риском развития цервикальной неоплазии распространенность онкогенных типов ВПЧ чрезвычайно велика. ВПЧ становится причиной CIN 2-3 и рака шейки матки в 91,8% и 94,5% случаев соответственно. [1]
К факторам риска дисплазии шейки матки относится длительный приём контрацептивов и курение. Выявлена связь между пассивным курением среди некурящих и повышенным риском возникновения CIN 1. [3]
Другие факторы риска — раннее начало половой жизни, большое число и частая смена половых партнеров, употребление алкоголя, сопутствующие половые инфекции, много беременностей и родов. Риск цервикальной CIN 2 особенно высок у женщин, которые до этого имели опыт пересадки органов, у них выявлена ВИЧ-инфекция или они принимают иммунодепрессанты. [2]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы дисплазии шейки матки
Дисплазия шейки матки, как правило, имеет бессимптомное течение, поэтому пациентки не предъявляют никаких специфических жалоб.
Патогенез дисплазии шейки матки
Критический фактор развития цервикальной интраэпителиальной неоплазии — инфицирование вирусом папилломы человека. Во многих случаях цервикальная интраэпителиальная неоплазия легкой степени отражает временную реакцию организма на папиломавирусную инфекцию и без лечения исчезает в течение полугода-года наблюдения. При цервикальной интраэпителиальной неоплазии умеренной и тяжелой степени высока вероятность встраивания вируса папилломы человека в клеточный геном. Инфицированные клетки начинают продуцировать вирусные белки E6 и Е7, которые продлевают жизнь клетки, сохраняя ее способность к неограниченному делению. Неизбежно формирующиеся на этом фоне мутации клеток ведут к формированию предрака (дисплазии) и рака шейки матки, влагалища и вульвы.
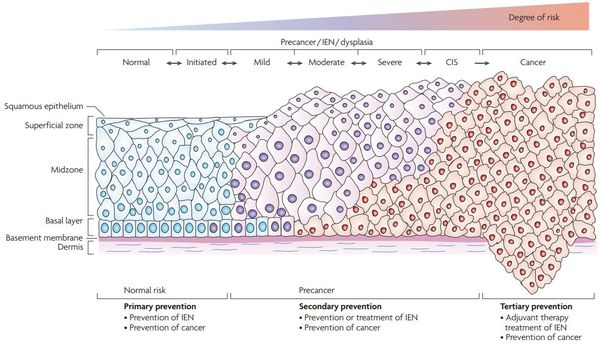
Онкогенные белки ВПЧ (Е6, Е7) взаимодействуют с регуляторными белками клеток шейки матки, приводя к повышению активности онкомаркера p16INK4A, что свидетельствует о неконтролируемом размножении клеток шейки матки. Таким образом, сверхэкспрессия p16INK4A, определяемая в материале шейки матки, который получают при биопсии, является биомаркером интеграции вируса папилломы человека высокого риска в геном и трансформации эпителиальных клеток под действием вируса, что делает эту информацию полезной при оценке прогноза развития предраковых и злокачественных поражений, связанных с инфицированием генитального тракта вирусом папилломы человека. [5]
Классификация и стадии развития дисплазии шейки матки
Для постановки цитологического диагноза (по результатам цитологического исследования соскобов шейки матки и цервикального канала с окрашиванием по Папаниколау (Рар-тест) или жидкостной цитологии) используется классификация Бетесда (The Bethesda System, 2014), основанная на термине SIL (Squamous Intraepithelial Lesion) – плоскоклеточное интраэпителиальное поражение. [10]
Выделяют три вида результатов соскобов с поверхности шейки матки (экзоцервикса):
- нормальные мазки, без изменений клеток шейки матки (NILM, Negative for intraepithelial lesion or malignancy);
- «непонятные» мазки без определенного значения, по которым нельзя определить характер поражения, однако они при этом не являются нормой (ASC-US, Atypical Squamous Cells of Undetermined Significance) или, что хуже, ASC-H, Atypical squamous cells cannot exclude HSIL, обнаружение атипичных клеток плоского эпителия, не исключающее SIL высокой степени);
- предраки низкой (LSIL, Low Grade Squamous Intraepithelial Lesion) и высокой (HSIL, High Grade Squamous Intraepithelial Lesion) степени.
Классификация Папаниколау
- 1-й класс — нормальная цитологическая картина (отрицательный результат);
- 2-й класс — изменение морфологии клеток, которое обусловлено воспалением во влагалище и (или) шейке матки;
- 3-й класс — единичные клетки с аномалией ядер и цитоплазмы (подозрение на злокачественное новообразование);
- 4-й класс — отдельные клетки с явными признаками озлокачествления;
- 5-й класс — много типично раковых клеток (злокачественное новообразование).
Существуют также гистологические классификации для оценки материала, полученного при биопсии.
По классификации R. M. Richart (1968) в зависимости от глубины поражения поверхностного клеточного слоя выделяют три степени дисплазии шейки матки:
- ЦИН 1 (дисплазия слабой степени) — признаки папилломавирусной инфекции (койлоцитоз и дискератоз). Поражение до 1/3 толщины клеточного пласта;
- ЦИН 2 (дисплазия средней степени) — поражена 1/2 толщины клеточного слоя;
- ЦИН 3 (дисплазия тяжелой степени) — поражение более 2/3 клеточного слоя. [8]
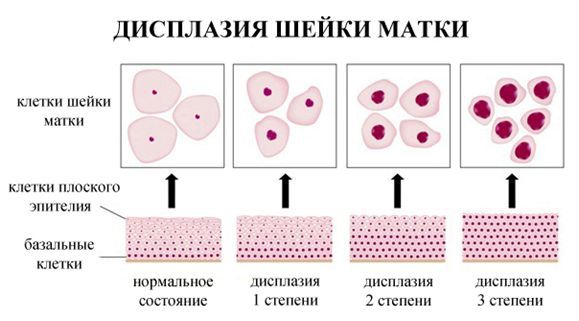
В приведенной ниже таблице даны соотношения классификаций предраковых поражений шейки матки. [9]
| Система Папаниколау | Описательная система ВОЗ | CIN | Терминологи- ческая система Бетесда (ТСБ) |
|---|---|---|---|
| Класс 1 (норма) | Отсутствие злокачественных клеток | Отсутствие неопластических изменений | Норма |
| Класс 2 (метаплазия эпителия, воспалительный тип) | Атипия, связанная с воспалением | Реактивные изменения клеток ASC: ASC - US, ASC - H | |
| Класс 3 ("дискариоз") | Слабая дисплазия | CIN 1 койлоцитоз | LSIL |
| Умеренная дисплазия | CIN 2 | HSIL | |
| Тяжелая дисплазия | CIN 3 | ||
| Класс 4 (клетки, подозрительные на рак или карцинома in situ | Карцинома in situ | ||
| Класс 5 (рак) | Инвазивная карцинома | Карцинома | Карцинома |
Осложнения дисплазии шейки матки
Последствия дисплазии шейки матки
Основное и самое опасное осложнение цервикальной интраэпителиальной неоплазии заключается в развитии рака шейки матки, любой случай развития которого — результат упущенных возможностей диагностики и лечения дисплазии шейки матки. [7]
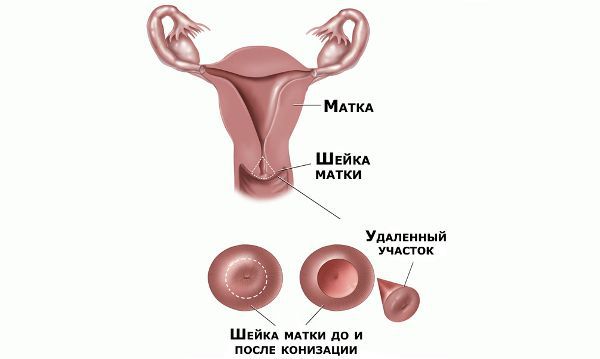
Проводились длительные, систематические исследования риска рака шейки матки у женщин с диагнозом цервикальной интраэпителиальной неоплазии 3 степени (CIN3) по сравнению с женщинами, у которых были нормальные цитологические результаты. Согласно полученным данным, долгосрочный относительный риск развития рака шейки матки зависит от различных гистологических типов CIN3 и выше всего он для аденокарциномы in situ. Даже через 25 и более лет после конизации (хирургического иссечения патологических тканей шейки матки) риск злокачественного перерождения клеток был значительным. [4]
Диагностика дисплазии шейки матки
Для ранней диагностики предраковых поражений шейки матки во многих странах мира существует система цервикального скрининга.
Методы диагностики дисплазии шейки матки
В России система цервикального скрининга включает последовательность действий:
- Цитологическое исследование: РАР-тест;
- ВПЧ-тестирование: в США и странах Евросоюза ВПЧ-тест применяется для первичного скрининга рака шейки матки (РШМ). В России его использование вариативно: при первичном скрининге в сочетании с РАР-тестом, в качестве самостоятельного теста, при ведении пациенток с неясными результатами РАР-теста (ASCUS) и для наблюдения паценток после лечения HSIL;
- Кольпоскопия: показаниями к исследованию являются положительные результаты РАР-теста (класс 2-5). Метод основан на осмотре шейки матки при помощи увеличивающих оптических систем и проведения диагностических проб с растворами уксусной кислоты и йода (Люголя). С помощью кольпоскопии определяют локализацию поражения, его размер, выбирают участок для проведения биопсии, определяют тактику лечения.
При кольпоскопии должна быть тщательно оценена зона трансформации (переходная зона стыка двух видов покровного эпителия шейки матки).
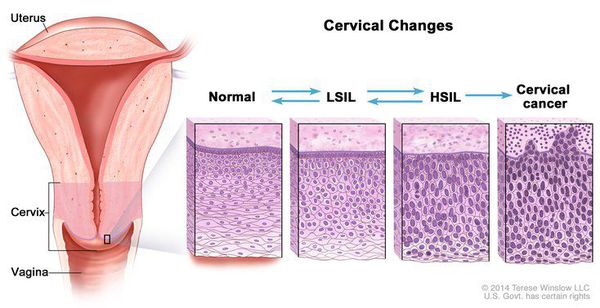
Влагалищная часть шейки матки (экзоцервикс) покрыта многослойным плоским эпителием. В канале шейки матки (цервикальном канале, эндоцервиксе) — цилиндрический эпителий. Место перехода цилиндрического эпителия цервикального канала в многослойный плоский эпителий поверхности шейки матки носит название зоны трансформации. Эта область имеет большое клиническое значение, поскольку именно в ней возникает более 80% случаев дисплазии и рака шейки матки.
- Зона трансформации 1 типа — переходная зона видна полностью. Это самый оптимальный и прогностически «благоприятный» вариант кольпоскопического заключения.
- Зона трансформации 2 типа — переходная зона частично скрыта в канале шейки матки. Адекватно оценить такую картину сложно, так как наиболее измененные участки могут быть не видны и пропущены.
- Зона трансформации 3 типа — переходная зона находится глубоко в канале шейки матки и оценить её кольпоскопически невозможно. Кольпоскопия в этом случае считается неинформативной, поскольку глубина залегания патологического очага остается неизвестной.
- Биопсия: прицельная или расширенная биопсия (конизация) всегда должна выполняться под контролем кольпоскопии. Выбор метода биопсии зависит от типа поражения, возраста пациентки и зоны трансформации. Важной информацией, которую дает биопсия, является возможность иммуногистохимического определения маркера ранней диагностики дисплазии с высокой степенью риска озлокачествления: p16INK4a.
Лечение дисплазии шейки матки
Динамическому наблюдению подлежат молодые пациентки (до 35 лет) с LSIL (ВПЧ, ЦИН 1, ЦИН 2, если при биопсии не обнаружен белок р16, являющийся признаком проникновения ВПЧ высокого риска в геном и трансформации опухолевых клеток под действием вируса). Наблюдать возможно пациенток только с 1 и 2 кольпоскопическим типом зоны трансформации.
Контрольные осмотры, цитологическое и ВПЧ-тестирование показаны через 6 и 12 месяцев после первичного обнаружения патологии.
Хирургическое лечение дисплазии
При выявлении HSIL (ЦИН 2 c обнаружением белка р16 при биопсии, ЦИН 3) неизбежно хирургическое лечение в виде абляции («прижигания») или эксцизии (удаления) поврежденной ткани. Для абляции используют электро-/радио-, крио- и лазерные воздействия. Эксцизия возможна электро-/радиоволновая или ножевая.
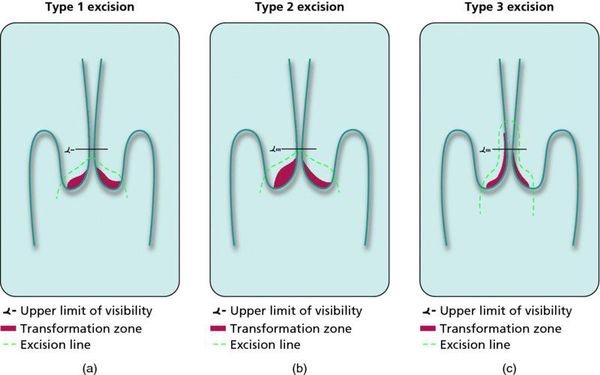
Немаловажно, что при выявлении по кольпоскопии 3 типа зоны трансформации на фоне положительного РАР-теста гинеколог обязан провести выскабливание слизистой канала шейки матки и/или широкую эксцизионную биопсию (конизацию шейки матки) для исключения опухолевого процесса, потенциально располагающегося вне зоны кольпоскопического обзора. Немаловажно наблюдение после операции через 6 и 12 месяцев с выполнением цитологического соскоба и ВПЧ-теста.
Следует отметить, что процедура хирургического иссечения патологических тканей на шейке матки увеличивает риск преждевременных родов. А сама по себе цервикальная интраэпителиальная неоплазия первой степени на течении беременности и родов никак не отражается и зачастую опасности не представляет. [12]
Средний возраст женщин, когда может потребоваться хирургическая коррекция цервикальной внутриэпителиальной неоплазии — около 30 лет. Хирургическое лечение нередко ассоциировано с неблагоприятным течением последующей беременности. Частота и тяжесть неблагоприятных осложнений возрастают с увеличением глубины иссекаемых тканей. [13]
Реабилитация после хирургического лечения
В течение месяца после операции следует воздержаться от спринцеваний, половых контактов и не пользоваться тампонами. На 2–3 недели исключают тяжёлые физические нагрузки и тепловые процедуры. Незначительные сукровичные выделения, усиливающиеся иногда до менструальноподобных, в течение 10–20 дней после операции — это нормальное явление.
При реабилитации после хирургического лечения шейки матки эффективны препараты, содержащие антисептик и стимулятор регенерации эпителия.
После лечения возможен рецидив, поэтому необходимо пожизненное наблюдение: цитологический мазок через 6 и 12 месяцев после операции, затем раз в год в течение 10 лет, далее раз в 3 года.
Планировать беременность после операции на шейке матки можно не ранее, чем через 3–6 месяцев. Эти сроки будут зависеть от глубины эксцизии или конизации и длины шейки матки [9] .
Лечение дисплазии при беременности
В большинстве случаев лечение должно быть отложено на послеродовый период. При беременности на фоне дисплазии шейки матки каждые три месяца проводится кольпоскопический и цитологический контроль. При выявлении рака шейки матки пациентку консультирует онкогинеколог. Доктор подбирает тактику лечения, может потребоваться прервать беременность по онкологическим показаниям [9] .
Прогноз. Профилактика
Дополнительными факторами риска прогрессирования ПВИ с формированием предраковой патологии являются:
- курение;
- длительное использование гормональных контрацептивов;
- многократные травматичные роды;
- ВИЧ-инфекция.
- У пациенток с ЦИН часто обнаруживают вирус простого герпеса 2 типа, цитомегаловирусную инфекцию, хламидийную урогенитальную инфекцию, бактериальный вагиноз, ассоциированный с резким снижением или отсутствием вагинальной лактофлоры, повышенным ростом во влагалище Gardnerella vaginalis и Atopobium vaginae, повышение концентрации в бакпосеве грибов рода Candida, Mycoplasma hominis.
Устранение и профилактика данных факторов способны снизить вероятность развития предраковой патологии шейки матки.
Рак шейки матки поражает преимущественно женщин репродуктивного возраста. Скрининг является важной стратегией вторичной профилактики. Длительный процесс канцерогенной трансформации от появления в организме вируса папилломы человека (ВПЧ) до инвазивного рака дает широкие возможности для выявления заболевания на стадии, когда лечение высокоэффективно. Подходящими скрининговыми тестами в мире признаны цитологическое исследование, визуальный осмотр после применения уксусной кислоты и тесты на выявление ВПЧ. Всемирная организация здравоохранения рекомендует проводить скрининг женщин по крайней мере один раз в жизни в возрасте от 30 до 49 лет. [14]
Согласно приказу Министерства здравоохранения РФ от 03.02.2015. N36ан "Об утверждении порядка проведения диспансеризации определенных групп взрослого населения", осмотр со взятием мазка (соскоба) с поверхности шейки матки и цервикального канала на цитологическое исследование производится 1 раза в 3 года для женщин в возрасте от 21 года до 69 лет включительно.
Вторичные опухоли тонкой кишки. Эпителиальные опухоли толстой кишки.
В червеобразном отростке можно часто встретить метастазы опухолей органов брюшной полости. В случае обсеменения брюшины метастатические узелки располагаются на серозной оболочке, при лимфогенном или гематогенном метастазировании скопления опухолевых элементов чаще обнаруживают неравномерно по периметру отростка, концентрируясь обычно у его ворот. Нередко группы опухолевых клеток обнаруживают в лимфатических щелях и сосудах стенки.
Чаще всего в слизистой оболочке отростка встречают гиперпластические полипы, аналогичные гипернластическим полипам толстой кишки. Гамартомные полипы (ювенильные, Пейтца Егерса) встречают редко. Несколько чаще они обнаруживаются в отростке при диффузном полипозе толстой кишки.
Эндометриоз. В стенке отростков, удаленных у женщин пубертатного возраста, могут встречаться очаги эндомегриоза обычно в субсерозном слое в виде нечетко отграниченных сине-багровых пятен или бляшек. Возможно сочетание с эндометриозом других органов. Гистологическая картина обычно типична для эндомегриоза. Однако в случаях со скудной стромой и полиморфизмом эпителия желез обнаруженные изменения можно принять за метастаз железистого рака, который чаще располагается в наружных слоях отростка.
Эпителиальные опухоли толстой кишки.
Доброкачественные эпителиальные опухоли толстой кишки до недавнего времени имели множество обозначений: полип, кишечный полип, слизистый полип, ворсинчатый полип, папиллома, ворсинчатая опухоль, железистый полип. Такие термины, как полип или ворсинчатая опухоль, отражают лишь макроскопические особенности опухоли и не несут в себе гистологическое содержание. Гистологическое строение эпителиальной опухоли точнее отражает термин «аденома». Выделяют 3 тина аденом: тубулярную, ворсинчатую и тубулярно-ворсинчатую.
Дифференциальная диагностика различного вида аденом строится на соотношении железистых и ворсинчатых структур.
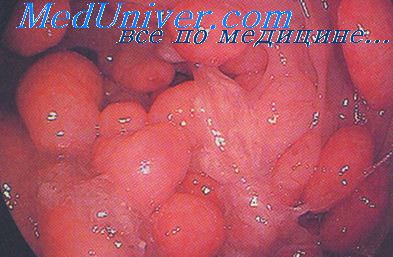
Тубулярная аденома (железистый полип) — наиболее распространенная доброкачественная опухоль толстой кишки, составляет около 60% всех удаленных аденом. Тубуляриые аденомы имеют ножку или широкое основание, поверхность их гладкая или крупнодольчатая. При микроскопическом исследовании состоят из большого числа округлых или извитых желез, довольно тесно примыкающих друг к другу, и слабо развитой стромы с большим количеством тонкостенных сосудов. В строме обычно отмечают лимфоидную инфильтрацию разной степени выраженности. Дисплазия эпителия тубулярных аденом, как правило, умеренная. Наблюдают определенную зависимость между увеличением размеров аденомы и степенью дисплазии.
Малигнизацию выявляют редко (0,2—2%), особенно низок этот процент в группе аденом диаметром менее 0,5 см.
Ворсинчатые аденомы в отличие от тубулярных имеют большие размеры, превышающие в подавляющем большинстве случаев 1 см. Наряду с полиповидными формами на ножках или на широком основании наблюдают своеобразные стелющиеся («ковровые») ворсинчатые аденомы, занимающие изредка десятки квадратных сантиметров поверхности слизистой оболочки толстой кишки. Обильное выделение слизи (до 1 литра и более), описывавшееся как типичный клинический симптом у больных ворсинчатыми аденомами, всгречается редко даже при крупных опухолях. Микроскопически выявляют многочисленные тонкие ворсинки с заостренными кончиками, прослеживающиеся от верхушек до основания, которое располагается вблизи мышечной мембраны слизистой оболочки. На косых срезах ворсинки выглядят как островки рыхлой соединительной ткани, окруженные эпителием, чего никогда не наблюдают на таких же срезах, проходящих через железистые структуры.
В ворсинчатых аденомах степень дисплазии эпителия выражена обычно значительнее, чем при других формах аденом, так же как и частота малигнизации, составляющая от 24 до 60%. Наряду с этим встречаются ворсинчатые аденомы с высокодифференцированным эпителием, содержащим большое количество бокаловидных клеток.
Второе место по распространенности после тубулярных аденом занимают тубулярво-ворсинчатые аденомы. Поверхность их дольчатая, местами ворсинчатая, они часто располагаются на широком основании. Изредка эти аденомы могут стелиться по поверхности кишки без формирования полипа, что придает им сходство с «ковровыми» ворсинчатыми аденомами. При микроскопическом исследовании железы, составляющие большую часть аденомы, извитые неправильной формы, с наличием сосочков, выступающих над поверхностью полипа и в просвет желез. Встречают кистозно расширенные железы с прорывом скопившейся в них слизи в строму и развитием в этой зоне воспалительной реакции. В редкие случаях обнаруживают плоскоклеточную метаплазию эпителия.
Малигнизация в группе тубулярно-ворсинчатых аденом составляет около 10%. Учитывая, что существует прямая зависимость между нарастанием степени дисплазии эпителия аденом и их малигнизацией, при описании аденом следует отмечать и выраженность дисшшзии. При слабой сгепени дисплазии железы имеют правильную округлую форму, их эпителий располагается в один ряд. Ядра эпителиальных клеток незначительно увеличены, фигуры митоза встречаются редко. В железах много бокаловидных клеток. При значительной (тяжелой) дисплазии наблюдают выраженную структурную и клеточную атинии. Железы имеют неправильную форму с развитием на отдельных участках криброзных структур. Эпителий желез становится псевдомногорядным, что обусловлено увеличением размеров ядер и смещением их (в части клеток в апикальном направлении). Ядра гиперхромные, число фигур митоза может увеличиваться. Бокаловидные клетки встречаются редко или полностью отсутствуют. Из-за плотного примыкания желез друг к другу строма определяется в виде тонких прослоек.
При умеренной дисплазии изменения соответствуют промежуточному положению между описанными группами.
Наиболее важным для патологоанатома вопросом является определение границы между значительной дисплазией и началом рака. По мнению отдельных исследователей, эта стадия должна квалифицироваться как рак in situ. Однако для органов желудочно-кишечного тракта, по утверждению некоторых ведущих специалистов, нет обоснованных критериев, которые позволяли бы отличать рак in situ от значительной дисплазии эпителия аденом, и такие изменения предлагают объединить в одну группу со значительной дисплазией эпителия или выделить их в группу резко выраженной дисплазии. Эти предложения аргументируют еще и тем, что пока опухоль ограничена пределами слизистой оболочки, лимфогенные метастазы практически не возникают.
Рак развивающийся из аденом, но классификации ВОЗ диагностируют в тех случаях, когда обнаруживают прорастание раковых комплексов в мышечную мембрану слизистой оболочки или подслизистую основу. Однако следует иметь в виду, что изредка сходные изменения могут быть обусловлены псевдокарциноматознои инвазией, вызванной травматическим перемещением эпителия в подслизистую основу, например при перекруте ножки полипа. В этих случаях железы, проникающие под эпителий, могут иметь неправильную форму, заполняться слизью, однако выстилающий их эпителий не имеет признаков выраженной дисплазии, а в окружающей ткани часто определяют следы старых или свежих кровоизлияний.
Среди тубулярных и тубулярно-ворсинчатых аденом изредка встречаются опухоли, железы которых выстланы не «темными» дисплазированными всасывающими клетками, характерными для обычных аденом, а секретирующими бокаловидными клетками. Количество и размеры их значительно увеличены, многие клетки имеют сходство с перстневидными, что придает этим аденомам своеобразный «светлоклеточный» характер.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Цитология (гистология) биопсии слюнной железы при опухоли
Около 60% всех новообразований слюнных желез представлены плеоморфными аденомами, из которых 80% возникают в околоушной слюнной железе. Миоэпителиомы составляют примерно 1,5% всех новообразований слюнных желез, которые состоят из пролиферирующих миоэпителиальных клеток, демонстрирующих веретнообразные, эпителиоидные или плазмоцитоидные характеристики.
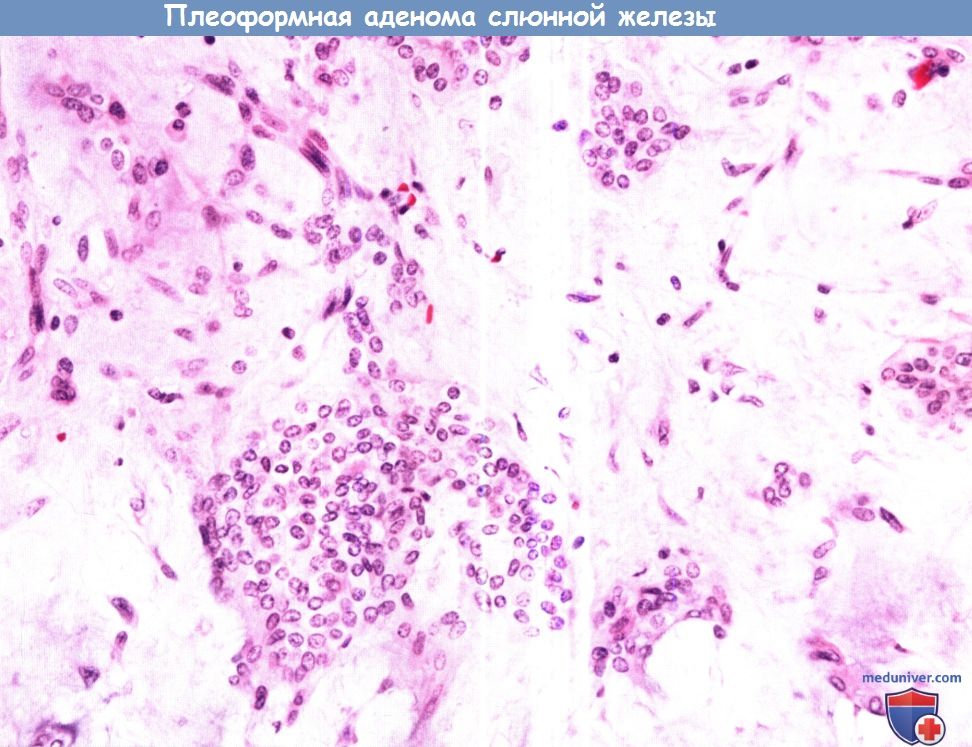
Плеоморфная аденома.
При микроскопии определяется пролиферация цитологически нормальных миоэпителиальных клеток, формирующих скопления неправильной формы в миксоидной мезенхимальной строме.
Для мезенхимального компонента характерны миксоидные и фиброзные изменения, иногда встречаются признаки хрящевой или костной метаплазии.
В течение пяти лет рецидивируют 3,4% опухолей, в течение 10 лет — 6,8%.
Часто рецидивирующие плеоморфные аденомы отличает многоочаговое строение.
Плеоморфные аденомы составляют около 60% всех опухолей слюнных желез. Из них 80% возникают в околоушной слюнной железе, 10% в поднижнечелюстной и 10% в малых слюнных железах.
Базальноклеточные аденомы представляют собой редкие доброкачественные заболевания слюнных желез, которые представлены пролиферирующими эпителиальными и миоэпителиальными клетками, отличающимся базалоидным видом и трабекулярным ростом. По составу они сходны с плеоморфными аденомами, но лишены мезенхимального компонента. После полного удаления рецидивируют редко.
Опухоль Уортина (сосочковая кистаденолимфома) составляет примерно 3,5% всех эпителиальных опухолей слюнных желез. Встречается практически исключительно в околоушной слюнной железе. Может иметь дольчатое строение, иногда двусторонняя.
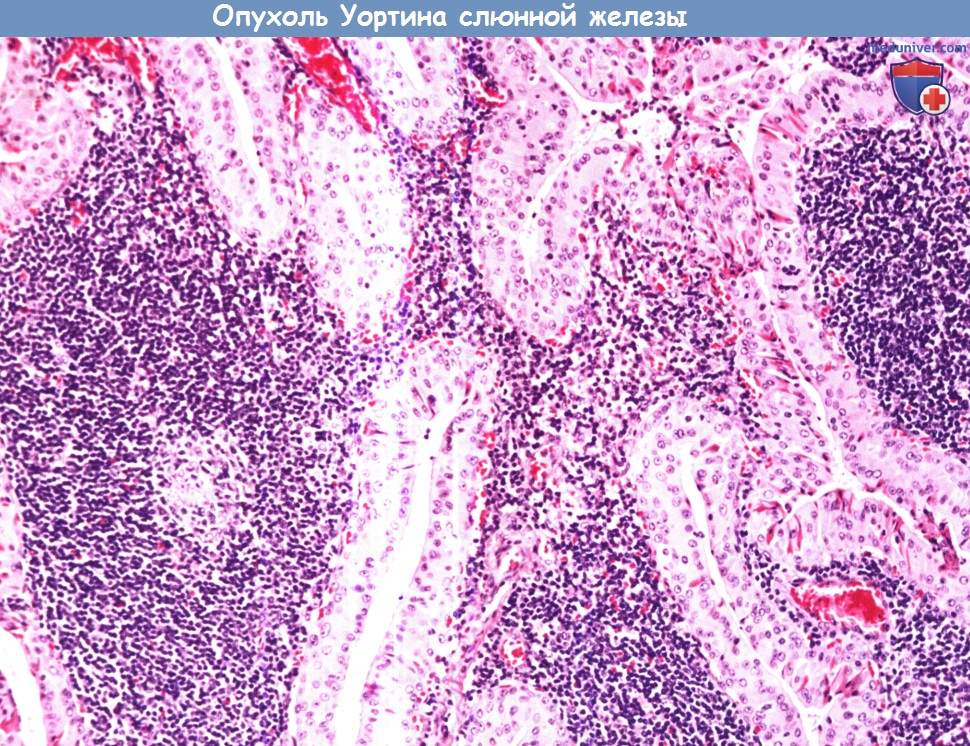
Опухоль Уортина (сосочковая кистаденолимфома) составляет примерно 3,5% всех эпителиальных опухолей слюнных желез.
Встречается практически исключительно в околоушной слюнной железе. Может иметь дольчатое строение, иногда двусторонняя.
При микроскопии опухоль имеет кистозно-сосочковое строение. Эпителиальные клетки с онкоцитарной метаплазией (большое количество цитоплазматических митохондрий,
розовая цитоплазма с частыми включениями) располагаются в два ряда, формируя сосочковые структуры, которые перемежаются с участками лимфоидной гиперплазии.
После удаления рецидивирует редко.
Онкоцитарная аденома (онкоцитома) представляет собой редкую доброкачественную опухоль слюнных желез, состоящую из онкоцитарных эпителиальных клеток, растущих в виде гнезд или трабекул. Канальцевая аденома чаще всего возникает на верхней губе, состоит из рядов плоских цилиндрических клеток, формирующих канальцы. Аденома сальных желез является доброкачественным образованием, образующимся в результате пролиферации сальных желез, в некоторых из них имеются включения лимфоидной ткани (сальные лимфоаденомы). Протоковые папилломы и цистаденомы встречаются редко.
Ацинозно-клеточный рак характеризуется пролиферацией ацинарных элементов, которые перемежаются с промежуточными мелкими клетками, вакуолями и прозрачными клетками. При мукоэпидермиодном раке обнаруживаются клетки злокачественного эпителия, в котором муцинозные клетки перемежаются с участками эпидермоидной дифференциации. Аденокистозная карцинома составляет примерно 10% от всех случаев злокачественных новообразований слюнных желез, имеет решетчатое строение, промежутки между клетками заполнены мукополисахаридами.
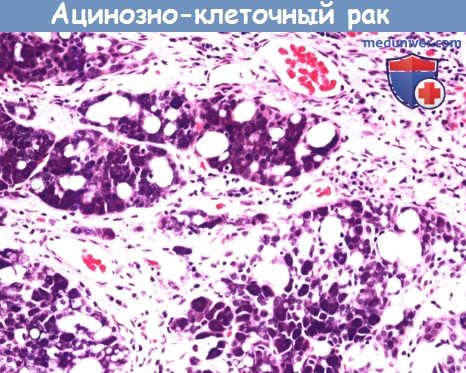
Ацинозно-клеточный рак чаще всего поражает околоушную слюнную железу.
Он характеризуется частичной ацинозной дифференцировкой (цитоплазма с секретирующими зимоген гранулами вкраплениями)
мелких и вакуолизированных мелких и прозрачных клеток.
Полиморфная аденокарцинома низкой степени злокачественности чаще всего возникает на небе, характеризуется цитологической однородностью, гистологическим разнообразием и инфильтративным ростом. Эпителиально-миоэпителиальная карцинома, редкая злокачественная опухоль, имеет двуслойную структуру, в которой внутренний слой представлен кубическим эпителием, а наружный — миоэпителиальными клетками с прозрачной цитоплазмой.
Из внутриротовых малых слюнных желез может возникать редкая злокачественан опухоль — светлоклеточная карцинома (гиалинизирующая светлоклеточная карцинома). Она представлена скоплениями однородных прозрачных клеток с высоким содержанием гликогена. Базальноклеточная аденокарцинома характеризуется пролиферацией миоэпителиальных клеток с частыми периодическими участками протоковой дифференциации. Карцинома в плеоморфной аденоме представляет собой смешанную злокачественную опухоль, в которой эпителиальный компонент подвергся злокачественной трансформации.
К редким злокачественным опухолям относятся сальная карцинома и сальная лимфоаденокарцинома. К другим возможным злокачественным новообразованиям также относится цистаденокарцинома, слизистая аденокарцинома, онкоцитарная карцинома, карцинома слюнного протока, неуточненная аденокарцинома, карциносаркома, плоскоклеточный рак, мелкоклеточный рак, крупноклеточный рак, лимфоэпителиальный рак.
Наиболее часто встречающимся злокачественным новообразованием слюнных желез является мукоэпидермоидный рак.
При нем обнаруживаются клетки злокачественного эпителия, в котором муцинозные клетки перемежаются с участками эпидермоидной дифференциации
(крупные незрелые клетки с сохраненными межклеточными мостиками, не продуцирующие кератин). Аденокистозный рак составляет примерно 10% от всех случаев злокачественных новообразований слюнных желез,
имеет решетчатое строение, промежутки между клетками заполнены мукополисахаридами.
При микроскопии определяются однородные пролиферирующие миоэпителиальные клетки со скудной цитоплазмой и интенсивно окрашенными ядрами неправильной формы.
Исход заболевания коррелирует с гистологической степенью злокачественности опухоли. Базальноклеточная аденокарцинома представляет собой злокачественный вариант базальноклеточной аденомы.
Она характеризуется пролиферацией миоэпителиальных клеток с частыми периодическими участками протоковой дифференциации (двухслойная эпителиальная и миоэпителиальная выстилка). Карцинома в плеоморфной аденоме представляет собой смешанную злокачественную опухоль, в которой эпителиальный компонент подвергся злокачественной трансформации.
Злокачественный эпителий может присутствовать лишь на определенных участках, иногда его локализация ограничена капсулой доброкачественной опухоли, из которой тот происходит.
Обратите внимание на крупные недифференцированные злокачественные клетки (в левой части изображения), которые проникают в ткань плеоморфной аденомы (в правой части изображения).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Эпидемиология и типы злокачественных опухолей слюнной железы
Злокачественные новообразования слюнных желез составляют лишь 6% от всех опухолей головы и шеи. Заболеваемость в США составляет 11,65 на 1 миллион человек в год. Существует около 20 разных гистологических типов опухолей, способных поражать слюнные железы (не считая метастатических поражений).
Жалобы большинства пациентов абсолютно такие же, как при доброкачественных опухолях что и создает проблемы при лечении. Эта глава сфокусирована на наиболее распространенных формах рака и на алгоритмах лечения, на сегодняшний день считающихся общепринятыми.
а) Эпидемиология рака слюнной железы. Ежегодно примерно в одном случае на 100000 населения может появиться злокачественная опухоль слюнных желез. Их распространенность зависит от возраста, пола, локализации опухоли. Наибольшая часть злокачественных новообразований слюнных желез возникает в околоушной слюнной железе (составляя порядка 25% всех ее опухолей).
Наиболее частой гистологической формой рака слюнных желез является мукоэпидермоидный рак (29-43% всех злокачественных новообразований слюнных желез). В 70% случаев мукоэпидермоидный рак поражает околоушную слюнную железу. Второй и третьей по частоте встречаемости формами являются железисто-кистозный рак (20%) и железистый рак (14%). В малых слюнных железах и в поднижнечелюстной слюнной железе наиболее часто встречается железисто-кистозный рак.
Злокачественные новообразования слюнных желез встречаются значительно чаще (3-5 раз) у пациентов старше 50 лет. Мужчины и женщины заболевают одинаково часто. Среди общих типов опухолей плоскоклеточный рак чаще встречается в пожилом возрасте и у мужчин. Железисто-кистозный рак и ацинозный рак чаще встречаются у женщин и у более молодых пациентов.
К факторам риска относят табакокурение, употребление алкоголя, воздействие ионизирующего излучения, а также некоторые производственные факторы и факторы окружающей среды. Детальное рассмотрение этиологических факторов рака слюнных желез выходит за рамки этой главы.

б) Терминология. Злокачественные опухоли слюнных желез классифицируются согласно их гистологическому строению. Список наиболее часто встречающихся форм и частота их встречаемости приведены в таблице ниже. Полное описание всех гистологических вариантов выходит за рамки данной статьи. Как уже упоминалось в статьях на сайте, согласно двухклеточной теории происхождения опухолей слюнных желез, опухоли, происходящие из вставочных протоковых клеток (железистый рак, железисто-кистозный рак) обычно характеризуются менее агрессивным ростом, чем происходящие из экскреторных протоковых клеток (плоскоклеточный рак, мукоэпидермоидный рак).
1. Мукоэпидермоидный рак. Мукоэпидермоидный рак чаще всего поражает околоушную слюнную железу, составляя около 8% всех ее опухолей. Мукоэпидермоидный рак малых слюнных желез обычно возникает на слизистой щек или неба. Мукоэпидермоидная опухоль состоит из клеток двух типов: мукоцитов и клеток плоского эпителия. В зависимости от клеточного состава, они могут иметь высокую, среднюю и низкую степень злокачественности.
Высокодифференцированные опухоли содержат больше мукоцитов, в то время как для низкодифференцированных образований характерно большое количество плоских клеток. В последнем случае мукоэпидермоидный рак бывает сложно отличить от плоскоклеточного рака, что возможно лишь с применением специальных методик окрашивания, позволяющих выявить небольшое количество мукоцитов.
При макроскопическом исследовании опухоли низкой степени злокачественности обычно имеют небольшой размер, окружены капсулой, имеют кистозный компонент. Опухоли высокой степени злокачественности достигают больших размеров, для них характерен инфильтративный рост, отсутствие четкой капсулы и наличие метастазов в регионарные лимфоузлы. Признаками высокой степени злокачественности при микроскопическом исследовании являются: наличие четырех и более митозов в поле зрения, периневральная инвазия, некроз, малое число кистозных включений, клеточная анаплазия.
Несколько исследований подтвердили прогностическую значимость степени злокачественности опухоли. Пятилетняя выживаемость для трех степеней злокачественности составила 95%, 72% и 0%, соответственно. После 10 лет наблюдения большинство (80-90%) пациентов с раком низкой степени злокачественности не имели рецидивов, в то время как значительно большая часть случаев с низкодифференцированной опухолью закончилась либо смертью, либо местными или регионарными рецидивами.
Соответственно, от гистологического строения опухоли может зависеть режим адъювантной терапии. Несмотря на благоприятный прогноз, даже у пациентов с опухолями низкой степени злокачественности метастазы могут развиваться через 15 и более лет после первичного лечения, поэтому вне зависимости от степени злокачественности обязательно длительное наблюдение.
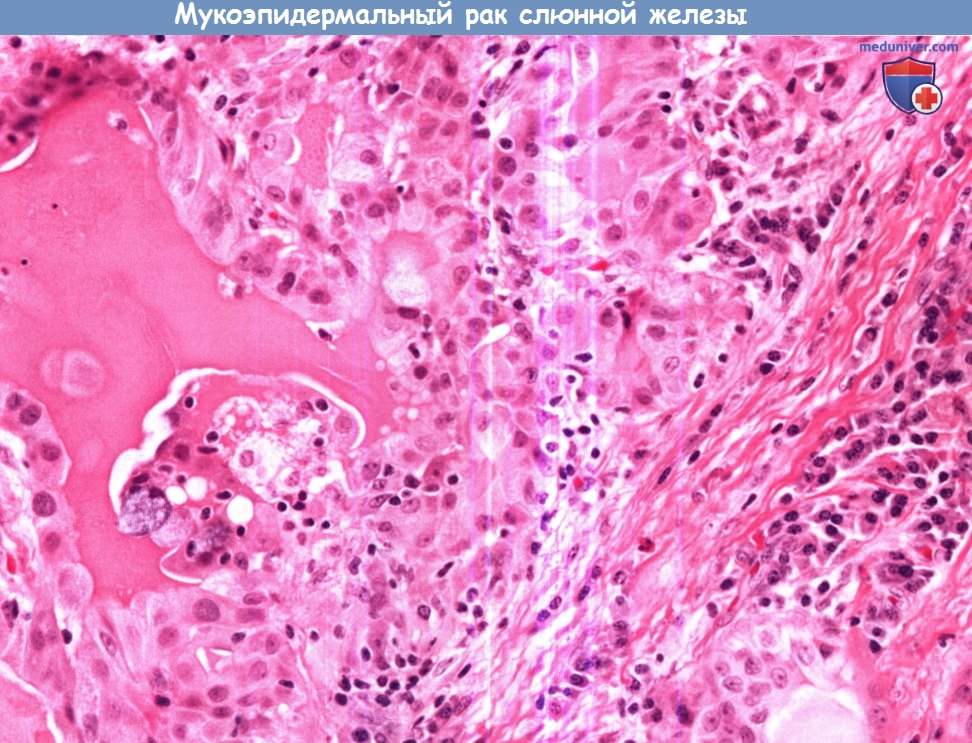
Наиболее часто встречающимся злокачественным новообразованием слюнных желез является мукоэпидермоидный рак.
При нем обнаруживаются клетки злокачественного эпителия, в котором муцинозные клетки перемежаются с участками эпидермоидной дифференциации
(крупные незрелые клетки с сохраненными межклеточными мостиками, не продуцирующие кератин).
2. Аденокистозный рак. Аденокистозный рак является вторым по частоте встречаемости злокачественным заболеванием слюнных желез, и первым по частоте поражения поднижнечелюстных и малых слюнных желез. Наиболее часто он возникает в полости рта, особенно в области неба. Как правило, капсулы опухоль не имеет и свободно прорастает в окружающие ткани. Существует три гистологических формы аденокистозного рака: солидная, сетчатая и трубчатая.
При солидных опухолях злокачественные эпителиальные клетки располагаются плотными пластами, количество кистозных участков между ними невелико. При трубчатой форме клетки формируют небольшие протоки и трубочки. При сетчатом типе между злокачественными клетками располагаются кистозные пространства, заполненные слизью с большим содержанием базофилов. Иногда в пределах одной опухоли могут обнаруживаться сразу все три типа клеточной конфигурации, но обычно преобладает какая-то одна форма. При солидной форме прогноз обычно наименее благоприятный, при трубчатой, напротив, наиболее велика вероятность благоприятного исхода.
Аденокистозный рак характеризуется медленным ростом, периневральной инвазией и отдаленным метастазированием. Опухоль крайне сложно удалить. Рецидивы могут возникать как на месте первичного роста опухоли, так и отдаленно (чаще всего в легких) спустя 10-20 лет после лечения. Поскольку рост опухоли достаточно медленный, пятилетняя выживаемость составляет 65%. Иногда пациенты могут прожить еще много лет уже после подтверждения рецидива заболевания.
Тем не менее, 15-летняя выживаемость составляет 12%. Метастазы в регионарные лимфоузлы возникают редко (12%), поэтому в большинстве случаев воздействовать на шейные лимфоузлы не требуется. Лечение хирургическое. Послеоперационная лучевая терапия несколько улучшает прогноз.
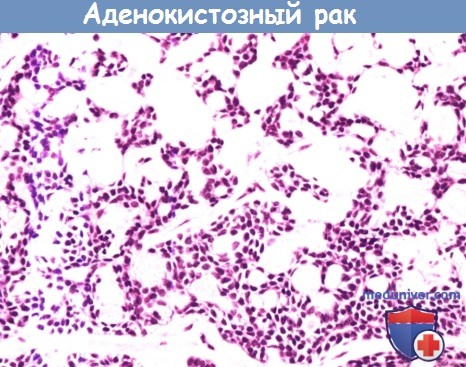
Аденокистозный рак составляет примерно 10% от всех случаев злокачественных новообразований слюнных желез,
имеет решетчатое строение, промежутки между клетками заполнены мукополисахаридами.
При микроскопии определяются однородные пролиферирующие миоэпителиальные клетки со скудной цитоплазмой и интенсивно окрашенными ядрами неправильной формы.
Исход заболевания коррелирует с гистологической степенью злокачественности опухоли.
3. Ацинозноклеточный рак. Ацинозноклеточный рак представляет собой редкую форму рака слюнных желез, которая составляет лишь около 6-8% всех их новообразований. Опухоль происходит из серозных клеток, поэтому наиболее часто ацинозноклеточный рак поражает околоушную слюнную железу. Ацинозноклеточный рак представляет собой инкапсулированную, твердую опухоль бело-серого цвета, которая состоит из скоплений однородных округлых клеток с большим содержанием цитоплазмы. Свое второе название, светлоклеточный рак, опухоль получила из-за того, что в некоторых случаях цитоплазма клеток имеет прозрачный вид.
Как правило, ацинозноклеточный рак характеризуется благоприятным прогнозом. Недавние исследования показали, что существует несколько различных форм рака, каждая с различным прогнозом. Паралич или парез лицевого нерва, поражение глубокой доли железы и/или метастазирование в несколько шейных лимфатических узлов являются признаками неблагоприятного прогноза. 5-, 10- и 15-летняя выживаемость составляет 83%, 76% и 65% соответственно. Лечение заключается в резекции. При наличии метастазов в шейные лимфоузлы выполняется шейная лимфодиссекция.

Ацинозно-клеточный рак чаще всего поражает околоушную слюнную железу.
Он характеризуется частичной ацинозной дифференцировкой (цитоплазма с секретирующими зимоген гранулами вкраплениями)
мелких и вакуолизированных мелких и прозрачных клеток.
4. Злокачественные смешанные опухоли. Термином «злокачественная смешанная опухоль» обозначаются сразу три различных заболевания: рак в плеоморфной аденоме, карциносаркома и метастазирующая смешанная опухоль. Эти новообразования составляют около 5-12% всех опухолей слюнных желез, каждая из них имеет свои характерные особенности. Как уже упоминалось в предыдущей главе, плеоморфная аденома имеет риск малигнизации 1-1,5% в год. Опухоль плотная, не имеет капсулы, с участками некроза и кровоизлияний.
Пациенты сообщают, что они длительное время жили с опухолью, которая не увеличивалась в размерах, но недавно начала стремительно расти. Чаще всего поражается околоушная слюнная железа. При гистологическом исследовании в ткани плеоморфной аденомы обнаруживаются участки злокачественного эпителия. 5-, 10- и 15-летняя выживаемость составляет 40%, 29% и 19% соответственно. У большого числа пациентов возникают регионарные и отдаленные метастазы (особенно в легких и в костях). При поражении поднижнечелюстной или малых слюнных желез прогноз еще более неблагоприятный.
Карциносаркомы, или истинные смешанные опухоли, встречаются крайне редко. Прогноз неблагоприятный. Пятилетняя выживаемость составляет 50%, 10-летняя 30%. Наконец, метастазирующие смешанные опухоли (метастазирующая доброкачественная плеоморфная аденома) чаще всего возникают в околоушной железе. Удивительно то, что и первичный очаг, и метастазы (обычно в костях и легких) при микроскопическом исследовании не имеют признаков злокачественности. Иногда развиваются отдаленные метастазы, но от самого заболевания больные умирают редко.
При всех трех опухолях основным методом лечения является хирургический. При карциносаркоме и раке в плеоморфной аденоме также проводится послеоперационная лучевая терапия.
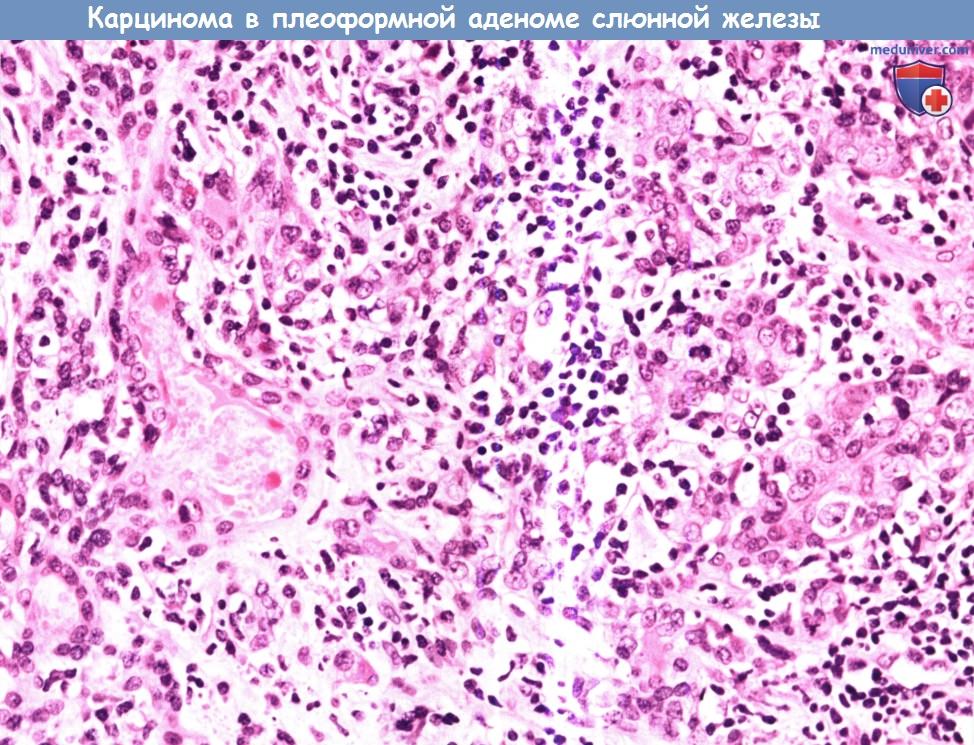
Карцинома в плеоморфной аденоме представляет собой смешанную злокачественную опухоль, в которой эпителиальный компонент подвергся злокачественной трансформации.
Злокачественный эпителий может присутствовать лишь на определенных участках, иногда его локализация ограничена капсулой доброкачественной опухоли, из которой тот происходит.
Обратите внимание на крупные недифференцированные злокачественные клетки (в левой части изображения), которые проникают в ткань плеоморфной аденомы (в правой части изображения).
5. Аденокарцинома. Ранее термином «аденокарцинома» обозначалась любая раковая опухоль, происходящая из протоковых клеток слюнных желез, считалось, что аденокарцинома составляет около 20% всех злокачественных новообразований слюнных желез. Но по мере развития представлений об онкологических заболеваниях слюнных желез стало ясно, что термином «аденокарцинома» обозначается три различных по строению опухоли, каждая из которых имеет свои характерные клинические особенности.
Образование, которые сейчас называют аденокарциномой (или «неуточненной аденокарциномой») составляет около 1-9% всех злокачественных опухолей слюнных желез. Эта опухоль, в 68% поражающая малые слюнные железы, имеет риск рецидива в 50%, метастазирует в шейные лимфоузлы в 17% случаев. Пятилетняя выживаемость около 40%. Внутри данной группы опухолей далее выделяют: аденокарциному, слизистую аденокарциному, трабекулярную аденокарциному и сальную аденокарциному.
Полиморфная аденокарцинома низкой степени злокачественности (дольковый рак) характеризуется клиническим течением, отличных от остальных злокачественных опухолей слюнных желез. 10-летняя выживаемость при этом варианте рака составляет более 90%. Чаще всего опухоль локализуется в полости рта, на небе или слизистой поверхности губ. Вероятность метастази-рования в шейные лимфоузлы не превышает 5%. После хирургического удаления рецидивирует редко. Адъювантная терапия и лимфодиссекция показаны редко, на исход они не влияют.
Противоположностью долькового рака является протоковый рак. Опухоль имеет крайне агрессивное течение, поражает преимущественно мужчин старше 70 лет. Чаще всего локализуется в околоушной слюнной железе, метастазы в шейные лимфоузлы встречаются в 50% случаев. Как и при протоковом раке молочных желез, при микроскопическом исследовании обнаруживают скопления опухолевых клеток и участки комедо-некроза. Возможно развитие и местных, и отдаленных рецидивов, поэтому пациентам с протоковым раком проводится полная паротидэктомия, шейная лимфодиссекция и химиотерапия.
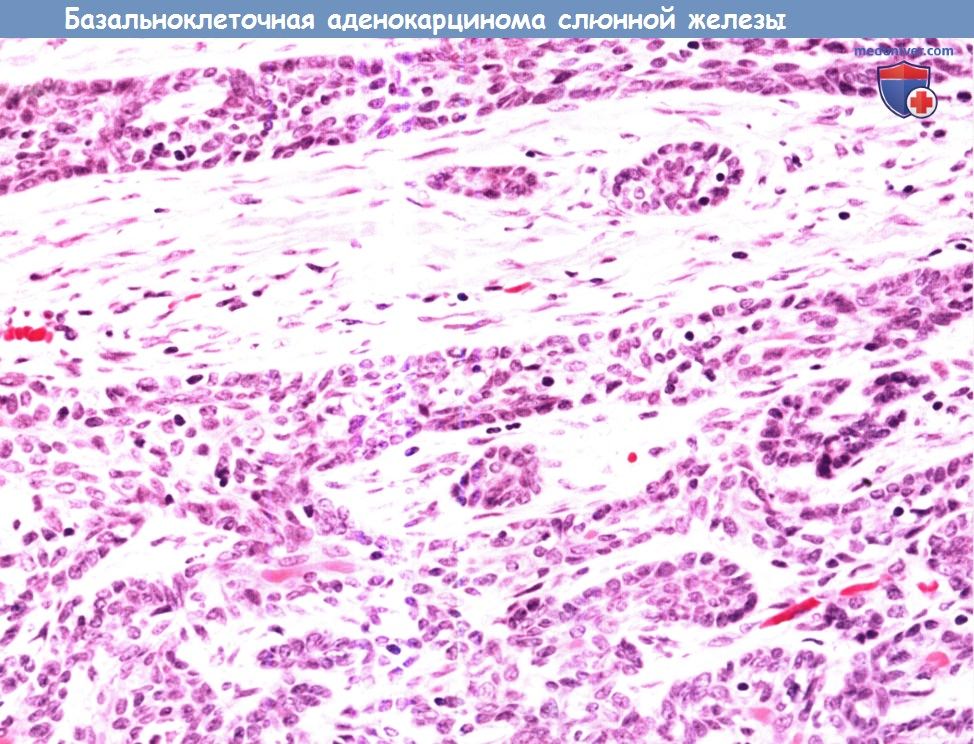
Базальноклеточная аденокарцинома представляет собой злокачественный вариант базальноклеточной аденомы.
Она характеризуется пролиферацией миоэпителиальных клеток с частыми периодическими участками протоковой дифференциации (двухслойная эпителиальная и миоэпителиальная выстилка).
6. Плоскоклеточный рак. Плоскоклеточный рак слюнных желез наиболее часто имеет метастатическое происхождение (из кожи, наружного слухового прохода, верхних отделов дыхательного и пищеварительного трактов). Также плоскоклеточный рак бывает сложно дифференцировать от мукоэпидермоидного рака высокой степени злокачественности. Поэтому истинный первичный плоскоклеточный рак слюнных желез встречается достаточно редко. Чаще всего он локализуется в околоушной слюнной железе.
Шейные метастазы встречаются у 46% пациентов, у 30% пациентов имеются скрытые метастазы. Из-за высокого риска местного и регионарного рецидива пятилетняя выживаемость составляет лишь 24%. Пациентам проводится хирургическое удаление опухоли, шейная лимфодиссекция, лучевая терапия.
7. Лимфома и метастатический рак. Развитие опухоли слюной железы не всегда связано с ней самой, а может происходить либо из местных лимфатических узлов, либо быть проявлением системного заболевания. Чаще всего лимфомы возникают в околоушной слюнной железе, у пациентов с синдромом Шегрена риск их развития возрастает в 40 раз. Основой лечения остается химио- и/или лучевая терапия. Исключение составляет MALT-лимфома, при которой возможно ее хирургическое удаление.
Также возможно метастатическое (гематогенное или лимфогенное) поражение околоушной и поднижнечелюстной желез. В околоушную слюнную железу метастазы чаще всего попадают лимфогенным путем от кожи лица и скальпа. В поднижнечелюстную железу обычно метастазирует рак полости рта и ротоглотки. Иногда в слюнные железы метастазирует рак почек, легких и предстательной железы.
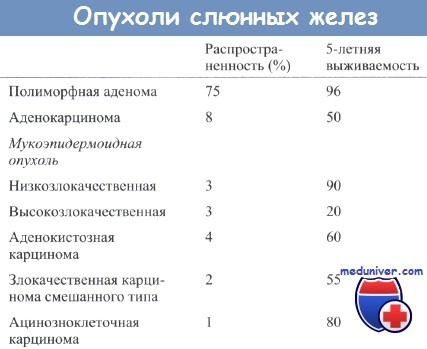
Гистологические характеристики опухолей слюнных желез и выживаемость больных
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

