Что такое десмосомы кожи
Обновлено: 27.04.2024
Это аутоантитела, направленные против белков базальной мембраны кожи. Они являются клинико-лабораторным маркером буллезного пемфигоида и используются для диагностики и контроля лечения этого заболевания.
Синонимы русские
Антитела к базальной мембране кожи.
Синонимы английские
Bullous pemphigoid, BP180 and BP230 antibodies.
Метод исследования
Непрямая реакция иммунофлюоресценции.
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Базальная мембрана – это комплекс белков и полисахаридов, располагающихся между эпителием (или эндотелием) и прилежащей рыхлой соединительной тканью. Повреждение базальной мембраны приводит к потере взаимодействия между ними, что клинически проявляется формированием пузыря. Существует несколько причин, приводящих к нарушению целостности базальной мембраны (наследственные заболевания, токсическое повреждение), однако наибольшее значение имеет аутоиммунное повреждение, обусловленное присутствием в крови аутоантител к белкам мембраны. Соответственно, появление этих антител – признак буллезного пемфигоида (аутоиммунное заболевание, сопровождающееся поражением кожи). Буллезный пемфигоид, истинная пузырчатка, герпетиформный дерматит Дюринга и наследственные буллезные дерматозы объединяются в группу пузырных дерматозов. В отличие от истинной пузырчатки, буллезный пемфигоид характеризуется относительно благоприятным прогнозом и не требует назначения иммуносупрессивных препаратов.
Один из основных методов дифференциальной диагностики пузырных дерматозов и диагностики буллезного пемфигоида – это определение антител к эпидермальной базальной мембране. Они относятся к иммуноглобулинам класса IgG и обнаруживаются в крови 70-75 % больных буллезным пемфигоидом. Аутоантигенами при буллезном пемфигоиде будут пептиды с молекулярной массой 180 кДа (антиген буллезного пемфигоида – 2, BP-antigen-2, BP180, коллаген XVII типа) и 230 кДа (антиген буллезного пемфигоида – 1, BP-antigen-1, BP230). BP-antigen-2 – трансмембранный белок, обеспечивающий взаимосвязь базальных клеток эпидермиса и "заякоривающих" (сцепляющих) фибрилл. Считается, антитела к нему являются непосредственной причиной заболевания, а антитела к BP-antigen-1 появляются вторично. Наличие антител к эпидермальной базальной мембране не характерно для других пузырных дерматозов.
Концентрация антител к эпидермальной базальной мембране может определяться несколькими методами. Основной метод – непрямая реакция иммунофлюоресценции (НРИФ), другие тесты (ELISA, иммуноблотинг, иммунопреципитация) не используются при первичной диагностике пемфигоида.
Так как антитела к полудесмосомам являются непосредственной причиной буллезного пемфигоида, их уровень отражает активность заболевания. Результат анализа положителен в большинстве случаев впервые возникшего буллезного пемфигоида. При контроле заболевания уровень антител снижается, и результат может стать отрицательным, поэтому кровь на исследование следует сдавать до начала терапии.
Результат анализа следует интерпретировать с учетом дополнительных клинических и лабораторных данных. Антитела к эпидермальной базальной мембране наблюдаются у 33 % пожилых пациентов с другими зудящими дерматозами, так что положительный результат данного исследования не является абсолютным диагностическим критерием буллезного пемфигоида. Для подтверждения положительного результата проводят исследование биопсийного материала с помощью метода прямой иммунофлюоресценции (ПИФ).
Следует отметить, что значение анализа на антитела к базальной мембране возрастает при диагностике буллезного пемфигоида в случаях, когда взятие материала на биопсию затруднено (локализация пузыря на слизистых оболочках, наличие тяжелой сопутствующей патологии).
Буллезный пемфигоид иногда сочетается с другими аутоиммунными состояниями, такими как сахарный диабет 1-го типа, ревматоидный артрит и неспецифический язвенный колит. Кроме того, у пациентов с этим заболеванием повышен риск онкологий (наиболее часто встречается аденокарцинома желудка). По этой причине при положительном результате анализа и подтверждении диагноза "буллезный пемфигоид" проводят дополнительные лабораторные и инструментальные исследования для исключения сопутствующей патологии.
• Так же как и десмосомы, полудесмосомы обеспечивают структурную устойчивость слоев эпителия
• Полудесмосомы расположены на базальной поверхности эпителиальных клеток, где они связывают внеклеточный матрикс с сетью промежуточных филаментов при участии трансмембранных рецепторов
• Полудесмосомы отличаются от десмосом по структуре и содержат, по меньшей мере, шесть уникальных белков
• Мутации в белках полудесмосом вызывают заболевания, близкие к тем, которые связаны с мутациями в генах белков десмосом
• Сигнальные процессы, регулирующие сборку полудесмосом, исследованы недостаточно
Полудесмосома представляет собой клеточный контакт, расположенный с базальной стороны плазматической мембраны эпителиальных клеток. Как показано на рисунке ниже, эта структура является комплексом, содержащим бляшки, переплетенные филаментами, и внешне выглядит как половина десмосомы.
Однако, несмотря на внешнее сходство, полудесмосомы не являются половиной десмосомы. Их основная функция заключается в прикреплении слоев эпителия к базальной ламине. Это служит еще одной чертой, отличающей полудесомому от десмосомы. В то время как обе структуры скрепляют слои эпителия вместе, в клетке они ориентируются под прямым углом по отношению друг к другу и, таким образом, противостоят различным типам механического стресса. Оба типа этих структур, связанные вместе промежуточными филаментами, образуют очень прочную сеть.
Отсутствие полудесмосом вызывает образование волдырей на поверхности ткани разных эпителиев и в том числе на коже, и такие заболевания могут заканчиваться смертельным исходом.
На рисунке ниже схематически представлено строение полудесмосомы. На цитоплазматической стороне «типичной» (тип I) полудесмосомы можно видеть пучок промежуточных филаментов (кератины 5 и 14), прикрепленных к внутренней бляшке. Эта бляшка включает белки ВР230 и HD1/плектин, связанные с белками промежуточных филаментов.
Наружная бляшка содержит два типа трансмембранных белков: интегриновый рецептор (α6β4) и представитель семейства коллагенов (известный как коллаген XVII или ВР180). От плазматической мембраны через lamina lucida в lamina densa тянутся филаменты, выполняющие якорную функцию и состоящие из ВР180 и ламинина-5, который представляет собой белок внеклеточного матрикса).
В lamina densa находится много различных ламинарных белков. Наконец, заякоривающие фибриллы, состоящие из коллагена VII, соединяют lamina densa с суббазальной lamina densa, состоящей из нескольких белков внеклеточного матрикса. В некоторых тканях, например в кишечнике, обнаружены полудесмосомы типа II, в которых белки ВР180 и ВР230 отсутствуют.
Несмотря на критическую роль, которую играют десмосомы в обеспечении поддержания архитектуры ткани, они не представляют собой статических структур. Например, при ранении кожи происходит отсоединение клеток от нижележащей базальной ламины и их перемещение в раневую область. Там они вступают в деление, восстанавливают популяцию клеток в раневой области, и затем снова прикрепляются к базальной ламине и друг к другу. Эти изменения фенотипа предполагают способность клеток к диссоциации и реассоциации контактов с матриксом и между собой. К числу таких контактов относятся полудесмосомы и десмосомы соответственно.
Один из механизмов сборки и разборки полудесмосом подтверждается экспериментами, проведенными с культурой клеток эпителия и на модели заживления раны in vitro. Результаты показывают, что при миграции клеток белки полудесмосом остаются в комплексе, который в ходе эндоцитоза интернализуется. Позже, когда клетки опять присоединяются к базальной ламине, эти комплексы снова поступают на поверхность клетки, и структура полудесмосомы восстанавливается.
Вероятно, критическую роль в сборке полудесмосом играют α6β4 интегриновые рецепторы. При добавлении к клеткам антител, блокирующих связывание α6β4 интегрина с внеклеточным лигандом (ламинином-5), на поверхности клеток не происходит образования полудесмосом. Другими экспериментами показано, что в процессе сборки полудесмосом, видимо, участвует дефосфорилирование α6 цепи интегринового рецептора. В настоящее время ведутся исследования по выяснению природы внутриклеточных сигнальных путей, ответственных за регуляцию фосфорилирования интегринового рецептора и за сборку и разборку полудесмосом.
Полудесмосомы являются специализированными структурами, формирующимися в местах контакта эпителиальных клеток и внеклеточного матрикса, называемого базальной ламиной.
Для полудесмосомы характерно скопление нитчатого материала, который заканчивается плотной бляшкой на поверхности клетки. Полудесмосомы присоединяются к базальной мембране,
которая состоит из базальной ламины и сети коллагеновых фибрилл.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
• Плотные контакты представляют собой разновидность контактного комплекса, который образуется между соседними эпителиальными или эндотелиальными клетками
• Плотные контакты регулируют транспорт частиц между эпителиальными клетками
• Плотные контакты сохраняют полярность эпителиальных клеток, выполняя функцию «загородки», которая предотвращает миграцию белков плазматической мембраны между апикальной и базальной областью
Межклеточные контакты играют критическую роль в образовании многоклеточных организмов и в обеспечении их жизнеспособности. Вдоль латеральных поверхностей примыкающих друг к другу клеток эпителия и эндотелия могут образоваться три различных типа контактных комплексов. У позвоночных это плотные контакты, адгезивные контакты и десмосомы. У беспозвоночных вместо плотного контакта часто возникает септированный контакт. Взаимное положение контактов схематически представлено на рисунке ниже.
Они поддерживают существование обособленных специализированных областей у многоклеточных организмов и регулируют между ними транспорт молекул. Они также предохраняют клетки от химических и физических повреждений. Мы рассмотрим каждый тип межклеточных взаимодействий, начиная с плотного контакта.
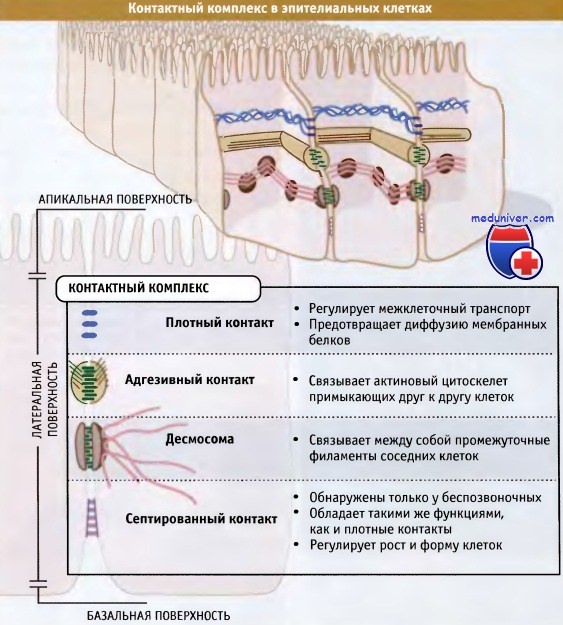
Контактный комплекс подразделяется, по меньшей мере, на три вида межклеточных контактов.
Они обеспечивают эпителиальной клетке возможность поддерживать свою структуру и функционировать в качестве селективного транспортного барьера.
Септированные контакты обнаружены только у беспозвоночных, где они часто присутствуют вместо плотных контактов.
Как видно на рисунке ниже, на фотографии ультратонкого среза клеток в трансмиссионном электронном микроскопе плотные контакты видны в виде групп небольших контактов (иногда называемых «поцелуями»). Эти контакты существуют между латеральными мембранами соседних клеток, расположенными напротив. Белки на цитоплазматической стороне мембраны, примыкающей к этим контактам, имеют вид электронно-плотных «облаков». На сколах замороженных суспензий клеток видна другая картина, которая показывает распределение белка в двух липидных монослоях, разделенных в середине плазматической мембраны.
При этом плотные контакты имеют вид переплетенной сети тонких фибрилл (или нитей), если белки остаются встроенными в мембрану, или же выглядят как сеть углублений, если в процессе скола произошла потеря белков.
Плотные контакты имеют сложный молекулярный состав. В зоне этих контактов обнаружено более 24 белков. Среди них идентифицировано три типа трансмембранных белков: клаудины, окклюдины и контактные адгезивные молекулы (JAM). Клаудины являются основными белками фибриллярных структур плотного контакта. Упомянутые выше поры образуются при организации внеклеточных доменов клаудинов в петли, формирующие селективные каналы в фибриллах.
У млекопитающих идентифицировано по меньшей мере 24 клаудиновых белка, и различные их комбинации формируют каналы, обладающие различной проницаемостью по отношению к ионам. Трансфекция клаудиновых генов в клетки, которые в норме их не экспрессируют, приводит к формированию плотных контактов. Окклюдины латерально сополимеризуются с клаудинами вдоль фибрилл плотного контакта, в латеральном направлении, однако их точная функция неизвестна.
Три трансмембранных белка прочно связаны с девятью или более структурными белками, включая актин. Они также способны к эпизодическому связыванию более двенадцати сигнальных белков. Это позволяет предполагать, что плотные контакты играют дополнительную роль в качестве присутствующих на клеточной поверхности организаторов сигнала, подобно тому как это имеет место для фокального адгезивного комплекса на базальной поверхности клеток.
Многие другие белки зоны плотного контакта, например ZO-1, по своей первичной структуре относятся к семейству мембраносвязанных гуанилаткиназ (MAGUK). Эти белки содержат три домена, расположенные в характерном порядке. Благодаря этим доменам они связываются со многими типами белковых мишеней, включая сигнальные белки и элементы актинового цитоскелета. Некоторые из белков зоны плотного контакта содержат также домен PDZ, который дает им возможность связываться между собой. В модельных экспериментах in vitro с использованием интактных и усеченных форм этих белков продемонстрирована возможность образования в зоне контакта их различных комбинаций.
Плотные контакты играют две важные роли. Во-первых, они представляют собой молекулярные структуры, регулирующие параклеточный транспорт (транспорт материалов, происходящий в пространстве между клетками) в эпителиальных и эндотелиальных слоях. (Ранее считалось, что они функционируют в качестве барьеров, блокирующих (предотвращающих) этот транспорт, и, поэтому, контактные зоны назывались zonula occludens.) Этим плотные контакты напоминают «молекулярный фильтр», через который пропускаются молекулы клеточного окружения при прохождении ими границ эпителия и эндотелия.
Однако не все фильтры одинаковы, поскольку для каждого вида ткани необходим фильтр, способный удалять определенный набор молекул. Например, для ткани почек не обязательно удалять дымовые частицы. Фактически диапазон размеров частиц, проходящих через плотные контакты за счет свободной диффузии, варьирует между 4 и 40 А, в зависимости от типа ткани.
Физические барьеры для транспорта ионов и других растворимых компонентов имеют различную природу: ионы проходят мгновенно, а другим растворимым компонентам для прохождения через плотный контакт необходимы минуты или даже часы. Каким образом это осуществляется? Недавно предложенная модель постулирует, что барьер проницаемости в плотном контакте создается за счет слоев пор, несущих селективные заряды и образующих сетчатую структуру, состоящую из хрупких нитевидных структур. Ионы способны проходить через эти поры, однако для прохождения других растворимых компонентов должна нарушиться целостность нитей.
По мере разрыва и воссоединения нитей компонент постепенно продвигается через барьер контакта, как показано на рисунке ниже.
Вторая роль плотных контактов состоит в том, что в структурном и функциональном отношении они делят плазматическую мембрану поляризованных клеток на два домена. Апикальная (от греч. слова apex — вершина) поверхность представляет собой часть плазматической мембраны, которая ориентирована по направлению к полости или к пространству с одной стороны слоя эпителия. Базальная (или нижняя) поверхность представляет собой область с противоположной стороны, которая находится в контакте с внеклеточным матриксом.
Латеральные поверхности формируют «стороны» между этими двумя областями. Плотные контакты полностью окружают клетки эпителия и эндотелия вдоль латеральной поверхности по границе апикальной и латеральной зон. Тем самым клетка подразделяется на две области: апикальный и базолатеральный домены. Эти домены разграничивают поверхность клетки на область «вершины» и область «основания», играющие различную роль в контроле трансклеточного перемещения метаболитов. Хотя мембранные белки могут диффундировать в плоскости каждого домена, они не мигрируют от одного домена к другому через плотные контакты.
В этом смысле плотные контакты как бы играют роль «изгороди», благодаря которой поддерживается уникальный молекулярный состав в пределах каждого из двух мембранных доменов.
Хотя молекулярные механизмы этого диффузионного барьера исследованы еще недостаточно, идентифицированы два отдельных макромолекулярных комплекса, играющие важную роль в формировании и поддержке полярного распределения белков плазматической мембраны в клетках эпителия и эндотелия. Изменения экспрессии любого из этих белков приводят к утрате клеткой полярности. Эти комплексы обнаружены в плотных контактах и непосредственно связаны с белками, входящими в состав сетчатых структур, о которых шла речь выше.
Электронная микрофотография клеточного препарата, приготовленного методом замораживания-скалывания.
Видна фибриллярная сеть, образующая плотный контакт.
На фотографии, выполненной с помощью трансмиссионного электронного микроскопа (на вставке),
показана связь между мембранами, существующая в плотном контакте. В плотных контактах клетки удерживаются вместе окклюдином, клаудином и контактными адгезивными молекулами. Модель, описывающая процессы быстрого и медленного транспорта растворимых веществ через плотный контакт.
Быстрый транспорт некоторых ионов происходит через ионные каналы, встроенные в фибриллярные структуры контакта.
Медленный транспорт веществ, которые не могут проходить через каналы, осуществляется при возникновении в фибриллах разрывов,
через которые происходит их транспорт. Поскольку существует много фибриллярных слоев, этот процесс транспорта включает несколько стадий.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
• Основная функция десмосом заключается в обеспечении структурной целостности слоев клеток эпителия за счет связывания их сетей промежуточных филаментов
• Десмосомы являются компонентами контактного комплекса
• В десмосомах находится, по меньшей мере, семь белков. Молекулярный состав десмосом различается в зависимости от типа клеток и тканей
• Десмосомы функционируют как адгезивные структуры и как комплексы передачи сигнала
• Мутации в белках, входящих в состав десмосом, снижают прочность эпителиальных структур. Эти мутации могут оказаться летальными, особенно если они затрагивают структуру кожи
Десмосомы являются компонентом контактного комплекса эпителиальных клеток. Они также присутствуют между клетками неэпителиального происхождения, например клетками миокарда, печени, селезенки и некоторыми клетками нервной системы. В электронном микроскопе можно наблюдать три характерных особенности десмосом:
• Массивные скопления фибрилл, проходящие через щель (в середине десмосомы, около 30 нм в ширину) между плазматическими мембранами двух рядом расположенных клеток.
• Эти фибриллы прикреплены к толстой бляшке электронно-плотного материала, расположенной на цитозольной стороне плазматической мембраны.
• Бляшки, состоящие из электронно-плотного материала, прикреплены к филаментам цитозоля каждой клетки.
Плотный материал, присутствующий на плазматической мембране, состоит из двух структур, внутренней и наружной плотных бляшек. Каждая десмосома довольно мала (средний диаметр составляет около 0,2 мкм), и на участке контакта двух клеток можно видеть несколько десмосом.
Структура десмосомы напоминает подвесной мост: филаменты цитозоля двух соседних клеток связаны между собой посредством внеклеточных филаментов, прикрепленных к «якорным» структурам на плазматической мембране. Поэтому контакт был назван десмосомой, от двух греческих слов: desmos (связь, скрепление, цепь) и soma (тело). Очевидно, что назначение такой структуры состоит в связывании двух клеток друг с другом.
Какими клеточными функциями обладает такой контакт? Вспомним две основные функции контактного комплекса, представленного на рисунке ниже: контроль межклеточного транспорта и обеспечение устойчивости к физическим нагрузкам, которые воздействуют на ткань эпителия. Поскольку десмосомы особенно характерны для клеток, подвергающихся физическим нагрузкам, например для клеток кожи и сердечной мышцы, биологи думали, что в основном им свойственна вторая из вышеуказанных функций.
В соответствии с этим, цитоплазматические филаменты, прикрепленные к плотным бляшкам, были названы тонофиламентами, что должно было отражать приложенную к ним нагрузку (от греч. tonos). Позже оказалось, что эти филаменты являются промежуточными филаментами, т. е. представляют собой основной класс цитоскелетных структур, хотя иногда их все еще называют тонофиламентами.
Помимо фибрилл промежуточных филаментов, в десмосомах идентифицировано, по меньшей мере, еще семь других типов белков, которые организованы в три семейства. Три из них (десмоглеин, десмоколин 1 и десмоколин 2) относятся к подсемейству кадгериновых рецепторов. Эти белки представляют собой основные трансмембранные белки десмосом и являются главными компонентами наружных плотных бляшек.
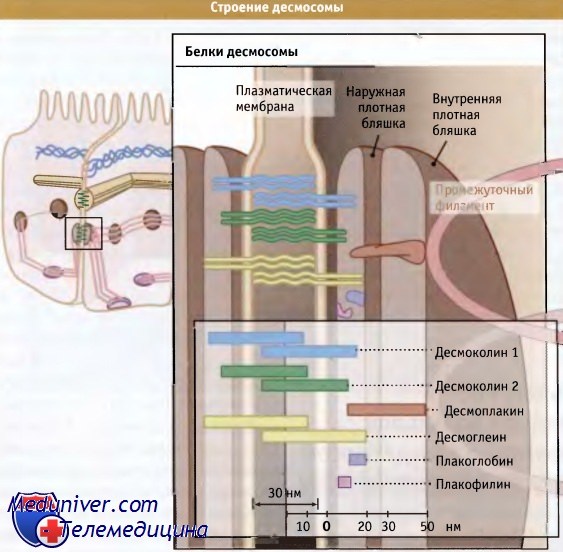
Белки десмосомы распределяются в плазматической мембране и в двух бляшках,
расположенных на поверхности клеток.
Они образуют «связующие филаменты», проходящие через межклеточное пространство, и служат сайтами связывания для цитоплазматических белков, представителей семейства armadillo (плакоглобина, плакофилинов) и семейства плакина (десмоплакина). Десмоплакин, в свою очередь, связывается с белками промежуточных филаментов во внутренней плотной бляшке.
Тонкая структура десмосомы, а также число образующихся десмосом в разных типах клеток варьирует, что отражает разнообразие нагрузок, которые должны выдерживать клетки.
В общем, десмосому можно уподобить «точечной сварке» двух клеток. Наряду с такой структурной ролью, белки десмосомы также играют важную сигнальную роль на поверхности клеток. Например, плакоглобин представляет собой белок, родственный b-катенину, который связывается с «классическими» кадгеринами адгезивного контакта. b-катенин является структурным белком адгезивного контакта, и также способен передавать сигналы в ядро клетки.
Аналогичным образом, при активации сигнальных рецепторов на поверхности клеток, плакоглобин и плакофилины начинают поступать в ядро, а плакоглобин даже непосредственно связывается с рецепторами фактора роста. В результате этого десмосомы могут контролировать экспрессию многих генов и оказывать существенное влияние на функцию внутриклеточных белков, включая белки других контактов.
Наиболее показательным примером, иллюстрирующим значение функционирования десмосом, является нарушение их структуры. В этом случае слои эпителия становятся очень непрочными, что приводит к легкой травмируемости органов, который они покрывают. Особенно это проявляется в случае кожи, склонной к образованию волдырей.
Под микроскопом видно, что, если между эпителиальными клетками отсутствуют десмосомы, то они плохо организованы, не имеют контактных комплексов и расположены небольшими группами, а не образуют единый непрерывный слой.
При разрушении или утрате десмосомальных контактов развивается ряд заболеваний, которые по своей этиологии подразделяются на две группы. Такие генодерматозы, как, например, ладонно-подошвенная кератодерма или контактный буллезный эпидермолиз, развиваются вследствие мутаций в белках десмосом или полудесмосом соответственно. Аутоиммунные буллезные дерматозы, например вульгарная пузырчатка (pemphigus vulgaris) или буллезный пемфигоид (bullous pemphigoid), возникают, когда у больных образуются аутоантитела к белкам своих десмосом или полудесмосом соответственно.
При болезнях обеих групп наблюдаются глубокие нарушения структуры и функции межклеточных контактов, и заболевание может приводить к смертельному исходу.
Для диагностики и лечения этих заболеваний используют комбинацию методов молекулярной генетики и тканевой инженерии. Мутации в генах белков десмосом обнаруживаются при пренатальном скрининге Это возможно по крайней мере при генодерматозных заболеваниях. При анализе образца плодной ткани методом ПЦР амплифицируется изучаемый ген (например, десмоколин-1). Затем с учетом полиморфизма длины фрагмента рестрикции и/или путем Саузерн-блоттинга анализируется ДНК.
Сейчас методы лечения пациентов с этими заболеваниями в основном сводятся к проведению мероприятий по защите кожных покровов и к соблюдению условий, исключающих образование волдырей. Для больных характерно плохое качество жизни. В настоящее время для лечения болезней, связанных с дисфункцией десмосомальных контактов, исследуется возможность применения искусственной кожи. При замещении поврежденных участков кожи лоскутом, представляющим собой слой здоровых клеток, интегрированных в искусственный внеклеточный матрикс, ученые надеются получить более стабильный и устойчивый к травме кожный покров, способный формировать нормальные десмосомы.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Антитела к десмосомам кожи – это аутоантитела, направленные организмом против компонентов собственных кератиноцитов. Они являются специфическими клинико-лабораторными маркерами истинной пузырчатки (пемфигуса) и используются при диагностике этого заболевания и контроле за его лечением.
Синонимы русские
Аутонтитела к десмосомам кожи, антитела к десмоглеинам, антидесмоглеины.
Синонимы английские
Desmoglein Antibodies, Desmoglein 1 (DSG1) and Desmoglein 3 (DSG3) Antibodies.
Метод исследования
Непрямая реакция иммунофлюоресценции.
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Десмосомы – это межклеточные контакты кератиноцитов, обеспечивающие барьерную функцию кожи. Их повреждение приводит к потере взаимодействия между соседними клетками, что проявляется формированием пузыря. Существует несколько причин, приводящих к разрушению десмосом (стрептококковая инфекция, токсическое воздействие). Однако наибольшее значение имеет аутоиммунное повреждение, обусловленное присутствием в крови аутоантител к десмосомам. Антитела к десмосомам являются характерным признаком истинной пузырчатки (пемфигуса). Пемфигус – это хроническое аутоиммунное заболевание неизвестной этиологии, поражающее кожу и слизистые. На основании общности клинической картины пемфигус, буллезный пемфигоид, герпетиформный дерматит Дюринга и наследственные буллезные дерматозы объединяются в группу пузырных дерматозов. Так как тактика лечения пузырных дерматозов значительно различается, дифференциальная диагностика этих заболеваний принципиально важна.
Одним из основных методов дифференциальной диагностики пузырных дерматозов является анализ на антитела к десмосомам кожи. Они направлены против белка десмоглеина, входящего в состав десмосом. Взаимодействие аутоантител и десмоглеина запускает иммунные механизмы, приводящие к разрушению десмосом. Такие аутоантитела обнаруживаются у 80-90 % больных истинной пузырчаткой. Различают несколько структурных вариантов десмоглеина. Десмоглеин-1 преобладает в десмосомах зернистого слоя кожи (и отсутствует в эпителии слизистых). Антитела к десмоглеину-1 наиболее часто вырабатываются при листовидной пузырчатке. Десмоглеин-3 преобладает в шиповидном слое кожи и слизистых, антитела к нему обнаруживаются у пациентов с вульгарной пузырчаткой. Для других пузырных дерматозов антитела к десмосомам нехарактерны. Результат анализа следует интерпретировать с учетом дополнительных лабораторных исследований (например, на антитела к глиадину, IgA).
Концентрация аутоантител к десмосомам может быть определена несколькими способами. Реакция непрямой иммунофлюоресценции (РНИФ) – это основной метод выявления аутоантител в сыворотке крови при подозрении на пемфигус. Чувствительность РНИФ составляет около 86 %. Антитела при этом могут не выявляться в первые несколько недель (и до 3 месяцев) пемфигуса, поэтому отрицательный результат исследования не позволяет полностью исключить заболевание. Значение РНИФ возрастает при диагностике пемфигуса в случаях, если биопсия затруднительна (у детей, пожилых людей, при локализации пузыря на слизистых оболочках).
При диагностике пемфигуса и других пузырных дерматозов учитывается тип свечения, полученный при РНИФ. Так, отложение иммуноглобулина IgG в межклеточных пространствах шиповатого слоя кожи – характерный признак вульгарной пузырчатки, зернистого слоя – листовидной пузырчатки. Выявление IgG или IgA вдоль эпидермодермального соединения нетипично для пемфигуса, и его следует трактовать в пользу других пузырных дерматозов.
Так как антитела к десмосомам являются непосредственной причиной пемфигуса, их уровень отражает активность заболевания. Результат анализа положителен в большинстве случаев впервые возникшего, нелеченого пемфигуса. При лечении заболевания уровень антител снижается, и результат исследования может стать отрицательным. По этой причине кровь на исследование необходимо сдавать до начала терапии. Тест на антитела к десмосомам проводится регулярно, 1 раз в полгода или чаще, для оценки активности заболевания и эффективности его лечения.
При положительном результате анализа и подтверждении диагноза "истинная пузырчатка" проводят ряд дополнительных лабораторных и инструментальных исследований, позволяющих оценить функцию жизненно важных органов до начала терапии иммуносупрессивными препаратами.
Читайте также:

