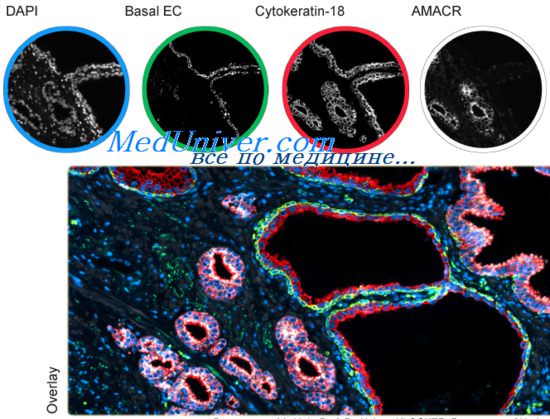
Что такое ацинарный эпителий
Обновлено: 24.04.2024
Эпителиальные опухоли предстательной железы. Аденома предстательной железы.
Многие клиницисты, а нередко и патологоанатомы без должных на то оснований аденомой именуют узловую гиперплазию предстательной железы, не являющуюся истинной опухолью. Аденома в действительном значении этого слова в предстательной железе встречается чрезвычайно редко, в виде трех структурных вариантов.
1-й из них — папиллярная аденома или папиллярная цистаденома. Тонкие ветвящиеся сосочки обычно покрыты высоким призматическим эпителием со светлой цитоплазмой и базально расположенными ядрами, под которым часто виден второй слой клеток типа базальных. Подобные папиллярные аденомы с эпителием типа ацинарного эпителия предстательной железы встречаются также в простатической части уретры.
2-й вариант — это базально-клеточная аденома типа соответствующей опухоли слюнной железы. Солидные или трабекулярные структуры построены из клеток с гиперхромными круглыми или овальными ядрами, скудной цитоплазмой; по периферии клетки расположены палисадообразно.
Наконец, описан аденоматоз «слюнножелезистого» типа иного строения, из криброзных или, частично, солидных структур. Последние построены в основном из клеток с гиперхромными угловатыми продолговатыми ядрами и вакуолизированной цитоплазмой, напоминающих миоэпителиоидные, без отчетливой полярности. Среди них рассеяны отдельные клетки с более светлыми округлыми ядрами. Мелкие полости содержат муцин или эозинофильные белковые массы.
По сравнению с карциномами других органов рак предстательной железы встречается у мужчин в пожилом возрасте (70-80 лет). Опухоль может прорастать в окружающие органы и ткани (особенно часто в мочевой пузырь и клетчатку малого газа) и довольно часто метаетазирует в лимфатические узлы и различные органы и ткани, особенно в кости, где метастазы обычно носят остеопластический характер. Иногда метастазы возникают при малы: размерах первичной опухоли, еще не проявляющейся клинически. При гистологическом исследовании такого метастаза следует иметь в виду, что биологическим маркером рака простатического происхождения является специфическая кислая фосфатаза, которую можно выявить в срезах с помощью иммуногистохимического (иммунопероксидазного) метода.
При патологоанатомическом исследовании мужчин пожилого возраста, умерших от различных заболеваний, гистологически в предстательной железе обнаруживают мелкие (чаще микроскопически малые) очаги так называемой латентной карциномы, обычно железистого строения. Считают, что они могут оставаться без значительного о прогрессирования многие годы. До сих пор не выявлено, всегда ли такая латентная карцинома предшествует инвазивному раку с явной клинической симптоматикой.
Аденокарцинома является наиболее обычной злокачественной опухолью предстательной железы. Возникает обычно в наружных отделах органа, часто в виде мулътицентрических очагов, поэтому в различных своих частях может иметь неодинаковое строение. Раз:гичают светлые, темные (базофильные и эозинофильные раковые клетки (но окраске цитоплазмы), в зависимости от тина построенных ими структур мелкоацинарные. крупноациарные, криброзные и солидно-трабекулярные аденокарщшомы. Мелкие ацишрные структуры могут залегать как в хорошо выраженной сгроме, так и вплотную примыкать друг к другу. В крунноапинарных карциномах железистые структуры могут быть образованы одним стоем кубических или высоких призматических клеток или местами скоплением их в несколько слоев, иногда с формированием папиллярных структур.
Редко в высокодифференцированных аденокарциномах почти отсутствует клеточный полиморфизм, ядра клеток довольно мономорфны, митозы малочисленны. Такие опухоли нередко приходится дифференцировать от железистых форм узловой гиперплазии предстательной железы. При этом следует учитывать, что в последних под слоем светлого призматического эпителия, можно видеть резервные (базальные) клетки, которые в злокачественных эпетелиаль-ных структурах отсутствуют железистые структуры в раковых опухолях нередко вплотную примыкают друг к другу, что не свойственно нормальной ткани предстательной железы. При узловой гиперплазии разрастания железистой ткани обычно находятся в четко отграниченных узлах, где часто сочетаются с гиперплазией не только соединительнотканных элементов, но и гладкой мышечной ткани. По периферии узлов ткань предстательной железы может быть сдавленной и атрофичной. Очаги аденокарциномы могут быть нечетко отграниченными, с признаками инвазивного роста, часто с наличием раковых клеток в периневральных лимфатических пространствах. Следует также иметь в виду, что в периферических отделах ткани предстательной железы могут встречаться поперечно исчерченные мышечные клетки, иногда в виде пучков, между которыми залегают отдельные железы. Такую картину можно ошибочно расценить как признак инвазии аденокарциномы.
При низкодифференцированных аденокарциномах с выраженными признаками анаплазии гистологический диагноз обычно не вызывает значительных трудностей.
Очень редко в предстательной железе встречают слизистый, «эндометриоидный» и аденокистозный рак, опухоль типа злокачественной смешанной опухоли слюнной железы.
«Эндометриоидный» рак обычно представляет собой папиллярное и/или железисто-папиллярное новообразование, покрывающее семенной бугорок, иногда выступающее из кратера мужской маточки в просвет простатической части уретры и инфильтрирующее ткань предстательной железы.Высокий призматический эпителий имеет овальные или продолговатые ядра, светлую базофильную или эозинофильную цитоплазму. Гистогенетическая принадлежность опухоли к мужской маточке сомнительна; возможно, что опухолевый рост возникает из терминальных (периуретральных) отделов протоков предстательной железы, тем более, что гистологически «эндометриоидный» рак не отличается от дуктальной карциномы.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Для цитирования: Щадрова В.В., Сетдикова Г.Р., Паклина О.В., и др. Ацинарная кистозная трансформация головки поджелудочной железы // Эффективная фармакотерапия. 2020. Т. 16. № 30. С. 38–42.
- Аннотация
- Статья
- Ссылки
- Английский вариант
Ацинарная кистозная трансформация головки поджелудочной железы, представляющая собой неопухолевое кистозное повреждение, в большинстве описанных в литературе случаев не имеет клинических симптомов и случайно обнаруживается при обследовании пациентов. Показания к хирургическому лечению, а также его объем определяются индивидуально с участием специалистов различного профиля. Предпочтительны органосохраняющие операции, поскольку данное образование доброкачественное.
- КЛЮЧЕВЫЕ СЛОВА: поджелудочная железа, кистозная трансформация, панкреатит
Ацинарная кистозная трансформация головки поджелудочной железы, представляющая собой неопухолевое кистозное повреждение, в большинстве описанных в литературе случаев не имеет клинических симптомов и случайно обнаруживается при обследовании пациентов. Показания к хирургическому лечению, а также его объем определяются индивидуально с участием специалистов различного профиля. Предпочтительны органосохраняющие операции, поскольку данное образование доброкачественное.
Рис. 2. МСКТ с внутривенным контрастированием (А – кистозное образование головки ПЖ. В периферических отделах каудальной части головки ПЖ однокамерная кистозная опухоль, прилежащая к стенке терминального отдела холедоха)
Рис. 3. МСКТ с внутривенным контрастированием (В – пристеночный солидный компонент в кистозном образовании)
Рис. 4. МСКТ с внутривенным контрастированием (С – компрессия дистального отдела холедоха с формированием внепеченочной билиарной гипертензии)
Рис. 5. МСКТ с внутривенным контрастированием (D – внутрипеченочная билиарная гипертензия; E – увеличение размеров желчного пузыря)
Рис. 6. Данные цитологического исследования: обнаружен муцин, эпителиальный компонент не просматривался
Рис. 7. Макроскопическое исследование: выявлена однокамерная киста диаметром 23 мм, расположенная ближе к передней поверхности стенки общего желчного протока и стенки двенадцатиперстной кишки, без связи с протоками
Рис. 8. Микроскопически внутренняя поверхность стенки кисты выстлана ацинарноподобным кубическим эпителием с образованием небольших железистых структур. Окрашивание гематоксилином и эозином, 400-кратное увеличение
Рис. 9. В области сосочковых структур просматриваются участки, представленные однорядным муцин-продуцирующим цилиндрическим эпителием. Окрашивание гематоксилином и эозином, 400-кратное увеличение
Рис. 10. При ИГХ отмечается диффузная положительная реакция с трипсином. ИГХИ, трипсин, 400-кратное увеличение
Таблица 2. Дифференциальная МСКТ-диагностика однокамерных кистозных новообразований поджелудочной железы
Кистозные образования (КО) поджелудочной железы (ПЖ) характеризуются различными этиологическими, морфологическими и клиническими особенностями, представляя сложную клинико-диагностическую задачу для специалистов различных профилей: гастроэнтерологов, хирургов, инструменталистов. Данные изменения ПЖ хорошо визуализируются при ультразвуковом исследовании органов брюшной полости (УЗИ), мультиспиральной компьютерной томографии с внутривенным контрастированием (МСКТ), эндоскопической ультрасонографии (ЭУС), магнитно-резонансной холангиопанкреатографии (МРХПГ), что впоследствии определяет тактику ведения пациентов. Большинство истинных кистозных опухолей представлено образованиями с муцинозной и серозной дифференцировкой эпителия, на долю которых приходится почти 70% [1]. Остальную часть составляют опухоли с эндокринной, смешанной и неопределенной (солидно-псевдопапиллярная опухоль) дифференцировкой.
Кистозные образования ПЖ с ацинарной дифференцировкой чрезвычайно редки и составляют менее 2% случаев всех КО ПЖ. Впервые данный гистологический тип был описан в 1981 г. G. Klöppel как кистозная трансформация ацинусов [2]. Спустя 21 год, в 2002 г. J. Albores-Saavedra предложил термин «ацинарно-клеточная цистаденома» [3]. Позднее, в 2010 г. ацинарно-клеточная цистаденома была включена как отдельная нозологическая форма в классификацию опухолей желудочно-кишечного тракта (ЖКТ) Всемирной организации здравоохранения (ВОЗ) (ICD-O 8551/0) [4]. Однако спустя 16 лет в последнем пересмотре классификации опухолей ЖКТ ВОЗ в 2019 г. термин «ацинарно-клеточная цистаденома» вновь был заменен термином «ацинарная кистозная трансформация» ПЖ без присвоения ICD-O кода заболевания, то есть исключена из группы истинных опухолей ПЖ [5]. Согласно классификации, ацинарная кистозная трансформация (АКТ) представляет собой неопухолевое кистозное повреждение (именно повреждение) ПЖ, стенка которого выстлана как ацинарным, так и протоковым эпителием.
В большинстве описанных случаев АКТ не имеет клинических симптомов и случайно обнаруживается при обследовании больных. При больших размерах АКТ может проявляться билиарной и панкреатической гипертензией и обструкцией, являясь причиной механической желтухи и абдоминального болевого синдрома [6]. Размер кист колеблется от 1,5 до 20,0 см (средний размер – 5,8 см), они могут быть как однокамерными, так и многокамерными. Встречаются варианты с мультицентрическим тотальным поражением ПЖ. Один из редких вариантов КО описан в данной статье.
Клинический случай
Пациентка 65 лет обратилась в Московский клинический научно-практический центр (МКНЦ) им. А.С. Логинова в июне 2019 г. с жалобами на кожный зуд, потемнение мочи, осветление кала. Из анамнеза известно, что больной в 2010 г. выполнена левосторонняя мастэктомия по поводу рака левой молочной железы рТ1N0M0. Химиотерапия, лучевая терапия, гормонотерапия не проводились. В 2017 г. выполнена радикальная мастэктомия по поводу рака правой молочной железы T4bN0M0, и проведено восемь курсов полихимиотерапии. В настоящее время больная получает гормонотерапию анастрозолом. В феврале 2019 г. при амбулаторном обследовании, по данным МСКТ органов брюшной полости без внутривенного контрастирования, выявлена кистозно-солидная опухоль головки ПЖ. В мае 2019 г. амбулаторно выполнено биохимическое исследование крови: впервые выявлен цитолиз (аланинаминотрансфераза (АЛТ) – 669 Ед/л, аспартатаминотрансфераза (АСТ) – 555 Ед/л), холестаз (гамма-глутамилтранспептидаза (ГГТП) – 945 Ед/л, щелочная фосфатаза (ЩФ) – 123 Ед/л), гиперхолестеринемия – до 7,68 мкмоль/л. Данными ультразвукового исследования органов брюшной полости подтверждено наличие очагового образования головки ПЖ, диагностирована билиарная гипертензия (внутрипеченочные желчные протоки расширены до 5 мм), вирсунгэктазия. Для уточнения характера изменений в ПЖ выполнена МРХПГ: кистозное новообразование головки поджелудочной железы до 22 мм в диаметре с обструкцией общего желчного и панкреатического протоков и развитием билиарной и панкреатической гипертензии. Связь с протоковой системой ПЖ не определяется.
В июле 2019 г. пациентка была госпитализирована в МКНЦ им. А.С. Логинова для дообследования и выполнения пункции кистозного образования головки ПЖ. При динамическом биохимическом анализе крови (16 июня 2019 г.) отмечались нарастание цитолиза (АЛТ – 1299 Ед/л, АСТ – 983 Ед/л) и холестаза (ГГТП – 1343 Ед/л, ЩФ – 931 Ед/л), появление гипербилирубинемии – 61,2 ммоль/л преимущественно за счет прямой фракции, гиперхолестеринемии – 10,2 мкмоль/л. Онкомаркеры СА19-9, РЭА в пределах референсных значений (табл. 1).
МСКТ с внутривенным контрастированием: КТ-картина кистозного образования головки ПЖ, вероятно цистаденома (рис. 1–3), компримирующая холедох с формированием билиарной гипертензии (рис. 4, 5). Дифференциальный диагноз проведен между муцинозной (наиболее вероятно) и серозной цистаденомами ПЖ, а также метастазом рака молочной железы с кистозной трансформацией. С целью уточнения диагноза пациентке выполнена тонкоигольная пункция опухоли под контролем ЭУС с цитологическим, иммунологическим и биохимическим исследованием пунктата. При пункции получено вязкое прозрачное отделяемое, по физическим характеристикам соответствующее муцину. По данным цитологического исследования, обнаружен муцин без эпителиального компонента (рис. 6). Уровень онкомаркера СА19-9 в отделяемом – 1000 Ед/мл при норме до 37 Ед/мл. Уровень амилазы в отделяемом материале не повышен.
Пациентке рекомендована консервативная терапия полиферментными препаратами в суточной дозе 75 000 Ед липазы, ингибиторами протонной помпы, урсодезоксихолевой кислотой по 250 мг три раза в день и повторная госпитализация в МКНЦ им. А.С. Логинова для проведения оперативного лечения кистозного образования головки ПЖ. В октябре 2019 г. больная была повторно госпитализирована в МКНЦ им. А.С. Логинова.
Предварительный диагноз: Основной: Муцинозная цистаденома головки поджелудочной железы.
Осложнение основного: Вторичный холестатический гепатит. Механическая желтуха.
Сопутствующий: Рак левой молочной железы T1N0M0, оперативное лечение в 2010 г. Рак правой молочной железы T4bN0M0, комбинированное лечение в 2017–2018 гг. (радикальная мастэктомия справа + восемь курсов химиотерапии). Гормонотерапия анастрозолом с 2018 г. по настоящее время.
С учетом полученных результатов обследования – наличия пристеночного солидного компонента (по данным МСКТ), муцина в содержимом кистозного образования, повышения в нем уровня онкомаркера СА19-9 до 1000 Ед/мл онкологический консилиум принял решение провести радикальное оперативное лечение в объеме панкреатодуоденальной резекции.
В октябре 2019 г. пациентке выполнена лапароскопическая пилорус-сохраняющая панкреатодуоденальная резекция. В послеоперационном периоде отмечалось развитие панкреатической фистулы класса B [7], потребовавшей дополнительного чрескожного дренирования под ультразвуковым контролем. Дренаж удален на десятые сутки. Пациентка выписана в удовлетворительном состоянии.
Данные патологоанатомического исследования операционного материала: макропрепарат представлен гастропанкреатодуоденальным комплексом; головка ПЖ размером 5,0 × 5,0 см; главный панкреатический проток проходим, диаметр 0,3 см, открывается на ампуле большого дуоденального сосочка (БДС); общий желчный проток в области радиального перидуктального края расширен до 1,1 см, проходим, открывается на ампуле БДС; вариант взаимоотношения протоков – V-тип. При раскрытии головки ПЖ на переднюю и заднюю поверхности обнаружена однокамерная киста диаметром 23 мм, расположенная ближе к передней поверхности стенки общего желчного протока и стенки двенадцатиперстной кишки, без связи с протоками (рис. 7). Киста тонкостенная, гладкостенная, заполнена прозрачным серозно-муцинозным содержимым. На остальном протяжении железа дольчатая, архитектоника сохранена.
Микроскопически внутренняя поверхность стенки кисты на большом протяжении выстлана ацинарноподобным кубическим эпителием с образованием небольших железистых и солидных структур. Эпителий с эозинофильной цитоплазмой и округлым ядром, ядрышки не выражены (рис. 8). В эпителиальной выстилке в области сосочковых структур просматриваются участки, представленные однорядным одно- или двуслойным муцин-продуцирующим цилиндрическим эпителием (рис. 9). Фигуры митоза и ядерная атипия отсутствуют. Подэпителиальная строма кисты малоклеточная с гиалинозом.
При иммуногистохимическом исследовании отмечалась выраженная положительная реакция с трипсином и муцином 6-го типа (рис. 10). В муцинозном эпителии позитивная реакция с цитокератином 7. Реакции с хромогранином А, синаптофизином и бета-катенином негативные.
Заключение: гистологическая и иммуногистохимическая картина соответствует ацинарной кистозной трансформации поджелудочной железы.
Таким образом, у пациентки диагностирована редкая форма кистозного образования ПЖ – ацинарная кистозная трансформация ПЖ.
Представленный случай редкого кистозного образования ПЖ отражает все трудности предоперационной диагностики кистозных новообразований ПЖ. Несмотря на проведение комплексного предоперационного обследования, окончательный клинический диагноз был установлен только по результатам патологоанатомического исследования. Предоперационная диагностика новообразований ПЖ основывается на сочетании клинических, рентгенологических и серологических данных. При КО ПЖ неспецифические отклонения лабораторных показателей обусловлены обструкцией билиарного дерева, а уровень онкомаркеров не превышает нормальных значений [8, 9]. Лучевая диагностика затруднительна ввиду сходства МСКТ-картины с некоторыми другими КО, особенно с муцинозной кистозной опухолью. В таблице 2 представлен ряд параметров для дифференциальной МСКТ-диагностики кистозных новообразований поджелудочной железы [7, 10, 11].
В некоторых ситуациях клиническое значение имеет диагностическая пункция образований. Повышенный уровень ракового эмбрионального антигена (РЭА) в пунктате – диагностический признак муцинозной цистаденомы [12]. Вывод о наличии муцина был сделан на основании субъективных данных – вязкого прозрачного отделяемого, полученного при пункции.
При интраоперационном гистологическом исследовании трудности возникают при изучении криостатного среза из-за наличия двойного протокового и ацинарного типов эпителия в данных кистозных образованиях [13]. Протоковый эпителий обычно цилиндрический однорядный, с минимальными признаками ядерного полиморфизма. Напротив, ацинарный эпителий, особенно на криостатных срезах, имитирует фокусы тяжелой дисплазии за счет ядерной гипертрофии, свойственной данному методу исследования, что может привести к ошибочной интерпретации результатов в сторону более злокачественного процесса [14]. Плановое исследование при соблюдении патологом четкого протокола диссекции не вызывает каких-либо диагностических сложностей.
В литературе не описаны случаи рецидива или малигнизации АКТ [9, 15]. Этот факт объясняется гистогенезом данного образования. Анализ гистологических исследований описанных в мировой литературе случаев, включая представленное выше клиническое наблюдение, показывает, что дифференцировка ацинарных клеток в АКТ возникает как результат метаплазии протокового эпителия. Ацинарная метаплазия достаточно редкий вид метаплазии в ПЖ и, как правило, затрагивает протоки мелкого калибра с частичной или полной заменой эпителия. В норме ацинарные клетки ПЖ не экспрессируют цитокератин 7, который является основой цитоскелета клеток протокового эпителия. Однако во всех случаях при иммуногистохимическом исследовании отмечалась положительная реакция с данным маркером, что подтверждает первоначальный протоковый фенотип клеток.
Согласно литературным данным, наиболее частым этиологическим фактором является механическая обструкция протоков ПЖ. Однако в представленном клиническом примере паренхима ПЖ вне образования была интактна, без признаков хронического панкреатита или обструкции главного и боковых панкреатических протоков. Вероятно, у данной пациентки решающую роль в развитии ацинарной трансформации бокового протока с дальнейшим кистозным его расширением сыграла предшествующая химиотерапия по поводу рака молочной железы. В результате этого изменились реологические свойства (плотность и вязкость) панкреатического сока, приведшие к функциональной внутрипротоковой обструкции, кистозной трансформации и ацинарной метаплазии. Кроме того, отсутствие в ацинарной кистозной трансформации мутаций KRAS, GNAS, RNF43, TP53, CDKN2A и SMAD4, характерных для протокового рака и/или панкреатической интраэпителиальной неоплазии поджелудочной железы, еще раз подчеркивает ее доброкачественный характер (по данным ВОЗ).
Отсутствие четких диагностических критериев затрудняет предоперационную диагностику ацинарной кистозной трансформации поджелудочной железы. Показания к хирургическому лечению, а также объем последнего должны определяться индивидуально с участием специалистов различного профиля. Предпочтение следует отдавать органосохраняющим операциям, поскольку данные образования являются доброкачественными и лишь имитируют кистозные опухоли поджелудочной железы.
Цитология (гистология) биопсии слюнной железы при опухоли
Около 60% всех новообразований слюнных желез представлены плеоморфными аденомами, из которых 80% возникают в околоушной слюнной железе. Миоэпителиомы составляют примерно 1,5% всех новообразований слюнных желез, которые состоят из пролиферирующих миоэпителиальных клеток, демонстрирующих веретнообразные, эпителиоидные или плазмоцитоидные характеристики.
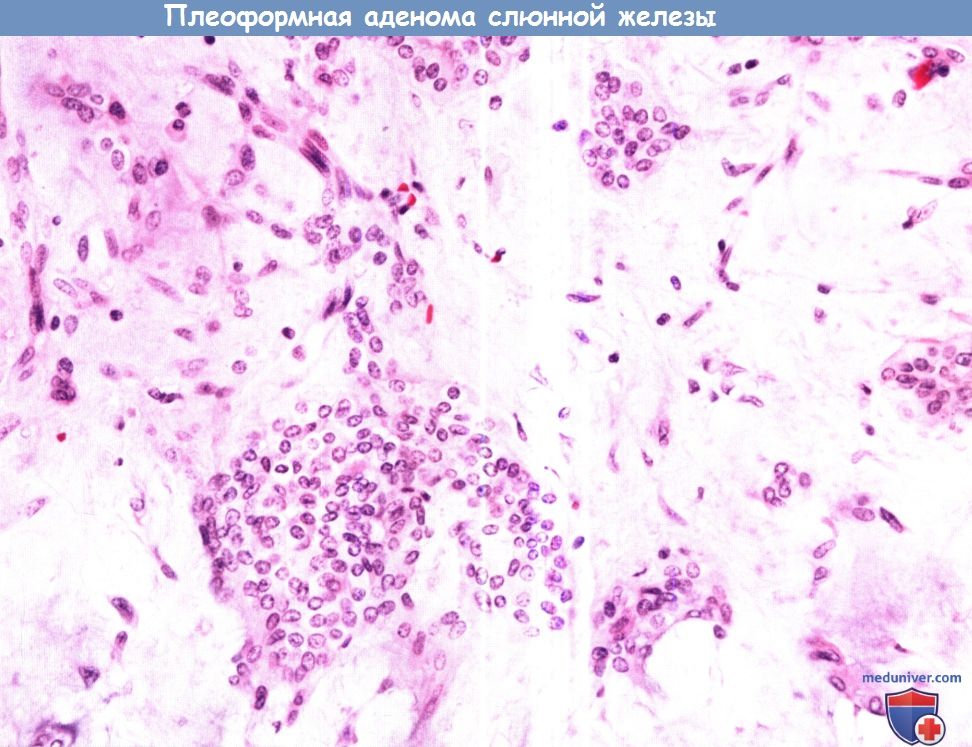
Плеоморфная аденома.
При микроскопии определяется пролиферация цитологически нормальных миоэпителиальных клеток, формирующих скопления неправильной формы в миксоидной мезенхимальной строме.
Для мезенхимального компонента характерны миксоидные и фиброзные изменения, иногда встречаются признаки хрящевой или костной метаплазии.
В течение пяти лет рецидивируют 3,4% опухолей, в течение 10 лет — 6,8%.
Часто рецидивирующие плеоморфные аденомы отличает многоочаговое строение.
Плеоморфные аденомы составляют около 60% всех опухолей слюнных желез. Из них 80% возникают в околоушной слюнной железе, 10% в поднижнечелюстной и 10% в малых слюнных железах.
Базальноклеточные аденомы представляют собой редкие доброкачественные заболевания слюнных желез, которые представлены пролиферирующими эпителиальными и миоэпителиальными клетками, отличающимся базалоидным видом и трабекулярным ростом. По составу они сходны с плеоморфными аденомами, но лишены мезенхимального компонента. После полного удаления рецидивируют редко.
Опухоль Уортина (сосочковая кистаденолимфома) составляет примерно 3,5% всех эпителиальных опухолей слюнных желез. Встречается практически исключительно в околоушной слюнной железе. Может иметь дольчатое строение, иногда двусторонняя.
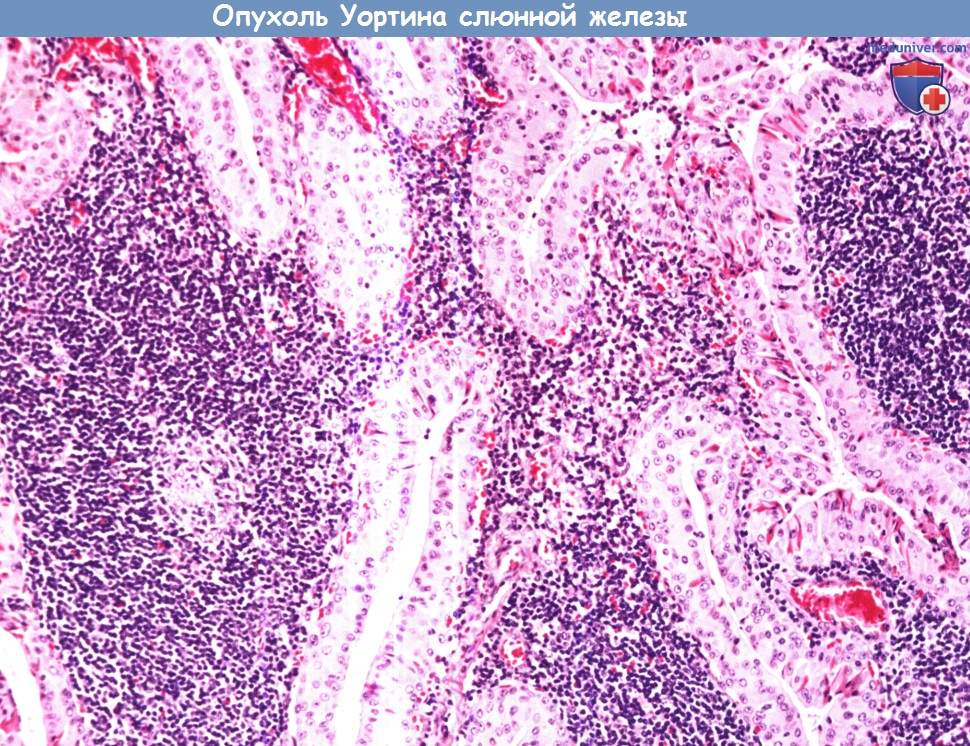
Опухоль Уортина (сосочковая кистаденолимфома) составляет примерно 3,5% всех эпителиальных опухолей слюнных желез.
Встречается практически исключительно в околоушной слюнной железе. Может иметь дольчатое строение, иногда двусторонняя.
При микроскопии опухоль имеет кистозно-сосочковое строение. Эпителиальные клетки с онкоцитарной метаплазией (большое количество цитоплазматических митохондрий,
розовая цитоплазма с частыми включениями) располагаются в два ряда, формируя сосочковые структуры, которые перемежаются с участками лимфоидной гиперплазии.
После удаления рецидивирует редко.
Онкоцитарная аденома (онкоцитома) представляет собой редкую доброкачественную опухоль слюнных желез, состоящую из онкоцитарных эпителиальных клеток, растущих в виде гнезд или трабекул. Канальцевая аденома чаще всего возникает на верхней губе, состоит из рядов плоских цилиндрических клеток, формирующих канальцы. Аденома сальных желез является доброкачественным образованием, образующимся в результате пролиферации сальных желез, в некоторых из них имеются включения лимфоидной ткани (сальные лимфоаденомы). Протоковые папилломы и цистаденомы встречаются редко.
Ацинозно-клеточный рак характеризуется пролиферацией ацинарных элементов, которые перемежаются с промежуточными мелкими клетками, вакуолями и прозрачными клетками. При мукоэпидермиодном раке обнаруживаются клетки злокачественного эпителия, в котором муцинозные клетки перемежаются с участками эпидермоидной дифференциации. Аденокистозная карцинома составляет примерно 10% от всех случаев злокачественных новообразований слюнных желез, имеет решетчатое строение, промежутки между клетками заполнены мукополисахаридами.
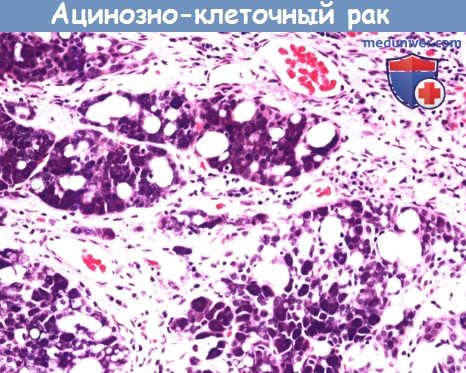
Ацинозно-клеточный рак чаще всего поражает околоушную слюнную железу.
Он характеризуется частичной ацинозной дифференцировкой (цитоплазма с секретирующими зимоген гранулами вкраплениями)
мелких и вакуолизированных мелких и прозрачных клеток.
Полиморфная аденокарцинома низкой степени злокачественности чаще всего возникает на небе, характеризуется цитологической однородностью, гистологическим разнообразием и инфильтративным ростом. Эпителиально-миоэпителиальная карцинома, редкая злокачественная опухоль, имеет двуслойную структуру, в которой внутренний слой представлен кубическим эпителием, а наружный — миоэпителиальными клетками с прозрачной цитоплазмой.
Из внутриротовых малых слюнных желез может возникать редкая злокачественан опухоль — светлоклеточная карцинома (гиалинизирующая светлоклеточная карцинома). Она представлена скоплениями однородных прозрачных клеток с высоким содержанием гликогена. Базальноклеточная аденокарцинома характеризуется пролиферацией миоэпителиальных клеток с частыми периодическими участками протоковой дифференциации. Карцинома в плеоморфной аденоме представляет собой смешанную злокачественную опухоль, в которой эпителиальный компонент подвергся злокачественной трансформации.
К редким злокачественным опухолям относятся сальная карцинома и сальная лимфоаденокарцинома. К другим возможным злокачественным новообразованиям также относится цистаденокарцинома, слизистая аденокарцинома, онкоцитарная карцинома, карцинома слюнного протока, неуточненная аденокарцинома, карциносаркома, плоскоклеточный рак, мелкоклеточный рак, крупноклеточный рак, лимфоэпителиальный рак.
Наиболее часто встречающимся злокачественным новообразованием слюнных желез является мукоэпидермоидный рак.
При нем обнаруживаются клетки злокачественного эпителия, в котором муцинозные клетки перемежаются с участками эпидермоидной дифференциации
(крупные незрелые клетки с сохраненными межклеточными мостиками, не продуцирующие кератин). Аденокистозный рак составляет примерно 10% от всех случаев злокачественных новообразований слюнных желез,
имеет решетчатое строение, промежутки между клетками заполнены мукополисахаридами.
При микроскопии определяются однородные пролиферирующие миоэпителиальные клетки со скудной цитоплазмой и интенсивно окрашенными ядрами неправильной формы.
Исход заболевания коррелирует с гистологической степенью злокачественности опухоли. Базальноклеточная аденокарцинома представляет собой злокачественный вариант базальноклеточной аденомы.
Она характеризуется пролиферацией миоэпителиальных клеток с частыми периодическими участками протоковой дифференциации (двухслойная эпителиальная и миоэпителиальная выстилка). Карцинома в плеоморфной аденоме представляет собой смешанную злокачественную опухоль, в которой эпителиальный компонент подвергся злокачественной трансформации.
Злокачественный эпителий может присутствовать лишь на определенных участках, иногда его локализация ограничена капсулой доброкачественной опухоли, из которой тот происходит.
Обратите внимание на крупные недифференцированные злокачественные клетки (в левой части изображения), которые проникают в ткань плеоморфной аденомы (в правой части изображения).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Ацинарные узлы на КТ легких: причины, диагностика
а) Терминология:
• Ацинарный узел (консолидированный легочный ацинус):
о Округлый, плохо отграниченный участок консолидации
о Поперечный размер: 5-8 мм
о Ацинарные узлы часто являются сгруппированными и мультифокальными
• Ацинус:
о Наибольшая структурная единица, в которой все дыхательные пути принимают участие в газообмене:
- Структурная единица легкого, расположенная дистальнее терминальной бронхиолы
- Снабжается респираторными бронхиолами первого порядка
- Содержит альвеолярные протоки и альвеолы
о Поперечный размер: 6-10 мм
• Вторичная легочная долька
о Содержит 3-25 ацинусов
(Слева) На аксиальной КТ без КУ у пациента с лихорадкой и кашлем определяются признаки бронхопневмонии в виде ацинарных узловв верхней доле правого легкого, выглядящих как мультифокальные округлые участки снижения пневматизации в виде «матового стекла» и частично солидные.
(Справа) На аксиальной КТ без КУ у пациента с умеренно выраженной грыжей пищеводного отверстия диафрагмы (не продемонстрирована) и аспирационным бронхиолитом визуализируются ацинарные узлы в нижней доле левого легкого, выглядящие как округлые участки консолидации окруженные «матовым стеклом». (Слева) На аксиальной КТ с КУ у пациента с кровохарканьем определяется первичный рак легкого, приводящий к обструкции нижнедолевого бронха справа. В нижней доле справа видны множественные округлые частично солидные ацинарные узлы (постобструктивная пневмония).
(Справа) На корональной КТ с КУ у пациента с мультицентрической инвазивной муцинозной аденокарциномой в нижних долях обоих легких и верхней доле правого легкого визуализируются множественные неоднородные (частично солидные) ацинарные узлы с просветлениями в центре. При описании подобных изменений нужно избегать термина «пневматизированные узлы».
б) Визуализация:
• Рентгенография:
о Мелкие округлые очаги с нечеткими границами
о Обычно мультифокальные
• КТ/КТВР:
о Мультифокальное поражение
о Солидная структура или «матовое стекло»
о Размер: 5-8 мм
в) Дифференциальная диагностика:
• Инфекция: бронхопневмония
• Аспирация
• Легочный васкулит
• Рак легкого: инвазивная муцинозная аденокарцинома
г) Клинические особенности:
• Симптомы:
о Инфекция: кашель, лихорадка, лейкоцитоз
о Инвазивная муцинозная аденокарцинома: бронхорея
д) Диагностическая памятка:
• Анализ мокроты с целью поиска инфекции
• Диагностика васкулита или злокачественной опухоли может потребовать эндоскопического исследования или открытой биопсии легкого
Редактор: Искандер Милевски. Дата обновления публикации: 27.12.2021

Невозможно правильно установить диагноз рака предстательной без гистологического исследования предстательной железы. Главной целью гистологического и цитологического исследования биопсийного и операционного материала является стадирование рака предстательной железы в целях определения дальнейшей тактики лечения, определения прогноза заболевания для каждого конкретного больного.
I. Гистологическая картина
Пролиферативные изменения железистого эпителия простаты периферической зоны обозначаются как простатическая интраэпителиальная неоплазия (PIN-ПИН), центральной зоны – атипическая аденоматозная гиперплазия. Все виды атипической гиперплазии являются факультативным предраком и рассматриваются как предшественники аденокарциномы.
1. Пролиферативная воспалительная атрофия (PIA) — локальные участки эпителиальной атрофии, близкие к PIN или карциноме. Эти повреждения демонстрируют генетическую альтерацию, связанную с раком простаты и признаками клеточного стресса.
Клинически: вероятный предшественник рака простаты, особенно в сочетании с PIN.
2. Простатическая интраэпителиальная неоплазия (PIN) — клеточная пролиферация ацинарного эпителия на разных стадиях клеточных отклонений, характеризуется прогрессирующей утратой маркеров секреторной дифференцировки и патологическим изменением ядер и ядрышек, плотности микрососудов, генетической нестабильностью и содержанием ДНК.
PIN бывает высокой и низкой степени.
PIN высокой степени делится на 6 типов:
— пучковидный тип – увеличенные ядра, хорошо заметные вакуоли, резидуальные базальные клетки;

Рисунок 1. PIN высокой степени. Пучковидный тип.
— микропапиллярный;
— плоский;
— крибриформный;
— мелкоклеточный;
— инвертированный;
Клинически:
- PIN высокой степени связан с 20-40% выявлением явного рака простаты при повторных биопсиях [ 1 ], по другим данным 30% [ 2 ]. Однако, при повторных биопсиях может выявляться стойкая PIN (до 5-43%);
- если при гистологическом исследовании обнаружено сочетание PIN с очагами мелкоацинарной атипической гиперплазии, то в 53% случаев в последующем выявляется карцинома;
- является гистологической находкой, не выявляется при пальцевом ректальном исследовании, УЗИ и ТРУЗИ и другими методами визуализации, не вызывает повышения ПСА, не влияет на плотность ПСА и коэффициент соотношения свободного и общего ПСА [ 3 ];
- больным с изолированной PIN высокой степени в течение 6 месяцев выполнялась повторная полифокальная биопсия, независимо от уровня ПСА и результатов пальцевого ректального исследования;
- в настоящее время при обнаружении PIN лечение больному не показано [ 4 ]. Блокаторы 5-альфа-редуктазы (финастерид) мало или вообще не оказывает влияния на PIN (частота PIN не изменилась через год приема финастерида) [ 5 ], [ 6 ];
- PIN является прогностическим фактором развития рака простаты.
3. Злокачественные образования.
А. Аденокарцинома — мелкоацинарный рак (small acinar carcinoma), составляет 95-97% всех случаев рака простаты. Этот вид рака происходит из ацинарного эпителия преимущественно периферической зоны предстательной железы. Но около 20-25% аденокарцином возникает в переходной зоне простаты. В этих случаях рак может быть диагностирован в ходе гистологического исследования после трансуретральной резекции предстательной железы, и он будет соответствовать стадиям Т1а или Т1b.

Рисунок 2. Мелкоклеточная аденокарцинома.
Клинически:
- клетки не имеют рецепторов к эстрогенам и прогестерону
- часть клеток не имеет рецепторов к андрогенам (в отличие от своих нормальных аналогов) [ 12 ].
Аденокарцинома может быть следующих гистологических вариантов:
1) Протоковый (эндометриоидный) рак (ductal or endometriod carcinoma) — характеризуется папиллярным ростом, локализуется в протоках простаты.
Клинически:
- проявляется гематурией и острой задержкой мочи;
- ПСА может быть нормальным или повышаться;
- цистоскопически – в области семенного бугорка можно увидеть белые папиллярные разрастания;
- метастазирует в легкие и половой член [ 9 ];
- по сравнению с обычной аденокарциномой отличается худшим прогнозом.

Рисунок 3. Протоковая (эндометриоидная) аденокарцинома.
2) Муцинозная аденокарцинома (или коллоидная) (mucinous adenocarcinoma) — характеризуется тем, то 25% и более желез в просвете содержит слизь (муцин), см. рисунок 4 , или железы «плавают» в большом количестве слизи, см. рисунок 5 . Однако, такая форма расположения муцина может быль найдена при атипичной аденоматозной гиперплазии, PIN, что будет симулировать рак простаты.
Клинически:
- клетки не имеют рецепторов к андрогенам;
- критерии Глисона НЕПРИМЕНИМЫ;
- прогноз такой формы рака простаты более неблагоприятный по сравнению с обычной аденокарциномой;
- устойчива к традиционной терапии;
- средняя продолжительность жизни не более 3 лет [ 4 ].

Рисунок 4. Муцинозная аденокарцинома.

Рисунок 5. Коллоидная аденокарцинома.
3) Перстневидноклеточный рак (signet cell carcinoma) – характеризуется наличием клеток в виде «перстня», кольца с камнем, что является результатом наличия цитоплазматического просвета, интрацитоплазматической слизи и липидных вакуолей.
Клинически:
- крайне неблагоприятный вид рака;
- больные погибают в течение 3х лет после установления диагноза.

Рисунок 6. Перстневидноклеточная карцинома.
4) Мелкоклеточный рак — нейроэндокринный рак (small cell carcinoma, neuroendocrine carcinoma) - который трудно отличить от низкодифференцированной аденокарциномы. Характерны большие нейроэндокринные клетки с большими эозинофильными гранулами. Гранулы содержат хромогранин А, серотонин, бомбезин, васкулярный эндотелиальный фактор роста (VEGF).
Клинически:
- нейроэндокринные клетки адрогеннезависимы и не вызывают повышения ПСА;
- клетки-предшественницы выделяют нейропептиды, что может иметь значение в клинике в виде формирования гормонорефрактерного фенотипа рака простаты. Однако клетки могут быть чувствительными к лучевой и химиотерапии (VP-16 этопозид, цисплатин);
- наряду с типичными признаками аденокарциномы предстательной железы могут иметь место паранеопластические синдромы в виде синдрома Кушинга, злокачественной геперкальциемии, синдрома неадекватной секреции антидиуретического гормона, миастенический синдром;
- средняя выживаемость – менее 1 года.

Рисунок 7. Нейроэндокринная аденокарцинома.
5) Плоскоклеточный рак (железисто-плоскоклеточный) — опухоли с плоскоклеточной дифференцировкой, возникающие из выстилающих базальных клеток в периуретральных железах, простатических ацинусах, не содержат железистых элементов.
Клинически: характерно агрессивное течение.
Вариант плоскоклеточной опухоли — аденоакантокарцинома — менее 0,6% опухолей простаты.
Клинически:
- возраст больных 50-80 лет;
- около 50% аденоакантокарцином возникает у больных карциномой после гормональной и лучевой терапии;
- описаны случаи взаимосвязи с инфекцией – шистосомозом;
- проявляется мочевой обструкцией, болью в костях, гематурией;
- быстро метастазирует в кости, вызывая остеолитическое их поражение;
- не вызывает повышение ПСА;
- гормональная, лучевая и химиотерапия неэффективны. Рекомендуется выполнить радикальную простатэктомию, цистопростэктомию, тотальную уретроэктомию [ 8 ].
6) Базалоидный рак (базально-клеточная карцинома) — на рисунке 8 — солидные скопления крупных базалоидных клеток, часто с периферическим некрозом, растет по периневральным пространствам. Клетки не имеют рецепторов к андрогенам, но имеют к эстрогенам и прогестерону [ 7 ].
Клинически: опухоль низкой степени злокачественности, но с высоким потенциалом быстрого злокачественного роста и образования отдаленных метастазов (биологическое поведение изучено недостаточно из-за малого количества случаев и непродолжительности наблюдений). Чаще всего проявляется мочевой обструкцией. Может наблюдаться местное экстрапростатическое распространение.

Рисунок 8. Базально-клеточная карцинома.
7) Аденосквамозный рак.
8) Кистозная аденокарцинома.
Б. Переходноклеточный (уротелиальный) рак — происходит из главных протоков предстательной железы, которые лежат вблизи мочеиспускательного канала, что и обусловливает его название. Он может как самостоятельным очагом рака простаты, так и быть одним из вариантов перехода рака из мочевого пузыря.
Бывает двух видов — первичный и вторичный.
- Первичный — встречается в 0,7-2,8% случаев всех видов рака предстательной железы, происходит из уротелиальной выстилки простатической уретры и проксимальной части простатических протоков.
- Вторичный — обусловлена прорастанием уроуротелиальных опухолей мочевого пузыря и уретры в простату [ 4 ]. Может наблюдаться сочетание инвазивной уротелиальной карциномы мочевого пузыря и вторичной уротелиальной карциномы предстательной железы.
Клинически:
- исключительно агрессивный «неуправляемый» рост;
- быстрое метастазирование, преимущественно в кости (остеолитические очаги) и лимфоузлы;
- отсутствует реакция на гормонотерапию;
- уровень ПСА может быть нормальным;
- проявляется мочевой обструкцией, гематурией;
- клинически наиболее неблагоприятный вариант – распространение в строму предстательной железы. Больным с раком in situ предстательной части мочеиспускательного канала сначала выполняют ТУР простаты, а потом проводят внутрипузырную химио- или иммунотерапию (БЦЖ). Но эта ситуация дискутабельна. В случае вторичной уротелиальной карциномы предстательной железы часть авторов считает внутрипузырную терапию неэффективной и рекомендует радикальную цистпростатэктомию [ 4 ].

Рисунок 9. Переходноклеточный рак.
В. Мезенхимальные опухоли — саркомы (лейомиосаркома, рабдомиосаркома) - встречаются редко (0,1-0,2% всех опухолей предстательной железы).
1) Лейомиосаркома — чаще встречается у взрослых (40-70 лет), однако 20% лейомиосарком может встречаться в молодом возрасте.
Клинически: прогноз крайне неблагоприятный, часто и быстро метастазирует (чаще в легкие), рецидивирует. 5-летняя выживаемость составляет около 40%.
2) Рабдомиосаркома — встречается у детей, относится к эмбриональному подтипу опухолей, для подтверждения необходимо иммуногистохическое подтвреждение. отдаленные метастазы встречаются редко. Наиболее агрессивный тип – альвеолярная рабдомиосаркома.
Клинически: отдаленные метастазы встречаются редко, прогноз крайне неблагоприятный, 5-летняя выживаемость составляет 0-10%. После биопсии и получения такого гистоответа проводится интенсивная лучевая и химиотерапия.
Г. Лимфоэпителиальный рак.
II. Индекс Глисона
Гистологическая степень (индекс Глисона) — наиболее значимым предиктором прогрессирования РПЖ после биопсии и радикальной простатэктомии является сумма Глисона, определенная в препарате. Исследование индекса Глисона выполняется в случаях, если опухоль происходит из секреторных клеток. Сумма Глисона состоит из двух слагаемых: первичного (наиболее распространенного) и вторичного (второй по распространенности) показателей Глисона (Gleason grade). Если в препарате не выявляется вторичный показатель Глисона, то для получения сумы Глисона первичный показатель Глисона удваивается. Первичный и вторичный показатели Глисона должны указываться в скобках после указания суммы Глисона (например: сумма Глисона 7 (3 + 4)).
Табл. 1. Степени злокачественности по Глисону (Gleason grade) [ 10 ].
Grade 2 — одиночные железы, более тесно располагающиеся, менее единообразные
Grade 3 — одиночные железы различного размера и взаимоотношения, крибриформные и папиллярные структуры
Grade 4 — неправильные скопления желез и сливающиеся пласты эпителия, могут наблюдаться светлые клетки
Grade 5 — анапластический рак
Табл. 2. Группировка сумм Глисона по прогностическим категориям [ 11 ].
Низко дифференцированный РПЖ
Клинически: чем больше утрачена дифференцировка клеток, тем хуже прогноз у данного больного.
III. Экстрапростатическое распространение
1. Прорастание в семенные пузырьки — прорастание карциномы в мышечный слой семенных пузырьков. Распространение идет по трем путям:
- вверх по ходу семявыносящих протоков;
- через основание предстательной железы или прорастание из жировой ткани перипростатической зоны или жировой ткани семенных пузырьков;
- изолированный депозит в семенные пузырьки.
Клинически:
- значительное ухудшение прогноза и выживаемости больных;
- требует изменения стадирования по системе TNM.
2. Рост по лимфатическим сосудам.
Клинически:
- встречается более, чем в 1/3 случаев при радикальной простатэктомии;
- не взаимосвязано с обнаружением метастазов опухоли в лимфатические узлы.
3. Метастазы в лимфоузлы — последовательность поражения: подчревные, запирательные, наружные, подвздошные, крестцовые, общие подвздошные, парааортальные .
Клинически:
- чаще всего опухоль предстательной железы метастазирует в паховые лимфоузлы;
- плохой прогноз;
- для обнаружения микрометастазов требуется иммуногистохимическое исследование с использованием антител против ПСА.
4. Прорастание опухоли в хирургический край — показывает, что во время операции опухоль иссечена не полностью, операция не радикальная. Если хирургический край положительный, то в этой зоне нельзя исключить экстрапростатическую инвазию опухоли.
5. Периневральный рост опухоли — распространение опухоли по сосудисто-нервным пучкам в заднелатеральных узлах предстательной железы. Наблюдается в 75-84% случаев [ 4 ].
Клинически:
- может привести к более быстрой распространенности опухоли и прогрессированию опухоли после лучевой терапии и радикальной простатэктомии.
Авторы статьи надеются, что использование приведенных данных поможет урологам в их повседневной работе.
Литература
[1]. Филип М. Ханно, С. Брюс Малкович, Алан Дж. Вейн. Руководство по клинической урологии, МИА, Москва, 2006.
[2]. Мационис Э.А., Резникова Г. Л. Шишков А. В. «Клиническое значение обнаружения интраэпителиальной неоплазии предстательной железы», Материалы пленума правления Российского общества урологов, Омск, 1999, стр. 112-113.
[3]. Hamper U. M. et all., Penile metastasis from prostate cancer: diagnosis with sonography, Journal of ultrasound in medicine : official journal of the American Institute of Ultrasound in Medicine, 1997 Nov;16(11):751-3.
[4]. М. И. Коган, О. Б. Лоран, С. Б. Петров. Радикальная хирургия рака предстательной железы, Москва, Гэотар, 2006 г.
[5]. R. Montironi et all, Prostate cancer prevention: review of target populations, pathological biomarkers, and chemopreventive agents, Journal of clinical pathology, 1999 Nov;52(11):793-803.
[6]. А. С. Переверзев, М. И. Коган. Рак предстательной железы, 2004.
[7]. Медведев В.Л., Мационис А.Э., Медведева Л.А. Клиническое значение гистологических типов рака предстательной железы. Урология 2003;(6):10–14.
[8]. Little N. A., Wiener J. S., Paulson D. F., Squamous cell carcinoma of the prostate: 2 cases of a rare malignancy and review of the literature, The Journal of urology, 1993 Jan;149(1):137-9.
[9]. Copeland I. N., Amin M. B. et all., The morphologic spectrum of metastatic prostatic adenocarcinoma to the lung: special emphasis on histologic features overlapping with other pulmonary neoplasms// Am. J. Clin. Pathol.- 2002, Vol. 117, P. 552-557.
[10]. Srigley J.R., Amin M.B., Humphrey P.A. Updated protocol for the examination of specimens from patients with carcinomas of the prostate gland, Archives of pathology & laboratory medicine, 2006 Jul;130(7):936-46.
[11]. Bostwick D.G., Grignon D.J., Hammond E.H., Amin M.B., Cohen M., Crawford D., et al. Prognostic factors in prostate cancer. College of American Pathologists consensus statement 1999 // Arch. Pathol. Lab. Med.- 2000.- Vol. 124.- P. 995-1000.
[12]. Медведев В. Л., Мационис А. Э., Медведева Л. А. Гормонрезистентсный рак предстательной железы// Урология – 2001, №4, с 29-33.
[13]. WILLIAM G. NELSON, ANGELO M. DE MARZO, THEODORE L. DeWEESE и WILLIAM B. ISAACS. Материалы Journal Urology (Vol. 172, S6-S12, Ноябрь 2004) Американская урологическая ассоциация
[14]. Набебина Т.И. и др. Методика морфологического исследования препарата после радикальной простатэктомии. Международная научно-практическая конференция "Актуальные вопросы диагностики и лечения рака предстательной железы". г. Минск, Беларусь, 2006.
Читайте также:

