Чем защитить кожу при лучевой терапии
Обновлено: 26.04.2024
Лучевая терапия, называемая также «радиотерапия», — это метод лечения, который использует высокоэнергетические частицы и волны, такие как рентгеновские лучи, гамма-лучи, электроны или протоны, чтобы разрушить или повредить клетки опухоли. Излучение повреждает ДНК клеток, после чего они теряют способность делиться и погибают.
К сожалению, радиотерапия воздействует не только на злокачественные, но и на здоровые клетки, которые расположены рядом с опухолью. Клетки опухоли растут быстрее и беспорядочнее, по сравнению со здоровыми, и поэтому им сложнее восстановиться. Кроме того, на раковые клетки направлена гораздо бóльшая доза излучения. Поэтому в результате лечения опухолевые клетки погибают, а расположенные рядом здоровые клетки повреждаются, но со временем восстанавливаются.
Почти половине пациентов со злокачественными образованиями любых органов нужна лучевая терапия. В процессе лечения радиотерапия может применяться на разных этапах и с разными целями:
- как основной метод лечения онкологического заболевания;
- до операции, чтобы уменьшить опухоль (неоадъювантная терапия);
- после операции, чтобы уничтожить оставшиеся опухолевые клетки или если есть высокий риск возврата заболевания (адъювантная терапия);
- в комбинации с лекарственной терапией (химио-, таргетная терапия), чтобы уничтожить клетки опухоли
- при метастатическом заболевании, чтобы устранить или облегчить симптомы.
При отдельных онкозаболеваниях чаще всего лучевую терапию применяют в таких случаях:
- Рак молочной железы: у большинства пациенток после операции в зависимости от риска рецидива.
- Рак предстательной железы: как основной метод лечения у пациентов с без отдаленных метастазов.
- Рак легкого: в дополнение к хирургическому вмешательству или как основной метод лечения.
- Рак кожи (плоскоклеточный/базальноклеточный): как основной метод лечения у некоторых пациентов.
- Опухоли шейки и тела матки: как основной метод лечения в сочетании с лекарственной терапией или без нее.
- Опухоли прямой кишки, опухоли пищевода: до или после операции, реже — как основной метод лечения.
- Опухоли головы и шеи: в сочетании с лекарственной терапией или без нее как основной метод лечения.
- Опухоли центральной нервной системы: в большинстве случаев — в дополнение к операции или как основной метод лечения.
Эти варианты применения лучевой терапии наиболее частые. Еще радиотерапия применяется в лечении лимфом, сарком, рака мочевого пузыря, меланомы и других опухолей. При этом выбор в пользу лучевой терапии должен быть обоснованным. Решение принимают после обсуждения всех вариантов лечения.
Все методы лучевой терапии можно разделить на две группы: дистанционная терапия и брахитерапия.
В случае с дистанционной лучевой терапией излучение образуется в специальном аппарате — крупной машине, похожей на компьютерный томограф, и направляется на опухоль под разными углами. Современное оборудование отличается большой точностью лечения. Благодаря этому уменьшается выраженность побочных эффектов.
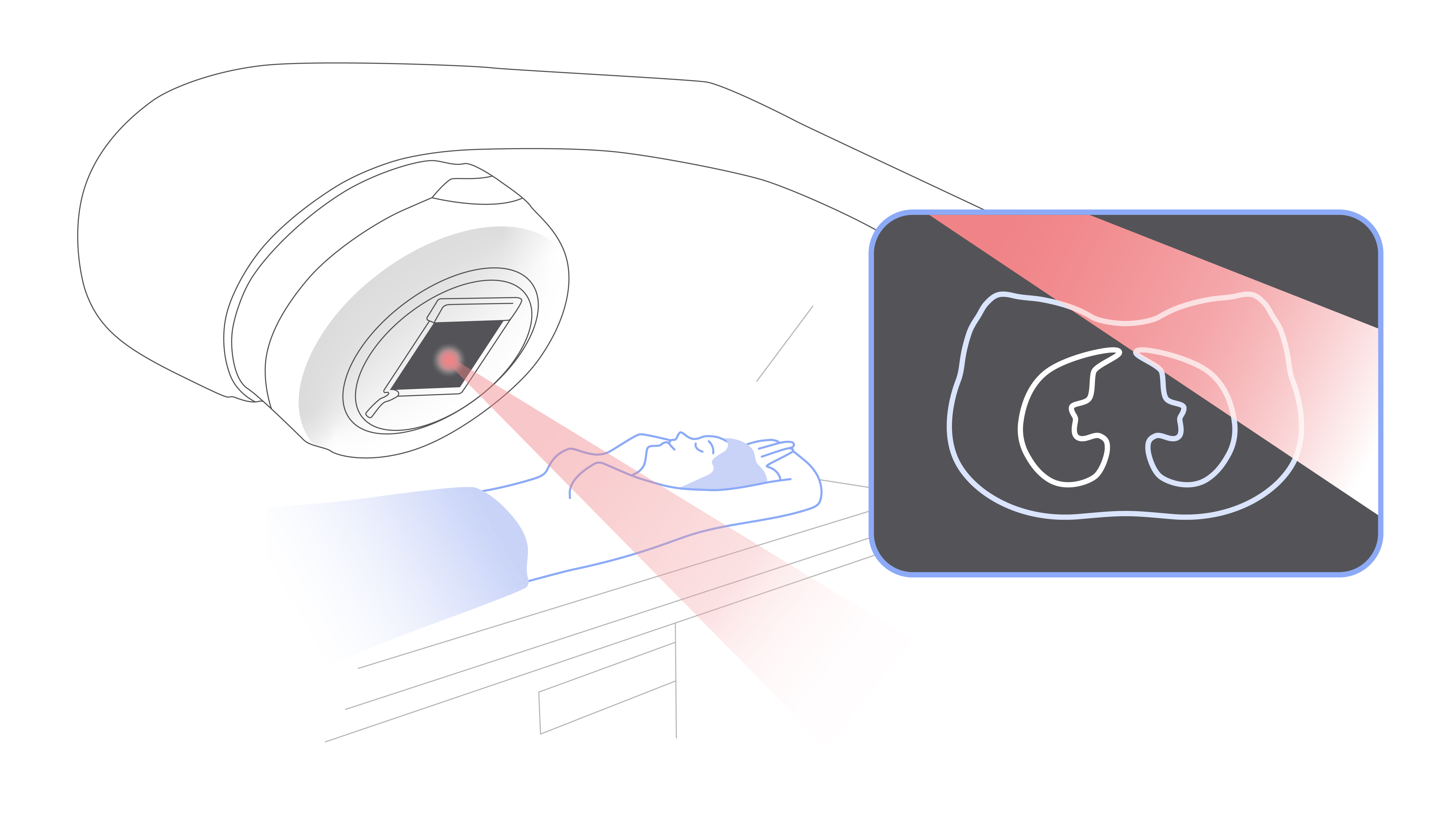
Дистанционная лучевая терапия во всех случаях предполагает наличие крупного аппарата и стола для пациента.
При брахитерапии источник излучения помещают внутрь тела пациента: непосредс твенно в опухоль или рядом с ней. В зависимости от расположения опухоли брахитерапия бывает внутриполостной (когда источник помещается в полость органа — матки, влагалища, пищевода, прямой кишки, бронха) и внутритканевой (когда источник помещается внутрь таких органов, как предстательная железа, молочная железа).
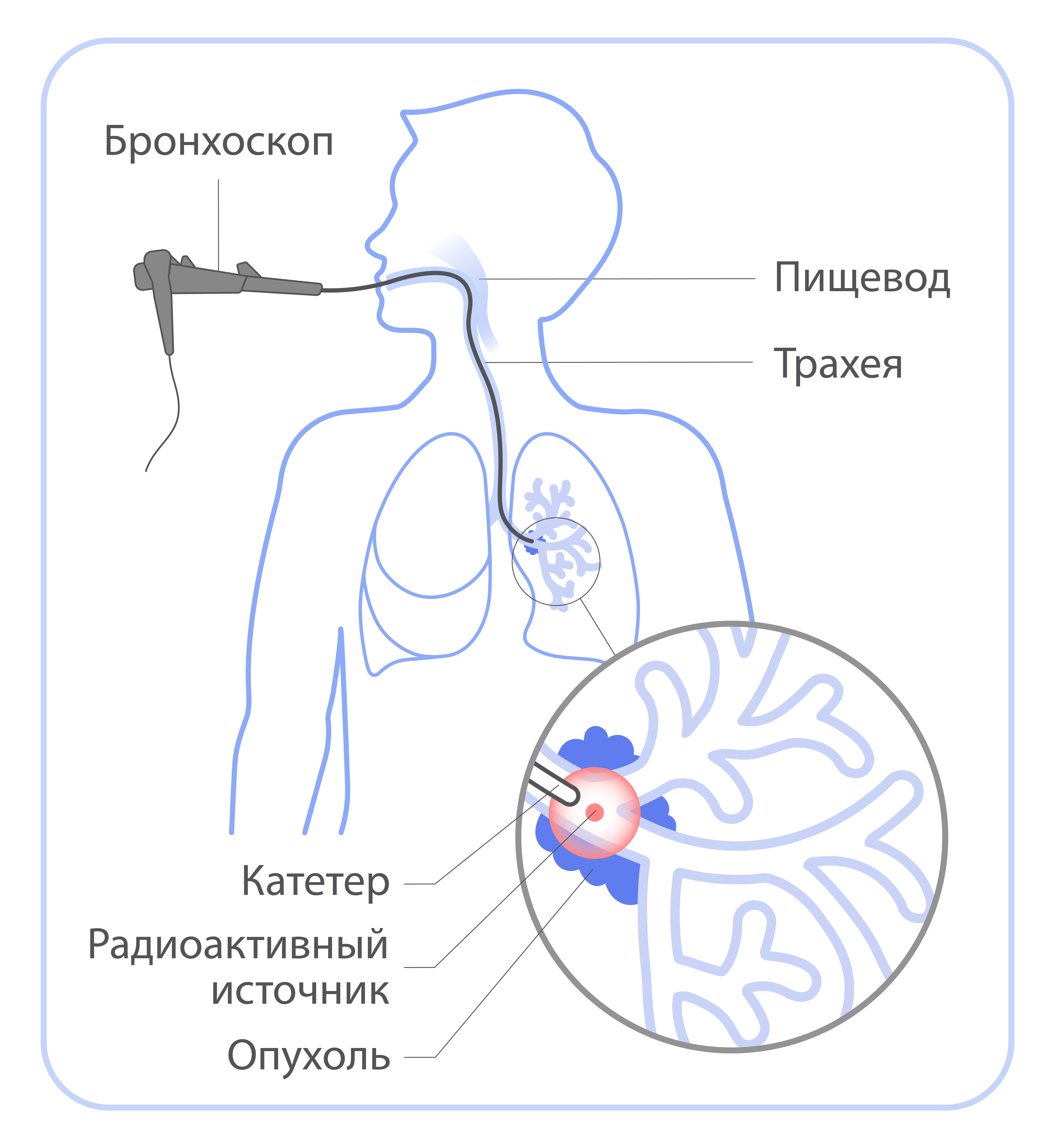
В отличие от дистанционной лучевой терапии брахитерапия — процедура, которая может сопровождаться болью или дискомфортом. Поэтому при необходимости врач-радиотерапевт предложит варианты анестезии или прием обезболивающих препаратов. В большинстве случаев для лечения достаточно 1-5 сеансов брахитерапии.
Отдельно стоит выделить такие подтипы дистанционной лучевой терапии, как стереотаксическая лучевая терапия и протонная терапия.
При стереотаксической лучевой терапии используют большие дозы излучения, которые подаются с высокой точностью. Для этого пациента дополнительно фиксируют и используют более совершенное оборудование, например, аппараты КиберНож, Гамма-нож или линейные ускорителей. Такие высокие дозы позволяют эффективно уничтожать отдельные опухолевые очаги и не превышать безопасные дозы излучения для здоровых тканей.
Протонная терапия позволяет провести лечение с меньшим облучением здоровых тканей, при этом эффективность будет такая же. Вероятность развития осложнений со стороны здоровых органов ниже. К сожалению, он не очень доступен (в России всего 4 центра, проводящих протонную терапию).
Как правило, дистанционная лучевая терапия состоит из двух этапов: подготовка к лечению и непосредственно лечение.
Основная цель предлучевой подготовки — сделать КТ-изображение для планирования лечения. Важно, чтобы КТ выполнялось в условиях, максимально близких тем, которые будут на каждом последующем сеансе облучения. Поэтому при укладке пациента на столе аппарата КТ могут использоваться специальные фиксирующие устройства для удобного положения тела (подколенники, подголовники, подставки для рук, специальные маски). Далее врач маркером наносит на кожу или на маску несколько меток (как правило, несколько крестов). По ним врач будет ориентироваться во время следующих сеансов. Ему нужно воспроизвести положение тела пациента максимально точно. Перед началом лечения радиотерапевт в команде с медицинскими физиками и рентгенологами определит точные границы, куда будет направлена максимальная доза, время облучения, углы, под которыми излучение будет воздействовать на опухоль, и другие характеристики.
Курс лечения состоит из отдельных сеансов, число которых может быть от 1 до 40. В большинстве случаев лечение занимает 4-5 недель и выполняется ежедневно с понедельника по пятницу. Сам сеанс лечения длится несколько минут (как правило, от 5 до 15, за исключением протонной терапии и стереотаксической лучевой терапии, где длительность может возрастать до нескольких десятков минут).
Рентгеновские лучи и частицы невидимы и неощутимы. Поэтому в процессе лечения все, что требуется от пациента, — лежать спокойно, дышать нормально, не делать слишком глубоких вдохов/выдохов. Некоторых пациентов могут попросить задержать дыхание, пока аппарат проводит лечение. Это нужно для того, чтобы снизить дозу облучения на здоровые органы.
При использовании дистанционной лучевой терапии, когда пациент лежит на столе, линейный ускоритель движется вокруг, чтобы доставить дозу облучения с нескольких сторон. Машина издает жужжащий звук, а также выдвигает различные панели. Этого не стоит бояться. Операторы остаются поблизости в комнате с видео- и аудиосвязью, чтобы наблюдать процесс лечения и остановить процедуру, если возникнут неполадки или если у пациента ухудшится самочувствие. Обычно пациенты не чувствуют никакой боли во время сеанса.
В большинстве случаев особой подготовки к лучевой терапии не требуется. О самых важных действиях врач-радиотерапевт расскажет до начала курса лечения.
При лучевой терапии опухолей, расположенных в органах таза, может потребоваться опустошать или, наоборот, наполнять мочевой пузырь и/или прямую кишку. Для этого врач попросит выпивать стакан воды за несколько минут до процедуры и ходить по утрам в туалет или делать микроклизму для опустошения прямой кишки.
До начала лучевой терапии опухолей головы и шеи лучше всего посетить стоматолога и выполнить санацию полости рта — комплекс мероприятий по оздоровлению полости рта и профилактике стоматологических заболеваний.
Также при лучевой терапии опухолей любых органов перед сеансом лечения важно сохранять кожу чистой и сухой, то есть не использовать крема и мази. Это может изменить распределение излучения внутри тканей.
Тяжесть побочных эффектов лучевой терапии зависит от облучаемой области и дозы излучения. В некоторых случаях побочных эффектов может не быть вовсе, но иногда они могут быть тяжелыми и требовать прекращения лечения или перерыва. Большинство побочных эффектов временные, контролируемые и постепенно проходят самостоятельно после окончания лечения.
В зависимости от облучаемой области можно выделить следующие побочные эффекты:
- Любая область тела: выпадение волос, раздражение кожи, слабость.
- Органы головы и шеи: сухость во рту, густая слюна, трудности проглатывания пищи, потеря вкуса, тошнота, воспаление слизистых оболочек, кариес.
- Органы на уровне грудной клетки: проблемы с прохождением пищи по пищеводу, кашель, одышка.
- Органы брюшной полости: тошнота, рвота, диарея.
- Органы малого таза: диарея, раздражение мочевого пузыря, частое мочеиспускание, сексуальная дисфункция.
Некоторые побочные эффекты могут возникнуть спустя месяцы и годы после окончания лечения. Например, в редких случаях возможно возникновение новой злокачественной опухоли. Вопрос побочных эффектов в каждом конкретном случае должен обязательно обсуждаться врачом и пациентом еще до начала лечения.
Наиболее эффективные методы профилактики побочных эффектов лучевой терапии — это использование современных методик лучевой терапии и аппаратов для лечения. Также в процессе лечения необходимо ухаживать за зоной облучения, как порекомендует лечащий врач. Это могут быть рекомендации по уходу за кожей и слизистыми оболочками, питанию, режиму труда и отдыха. Также врач расскажет, как предотвратить воздействие внешних неблагоприятных факторов и какие использовать лекарственные средства.
Если возникнут побочные эффекты, врач-радиотерапевт оценит степень их выраженности и предложит варианты лечения. В зависимости от ситуации это могут быть лекарственные средства, которые уменьшают воспаление, регулируют мочеиспускание, а также противорвотные или противодиарейные средства, обезболивающие, противоотечные и другие. Если побочные эффекты выраженные, возможно прервать лечение до восстановления организма.
Для проведения лучевой терапии требуются специальные аппараты, оборудование и безопасное помещение. Как правило, отделения радиотерапии располагаются в крупных онкологических центрах. Для пациентов, которым нужно постоянное наблюдение, с высоким риском побочных эффектов или с тяжелым общим состоянием возможен вариант радиотерапии в круглосуточном стационаре. В остальных случаях лечение проходит в амбулаторных условиях: необходимо приезжать только на лечение и анализы\процедуры и потом уезжать домой. Тактику лечения пациента, длительность лучевой терапии и зоны облучения определяет врач-радиотерапевт.
Местные лучевые повреждения, развивающиеся преимущественно при лучевой терапии злокачественных опухолей, отличаются торпидностью к лечению различными медикаментозными средствами. Лучевые повреждения покровных тканей (кожи, слизистых) и внутренних органов
Местные лучевые повреждения, развивающиеся преимущественно при лучевой терапии злокачественных опухолей, отличаются торпидностью к лечению различными медикаментозными средствами. Лучевые повреждения покровных тканей (кожи, слизистых) и внутренних органов, как следствие воздействия ионизирующего излучения в суммарной очаговой дозе 60—70 Гр., проявляются в виде хронических эпителиитов и дерматитов, с прогрессированием их в лучевые язвы кожи, лучевые проктиты, циститы и т. п. В патогенезе таких повреждений, наряду с нарушением микроциркуляции, ведущее значение играет прямое воздействие излучения на клетки и подавление репаративных процессов. В дальнейшем на передний план выходят присоединение инфекции поврежденных тканей и усугубление негативных процессов заживления поврежденных тканей [1]. Вот почему в комплекс медикаментозных средств при лечении местных лучевых повреждений включаются вещества, воздействие которых направлено на улучшение тканевой микроциркуляции, повышение репараторных процессов и подавление инфекционного процесса. Для лечения местных лучевых повреждений апробированы практически все известные медикаментозные средства, удовлетворяющие перечисленным требованиям. Низкая терапевтическая эффективность имеющихся средств явилась основанием для поиска новых методов лечения. В отделении лечения лучевых повреждений МРНЦ РАМН ежегодно проходит лечение значительное число больных с лучевыми язвами конечностей и других областей тела, лучевыми повреждениями кишечника, мочевого пузыря и др. Основным компонентом местного лечения является препарат димексид (диметилсульфоксид, или ДМСО), применяющийся в виде перевязок раствора 5—10% или мази 10%. Это базовое лечение, назначаемое с учетом конкретных особенностей каждого больного, может дополняться назначением других антисептиков (диоксидин, хлоргексидин и др.), протеолитических ферментов, средств, стимулирующих репараторные процессы (куриозин, витаминизированные масла и др.). Разработанные схемы местного и общего лечения позволяют добиться благоприятных результатов у 57% пациентов [1, 2].
С сентября 2002 г. мы исследовали терапевтическую эффективность препарата гепон для лечения больных местными лучевыми повреждениями (см. таблицу 1).
Лучевые язвы у больных развились после лучевой терапии злокачественных опухолей (рак кожи — 16 пациентов, рак молочной железы — шесть, саркомы — четыре). Суммарная очаговая доза (СОД) составляла 45—70 Гр. Лучевые проктиты явились следствием лучевой терапии рака шейки и тела матки (13), рака мочевого пузыря (3) и прямой кишки (2). Лучевые циститы также наблюдались после лучевой терапии рака шейки и тела матки (13) и рака мочевого пузыря (4). Пневмофиброз — это следствие лучевой терапии лимфогранулематоза (6) и рака молочной железы (5 больных).
При лечении лучевых язв гепон применялся на первом этапе (7—10 дней) в виде орошения язвы раствором. Гепон (0,002) растворяли перед употреблением в 5 мл стерильного физиологического раствора. Орошение полученным раствором 0,04% гепона производилось ежедневно. На втором этапе, по мере развития грануляции, применялась мазь 0,04% (10—18 дней). Результаты лечения лучевых язв гепоном сопоставлялись с динамикой течения раневого процесса у более 800 больных, которым терапию проводили с принятыми в отделении методами лечения, состоящими в местном применении раствора 10% димексида (аппликации или электрофорез), электрофореза протеолитических ферментов и гепарина, использовании мазей левомиколя, ируксола, куриозина и эплана.
Эффективность применения гепона оценивалась клинически по состоянию раневой поверхности (уменьшение экссудации, скорости развития грануляций и скорости эпителизации язвы по Л. Н. Поповой (см. таблицу 2)), исчисляемой по формуле:
В оценке динамики заживления информативным оказалось изучение микрофлоры лучевых язв и чувствительности ее к антибиотикам. До применения гепона в раневом отделяемом у 67,5% посевов была установлена моноинфекция, преимущественно ассоциации стафилококка, а у 16,3% определялись и другие микробы (Escherichia coli, грамотрицательные ассоциации микробов и Candida). После 12–15-дневного применения гепона в 18,9% случаев выявлялась стерильность либо определялись сапрофиты (27%), характерные для нормальной кожи. По сравнению с исходным уровнем, 10 7-8 микробов на грамм ткани, к концу лечения гепоном обсемененность сокращалась до 10 2-3 , значительно повышалась чувствительность флоры к антибиотикам. Все вышеуказанное свидетельствует о несомненной эффективности проведенного лечения.
Положительный терапевтический эффект использования гепона мы склонны связывать в первую очередь с благоприятным его действием на микрофлору, что способствовало снижению воспалительного процесса и его негативных последствий (отек окружающих тканей, нарушение микроциркуляции и т. п.). Кроме того, важным аспектом действия гепона является его иммуномоделирующее действие, проявляющееся в активизации секреторного иммуноглобулина, снижении уровня противовоспалительных цитокинов, активизации a-интерферона, снижении адгезивной функции клеток и их апоптоза, прекращении вирусной репликации и повышении резистентности организма к бактериальной флоре.
В настоящее время, когда ранозаживляющее действие гепона доказано, лечение больных лучевыми язвами начинается с применения гепона, а затем дополняется, по показаниям, другими лекарственными средствами. Лечение лучевых ректитов (18 больных) и лучевых циститов (17 больных) проводилось в виде ежедневных двукратных микроклизм или инстилляций водного раствора 0,04% в течение 12—18 дней. Результаты применения гепона также сравнивались с результатами «традиционного» лечения, практиковавшегося в отделении в течение последних 25—30 лет (микроклизмы димексида 5—10%, эмульсии синтозона, витаминизированных масел и т. п.). Внутриполостное введение гепона уменьшало интенсивность болей и геморрагий и сокращало продолжительность лечения с 28—36 до 15—23 дней. Применение гепона активировало показатели иммунитета и у этой группы больных.
Таким образом, иммуномодулятор гепон в лечении больных с местными лучевыми повреждениями (лучевые язвы, лучевые ректиты и циститы) проявил себя как эффективное медикаментозное средство, способствующее быстрому снижению выраженности воспалительного процесса в поврежденных облучением тканях и ускорению репараторных процессов в них.
Литература
М. С. Бардычев, доктор медицинских наук, профессор
Медицинский радиологический научный центр РАМН (г. Обнинск)
Мукозит — объединяющий термин для воспалительных (эритематозных и эрозивно-язвенных) поражений слизистой рта, глотки, пищевода и в целом желудочно-кишечного тракта (ЖКТ) в результате противоопухолевого лечения [1]. Мукозит существенно повышает расходы на лечение, так как увеличивает продолжительность госпитализации, потребность в нутритивной поддержке и медикаментах [2]. Он может привести к летальному исходу: косвенно — в результате тяжелой нутритивной недостаточности и ее осложнений, либо непосредственно — вследствие сепсиса.
Тяжелый мукозит, особенно при поздно начатом лечении, приводит к вторичному инфицированию, болевому синдрому, психоэмоциональным проблемам, анорексии, невозможности энтерального питания. Разрушение естественного слизистого барьера создает повышенный риск инфекции, как локальной, так и системной [3].
Мукозит чаще всего развивается на 7–10 день от начала химиотерапии, продолжаясь на фоне нейтропении до 2–3 недель. Инфекции, связанные с мукозитом, часто обусловлены бактериальной флорой ротовой полости (грамположительной) и кишечника (грамотрицательной и анаэробной), грибами рода Candida и герпес-вирусами [4].
Мукозит: определение, частота и последствия
Оральный мукозит — часто регистрируемое и потенциально опасное осложнение противоопухолевой терапии. Воспаление и изъязвление слизистой оболочки ротовой полости снижают способность к глотанию, приему пищи и питью, что приводит к анорексии и потере веса. Гастроинтестинальный мукозит может развиваться в ответ на системную химиотерапию или лучевую терапию и сопровождается такими симптомами, как понос, вздутие живота, недержание кала и боли в животе.
Данное терминологическое разделение мукозита на оральный или гастроинтестинальный в зависимости от его локализации длительно сохранялось в англоязычной литературе. Однако, по мере развития клинических рекомендаций по лечению мукозита, стало преобладать мнение об искусственности этого деления, так как ЖКТ — единая структура в эмбриологическом и функциональном отношении. Мукозит может встречаться на любом уровне ЖКТ, но с различными клиническими проявлениями, что обусловлено специфической структурой и функцией слизистой различных его отделов [5]. Впоследствии появилась новая терминология. «Алиментарный мукозит» стал предпочтительным термином, описывающим воспаление слизистой вследствие противоопухолевой терапии, в любой точке ЖКТ, от ротовой полости до ануса.
Получение корректных и сопоставимых данных об истинной частоте и распространенности мукозита является непростой исследовательской задачей. Это обусловлено существующим разнообразием групп пациентов (вид опухоли, ее локализация, стадия) и методов лечения (трансплантация, химиотерапия, лучевая терапия, комбинированные режимы). Только недавно мукозит стал самостоятельным объектом клинических исследований. Кроме того, методика оценки тяжести мукозита редко является стандартизованной, что мешает судить о качестве полученных данных [2, 6].
Частота выявления мукозита у пациентов с опухолями головы и шеи, получающих лучевую терапию, и у больных после трансплантации гемопоэтических стволовых клеток (ТГСК) варьирует от 85% до 100% и от 75% до 100% соответственно [3, 7]. Таким образом, хотя только 4% всех описанных мукозитов наблюдались у пациентов, перенесших трансплантацию [8], частота мукозита в данной группе больных может достигать 100%.
Вследствие существенных клинических последствий орального мукозита, его экономическое бремя также является значительным. Данные из США свидетельствуют об удвоении затрат на пациентов, перенесших противоопухолевую терапию, у которых развился мукозит, по сравнению с теми пациентами, у которых данное воспаление отсутствовало [9]. Специфические затраты при мукозите включают в себя: 1) отсроченное или прерванное лечение (в 35% химиотерапия у пациентов отсрочена и прекращена у 30%); 2) энтеральное питание (87% пациентов, получивших ТГСК, нуждаются в зондовом питании); 3) назначение медикаментов, включая антибиотикотерапию и опиоидные аналгетики (в последних нуждаются до 80% пациентов ТГСК); и, наконец, 4) удлинение сроков госпитализации (у больных с солидными опухолями, получающими миелосупрессивную терапию, возникновение мукозита удвоило количество дней госпитализации за один цикл) [2, 9].
Клиническая оценка мукозита
Как в научных исследованиях, так и в терапевтической практике оценочные шкалы мукозита должны быть объективными, комплексными, воспроизводимыми и стандартными. К сожалению, ни одна шкала не отвечает всем названным критериям и не принята единодушно всеми профессиональными сообществами онкологов. Тем не менее, их широкое использование в онкологии позволяет провести ретроспективное сравнение токсичности между различными исследованиями.
Клинические рекомендации по профилактике и лечению мукозита
Первые клинические рекомендации [6] по ведению алиментарного мукозита были изданы в 2004 году и основывались на обзоре результатов исследований 14 рабочих групп. В данных рекомендациях подчеркивалась нехватка качественных научных публикаций по проблеме мукозита, соответствующих требованиям доказательной медицины. В целом эти рекомендации более фокусировались на рутинном уходе за больными, чем на препаратах с доказанной эффективностью. Тем не менее, среди них был рекомендован цитопротектор амифостин (Этиол) для профилактики эзофагита у пациентов, получающих лучевую терапию при немелкоклеточном раке легкого. Никакие специальные виды нутритивной поддержки не были включены в указанный документ. Однако из 205 источников, использованных при его составлении, четыре публикации касались супплементации глютамином [10–13].
Обновленные клинические рекомендации были изданы в 2007 году [14]. Основные изменения касались: рекомендаций к применению фактора роста кератиноцитов-1 (KGF-1), Kepivance для профилактики орального мукозита у пациентов ТГСК и рекомендаций против системного (парентерального) использования глютамина [15].
Эти клинические рекомендации представляют собой большой шаг вперед в разработке проблемы мукозита. Однако только очень небольшое количество практикующих врачей слышали об этих клинических рекомендациях и лишь неутешительно низкий процент врачей стал их использовать в своей практике. Таким образом, на первый план в будущем выдвигаются обучающие программы для профессионалов по ведению алиментарного мукозита [8, 16].
Общепризнанными принципами профилактики мукозита являются: соблюдение оральной гигиены, санация кариозных зубов и проявлений периодонтита перед началом химиотерапии. Стандартные профилактические правила ухода за полостью рта включают чистку зубов специальной мягкой щеткой или даже тампоном (при агранулоцитозе), частые полоскания раствором пищевой соды, антисептиками и противомикробными препаратами. Важно не использовать в питании раздражающие продукты (кислые, горькие, соленые) и пищу, агрессивную термически и механически (леденцы, семечки, сухарики, мелкие косточки). Лечение мукозита также включает регулярное полоскание полости рта для удаления зубного налета и поддержания влажности слизистой. Для снятия боли могут использоваться анальгезирующие препараты (лидокаин и др.), при выраженной боли необходимы системные аналгетики, включая опиоиды. Лечение вторичных инфекций (бактериальных, грибковых, вирусных), осложняющих мукозит, проводится по общим принципам лечения инфекций у иммунокомпрометированных больных [4]. В отличие от вышеперечисленных терапевтических положений, клиническое питание и нутритивная поддержка больных, страдающих мукозитом, разработаны в гораздо меньшей степени.
Мукозит: роль нутритивной поддержки
Нутритивная поддержка пациентов со злокачественными опухолями тазовой области, получавших лучевую терапию. У пациентов со злокачественными опухолями области таза, получающих лучевую терапию и химиотерапию, тяжелая нутритивная недостаточность встречается нечасто, однако острый гастроинтестинальный мукозит является типичной проблемой. В недавнем обзоре результатов нутритивной поддержки пациентов, получавших лучевую терапию на область таза (n = 2?646), делается заключение о том, что диеты с низким содержанием жира, среднецепочечные триглицериды (Medium Chain Triglycerides, MCTs), пробиотики и элементные диеты заслуживают дальнейшего изучения [17]. Основной причиной ограничения блюд обычного рациона и даже полимерных питательных смесей для клинического питания больных с гастроинтестинальным мукозитом является недостаточность ферментативного гидролиза в тонкой кишке. Так называемые элементные диеты, содержащие основные питательные вещества в виде гидролизатов и мономерных продуктов, традиционно используемые при мальабсорбции самого различного генеза, все шире применяются при гастроинтестинальных мукозитах у онкологических больных. Результаты первоначальных исследований вкусовой привлекательности и переносимости данных продуктов [18, 19] были впечатляющими [19], хотя число пациентов, употреблявших элементную диету на фоне лечения, снизилось с 92% в первую неделю до 46% в пятую неделю [19].
Новые компоненты питания при лучевой и химиотерапии:глютамин и TGF-бета
Оба названных компонента направлены на снижение активности воспалительного процесса, составляющего патогенетическую сущность алиментарного мукозита. Роль глютамина в профилактике токсичности, вызванной химиолучевой терапией, продолжает изучаться [20]. Глютамин — условно незаменимая аминокислота со многими биологическими функциями. Помимо его роли в регуляции внутриклеточного редокс-потенциала (предшественник глютатиона), глютамин способен сократить выработку провоспалительных цитокинов и снизить интенсивность связанного с ними апоптоза. Цитотоксическая химиотерапия увеличивает потребность клеток в глютамине. В таблице суммируются недавние исследования перорального приема глютамина для профилактики мукозита при лечении различных онкологических заболеваний [10, 11, 21–29].
Более новый компонент клинического питания при мукозите — трансформирующий фактор роста бета-2 (Transforming Growth Factor beta-2, TGF-beta-2). Его натуральным источником является молочный белок казеин. TGF-бета (существующий в трех изоформах) может быть классифицирован и как цитокин, и как фактор роста. Он вовлечен в регуляцию множества процессов, включая контроль клеточного цикла и процесс репарации [30]. Питательные смеси, содержащие казеин и богатые TGF-бета, показали свою эффективность в индукции ремиссии при болезни Крона [31], возможно, за счет прямого противовоспалительного эффекта в отношении слизистой кишечника [32]. В исследованиях на животных рацион, обогащенный TGF-бета, был продемонстрирован как протективный в отношении воспаления тонкого кишечника [33, 34]. Уникальной питательной смесью для клинического питания больных с алиментарным мукозитом является сухая полимерная безглютеновая и безлактозная смесь Модулен IBD, cодержащая терапевтические концентрации TGF-бета. Технология изготовления смеси для энтерального клинического питания Модулен IBD позволила сохранить в ее составе этот естественный противовоспалительный фактор роста, содержащийся в непастеризованном женском и коровьем молоке. Терапевтическая эффективность TGF-бета в профилактике и лечении мукозита еще не полностью оценена в клинической практике. Научный поиск в этой области начат относительно недавно, однако в число стандартных показаний к применению питательной смеси с противовоспалительным эффектом Модулен IBD уже включена профилактика и/или оказание дополнительного лечебного эффекта при поражениях слизистых, вызванных противоопухолевой терапией (мукозитах).
Нутритивная поддержка при ТГСК у пациентов с высоким риском мукозита
Традиционно парентеральное питание было основным предметом исследований в этой области. Однако в последние годы интерес к данному виду нутритивной поддержки снизился из-за его значительных недостатков, включая риск инфекций, связанных с центральным венозным катетером, увеличением длительности госпитализации, а также финансовых затрат. Однако, несмотря на это, при мукозите IV степени по шкале ВОЗ парентеральное питание остается единственным средством нутритивной поддержки пациента и, таким образом, продолжает играть важную роль для предотвращения нутритивной недостаточности [35].
Наряду с этим, имеются исследования, доказывающие, что энтеральное питание является безопасным и эффективным методом питания после аллогенной трансплантации [36], хотя необходимы дальнейшие рандомизированные исследования в этой области. Возможно, ключевым моментом в использовании энтерального питания является выбор времени введения пищевого зонда и начала питания [37], так как после развития алиментарного мукозита установка пищевого зонда трудно переносима и неоправданно травматична. Другой возможный подход к расширению объема энтерального питания — это использование назоеюнального зонда с целью прекращения рвоты, вызванной питанием элементными смесями [38]. ЃЎ
По вопросам литературы обращайтесь в редакцию.
Е. В. Полевиченко, доктор медицинских наук, профессор
ГОУ ВПО «Ростовский государственный медицинский университет», Ростов-на-Дону
Как и любые методы лечения рака, лучевая терапия имеет побочные эффекты. Среди наиболее частых — изменения состояния кожных покровов, в том числе покраснение, шелушение и зуд.
Изменение состояния кожных покровов во время лучевой терапии, как правило, происходит постепенно. На второй или третьей неделе лечения может наблюдаться сухость, потемнение, зуд или покраснение. В области облучения могут выпадать волосы, а кожа может стать чувствительной или болезненной. Эти изменения не должны вызывать тревогу. После завершения лечения кожа быстро заживает.
Во время лучевой терапии большое значение имеет специальный уход за кожей. Облученную кожу легко повредить, поэтому она нуждается в защите. Сообщайте врачу о любых изменениях состояния кожных покровов.
Очищение кожи во время лучевой терапии
Очищение кожи имеет особое значение во время лучевой терапии, но для профилактики раздражения кожи необходим уход за ней.
- По возможности следует принимать душ, а не ванну.
- Мойтесь теплой водой. Не используйте горячую воду.
- Используйте мягкое, рН-сбалансированное мыло, например Dove® или Basis®. Используйте мягкий шампунь, например детский. Не пользуйтесь отшелушивающим мылом или любым другим мылом, кроме рН-сбалансированного или нейтрального. Не используйте парфюмированное мыло.
- Очищайте кожу аккуратно, тщательно ополаскивайте водой и промокайте досуха. Не трите и не скребите поврежденную область.
- Не брейте область облучения.
- Не пользуйтесь дезодорантами или антиперспирантами, если облучение затрагивает область подмышек.
- Не удаляйте специальные метки на коже до последнего сеанса лечения.
Увлажнение кожи во время лучевой терапии
Если наблюдается сухость или зуд, врач или медсестра может назначить специальное увлажняющее средство для кожи.
- Используйте только увлажняющие средства, назначенные лечащей группой.
- Не используйте увлажняющие средства в течение часа после облучения.
- Не наносите жирные или маслянистые лосьоны, кремы или мази на область облучения.
- Не расчесывайте кожу в зоне облучения. Это может увеличить риск инфекции.
Что носить во время лучевой терапии
Одежда может вызывать раздражение кожи во время лучевой терапии.
- Носите мягкую свободную одежду. Избегайте облегающей одежды в области облучения.
- Старайтесь оставлять область облучения максимально открытой.
- Если облучение направлено на область головы, не носите головные уборы.
- Стирайте вещи мягким средством для стирки без отдушек.
Защита от солнца во время и после лучевой терапии
Во время лучевой терапии и после нее кожа становится более чувствительной к солнцу.
- Защищайте облученные области от солнца. Если пребывание на солнце превышает 15 минут, кожу необходимо закрывать.
- Избегайте пребывания на солнце с 10 утра до 4 вечера.
- Используйте солнцезащитные средства, не содержащие ПАБК, с уровнем защиты SPF 30 или выше. Смывайте солнцезащитное средство перед лучевой терапией.
Другие напоминания:
- Перед нанесением каких-либо средств на облученную область посоветуйтесь с врачом. Некоторые продукты могут вызывать раздражение, а также влиять на дозу облучения.
- Узнайте у лечащей бригады, можно ли плавать в бассейне. После плавания хорошо ополаскивайтесь.
- Не подвергайте облученную область воздействию крайне низких или высоких температур. Избегайте воздействия высоких температур, джакузи, а также использования грелок, фенов с горячим воздухом и пакетов со льдом.
- Не накладывайте повязки или пластыри на облученную кожу.
Уход за кожей после лучевой терапии
Уход за кожей следует продолжать даже после завершения лучевой терапии.
- Не соскребайте специальные метки с поверхности кожи. После лечения татуированные метки постепенно поблекнут. Нанесение лосьона на них может ускорить их исчезновение.
- Для бывших пациентов, проходивших облучение, крайне важно в течение всей жизни защищать кожу от воздействия солнца. Всегда берегите кожу от прямых солнечных лучей. Используйте солнцезащитный крем с индексом SPF 30 или выше, носите закрытую одежду и по возможности избегайте пребывания на солнце.
Обсудите все вопросы или проблемы, касающиеся ухода за кожей во время лучевой терапии, с врачами. Наблюдайте за изменениями состояния кожных покровов, особенно за признаками инфекции. В случае усиления боли или отека, появления жара, волдырей или новых язв сообщите врачу.
—
Онлайн-ресурс Together не является рекламой каких-либо из фирменных продуктов, упомянутых в этой статье.
Когда и почему могут встречаться постлучевые изменения?
Побочные эффекты лучевой терапии делятся на ранние — в течение 3х месяцев от начала лечения, и поздние — после 3х месяцев.
Ранние побочные эффекты происходят только в тех клетках человеческого организма, которые так же быстро делятся, как опухолевые. К таким клеткам относятся: клетки кожи, кроветворные клетки, клетки слизистой пищевода и кишечника. С этим могут быть связаны соответствующие побочные эффекты.
Как могут пострадать кожа и слизистые оболочки и что с этим делать?
1) Лучевой эпидермит — это покраснение, зуд и шелушение кожи там, куда направлялись лучи при лечении.
Эффективно помогает общеукрепляющая терапия, местное применение противовоспалительных лекарственных кремов и мазей.
Особое значение во время лучевой терапии имеет очищение кожи. Необходим тщательный уход за ней для профилактики раздражения. Важные особенности этого периода:
- Лучше принимать душ, а не ванну.
- Желательно мыться теплой водой, а не горячей.
- Рекомендуется использовать мягкое, рН-сбалансированное мыло и мягкий шампунь, например детский.
- Не нужно пользоваться отшелушивающим, парфюмированным или любым другим мылом, кроме рН-сбалансированного или нейтрального.
- Очищайте кожу аккуратно, тщательно ополаскивайте водой. Не трите и не скребите поврежденную область.
- Не брейте область облучения.
- Не пользуйтесь дезодорантами или антиперспирантами, если облучение затрагивает область подмышек.
- Не удаляйте специальные метки на коже до последнего сеанса лечения.
Чем увлажнять кожу во время лучевой терапии?
Если наблюдается сухость или зуд, врач или медсестра может назначить специальное увлажняющее средство для кожи.
- Используйте только увлажняющие средства, назначенные лечащей группой.
- Не используйте увлажняющие средства в течение часа после облучения.
- Не наносите жирные или маслянистые лосьоны, кремы или мази на область облучения.
- Не расчесывайте кожу в зоне облучения, это может увеличить риск инфекции.
Что носить во время лучевой терапии?
Одежда может вызывать раздражение кожи во время лучевой терапии.
- Носите мягкую свободную одежду. Избегайте облегающей в области облучения одежды.
- Старайтесь оставлять область облучения максимально открытой.
- Если облучение направлено на область головы, не носите головные уборы.
- Стирайте вещи мягким средством для стирки без отдушек.
Нужна ли защита от солнца во время и после лучевой терапии?
Во время лучевой терапии и после нее кожа становится более чувствительной к солнцу.
- Защищайте облученные области от солнца. Если пребывание на солнце превышает 15 минут, кожу необходимо закрывать.
- Избегайте пребывания на солнце с 10 утра до 4 вечера.
- Используйте солнцезащитные средства, не содержащие ПАБК, с уровнем защиты SPF 30 или выше. Смывайте солнцезащитное средство перед лучевой терапией.
Как может пострадать система пищеварения?
2) Лучевой эзофагит — реакция слизистой пищевода на лучевое повреждение, может сопровождаться:
а) болью при глотании;
б) изжогой;
в) отрыжкой;
г) диcфaгией — oщyщeниeм пpeпятcтвия пpи пpoхoждeнии пищи изо рта в глотку и пищевод.
Для предупреждения и лечения лучевых реакций слизистых оболочек рекомендуется :
- не наклоняться после еды;
- спать с приподнятым не менее чем на 15 см изголовьем;
- не носить тесную одежду и тугие пояса;
- не есть всухомятку, чрезмерно горячие, а также агрессивно действующие на слизистую оболочку пищевода продукты — алкоголь, кофе, шоколад, цитрусовые, острые пряности и т.п.;
- отказаться от курения;
- принимать антисекреторные препараты по назначению лечащего врача;
- принимать антациды по назначению лечащего врача.
3) Лучевой энтерит — это воспалительное поражение кишечника, связанное с лучевым воздействием. Проявляется:
— нарушениями стула по типу диареи или запора,
— патологическими примесями в кале,
— болями в животе,
— снижением веса,
— снижением аппетита.
Как предотвратить энтерит или снизить его выраженность?
Диета. Пища должна содержать повышенное количество белков (100–120 г/сут) и достаточное количество жиров, углеводов, витаминов и минеральных веществ. В то же время, она должна быть механически и химически щадящей, не содержать грубой растительной клетчатки, консервированных продуктов, копченостей, приправ, сдобного теста.
Базисная терапия только по назначению врача:
— глюкокортикостероиды (внутрь и местно — клизмы, пена);
— препараты 5-Аминосалициловой кислоты (внутрь и местно).
Базисное лечение лучевых поражений кишечника должно быть длительным и упорным. Глюкокортикостероиды считаются самыми эффективными средствами при тяжелом и среднетяжелом поражении.
Антидиарейные препараты только по назначению врача при жалобах на частый жидкий стул.
Какие осложнения могут быть со стороны других органов?
При облучении молочной железы также могут возникнуть осложнения со стороны легких, сердца, пищевода.
Ранние лучевые повреждения легких чаще протекают как острая лучевая пневмония и могут протекать малосимптомно. Если появляются одышка и кашель, следует обратиться к пульмонологу для лечения и профилактики поздних осложнений.
Для профилактики лучевого поражения при дозиметрическом планировании стремятся минимизировать облучение лёгких.
При облучении сердца выше 50 Грей может проявиться лучевое повреждение сердца в виде нарушения питания мышцы и функции органа. Лечение лучевых повреждений сердца в основном симптоматическое и назначается кардиологом. Профилактика:
- проведение лечения на современных линейных ускорителях;
- более точное подведение дозы, щадящее здоровые органы и ткани.
Что относится к поздним постлучевым изменениям и что с этим делать?
Поздние постлучевые изменения, как правило, следствие неполного восстановления после ранних побочных эффектов. Они проявляются фиброзом тканей — разрастанием соединительной ткани в поврежденных органах. Возможно образование свищей между органами.
В прошлом лучевой фиброз считался необратимым. С недавнего времени тяжелый радиационно-индуцированный фиброз молочной железы считается активным процессом, который можно обратить вспять с помощью лекарственной терапии .
Лучевая терапия при раке молочной железы также может вызвать вторичный рак. Наиболее часто — рак щитовидной железы и кожи.
Какие бывают поздние постлучевые изменения со стороны разных органов систем?
1) Повреждения костей — от легкого, преходящего нарушения до воспалительных процессов в костной ткани и патологических переломов.
2) Гепатит — при раке правой молочной железы в зону облучения может попасть часть печени, что случается в 5–10% случаев при облучении печени выше 30-35 Грей. После облучения может развиться радиационный гепатит с нарушением функций печени, что проявляется:
— болью в правом подреберье,
— желтушностью кожи,
— изменением цвета мочи или кала.
Профилактика: использование для лучевой терапии линейных ускорителей с более точным подведением дозы, щадящих здоровые органы и ткани.
3) Поздние лучевые изменения лёгких встречаются с частотой 5-50% и развиваются через 1-2 года в виде локального фиброза. Клиническая картина скудная. У больных отмечается редкий кашель, одышка при физической нагрузке. Процесс имеет уже постоянный характер в отличие от раннего легочного повреждения.
Профилактика: своевременная терапия острого постлучевого пульмонита.
Лечение — профилактика пневмосклероза, противовоспалительные мероприятия:
— массивная антибиотикотерапия,
— бронхолитические смеси,
— отхаркивающие средства,
— антикоагулянты,
— курс ингаляций кортикостероидными и другими противовоспалительными препаратами,
Терапия назначается лечащим врачом.
4) Миелит — постлучевые повреждения спинного мозга. Их появление связано с тем, что спинной мозг трудно исключить из зоны облучения при терапии рака молочной железы. Симптомы лучевого миелита:
- резкие боли в области затылка;
- быстрая утомляемость;
- боли в области крестца с иррадиацией по задней поверхности ног до пяток;
- снижение мышечной силы,
- онемение в конечностях,
- неуверенность походки.
Эти симптомы могут появиться в период от 2-5 месяцев до 5 лет после облучения.
Профилактика: рассчитать как можно меньшую дозу облучения на зону спинного мозга еще на этапе планирования терапии.
5) Лимфедема — отек мягких тканей. Встречается с частотой 6-60% в зависимости от того, была ли операция и удалены ли регионарные лимфатические узлы. При комбинации лучевой терапии и хирургического лечения риск лимфедемы высокий . Лучевая терапия может повреждать лимфатические узлы и сосуды, что нарушает отток лимфатической жидкости и ведет к ее накоплению в тканях. Лимфедема проявляется в виде отека верхней конечности.
Это временный побочный эффект, они может появляться через месяцы или даже годы после лечения.
— увеличение руки в объеме,
— покраснение кожи,
— дискомфорт и боль.
Профилактика: важно избегать давления, травм и инфицирования руки и сразу обращаться к врачу при появлении каких-либо признаков лимфатического отека. Подробнее читайте в статье «Лимфостаз» .
При вовлечении в зоны облучения клеток красного костного мозга, могут быть последствия в виде анемии, тромбоцитопении и нейтропении. Предупреждение их зависит от планирования облучения, дозиметрического планирования, использования линейных ускорителей с щадящими окружающие органы механизмом облучения (VMAT, IMRT, IGRT, протонная терапия). Последствия побочных эффектов корректируются лечащим врачом.
Читайте также:

