Чем лечить ранки на коже при диабете
Обновлено: 25.04.2024
Синдром диабетической стопы (СДС) — очень серьезное осложнение сахарного диабета (СД). Это осложнение (в 85% случаев представленное трофическими язвами стоп разной тяжести) выявляется у 4—10% от общего числа пациентов с СД.
Синдром диабетической стопы (СДС) — очень серьезное осложнение сахарного диабета (СД). Это осложнение (в 85% случаев представленное трофическими язвами стоп разной тяжести) выявляется у 4—10% от общего числа пациентов с СД. Бытует мнение, что эффективность лечения язвенных дефектов стоп при СД низка, однако это не соответствует действительности. На самом деле при нейропатической форме (50—70% всех больных СДС) заживление трофической язвы происходит в 80—90% случаев. Для этого необходимо соблюдение нескольких обязательных условий (см. таблицу 1), тогда как низкая эффективность лечения часто связана с тем, что условия соблюдаются не полностью. Как показывает практика последних 10 лет, появление специализированных отделений и кабинетов «Диабетической стопы» значительно повысило эффективность лечения этих пациентов и снизило число ампутаций. Одна из не решенных пока проблем, актуальных для таких специализированных отделений, — низкая эффективность консервативного лечения диабетических язв при (нейро)ишемической форме СДС.
Ишемическая и нейроишемическая формы составляют менее половины всех случаев СДС (5—10% и 25—40%, соответственно) (Дедов, 1998, Shаw, 1996; Международная рабочая группа по диабетической стопе, 2000; Staroverova, 2001). Однако наличие выраженной ишемии принципиально меняет прогноз лечения у этих пациентов: вероятность заживления язвенных дефектов без восстановления магистрального кровотока составляет 10—30% (Международная рабочая группа по диабетической стопе, 2000). Следует помнить, что назначение большинства вазоактивных средств не повышает вероятность заживления язвенных дефектов. Согласно данным метаанализа (Loosemore, 1994), непростаноидные препараты (эффективные при II стадии хронической артериальной недостаточности, ХАН) неэффективны при III-IV стадиях. Простаниоды (алпростадил, илиопрост) влияют на прогноз при III-IV стадиях ХАН, но в основном — у больных с умеренными проявлениями критической ишемии (tcpO2>20 mmHg). Прогрессирование поражения и отсутствие заживления ран после малых ампутаций на фоне критической ишемии приводят к высокой ампутации у значительной части пациентов. Однако хорошо известно, что проведенное в таких условиях реконструктивное вмешательство на артериях нижних конечностей кардинально меняет прогноз лечения, позволяет избежать высокой, а в ряде случаев — и малой ампутации. Это привело к тому, что в последние годы хирургическая реконструкция артерий (путем шунтирования или эндоваскулярных вмешательств) рассматривается в качестве метода выбора при лечении как перемежающейся хромоты, так и язвенных дефектов ишемического происхождения при СД (American Diabetes Association, 1999; Международная рабочая группа по диабетической стопе, 2000). Была показана высокая эффективность реконструктивных операций у пациентов с СД, в ряде случаев сопоставимая с таковой у пациентов без нарушений углеводного обмена. Результатом широкого внедрения этих методов в зарубежных странах явилось значительное снижение числа ампутаций при ишемической форме синдрома диабетической стопы в Европе. Реконструктивные операции на артериях у больных сахарным диабетом проводятся и в России (Покровский, 2002; Гавриленко, 2002; Мухамадеев, 2002).
Еще один недавно вошедший в практику метод лечения — иммобилизирующая разгрузочная повязка (ИРП), в зарубежной литературе — Total Contact Cast. Такая фиксирующая повязка на голень и стопу представляет собой более или менее жесткий «сапожок» (из гипса или современных полимерных материалов, съемный или несъемный), переносящий нагрузку с области язвы на другие участки. Важно, что этот метод позволяет ходить по улице, работать и т. п., не подвергая при этом рану механической нагрузке. В большинстве зарубежных стран ИРП стал «золотым стандартом» разгрузки, но в России он практически не применялся из-за боязни возникновения осложнений (не всегда обоснованной). В нашей стране основным, хорошо себя зарекомендовавшим методом разгрузки сегодня является «полубашмак». Однако в ряде ситуаций «полубашмак» оказывается неэффективен либо существуют противопоказания к его применению. Это расположение язвы в средней части стопы или пяточной области, необходимость выходить на улицу, работать, а также несоблюдение пациентом предписанного режима разгрузки. В этих случаях требуется использование ИРП.
Пациент В., 57 лет, обратился за консультацией в отделение «Диабетическая стопа» ЭНЦ РАМН 15.04.2003. Диагноз: сахарный диабет 2 типа, тяжелого течения, декомпенсация. Диабетическая дистальная полинейропатия. Диабетическая макроангиопатия: атеросклероз артерий нижних конечностей, критическая ишемия левой нижней конечности (ХАН IV ст). Синдром диабетической стопы, нейроишемическая форма: инфицированный язвенный дефект левой пяточной области II-III cт. по Wagner. Диабетическая микроангиопатия: диабетическая нефропатия в стадии протеинурии с сохранной азотовыделительной функцией почек (IV ст. по Morgensen); диабетическая ретинопатия II ст. ИБС, стенокардия напряжения I ф. к. Многоузловой эутиреоидный зоб 0 ст. (ВОЗ).
СД 2 типа диагностирован в 1990 г. Пациент получал лечение диабетоном 80 мг 1-2 таб/сут (принимал препарат нерегулярно), контроль гликемии был нерегулярным. На момент осмотра уровень гликемии достиг 17,5 ммоль/л натощак.
Перемежающуюся хромоту не отмечал (однако вел малоподвижный образ жизни, редко проходил более 500 м).
23.02.2003 появился язвенный дефект левой пяточной области. Рана не заживала, несмотря на проводившееся амбулаторное и стационарное лечение (включавшее вазапростан 40 мкг/сут N 15), осложнилась раневой инфекцией (St. aureus, Enterococcus).
На момент осмотра: рана 4,5 х 3,5 см, глубиной до 3 см (см. рисунок 1). Стопа отечна, теплая на ощупь. Вибрационная чувствительность на стопах = 0-1 балл, пульсация на артериях правой стопы ослаблена, левой — не определяется.
Общее состояние: относительно удовлетворительное, температура тела в норме. ЧСС = 70 уд/мин, АД = 140—150/80—90 mmHg.
Рентгенологически: дефект мягких тканей пяточной области, признаков деструкции пяточной кости нет.
УЗДГ: справа — признаки стеноза ~50% бедренно-подколенного сегмента, артерий голени. Слева — стенотические изменения бедренно-подколенного сегмента (~50%), окклюзия передней тибиальной артерии, субтотальный стеноз задней большеберцовой артерии.
Дуплексное сканирование брюшного отдела аорты и артерий нижних конечностей (в ГКБ №81): сосудистая стенка неровная, утолщена в дистальных сегментах обеих задних большеберцовых артерий (ЗББА) с медиокальцинозом. Толщина комплекса «интима-медиа» до 1,2 мм. В просвете дистальных сегментов ЗББА — множественные микрокальцинаты, стенозирование ЗББА справа до 90%, слева до 80%.
Восстановление артериального кровотока
На основании данных обследования и с учетом неэффективности проводившейся консервативной терапии, пациент был направлен к ангиохирургу для проведения реконструктивного вмешательства на артериях нижней конечности. Указанное лечение осуществлялось в 25-м Центральном военном клиническом госпитале РВСН с 13.05.03 по 02.06.03.
При обследовании в стационаре были получены следующие данные.
Клинический анализ крови: гемоглобин — 128 г/л, эритр. — 4,36*10 12 /л, лейк. — 6,8*10 9 /л (пал. — 2%, сегм. — 62%, эоз. — 2%, лимф. — 28%, мон. — 6%), СОЭ — 23 мм/ч.
Клинический анализ мочи: уд. вес — 1014, белок — 1,22%, цил. — нет, лейк. — 2—4 в п/зр, эритр. — 3—5 в п/зр.
Биохимический анализ крови: общий белок — 69,0 ммоль/л, билирубин — 10,0 ммоль/л, креатинин — 120 мкмоль/л, мочевина — 6,1 ммоль/л, холестерин — 4,8 ммоль/л, β-липопротеиды — 40%, триглицериды — 1,0 ммоль/л, АЛТ, АСТ — в норме.
ЭКГ: ритм синусовый, правильный, 68 уд/мин. Горизонтальное положение электрической оси сердца.
Ro-графия органов грудной клетки: легочные поля прозрачны. Корни фиброзные, с петрификатами. Гипертрофия левого желудочка, уплотнена дуга аорты.
УЗИ органов брюшной полости: печень, селезенка, желчный пузырь, поджелудочная железа, почки — без патологических изменений.
Ангиография артерий нижних конечностей: абдоминальный отдел аорты с неровными контурами, просвет ее сохранен. Контуры магистральных артерий нижних конечностей неровные, просвет сохранен, выраженный кальциноз стенок артерий. Магистральные артерии обеих голеней с неровными контурами, резко истончаются ниже уровня щели голеностопных суставов. В дистальном отделе левой задней большеберцовой артерии определяются два тандемных критических стеноза. Подошвенные артериальные дуги разомкнуты.
Проведенное лечение
Антибиотикотерапия (офлоксацин 200 мг два раза в день), хирургическая обработка раны (иссечение некротизированных тканей из кармана глубиной до 3 см), дезинтоксикационная терапия, дезагреганты в/в. Пациент переведен на инсулинотерапию (актрапид 8 ЕД п/з, 6 ЕД п/о, 6 ЕД п/у; монотард 8 ЕД п/з, 8 ЕД — 22.00), достигнута компенсация углеводного обмена (гликемический профиль 25.06.03: 8,9–6,5–4,7–7,4–5,1 ммоль/л). В связи с диабетической нефропатией IV ст. пациент постоянно получает эналаприл 10 мг/сут.
20.05.03 произведена рентгеноэндоваскулярная ангиопластика задней большеберцовой артерии слева, восстановлен артериальный кровоток.
Операция проводилась под местной анестезией 0,5%—20,0 Sol. Novocaini, левосторонним чрезбедренным доступом антеградно пунктирована бедренная артерия. Через интродюсер диаметром 5F введен коронарный проводник в заднюю большеберцовую артерию дистальнее стенозов. В область критических стенозов подведен баллонный сегмент катетера размерами 2, 5x20, 0 мм. Выполнена ангиопластика под рабочим давлением до 5 атм. На контрольной ангиограмме стеноз устранен, препятствий для кровотока не определяется. Проводник удален. Интродюсер подшит к коже. Асептическая повязка. За период вмешательства больному внутриартериально введено 7 тыс. ЕД гепарина. Состояние пациента не изменилось.
После выписки: при допплеровском исследовании магистрального кровотока справа и слева в задних большеберцовых артериях — магистральный измененный кровоток (ЛПИ > 1), в тыльных артериях стопы — коллатеральный кровоток, но ЛПИ > 1 (возможно завышение лодыжечно-плечевого индекса, вследствие артериосклероза Менкеберга).
Чрескожное напряжение кислорода (tcpO2) на тыльной стороне левой стопы (через три месяца после ангиопластики): лежа — 19 mmHg, сидя — 20 mmHg (возможно занижение показателя вследствие отека стопы). По совокупности клинических данных, состояния раны и результатов инструментального обследования было сделано заключение, что явления критической ишемии устранены.
Применение индивидуальной разгрузочной повязки (Total Contact Cast)
Пациент был выписан для амбулаторного лечения, которое включало:
- ежедневные перевязки с промыванием раны раствором диоксидина, фурацилина, наложением атравматической повязки (Atrauman, Branolind);
- регулярное удаление гиперкератоза с краев раны;
- разгрузку пораженной конечности (костыли);
- компенсацию углеводного обмена (инсулинотерапия).
Признаков ишемии конечности не наблюдалось, рана заполнилась полноценной грануляционной тканью (см. рисунок 2), но скорость сокращения размеров раны оказалась ниже расчетной (см. рисунок 3).
Известно, что скорость заживления соответствует расчетной при отсутствии значимой ишемии, инфекции и механической нагрузки на рану. Учитывая, что разгрузка конечности с применением костылей не является оптимальной, было решено изготовить иммобилизирующую разгрузочную повязку.
Эквивалентный радиус раны рассчитывается как (d1+d2)/4, где d1 и d2 — соответственно максимальный и перпендикулярный ему минимальный диаметр раны.
Расчетная скорость заживления (черная линия) определяется по формуле Cavanagh: r = -0.74 + 1.04*r0 — 0.1*t — 0.012*r0*t, где r — эквивалентный радиус раны в данный момент, r0 — исходный эквивалентный радиус раны, а t — время с начала лечения (дни) (Cavanagh, 2001).
Реальные размеры раны наносились на график (красная линия) при каждом осмотре пациента (точка «0» — 1 месяц после баллонной ангиопластики). Из графика видно, что после изготовления ИРП скорость заживления (угол наклона графика) значительно выросла и достигла расчетной.
При применении этого метода разгрузки рана начала затягиваться гораздо быстрее, и к 10.09.03 было достигнуто заживление язвы (см. рисунок 4).
Основными методами реваскуляризации нижних конечностей являются шунтирующие операции и чрескожная транслюминальная баллонная ангиопластика (ЧТБА). Зачастую ЧТБА считают недостаточно эффективной и предлагают не использовать у пациентов с СД. Известно, что долговременный эффект шунтирования выше, чем у баллонной ангиопластики, причем у больных с СД эта разница выражена сильнее (Dyet, 2000). Но в критических ситуациях (язвенные дефекты, критическая ишемия) ангиопластика представляет собой малоинвазивный метод, позволяющий стабилизировать ситуацию и избежать ампутации, что зачастую более важно, чем отдаленные результаты вмешательства. Это так называемая limb-saving angioplasty — ангиопластика для спасения конечности.
История болезни, представленная выше, демонстрирует также, как важна постоянная оценка эффективности проводимого лечения (в нашем случае — сопоставление динамики размеров язвы с результатами расчета по формуле Cavanagh). Если эффект от лечения недостаточен, необходимо выявить причину, по которой это происходит. В нашем случае отсутствие оптимального режима разгрузки оказалось достаточной причиной для замедленного заживления раны, и эта проблема могла быть решена только с помощью нового метода — иммобилизирующей разгрузочной повязки. Следует особенно отметить, что для приближения к «идеальной» скорости заживления не потребовалось использования ни «стимуляторов заживления» (солкосерил, актовегин, метилурацил и т. п.), ни «сосудистых» средств. Эти препараты широко применяются, однако их эффективность в отсутствии необходимых условий для заживления (см. таблицу 1) крайне низка.
В настоящее время становятся доступными новые методы лечения СДС, внедрение которых в повседневную практику вполне возможно и крайне необходимо. Только адекватное комбинированное лечение позволяет достичь оптимальных результатов, особенно в сложных случаях, таких, как синдром диабетической стопы.
По вопросам литературы обращайтесь в редакцию
О. В. Удовиченко, кандидат медицинских наук
Г. Р. Галстян, кандидат медицинских наук
И. А. Ерошкин, кандидат медицинских наук
А. А. Ефимов, О. В. Носов
Ю. Г. Васильев, кандидат медицинских наук
Эндокринологический научный центр РАМН (Москва), 25-й Центральный военный клинический госпиталь РВСН (Одинцово)
Нарастание частоты заболеваемости инсулинзависимым сахарным диабетом (ИЗСД) у детей и подростков требует расширения исследований по профилактическому и раннему выявлению как доклинических стадий сахарного диабета (СД), так и его осложнений, своевременное
Ряд авторов не только признают, что поражение кожи при ИЗСД является наиболее доступным признаком для клинической оценки врачом, но и прослеживают связь между поражением кожи при ИЗСД и такими осложнениями этого заболевания, как нефропатия, нейропатия, ретинопатия, развитие ограничения подвижности суставов (ОПС) — артропатия (хайропатия)
В настоящее время поражение кожи при ИЗСД у детей может быть классифицировано следующим образом: первичное, вторичное и смешанное (сочетанное) поражения кожи; метаболические нарушения кожи; поражение кожи, связанное с лечением ИЗСД
Нарастание частоты заболеваемости инсулинзависимым сахарным диабетом (ИЗСД) у детей и подростков требует расширения исследований по профилактическому и раннему выявлению как доклинических стадий сахарного диабета (СД), так и его осложнений, своевременное обнаружение и лечение которых являются основными факторами, позволяющими предотвратить инвалидизацию и сократить смертность больных. При ИЗСД поражаются все органы и ткани организма, наиболее общим механизмом поражения является формирование диабетической микроангиопатии. Ряд авторов не только признают, что поражение кожи при ИЗСД является наиболее доступным признаком для клинической оценки врачом, но и прослеживают связь между поражением кожи при ИЗСД и такими осложнениями этого заболевания, как нефропатия, нейропатия, ретинопатия, развитие ограничения подвижности суставов (ОПС) — артропатия (хайропатия). Большинство исследований, проведенных в основном у взрослых больных, страдающих как инсулиннезависимым сахарным диабетом (ИНСД), так и ИЗСД, статистически достоверно показывают, что частота встречаемости симптомокомплекса поражения кожи, чаще всего описываемого как «диабетическая дермопатия», возрастает с повышением частоты других специфических осложнений СД. Все исследователи отмечают, что своевременная диагностика и лечение, включающее повышение уровня гликемического контроля, уменьшают проявления осложнений, а на ранних стадиях делают возможным их обратное развитие.
Особенностью кожных покровов ребенка, обусловливающей их повышенную чувствительность к патологическим изменениям, является более тонкий, чем у взрослых, и более рыхлый слой эпидермиса за счет большего содержания воды. Граница между эпидермисом и дермой неровная, связь между ними слабее, чем у взрослых. Дерма имеет преимущественно клеточную структуру, особенно у детей до шести лет; коллагеновые волокна очень тонкие, эластические, слабо развиты, тогда как волокнистая структура у взрослых имеет малое количество клеточных элементов. За счет этих особенностей защитная функция кожи у детей ослаблена — кожа более ранима, склонна к инфицированию (недостаточная кератинизация рогового слоя, его тонкость, незрелость местного иммунитета), эпидермолизу (легкое отделение эпидермиса от дермы), особенно у детей до трех лет. Поверхность детской кожи суше, чем у взрослых, имеет более выраженную склонность к шелушению вследствие физиологического паракератоза и более слабого функционирования железистого аппарата кожи.
Большинство исследователей считают, что поражения кожи при СД встречаются довольно часто, и, учитывая микроскопические изменения, они могут достигать даже 100% при манифестации заболевания. С помощью гистологических и электронно-микроскопических исследований доказано сходство морфологического строения кожи больных СД в возрасте моложе 40 лет и практически здоровых людей старше 60 лет. У них исчезают эластические волокна и активируются фибробласты, отмечаются разрывы коллагеновых пучков, снижение синтеза эластина и полимеризации коллагена при повышении количества коллагеновых белков, глюкозоаминогликанов, структурных гликопротеинов. При этом установлено, что снижение количества эластических волокон на всех стадиях старения кожи обычно предшествует изменениям коллагена.
У детей, в отличие от взрослых, практически не встречаются такие разнообразные, распространенные при СД первичные формы поражения кожи микроангиопатического и макроангиопатического генеза (в связи с резистентностью к инсулину), как генерализованная кольцевидная гранулема (granuloma annulare), папуллезно-роговой дерматоз Карле (hyperkeratosis follicularis et parafollicularis in cutem penetrans), папиллярно-пигментная дистрофия кожи (acanthosis nigricans), эруптивные ксантомы (xantoma papuloeruptivum), склередема (scleredema), кальцифилаксия (calcifilaxia), а также исчезающие гранулемы, резипелоидоподобная эритема, пигментный пурпурный дерматоз, периунгвальные телеангиоэктазии. Также крайне редки у детей и такие вторичные инфекционные поражения, в том числе кожи, как злокачественный наружный отит — тяжелая инфекция, вызываемая Pseudomonas; неклостридиальная газовая гангрена, как правило вызываемая Proteus, Klebsiella, E. coli, Pseudomonas; некротизирующий фасциит — смертельная инфекция, поражающая поверхностную фасцию. Из метаболических нарушений кожи, сопровождающих СД, практически не встречаются у детей гемохроматоз и порфирия.
- классическая — единичные крупные очаги поражения, чаще встречаемые на коже голеней, нередко с изъязвлениями;
- атипичная — с двумя вариантами течения — склеродермоподобным и поверхностно-бляшечным.
Никакое современное лечение, направленное либо на коррекцию углеводного обмена и метаболических нарушений, либо на улучшение микроциркуляции и тканевой резистентности (лазеротерапия, рентгенотерапия, криодеструкция и др.), не позволяет добиться стойких радикальных результатов. В настоящее время большинство исследователей все же рассматривают ЛН как самостоятельное заболевание — хронический дерматоз.
Таким образом, в настоящее время поражения кожи при ИЗСД у детей может быть классифицированы следующим образом:
- первичное, вторичное и смешанное (сочетанное) поражение кожи;
- метаболические нарушения кожи;
- поражение кожи, связанное с лечением ИЗСД.
Первичное поражение кожи — это сосудистые поражения (осложнения) микроангиопатического генеза — структурные и функциональные нарушения в мелких кровеносных сосудах (артериолы, венулы, капилляры). Клинически проявляются эритемой конечностей, внешне напоминающей рожу, иногда с изъязвлениями. Микроскопически характерны утолщение базальных мембран сосудов и пролиферация эндотелиальных клеток. К ним относится диабетическая дермопатия и рубеоз. Собственно диабетическая дермопатия — одна из самых распространенных форм поражения кожи — выражается в образовании множественных бессимптомных двухсторонних атрофических гиперпигментированных пятен, чаще всего на голенях. Их присутствие свидетельствует о возможности микрососудистых изменений в других тканях. Специфическое лечение дермопатии не проводится. Также имеет место рубеоз — розовый оттенок кожи лица у больных ИЗСД, обусловленный функциональной микроангиопатией или повышенным сродством гликированного гемоглобина к кислороду.
Вторичное поражение кожи включает: кожные инфекции — бактериальные и грибковые; неврологические нарушения — сенсорные, моторные и автономные.
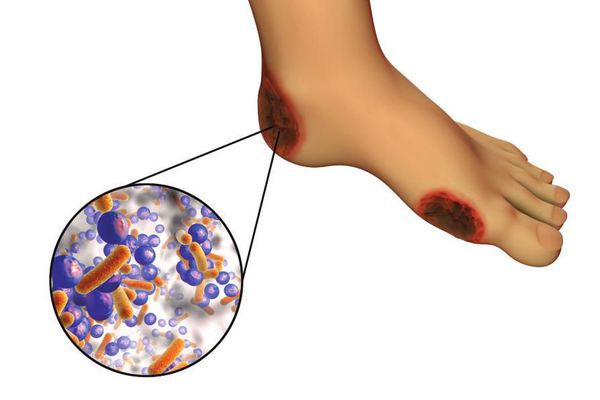
Больные СД склонны к развитию инфекционно-воспалительных заболеваний, особенно при неудовлетворительном контроле гликемии. На поверхности кожи больных СД выявляется в 2,5 раза больше микроорганизмов, чем у здоровых лиц, а бактерицидная активность кожи у больных СД ниже, чем у здоровых, в среднем на 20%, и это снижение прямо коррелирует с тяжестью течения СД, в связи с чем при СД, в том числе ИЗСД, часто наблюдаются различные инфекционно-воспалительные и инфекционно-грибковые заболевания кожи. Прежде всего они развиваются на коже нижних конечностей, пораженных нейропатией и ишемией. Это обычно полимикробные инфекции: золотистый стафилококк, гемолитический стрептококк, грамотрицательные аэробные бактерии и множество анаэробов. На ногах, в области мозолей или в других местах трения и нарушения целостности кожи, в области ногтевых лож образуются язвы или нагноения. Инфекция может распространиться на окружающие ткани, вызывая некротизирующий целлюлит, лимфангит, гнойный миозит, некротизирующий фасциит, остеомиелит или даже газовую гангрену (такие исходы распространения инфекции у детей практически не встречаются). Пиодермии, фурункулы, карбункулы, флегмоны, рожа, дерматиты, эпидермофития, кандидомикоз, хронические паронихии и панариции, инфицированная гангрена встречаются у больных СД значительно чаще, чем в популяции. По принятой нами классификации ИЗСД у детей и подростков инфекционно-воспалительные и инфекционно-грибковые заболевания, в том числе кожи, отнесены не к сопутствующим ИЗСД заболеваниям, а к неспецифическим осложнениям ИЗСД, что правомерно, так как распространенность, тяжесть этих поражений, сложность их лечения у детей обусловлена именно наличием ИЗСД. Фурункулез у больных СД протекает тяжело и длительно, а подкожные абсцессы головы могут привести даже к тяжелым поражениям мозга. У взрослых больных СД встречается и гангрена Фурнье, для которой характерно поражение подкожных тканей в области полового члена, мошонки и промежности, реже — стенки живота. Возбудителем этого поражения является смешанная аэробная и анаэробная микрофлора. Микробно-воспалительные процессы при СД могут привести к сепсису. Присоединение инфекционно-воспалительных и грибковых заболеваний кожи, как правило, приводит к тяжелым и длительным декомпенсациям СД и увеличивает потребность организма в инсулине. У лиц с хорошим контролем СД фурункулез и карбункулы встречаются не чаще, чем в популяции здоровых. Из грибковых поражений у детей с ИЗСД наиболее распространены кандидозы, чаще всего вызывающие ангулярные стоматиты, паронихии, вульвовагиниты или баланиты.
Эпидермофитии у детей с ИЗСД довольно редки, но часто осложняются вторичной бактериальной инфекцией. Крайне редки у детей трудно поддающиеся терапии фикомикоз, мукормикоз, при которых в процесс могут вовлекаться мозговые оболочки. У детей с ИЗСД довольно распространены дерматомикозы, особенно стоп и ладоней, кожа которых становится сухой и чешуйчатой.
Широко распространены вторичные нарушения кожи, связанные с неврологической патологией при СД. Среди них: сенсорные нарушения — онемение пальцев ног, постепенно распространяющееся выше, захватывающее стопы, способствующее развитию травматических язвенных поражений, вторичных инфекций и гангрены, особенно при наличии сосудистых изменений; моторные нарушения — слабость межкостных мышц вызывает уплощение стоп с потерей смягчающей функции подошвы стоп; автономные (вегетативные) нарушения — гипергидроз верхней половины тела и сухость кожи нижней части туловища. Эти проявления относятся к диабетической нейропатии, поражающей 5-50% больных СД. У детей с ИЗСД наиболее часто встречается дистальная симметричная сенсорно-моторная полинейропатия с минимальными кожными проявлениями (сухость кожи, гиперкератоз, мозоли, вторичное инфицирование пораженных участков кожи, нарушения роста ногтей), обратимая в фазе начальных проявлений. Именно нейропатия — один из ведущих патогенетических факторов развития в дальнейшем синдрома «диабетической стопы» (ДС). Среди больных СД, осложненным синдромом ДС, частота ампутации нижних конечностей в 15 раз выше, чем у остального населения. При преобладании нейропатических изменений над изменениями периферического кровотока развивается нейропатическая форма ДС, одним из вариантов течения которой является поражение кожи — нейропатическая язва. Она чаще возникает на участках стопы, испытывающих давление, — плантарной поверхности и межпальцевых промежутках. Длительно протекающая сенсорно-моторная нейропатия приводит к деформации стопы с перераспределением и повышением давления на ее отдельные участки. В этих местах отмечается утолщение кожи, гиперкератоз с высокой плотностью. В дальнейшем развивается аутолиз подлежащих мягких тканей с формированием язвенного дефекта, при этом больной может ничего не замечать из-за снижения болевой чувствительности. Язвенный дефект может вторично инфицироваться, в том числе анаэробной микрофлорой, с развитием гипертермии, лейкоцитоза, требующих срочного хирургического лечения с некроэктомией, антибактериальной терапией, улучшением гликемического контроля. У детей все формы ДС встречаются крайне редко, но начальные проявления имеют место в детском возрасте, что требует адекватного обучения, обследования и лечения больных, в том числе прицельного осмотра состояния кожи при ИЗСД.
К смешанному (сочетанному) поражению кожи при СД относятся: утолщение кожи (синдром «диабетической руки» — ОПС с утолщением кожи и склеродермоподобным синдромом), желтый цвет кожи и ногтей, синдром «диабетических пузырей», пруригус и повреждения волос. К нему же следует отнести склеродермоподобные изменения кожи пальцев и тыльной части кистей рук, снижающие их подвижность. Кожа утолщается в области пальцевых суставов и периунгвально. Эти изменения, иногда в сочетании с артропатией (ОПС), описываются некоторыми исследователями как синдром «диабетической руки». Часто с утолщением кожи ассоциируется гиперкератоз. Желтый цвет кожи и ногтей (ксантохромия) ранее связывался с гиперкаротинемией, но сейчас доказано, что при СД в крови сохраняется нормальный уровень каротина. В настоящее время этиология и патогенез не выяснены. Синдром «диабетических пузырей» возникает редко, как правило на коже конечностей. Выявляются одиночные или множественные пузыри, заживающие без рубцевания через две—пять недель. Возможна симптоматическая терапия. Пруригус — поражение кожи в аногенитальной области на фоне кандидоза (гиперемия, трещины, шелушения, вторичное инфицирование). Иногда при плохо контролируемом СД может быть диффузное выпадение, а у больных пониженного питания — избыточный рост волос (лануго) на коже рук и спины. Редко, обычно при плохом уровне гликемического контроля, наблюдаются повышенное шелушение кожи, себорейный дерматит, ихтиозоподобный синдром, особенно в области голеней.
К метаболическим нарушениям кожи при СД относится ксантоматоз, редко встречающийся в детском возрасте и являющийся следствием гиперлипидемии. Клинически ксантоматоз проявляется в виде плотных желтых папул с эритематозным ободком, чаще на кистях, стопах, ягодицах, разгибательных поверхностях верхних и нижних конечностей. Купируется адекватной инсулинотерапией.
Специфическими кожными осложнениями лечения ИЗСД являются липодистрофии, образующиеся в местах инъекций инсулина. Встречаются в виде липом или липогипертрофий (плюс-ткань) и липоатрофий (минус-ткань). В связи с широким применением в настоящее время хорошо очищенных биосинтетических человеческих инсулинов липоатрофии встречаются крайне редко. В настоящее время именно липогипертрофии, или липомы, представляют собой наиболее распространенную проблему для больных ИЗСД, даже при небольшом сроке заболевания. Они возникают в результате некорректной техники введения инсулина (нарушения схем ротаций мест инъекций инсулина, несоблюдение техники и правил введения препаратов), а иногда и без видимых причин; затрудняют абсорбцию и метаболизм инсулина, ухудшают компенсацию заболевания, увеличивают потребность в инсулине, создают косметические дефекты на коже. Кроме вышеописанных правил профилактики липодистрофий, в случае их появления дополнительно и с хорошим эффектом применяется массаж липом, физиотерапия. Также у некоторых больных периодически возникают кровоподтеки в местах инъекций инсулина. Эти места, как правило, теплее на ощупь, чем окружающая кожа.
Обобщая вышеизложенное, можно сказать, что исследование кожи, представляющей собой наиболее доступную неинвазивному клиническому осмотру систему организма, имеет огромное клиническое значение. Знание особенностей поражения кожи у детей при ИЗСД не только помогает в оценке фазы течения заболевания, но и имеет непреходящее значение для решения вопросов о направлении диагностического поиска, коррекции лечения и прогнозе течения ИЗСД.

Незначительная ранка или порез – мелочь для здорового человека. Для диабетиков всё обстоит иначе: любое повреждение мягких тканей заживает намного дольше, а риск инфицирования повышается в разы. Правильный уход за повреждённым участком – основа предупреждения нежелательных осложнений.
Принципы ухода за ранами для диабетиков
Сахарный диабет нарушает нормальную жизнедеятельность организма. Под угрозой: обменные процессы, функционирование сердечно-сосудистой системы, внутренних органов, состояние кожи, слизистой. Регенерация тканей у диабетиков также нарушается.
Длительно незаживающая рана при сахарном диабете – не только неудобно, но и опасно. Ослабленный организм больного не в состоянии активно противостоять болезнетворным бактериям, поэтому риск инфицирования повреждённого места и загноения повышается в несколько раз.
Своевременная и правильная обработка раны – основа предупреждения осложнений для диабетиков. Привычный алгоритм действий (йод – пластырь) в данном случае не подойдёт.
При мельчайших порезах, ранках, необходимо:
- очистить поврежденный участок кожи от загрязнений;
- дать ранке просохнуть;
- выполнить обработку;
- для обработки рекомендуют использовать антисептик (хлоргексидин, растворы йода, перекись, мирамистин);
- обработанную рану перевязывают стерильной повязкой (материал должен хорошо впитывать выделения и обеспечивать удаление без травмы).
Стерильная повязка защищает рану от загрязнений и предупреждает занесение инфекции. Перевязки необходимо выполнять регулярно.
Специальные мази для обработки ран
Крайне важно постоянно контролировать процесс заживления. Внимательно осматривайте рану при каждой перевязке, обращайте внимание на любые изменения. Ускорить восстановление повреждённых тканей поможет местное лечение.
Рекомендуется использовать препараты, содержащие в составе аллантоин, инсулин и мочевину. Они улучшают местный метаболизм, снижают негативное воздействие глюкозы на клетки. К таким мазям относят Диа Дерм, гепариновую и инсулиновую.
Благотворное влияние на восстановительный процесс оказывают мази на жировой основе. Они питают и увлажняют поражённые участки, ускоряют рост здоровых тканей. В данную группу препаратов входят Метилурацил, Солкосерил.
Предотвращают развитие грибковых поражений. Мазь Уреата устраняет грибковые поражения, а мочевина в составе активно питает кожу. Мазь Вирта обладает широким спектром действия. Она борется с сухостью кожи, воспалением, вызванным грибковой инфекцией.
Применять ту или иную мазь следует только после консультации с врачом и строго по предназначению. Важно убедиться, что в составе препарата отсутствует спирт, красители, салициловая кислота. Для ускорения восстановления к наружным средствам подключают приём витаминов и минералов. Они повышают тонус организма, улучшают обменные процессы.

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Кожные высыпания могут возникать как при первичном (инсулинозависимый и инсулинезависимый диабет), так и вторичном (поражения поджелудочной железы при интоксикациях, хирургическое вмешательство и др.) сахарном диабете. У больных сахарным диабетом наиболее часто встречается диабетический пузырь, различные бактериальные (фурункул, карбункул, рожа и др.), грибковые (кандидоз, паронихия, рубромикоз) и вирусные (опоясывающий лишай и др.) инфекции. Диабетическая макро- и микроангиопатия обусловлены поражением как крупных, так и мелких (артериолы, венулы, капилляры) сосудов. При этом чаще развивается эритема конечностей, внешне напоминающая рожу. Образуются трофические язвы, гангрены, которые осложняются разнообразными инфекциями.
Лечение. Проводят лечение основного заболевания у эндокринолога. Лечение дерматологического аспекта такое же, как и при аналогичных дерматозах.

[1], [2], [3], [4], [5], [6]
Что нужно обследовать?
Как обследовать?
Какие анализы необходимы?
Портал iLive не предоставляет медицинские консультации, диагностику или лечение.
Информация, опубликованная на портале, предназначена только для ознакомления и не должна использоваться без консультации со специалистом.
Внимательно ознакомьтесь с правилами и политикой сайта. Вы также можете связаться с нами!
Copyright © 2011 - 2022 iLive. Все права защищены.
Что такое диабетическая стопа? Причины возникновения, диагностику и методы лечения разберем в статье доктора Есипенко И. А., сосудистого хирурга со стажем в 37 лет.
Над статьей доктора Есипенко И. А. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Диабетическая стопа (синдром диабетической стопы, СДС) — это тяжёлое осложнение сахарного диабета в виде инфекции, язв или разрушения глубоких тканей, которое возникает в связи с нарушением макроструктуры стопы и микроциркуляции крови, по причине разрушения нервных окончаний и нервных волокон. [10]
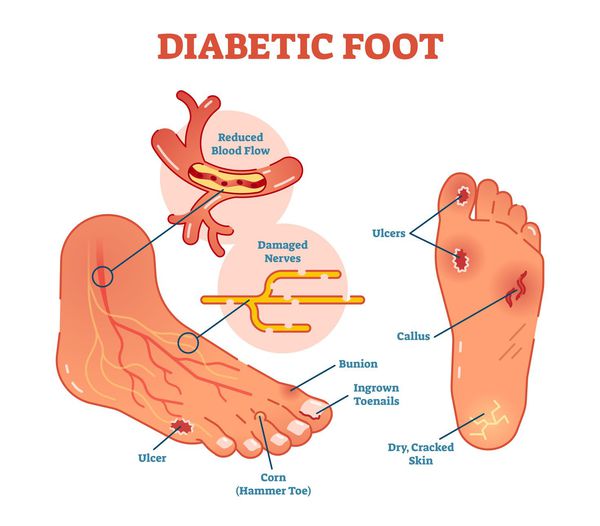
Главная причина ДС — это сахарный диабет (СД). И хотя синдром диабетической стопы не развивается с первого дня увеличения уровня глюкозы в крови более 7,0-8,0 ммоль/л, каждый пациент с диагнозом «сахарный диабет» должен помнить о таком грозном возможном осложнении.
Хронические раны на ногах у людей с сахарным диабетом встречаются в 4-15 % случаев. В некоторых случаях они становятся первым признаком развившегося диабета [10] .
Основные «пусковые механизмы» развития язв при СДС:
1. Ношение неудобной обуви. К изменению нагрузки на суставы стопы, сдавливанию или потёртости кожи, локальной микроишемии, инфильтрату, или некрозу могу привести любые дефекты обуви:
- несоответствующий размер обуви (меньше или больше, чем нужно);
- стоптанные и/или высокие каблуки;
- рубец на стельке;
- дефект подошвы;
- мокрая обувь;
- несоответствие обуви времени года.
2. Увеличенный вес тела. Учитывая площадь стоп, при увеличении веса тела (даже на 1 кг) увеличивается и нагрузка на каждый сустав стопы. Самая уязвимая область — подошвенная поверхность.
3. Разрастание эпидермиса (поверхности) кожи. Этот процесс происходит из-за нарушенных обменных процессов в коже на фоне СД (под утолщённым эпидермисом-"мозолью" в слоях кожи нарушается микроциркуляция, что приводит к микроишемии и некрозу).
4. Микротравмы:
- укусы животных;
- уколы шипами растений;
- порезы при педикюре и т. п.
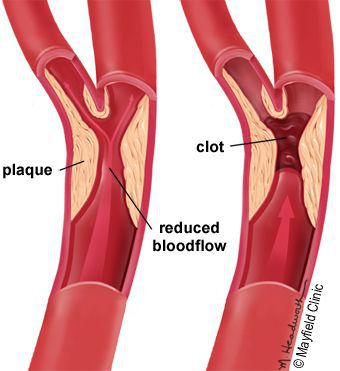
5. Стенозы (сужение) и окклюзии (закупорка) магистральных артерий. В результате отсутствия кровоснабжения в стопах и голенях к микроишемии присоединяется макроишемия и развитие гангрены конечности.
6. Условно патогенная или патогенная микрофлора. Активизация флоры (микробов и других микроорганизмов) на поверхности кожи в условиях СД приводит к воспалению кожного покрова, а в условия ишемии или микротравмы значительно ускоряется развитие гангрены.
Часто наблюдается сочетание нескольких причин возникновения язв при СДС.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы диабетической стопы
Отправной точкой развития СДС считается не дата установления диагноза «Сахарный диабет», а время, когда были выявлены первые симптомы СД (однократные подъёмы глюкозы крови, сухость во рту и другие).
Симптомы СДС:
- онемение, зябкость, жжение, отёки в стопах и другие неприятные ощущения;
- выпадение волос на на стопах и голенях, потливость стоп;
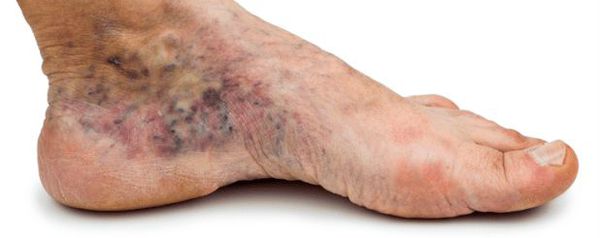
- изменение окраски кожи (гиперемия, гиперпигментация, цианоз);
- утолщение, расслаивание, изменение формы и цвета ногтевых пластинок;
- кровоизлияния под ногтевой пластинкой в виде «синяков» под ногтями;
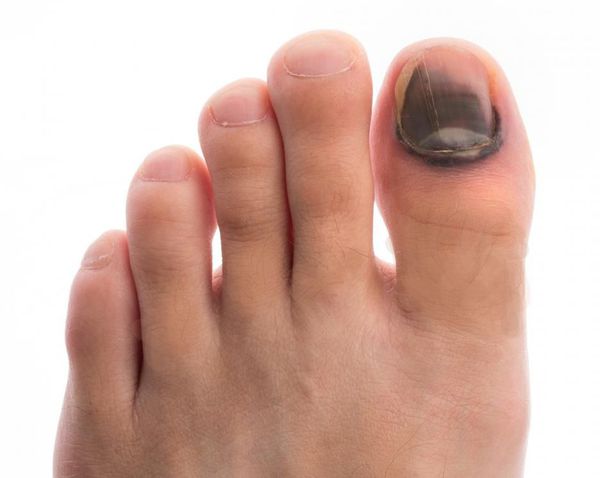
- деформация стоп;
- снижение чувствительности стоп — вибрационного, температурного, болевого и тактильного восприятия;
- боль в области стопы и язвы, возникающая как в покое или ночью, так и при ходьбе на определённые расстояния;
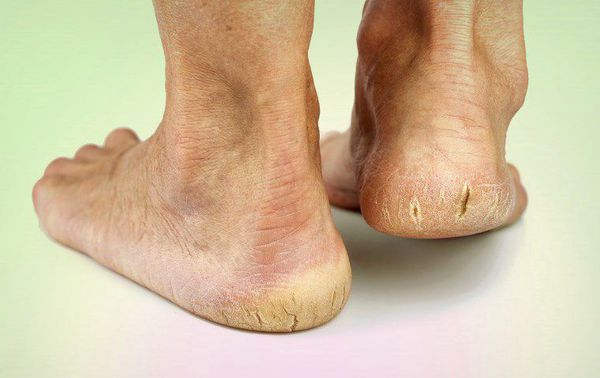
- истончение кожи, шелушение;
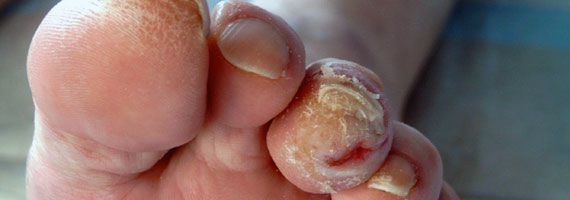
- понижение или увеличение температуры стоп и голеней;
- длительная эпителизация (заживление) микротравм — до двух месяцев, при этом остаются коричневые рубцы;
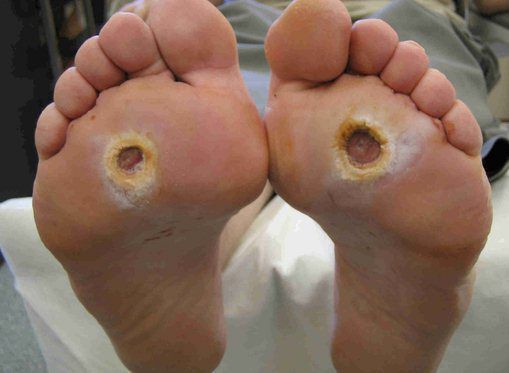
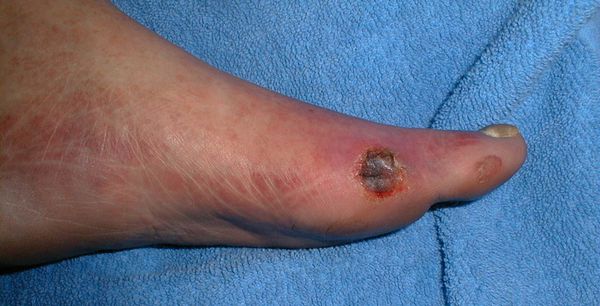
- трофические язвы, длительно не заживающие на стопах.
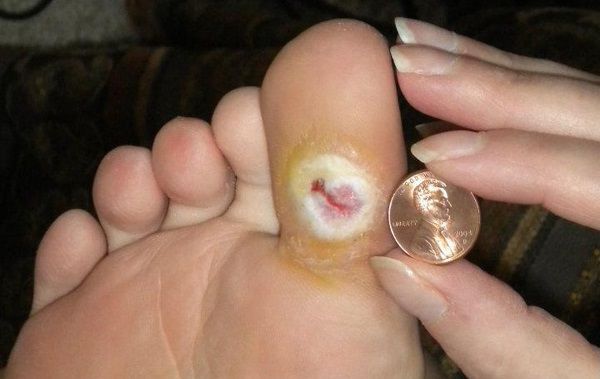
Чаще всего трофическим изменениям подвержены дистальные отделы конечности: пальцы и подошвенная поверхность стопы в проекции головок плюсневых костей. Зона образования трофической язвы зависит от причины её возникновения.
Патогенез диабетической стопы
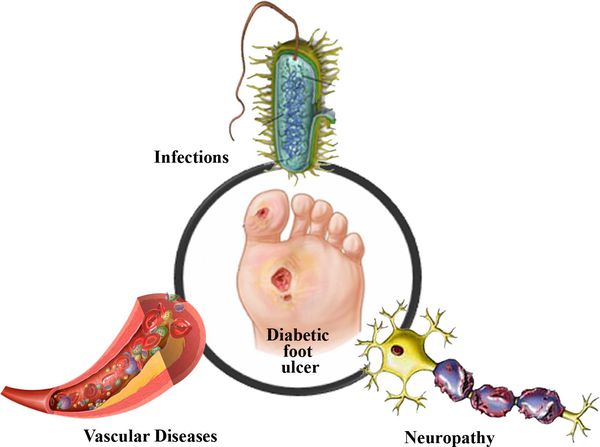
Механизм развития СДС представляет собой следующую последовательность нарушений:
- Снижается выработка гормона инсулина.
- Увеличивается уровеь глюкозы в крови — развивается гипергликемия.
- Блокируется кровоток в мелких сосудах, через сосудистую стенку перестаёт поступать кислород и другие микроэлементы.
- Разрушаются нервные волокна и рецепторы.
- Наступает микро- и макроишемия тканей стопы.
- Образуются трофические язвы.
Таким образом, при СДС происходит повреждение всех тканей ноги.
В результате дефицита инсулина в организме диабетика количество глюкозы в крови увеличивается. Это в свою очередь негативно сказывается на состоянии как мелких, так и крупных сосудов:
- на стенках сосудов скапливаются иммунологические вещества;
- мембраны становятся отёчными;
- просвет сосудов сужается.
В результате этих изменений кровообращение нарушается и образуются небольшие тромбы. Эти изменения в организме препятствуют поступлению достаточного количества микроэлементов и кислорода в клетки и тем самым приводят к нарушениям обменного процесса. Кислородное голодание тканей замедляет процесс деления клеток и провоцирует их распад.
Увеличение уровня глюкозы в крови также становятся причиной поражения нервных волокон — снижается чувствительность.
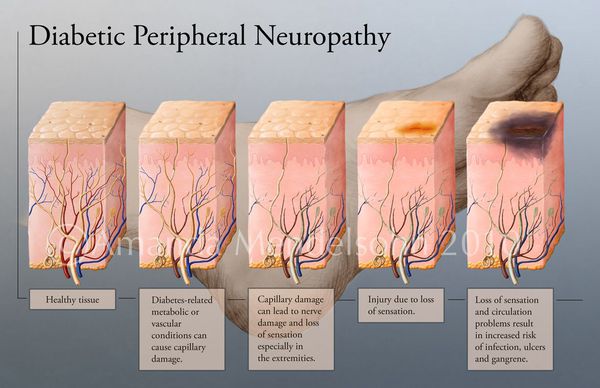
Все деструктивные процессы, происходящие в тканях стопы приводят к тому, что любое повреждение кожи становится лёгким процессом, а заживление — длительным. Усугубить состояние стопы могут присоединившиеся инфекции, которые способны привести к образованию гангрены — некрозу тканей. [9]
Классификация и стадии развития диабетической стопы
Классификация I Международного симпозиума по диабетической стопе
В 1991 году в Нидерландах на I Международном симпозиуме была принята классификация СДС, которая является наиболее распространённой. [1] Она предполагает разделение заболевания на три типа в зависимости от преобладающего патологического процесса:
- нейропатическая инфицированная стопа:
- длительное течение сахарного диабета;
- позднее возникновение осложнений;
- отсутствие болевого синдрома;
- цвет и температура кожи не изменены;
- уменьшение всех видов периферической чувствительности;
- наличие периферического пульса.
Классификация Вагнера
По степени выраженности поражений тканей стопы выделяют следующие стадии СДС: [6] [7]
- Стадия 0 — изменение костной структуры стопы — артропатия;
- Стадия 1 — изъязвление (язвы) кожи;
- Стадия 2 — изъязвление всех мягких тканей, дном язвы являются кости и сухожилия;
- Стадия 3 — абсцедирование и остеомиелит (воспаление костной ткани);
- Стадия 4 — образование гангрены дистальных отделов стопы (пальцев);
- Стадия 5 — образование гангрены стопы и отделов голени.
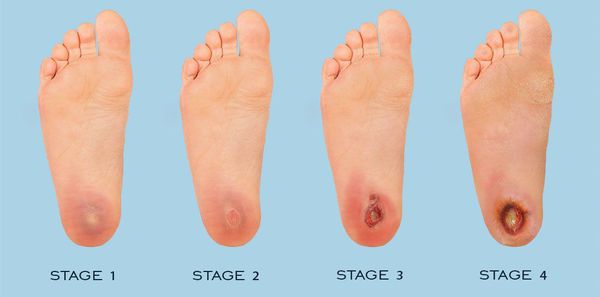
Классификация Техасского университета
Данная классификация была разработана в 1996-1998 годах. [8] В её основе лежит оценка язвы по глубине, наличию инфицирования и ишемии — риска ампутации конечности.
Читайте также:

