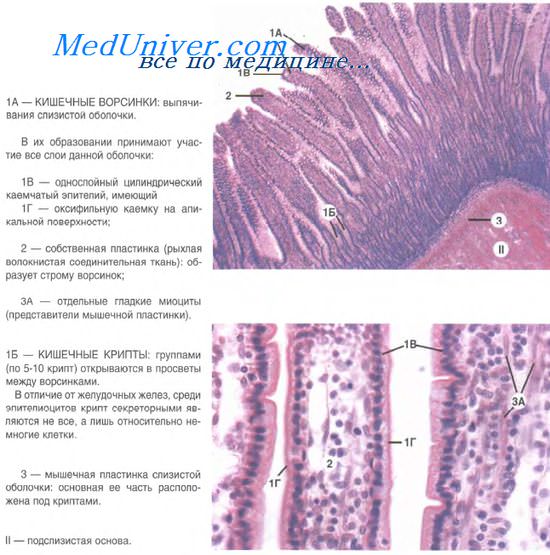
Человек не может есть из за эпителии
Обновлено: 26.04.2024
Влияние продуктов питания на полярность эпителия кишечника
Деятельность клеток скелетных мышц не зависит от полярности клеток. Например, мышечные клетки получают сигналы о поступлении глюкозы от любой точки цитоплазматической мембраны, и, насколько можно в настоящее время предполагать, изменения в экспрессии генов не зависят от места попадания глюкозы в клетку. Клетки в составе эпителия различаются по своей полярности. Это разделение между апикальной (граничащей с содержимым кишки в случае кишечного эпителия) и базолатеральной частями является существенным для активности эпителия. Данное свойство клеток хорошо изучено относительно переноса нутриентов через эпителий кишки. Существуют различия в переносе через апикальную и базолатеральную мембраны ионов, молекул малого размера и макромолекул.
Именно полярность эпителия определяет направление движения этих субстанций через эпителий (внутрь клетки или наружу из нее). Данное свойство следует учитывать также и при обсуждении других функций эпителиальной клетки. Полярность особенно важна при исследовании взаимодействия нутриентов и генов в кишечном эпителии. Полярность эпителиальных клеток характеризует два важнейших механизма, посредством которых нутриенты (и другие компоненты содержимого кишки) оказывают влияние на гены:
(1) прямое воздействие содержимого кишки на энтероциты;
(2) непрямое воздействие, осуществляемое через гормоны, фактор роста и цитокины.
Более того, кишечный эпителий выступает в роли барьера между организмом и внешней средой, которую в данном случае представляет содержимое кишки. Этот барьер не является полностью непроницаемым, поскольку кишечник выборочно «позволяет» макромолекулам проходить через него. Кроме того, происходит активная абсорбция нутриентов. Постепенно стало понятно, что энтероцит выступает в роли иммунной клетки. Он имеет рецепторы для продуктов деятельности бактериальных клеток, а также участвует в экспрессии разнообразных молекул на своей поверхности, имеющей иммуноглобулиновые домены. Эпителиальная клетка также экспрессирует белки, которые могут взаимодействовать с иммуноцитами в кишечнике. К этим белкам относят такие поверхностные молекулы, как молекулы главного комплекса гистосовместимости (ГКГС) класса II и те цитокины, которые высвобождаются из эпителия, например хемокины или интерлейкин (IL) 6.
Перечисленные сигнальные белки дают возможность эпителиальной клетке играть ведущую роль в процессах, происходящих в кишечнике. Исследовательская группа выдвинула гипотезу, что изменения содержимого кишечника регулируют экспрессию эпителиальной клеткой сигнальных молекул. Это означает, что изменения содержимого кишечника в результате вариаций в диете оказывают влияние через эпителий кишечника на другие его структуры, особенно на иммунную систему его слизистой оболочки. Существуют два компонента сигнального пути, связывающие питание и бактерии, находящиеся в просвете кишки, с иммунной системой слизистой оболочки:
(1) афферентный путь, включающий механизмы, посредством которых изменение кишечного содержимого влияет на экспрессию генов в кишечном эпителии;
(2) эфферентный путь, представляющий собой действие белков, экспрессированных эпителиальной клеткой, действующей как компонент иммунной системы кишечника. В настоящее время существуют доказательства функционирования обоих путей.
Современная наука позволяет изучить изменения, происходящие с молекулами в эпителии кишки в ответ на изменения в диете (афферентный путь). В качестве экспериментальной модели может выступить экспрессия молекул ГКГС класса II в эпителии мыши, которая только что перестала получать грудное молоко. Молекулы ГКГС класса II ответственны за презентацию антигена, их экспрессия на эпителии кишечника мышей отмечается после их отлучения от груди, поэтому возможен перевод мышей на привычную для них пищу (корм для мышей) или определенного состава жидкую смесь (энтеральное питание) для изучения разницы между двумя видами питания. Эпителиальные клетки мыши исследовали в разные моменты времени после прекращения кормления ее грудным молоком. При этом изучали экспрессию молекул ГКГС класса II и инвариантную цепь, которая также подвергается экспрессии.
Воздействие энтерального питания (Vivonex) значительно отличалось от такового при кормлении мышей обычным для них кормом.
В норме корм для мышей индуцирует экспрессию генов сигнальных молекул между 20 и 30 днями жизни, в то время как энтеральное питание за этот же период не приводит к экспрессии генов в кишечном эпителии. В настоящее время доказано, что регуляторный нуклеарный белок (трансактиватор класса II, СIIТА) является необходимым и достаточным условием для экспрессии молекул ГКГС класса II.
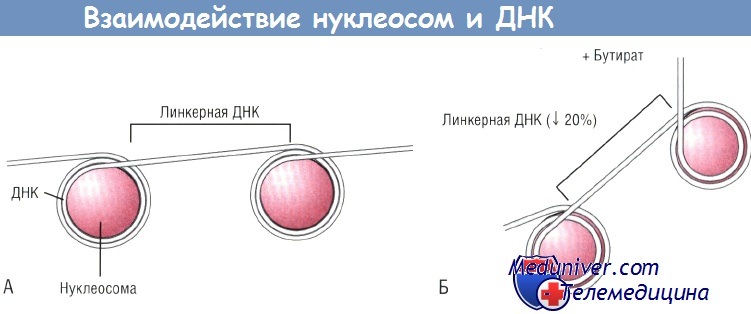
(А) ДНК делает два полных оборота вокруг нуклеосом, состоящих из неацетилированных гистонов.
(Б) При бутират-индуцированном ацетилировании нуклеосомы раширяются, при этом уменьшается количество оборотов ДНК вокруг нуклеосом до 1,8 и сокращается длина связующего их участка ДНК (линкерной ДНК).
В результате ДНК не может линейно следовать от нуклеосомы к нуклеосоме, поворачивается под углом после каждой нуклеосомы, что ведет к нарушению совокупности нуклеосом. ДНК — дезоксирибонуклеиновая кислота.
Были проведены эксперименты с целью изучить, действительно ли влияние питания опосредовано трансактиватором класса II. У мышей были выявлены три изоформы СИТА. Интересно, что нормальная комплексная диета повышала экспрессию молекул ГКГС класса II посредством СIIТА IV. Кроме регуляции молекул ГКГС класса II посредством диеты отмечалась еще и медленная, зависимая от времени регуляция посредством СIIТАIII. Данные эксперименты показывают, что изменения в диете соответствуют определенным изменениям молекулярных взаимосвязей между содержимым кишечника и механизмом сигнальной трансдукции в эпителиальной клетке.
Бактериальная ферментация тех углеводов, которые не абсорбировались в кишечнике, приводит к продукции короткоцепочечных жирных кислот (КЦЖК). Это означает, что уровень бутирата отражает изменения в популяции бактерий и в тех субстратах, которые доступны для метаболизма бактерий. Уровень бутирата сильно зависит от внешних воздействий. Например, у новорожденных детей отмечают очень низкие уровни бутирата как в тонкой, так и в толстой кишке; уровень бутирата в организме ребенка достигает уровня взрослого к 2-летнему возрасту. Интересно, что в течение первых 6 мес жизни уровни бутирата намного выше у детей, находящихся на искусственном вскармливании, чем у детей, получающих грудное молоко.
Следовательно, уровень бутирата отражает те изменения, которые происходят в содержимом кишечника. Было высказано предположение, что концентрация бутирата может изменять активность сигнала в эпителиальной клетке. Исходя из этой гипотезы было исследовано воздействие бутирата на IL-8 и экспрессию моноцитарного хемотаксического протеина 1 (МСР-1). Увеличение концентрации бутирата повышало секрецию IL-8 при одновременном снижении экспрессии МСР-1. Эти эффекты были обнаружены в популяциях неактивных эпителиальных клеток, но наибольшие изменения были характерны для клеток, стимулированных такими провоспалительными агентами, как липополисахариды (ЛПС) или IL-1b.
Известно, что бутират изменяет ацетилирование гистонов. Нуклеосома состоит из соленоида гистонов, вокруг которого дважды «обернута» ДНК. Бутират повышает ацетилирование гистона, тем самым снижая его компактность. В результате ДНК не может «обернуться» вокруг большой нуклеосомы полным оборотом, а нуклеосома теряет способность упаковываться в плотную структуру. Это «обнажает» ДНК и делает ее более подверженной действию факторов транскрипции. Было высказано предположение, что таким образом бутират изменяет экспрессию хемокинов. Для проверки данной гипотезы был использован фунгицид трихостатин A (TSA), в 700 раз более мощный индуктор ацетилирования гистонов по сравнению с бутиратом.
Если бы действие бутирата на секрецию хемокина было обусловлено повышением ацетилирования гистонов, то можно было бы ожидать подобного эффекта и от TSA. Опыты с TSA показали, что TSA повышал секрецию IL-8 и снижал секрецию МСР-1. В нижней части рисунка продемонстрировано, что и TSA, и бутират повышали ацетилирование гистона-4. Неацетилированные гистоны быстрее продвигались через гель и образовывали одну полоску («ступеньку»), в то время как ацетилированные гистоны образовывали «лестницу» в зависимости от степени ацетилирования. Гистон-4 имеет 4 ацетилированных остатка лизина. Таким образом, ацетилирование гистонов будет отражено в образовании «лестницы» из 5 «ступенек». Это можно увидеть при действии бутирата или TSA. Верхняя часть рисунка показывает, что TSA дает такой же эффект, как и бутират. TSA повышает секрецию IL-8 и снижает секрецию МСР-1. Более того, степень увеличения IL-8 меняется в зависимости от степени ацетилирования гистонов. Эффект бутирата на ацетилирование гистонов обратим.
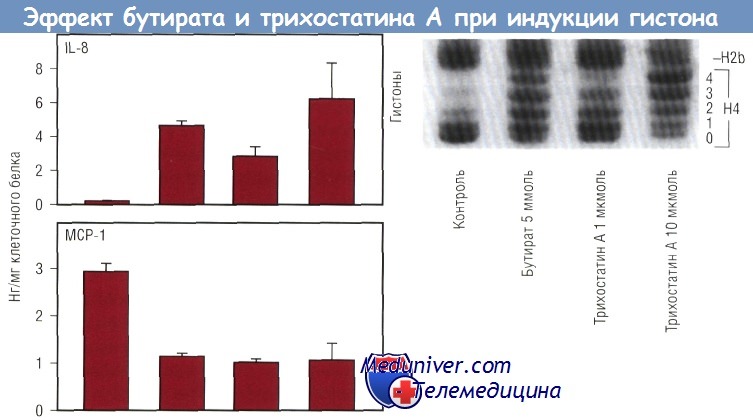
Ацетилирование и секреция хемокина клетками Сасо-2. Как бутират, так и трихостатин А увеличивали ацетилирование гистонов. Одновременно увеличивалась секреция IL-8 и уменьшалась продукция МСР-1 в клетках Сасо-2, стимулированных IL-1.
Трихостатин А, специфический ингибитор гистондеацетилазы, действовал так же, как и бутират, когда поступал в концентрациях, приводящих к сравнимому изменению ацетилирования гистона.
На диаграмме представлены стандартные отклонения трех различных ячеек для каждого вещества, отражающие результаты трех экспериментов. IL — интерлейкин; МСР — моноцитарный хемотаксический протеин.
После прекращения действия бутирата ацетилирование гистонов возвращается к норме и отмечается такое же действие IL-1b на секрецию IL-8 и секрецию МСР-1, как до эксперимента. КЦЖК с различной длиной цепи оказывают дифференцированное влияние на ацетилирование гистонов. Бутират является наиболее действенной КЦЖК, индуцирующей ацетилирование гистонов, в то время как от кислот с большей или меньшей углеводной цепью наблюдаются менее выраженные эффекты. Данное влияние на ацетилирование гистонов обусловлено действием на экспрессию IL-8 и МСР-1. Из всех использованных в опыте КЦЖК именно бутират вызывает наибольшее увеличение секреции IL-8 и наиболее выраженное уменьшение секреции МСР-1.
Итак, эти опыты показывают, что бутират изменяет экспрессию хемокинов в эпителиальной клетке. КЦЖК изменяют экспрессию посредством ацетилирования гистонов. Данные эксперименты, однако, не исключают возможность того, что дополнительное действие бутирата может быть опосредовано промоторными системами. Действительно, недавно проведенные исследования показали, что бутират снижает экспрессию связывающего инсулиноподобный фактор роста белка (IGFBP) 3, посредством ацетилирования протеина, ингибирующего связывание ДНК. В дальнейшем необходимо исследовать взаимосвязь между хромосомной регуляцией, продемонстрированной в приведенном эксперименте, и регуляцией, обусловленной промотором, как для бутирата, так и для других молекул содержимого кишечника.
Доказательство действия экспрессии генов эпителиальных клеток на иммунную систему слизистой оболочки (эфферентного пути) основано на возможности селективного изменения экспрессии генов в эпителиальной клетке кишечника посредством трансгенных технологий. В качестве модели для демонстрации управления иммунной системой слизистой оболочки эпителием была использована экспрессия хемокинов в эпителии. Хемокин IL-8, который у человека отвечает за мобилизацию нейтрофилов, был первым из идентифицированных хемотаксических цитокинов. Однако IL-8 у мышей не экспрессирован. Для изучения действия хемокинов на иммунную систему слизистой оболочки была разработана система, с помощью которой макрофагальный воспалительный белок 2, имеющий эффект, практически подобный эффекту IL-8 у человека, был присоединен к промотору FABPI (белок кишечника, связывающий жирную кислоту).
Промотор активен только в эпителиальных клетках тонкой кишки и проксимального отдела толстой кишки. Была разработана специальная «конструкция», где промотор FABPI и макрофагальный воспалительный белок 2 комплементарной ДНК (кДНК) были присоединены к интрону и полиадениловому «хвосту». Эта «конструкция» была внедрена в яйцеклетку мыши. Было выявлено, что эпителий первой генерации экспрессирует макрофагальный воспалительный белок 2 мРНК. Анализы показали воздействие этой «конструкции» на мобилизацию как нейтрофилов, так и лимфоцитов. У трансгенной мыши отмечали повышенную мобилизацию нейтрофилов в собственной пластинке слизистой оболочки кишечника и в эпителиальных клетках. Эффект хемокина был отмечен только в тех клетках, где промотор FABPI был активен. В тонкой кишке, где промотор FABPI активен, мобилизация нейтрофилов, выражающаяся активностью миелопероксидазы (на единицу массы кишки), была значительно выше у трансгенных мышей. В проксимальной кишке, где промотор FABPI также активен, отмечали увеличение нейтрофильной инфильтрации.
Однако в дистальном отделе толстой кишки, где промотор FABPI неактивен, подобных эффектов отмечено не было. Кроме того, в печени и селезенке трансгенных мышей не выявляли увеличения инфильтрации больше, чем у нормальных мышей (в этих органах промотор FABPI неактивен). На первый взгляд, эти данные свидетельствуют о том, что эпителиальная клетка может посредством высвобождения хемокинов изменять иммунную функцию слизистой оболочки в кишечнике in vivo.
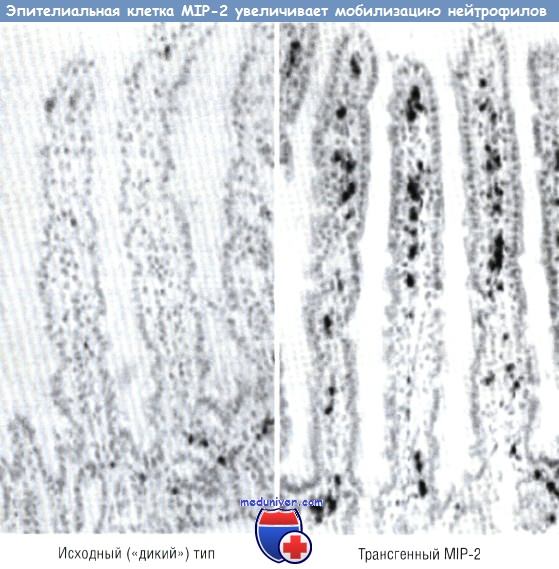
У трансгенной мыши MIP-2 экспрессирует эпителий кишечника, используя эпителий-специфический промотор. Нейтрофилы были локализованы с помощью миелопероксидазы.
MIP — макрофагальный воспалительный белок
Дальнейший анализ иммунной системы показал, что в тонкой кишке помимо инфильтрации нейтрофилов была отмечена повышенная инфильтрация лимфоцитов. Их количество в собственной пластинке слизистой оболочки было увеличено. Также было отмечено удвоение числа лимфоцитов в эпителиальном слое слизистой оболочки кишки. Исследование рецепторов, расположенных на поверхности лимфоцитов, локализованных в эпителии, показало, что лимфоциты экспрессировали CXCR2, который является рецептором, отвечающим за трансдукцию активности макрофагального воспалительного белка 2. Таким образом, эксперименты показывают, что изменение экспрессии только одного хемокина в эпителии влияет на функцию как лимфоцитов, так и нейтрофилов.
Однако изменения содержимого кишечника могут оказывать воздействие на многие хемокины. Кроме того, вероятен эффект воздействия на иммунную систему и других цитокинов. Становится понятно, что изменения экспрессии генов в эпителии оказывают большое влияние на остальные составляющие иммунной системы слизистой оболочки.
Существует гипотеза, что эти сигнальные процессы важны не только для понимания физиологии здорового организма, но и для лечения заболеваний. Например, начальным этапом терапии детей с болезнью Крона в Великобритании является лечебное питание. Несмотря на то что известны многие механизмы, посредством которых энтеральное питание проявляет свои лечебные свойства, есть мнение, что еще одним методом может быть радикальная смена содержимого кишечника до такой степени, что изменятся сигналы, идущие от эпителия кишечника к иммунному компоненту слизистой оболочки, в результате снизится экспрессия воспаления при болезни Крона. Этим методом можно достигать уменьшения активности воспалительного процесса при данной патологии.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Моча – биологическая жидкость, которая может отражать состояние организма, а ее показатели – свидетельствовать о заболеваниях различных органов и систем.
Во многих случаях даже визуальная оценка мочи позволяет сделать предположения о возможных патологических процессах, протекающих в организме.
Особенно это касается распространенных почечных заболеваний (пиелонефрит, гломерулонефрит), диагностировать которые врач может, в основном ориентируясь на результаты анализа мочи.
Объем мочи, выделенной в течение суток, может служить показателем работы не только мочевыделительной, но и сердечно-сосудистой системы.
В норме за сутки человек выделяет от 1,5 до 2 л мочи. Однако эта величина – усредненный показатель, и после однократного измерения объема суточной мочи нельзя с уверенностью говорить о каком-либо заболевании. Например, после потребления большого количества жидкости и белковых продуктов выработка мочи увеличится, и наоборот, если в организм поступает мало жидкости или много соли – уменьшится. Объем мочи сокращается при физических нагрузках, когда жидкость выводится с потом. Повышение температуры тела, диарея, рвота также приводят к снижению выделения мочи. Количество выделяемой мочи меняется в течение суток: возрастает в утренние и дневные часы и уменьшается в вечерние и ночные вследствие снижения давления крови и уменьшения фильтрации жидкости почками.
- полиурия – повышенное количество выделенной мочи (более 2000 мл в сутки);
- олигурия – пониженное количество выделенной мочи (менее 500 мл в сутки);
- анурия – суточное выделение мочи менее 50 мл.
Полиурия отмечается при хронических заболеваниях почек, сахарном и несахарном диабете, гиперпаратиреозе и т. д.
Олигурия наблюдается при заболеваниях почек (пиелонефрит, гломерулонефрит), а также при уменьшении просвета или обтурации мочевыводящих путей камнем или опухолью. Олигурия также возникает при массивной кровопотере, интоксикации, голодании, обширных ожогах, резком снижении артериального давления.
При задержке мочеиспускания почки работают полноценно, но выход мочи из мочевого пузыря затруднен у мужчин из-за сжатия мочеиспускательного канала увеличенной простатой при ее воспалении или опухоли,


переливании несовместимой крови, отравлении ядами, сепсисе, шоке. В ряде случаев анурия может быть связана с нарушением оттока мочи из-за камней, сдавления мочеточников опухолью, случайной перевязки или пересечения мочеточников при операциях. Длительная анурия ведет к уремии – отравлению организма вредными веществами, которые должны выводиться с мочой.
Моча здорового человека имеет светло-желтый цвет. Если человек потребляет много жидкости, моча светлеет, при недостатке воды становится интенсивно-желтого цвета.
Моча меняет цвет в зависимости от продуктов и напитков, потребляемых человеком. Свекла окрашивает мочу в розовый цвет, морковь – в оранжевый. На цвет мочи влияют и некоторые лекарства. Насыщенно-желтый цвет моча приобретает от рибофлавина, нитроксолина, красноватый – от аминофеназона, фениндиона и больших доз ацетилсалициловой кислоты, оранжевый – от фуразидина, нитрофурантоина, рифампицина, темно-коричневый – от метронидазола.
Цвет мочи – хороший индикатор обмена веществ, поэтому его изменение может служить признаком некоторых заболеваний.
Темно-желтый, почти коричневый цвет может указывать на повышенное содержание билирубина, что происходит при гепатитах, циррозе, желчнокаменной болезни, при массивном разрушении эритроцитов (после перенесенных инфекций, осложнений при переливании крови, малярии). Мутной буро-красного цвета моча становится при гломерулонефрите. При пиелонефрите моча может изменять цвет от грязно-желтого до розово-желтого, а при почечной колике (мочекаменной болезни), инфаркте почки может приобретать насыщенно-красный цвет.
Прозрачность мочи также входит в число основных параметров в анализе. Свежевыпущенная моча прозрачна, однако ее мутность может свидетельствовать не только о заболеваниях, но и о нарушении гигиенической обработки перед мочеиспусканием. В постоявшей (или несвежей) моче выпадает осадок, который состоит из слизи и солей.
Мутность мочи можно объяснить присутствием солей (фосфатов, оксалатов, уратов) при нарушении обмена веществ, мочекаменной болезни; микроорганизмов, клеток эпителия, лейкоцитов, эритроцитов – при цистите, пиелонефрите; белка – при гломеруло- и пиелонефрите.
Удельный вес мочи здорового человека колеблется в пределах 1010-1020 г/л. Большое количество выпитой воды приводит к снижению удельного веса, при недостаточном поступлении в организм воды, а также при усиленном потоотделении, рвоте, диарее удельный вес мочи повышается. Слабо окрашенная моча чаще имеет низкий удельный вес, интенсивно-желтая – высокий.
Низкий удельный вес указывает на нарушение работы почек, например, при хроническом пиелонефрите или при синдроме Кушинга. Высокий удельный вес мочи обусловлен большим содержанием в ней растворенных и нерастворенных веществ: белка при остром гломерулонефрите, глюкозы при сахарном диабете, лейкоцитов и эритроцитов при цистите и воспалительных заболеваниях, солей при мочекаменной болезни, а также отмечается при нарушении питьевого режима и обезвоживании. Часто высокий удельный вес мочи бывает следствием применения высоких доз препаратов, выводимых с мочой (антибиотики и др.).
Если моча имеет резкий запах нашатыря, это может служить признаком обезвоживания, пиелонефрита, цистита. Запах несвежей рыбы возникает при воспалительных и инфекционных заболеваниях мочеполового тракта. Моча пахнет ацетоном при осложнении течения сахарного диабета (тревожный симптом диабетической комы).
Неприятный запах в сочетании с пенистостью мочи может указывать на наличие в ней белка, что требует обязательной консультации уролога.
У здорового человека при полноценном питании моча имеет слабокислую реакцию. Если в диете преобладают те или иные продукты, реакция мочи может сдвигаться в кислую или щелочную сторону.
При употреблении преимущественно мясной пищи и других богатых белками веществ реакция мочи становится кислой; растительная пища дает щелочную реакцию.
Заболевания тоже меняют кислотно-щелочной баланс. При высокой температуре, диабете, голодании рН мочи становится кислой; при циститах, гематурии, рвоте, раке мочевого пузыря и почек, повышении уровня гормонов паращитовидных желез – щелочной.
Заметив постоянные изменения цвета, запаха, количества мочи, необходимо в первую очередь посетить терапевта.
Врач на основании осмотра и жалоб пациента дает направления на соответствующие анализы. Только после получения результатов анализов мочи и крови решается вопрос о дальнейших консультациях. При наличии в моче белка, эритроцитов, лейкоцитов и цилиндров необходим визит к нефрологу или урологу, при повышенном удельном весе и обнаружении в моче глюкозы – к эндокринологу.
В первую очередь следует обратить внимание на питьевой режим, диету, соотнести изменения в моче с употребляемыми лекарственными препаратами.
Основные показатели мочи: цвет, плотность, реакцию, наличие глюкозы, лейкоцитов, эритроцитов и клеток эпителия определяют с помощью общего анализа мочи.
Метод определения Определение физико-химических параметров выполняется на автоматическом анализаторе методом «сухой химии». Аппаратная микроскопия проводится методом планарной цитометрии с использованием осевого гидродинамического фокусирования и автоматического распозна.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Вирус папилломы человека: причины появления, симптомы, диагностика и способы лечения.
Определение
Вирусы папилломы человека (ВПЧ) — это группа чрезвычайно распространенных и генетически разнородных ДНК-содержащих вирусов, поражающих эпителий кожных покровов и слизистых оболочек. Вирус папилломы человека относится к семейству папилломавирусов. Было выявлено и описано более 190 типов ВПЧ. Каждый тип отличается более чем на 10% от ближайшего родственного штамма. Из их числа более 30 типов ВПЧ могут инфицировать эпителиальный слой урогенитального тракта. В зависимости от онкогенного потенциала выделяют вирусы высокого (типы 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59) и низкого (типы 6, 11, 42, 43, 44) онкогенного риска.
На долю двух высокоонкогенных типов ВПЧ (16 и 18) приходится до 70% случаев рака шейки матки, 80% рака вульвы и влагалища, 92% анального рака, 95% рака ротовой полости, 89% рака ротоглотки, 63% рака полового члена.
При этом 16-й тип имеет самый высокий канцерогенный потенциал. Генотипы ВПЧ 6 и 11 вызывают практически все виды аногенитальных бородавок и большинство случаев рецидивирующего респираторного папилломатоза, который наблюдается в основном у детей младше 5 лет или у лиц 20-30 лет.
Причины появления ВПЧ
Заболевания, вызванные вирусом папилломы человека (ВПЧ), относятся к болезням с латентным началом, хроническим персистирующим течением и проявляются доброкачественными и злокачественными новообразованиями в зоне входных ворот инфекции.
Источником возбудителя инфекции является больной человек или носитель. ВПЧ передается от человека к человеку при оральном, генитальном и анальном половых контактах, а также контактно-бытовым и вертикальным (от матери к ребенку) путями.
Вирус папилломы человека — единственный вирус, который не проникает в кровь, вследствие чего инфекционный процесс протекает без развития воспалительной реакции. В процессе инфицирования вирус папилломы человека поражает незрелые клетки, чаще базального слоя, которые затем становятся постоянным источником инфицирования эпителиальных клеток. Инфицированию способствует наличие микротравм и воспалительных процессов кожи и слизистых оболочек, приводящих к снижению местного иммунитета.
Вирус способен персистировать (хронически присутствовать) в месте проникновения как угодно долго. Инкубационный период заболевания может длиться от нескольких месяцев до нескольких лет. Среднее время между инфицированием ВПЧ и развитием аногенитальных бородавок составляет от 3 месяцев у женщин и до 11 месяцев у мужчин. Инфицирование человека может происходить как одним, так и несколькими типами ВПЧ.
Интервал между инфицированием ВПЧ и прогрессированием до инвазивного рака составляет, как правило, 10 лет или более.
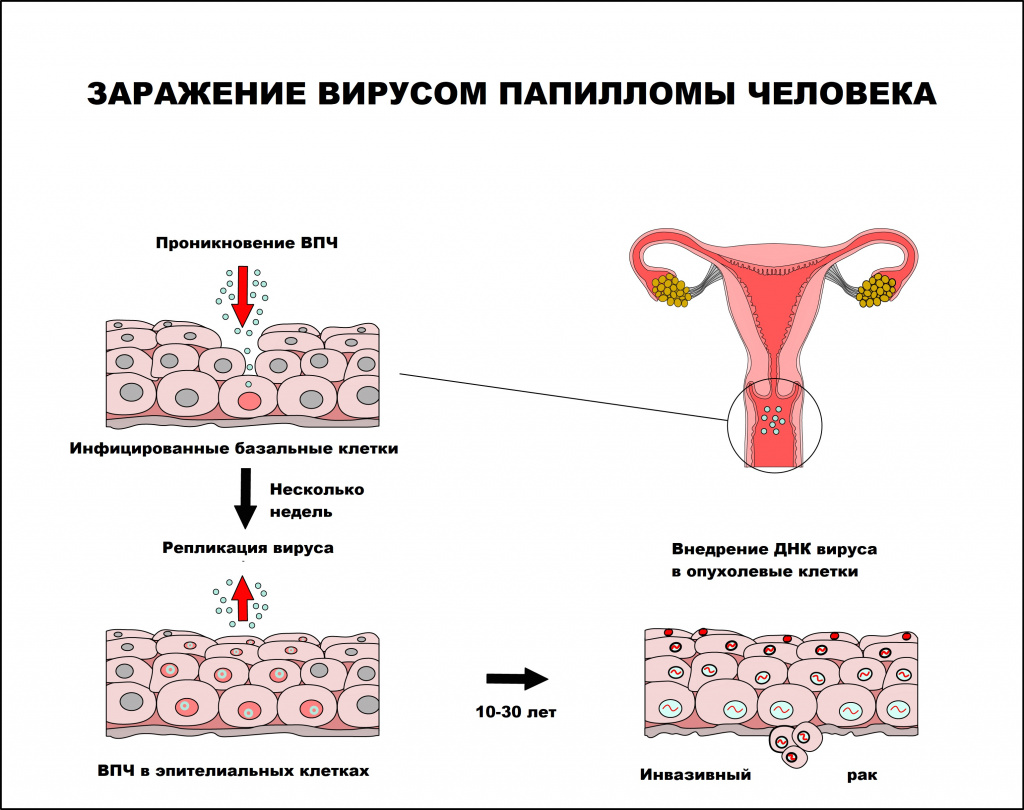
Папилломавирусная инфекция чаще регистрируется у лиц молодого возраста, имеющих большое число половых партнеров. По данным ВОЗ, 50-80% населения инфицировано ВПЧ, но лишь 5-10% инфицированных лиц имеют клинические проявления заболевания.
Классификация заболевания
Общепринятой классификации аногенитальных (венерических) бородавок не существует. Однако выделяют несколько их клинических разновидностей:
- остроконечные кондиломы;
- бородавки в виде папул;
- поражения в виде пятен;
- внутриэпителиальная неоплазия;
- бовеноидный папулез и болезнь Боуэна;
- гигантская кондилома Бушке-Левенштайна (карциномоподобная остроконечная кондилома).
Симптомы ВПЧ
- наличие одиночных или множественных образований в виде папул, папиллом, пятен на кожных покровах и слизистых оболочках половых органов;
- зуд и парестезии (расстройство чувствительности) в области поражения; болезненность во время половых контактов (диспареуния);
- при локализации высыпаний в области уретры наблюдается зуд, жжение, болезненность при мочеиспускании (дизурия); при обширных поражениях в области уретры – затрудненное мочеиспускание;
- болезненные трещины и кровоточивость кожных покровов и слизистых оболочек в местах поражения.
Бородавки в виде папул – папулезные высыпания без пальцеобразных выпячиваний, локализующиеся на кератинизированном эпителии половых органов.
Поражения в виде пятен – серовато-белые, розовато-красные или красновато-коричневые пятна на коже и/или слизистой оболочке половых органов;
Бовеноидный папулез и болезнь Боуэна – папулы и пятна с гладкой или бархатистой поверхностью; цвет элементов в местах поражения слизистой оболочки – бурый или оранжево-красный, а поражений на коже – пепельно-серый или коричневато-черный.
Гигантская кондилома Бушке-Левенштайна – мелкие бородавчатоподобные папилломы, сливающиеся между собой и образующие очаг поражения с широким основанием.
Респираторный папилломатоз – заболевание, при котором папилломы формируются в дыхательных путях, ведущих от носа и полости рта в легкие.
Диагностика ВПЧ
Латентно протекающая инфекция диагностируется только с помощью молекулярно-биологических методов исследования. Субклиническая инфекция диагностируется при молекулярно-биологическом, кольпоскопическом, цитологическом и морфологическом исследовании.
Для улучшения визуализации аногенитальных бородавок может быть проведена проба с 3-5% раствором уксусной кислоты. Тест считается отрицательным, если после обработки уксусной кислотой на поверхности шейки матки нет белых участков. И положительным при выявлении на шейке матки участков белого цвета (ацетобелых участков), отличных от остальной поверхности шейки матки.
Изменения эпителия шейки матки, вызванные ВПЧ, могут быть выявлены цитологическим методом микроскопии слущенных клеток с окраской по Папаниколау (Пап-тест).
Метод окрашивания по Папаниколау - специально разработанный метод, позволяющий с наибольшей степенью достоверности выявить ранние предраковые заболевания шейки матки. Рак шейки матки в структуре злокачественных новообразований репродуктивной системы занимает третье место. До 1992 г. заб.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Хеликобактериоз: причины появления, симптомы, диагностика и способы лечения.
Определение
Хеликобактериоз – инфекционное заболевание, поражающее пилорический отдел желудка, или привратник, и двенадцатиперстную кишку. Его возбудителем является уникальная патогенная микроаэрофильная грамотрицательная бактерия хеликобактер пилори (H. pylori). Свое название бактерия получила за счет отдела желудка, в котором она обитает – пилорического.
В результате своей жизнедеятельности H. pylori формирует вокруг себя «облако» щелочной среды, что позволяет этой бактерии выживать в агрессивной кислотной среде желудка, вызывая ускоренную секрецию соляной кислоты, а также снижение секреции щелочи в двенадцатиперстной кишке.
В результате микроорганизм еще сильнее колонизирует слизистую оболочку, формирует ее повышенную восприимчивость к соляной кислоте и провоцирует воспаление, приводящее к развитию язвенных дефектов.
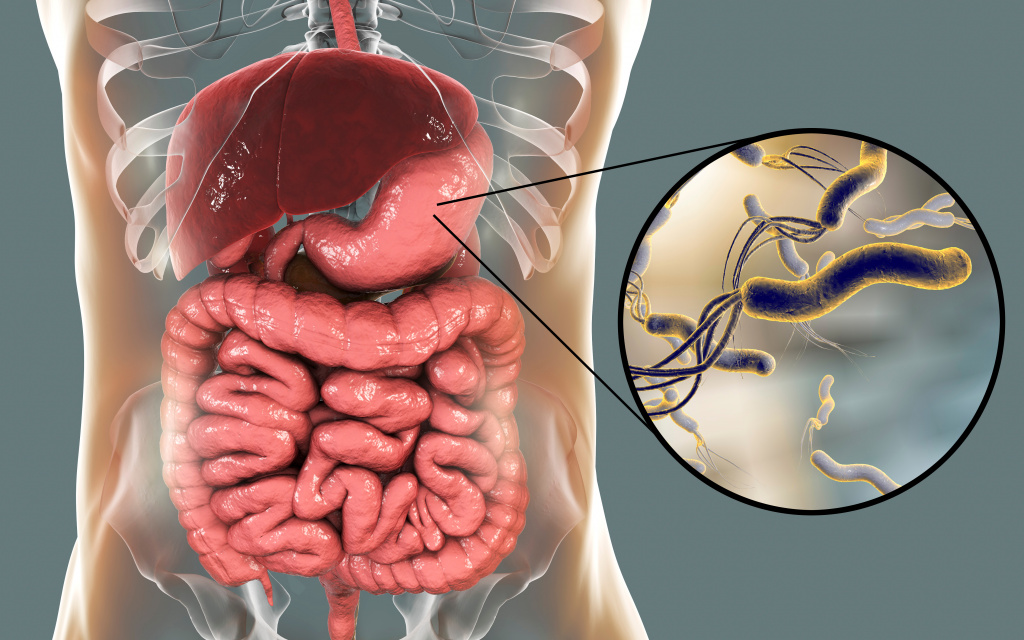
Хеликобактер пилори – спиралевидная бактерия длиной 3,5 и шириной 0,5 микрон. Она имеет жгутики, с помощью которых свободно перемещается по стенке желудка либо надежно на ней закрепляется. Бактерия H. pylori очень изменчива, ее штаммы (разновидности) отличаются друг от друга способностью прикрепляться к слизистой оболочке желудка, вызывать воспалительный процесс и обладают разной степенью патогенности.

Хеликобактер пилори, колонизирующая слизистую оболочку желудка, — частая причина ее воспалительных изменений, она признана этиологическим фактором гастрита, а сам гастрит — инфекционным заболеванием. В зависимости от состояния защитных факторов желудка возникший инфекционный процесс может протекать латентно или с выраженной клинической симптоматикой воспаления. Согласно современным представлениям, H. pylori вызывает хронический гастрит у всех зараженных лиц. Это может привести к язвенной болезни, атрофическому гастриту, аденокарциноме желудка или низкодифференцируемой лимфоме желудка. H. pylori относится к канцерогенам первого порядка.
Результаты многочисленных исследований дают основание предполагать возможную патогенетическую или опосредованную роль инфекции H. pylori в развитии и/или течении заболеваний, не относящихся к пищеварению: кардио-, цереброваскулярных, аутоиммунных заболеваний, заболеваний крови, кожи, нервной системы и многих других.
Патоген отличается относительной устойчивостью к окружающей среде: при кипячении хеликобактерии гибнут практически мгновенно, при обработке дезинфицирующими составами — в течение нескольких минут.
Причины появления хеликобактериоза
Заразиться бактерией можно при контакте с загрязненной водой или продуктами питания. Инфицирование возможно во время проведения эндоскопии и при использовании других плохо стерилизованных медицинских инструментов, которые имели прямой контакт со слизистой желудка пациента.
Бытовой способ передачи (например, через поцелуи, личные вещи и проч.) также возможен, о чем свидетельствует выделение бактерии из слюны и зубного налета.
Распространенность инфекции варьируется в зависимости от географического региона, возраста пациента, его этнической принадлежности и социально-экономического статуса. По данным Департамента здравоохранения г. Москвы (2019), распространенность этой инфекции в Москве составляет 60,7–88%, в Санкт-Петербурге - 63,6%, в Восточной Сибири достигает 90%.
Классификация заболеваний
Заболевания, связанные с H. pylori:
- гастрит,
- дуоденит,
- гастродуоденит,
- эзофагит,
- язвенная болезнь желудка,
- язвенная болезнь двенадцатиперстной кишки,
- железодефицитная анемия неясного генеза,
- рак желудка,
- рак двенадцатиперстной кишки.
Основной жалобой, с которой больные с признаками Helicobacter-инфекции обращаются к врачу, являются желудочные боли. Локализация симптома может меняться и переходить в область расположения двенадцатиперстной кишки.
Боли бывают острыми, ноющими, тупыми, возникают в верхних отделах живота слева и по центру в околопупочной области. Дискомфорт может возникать при длительном голодании, натощак или через определенное время после приема пищи.
Симптоматика хеликобактериоза зависит от клинической формы заболевания и может включать:
- чувство тяжести в животе после еды;
- нарушение аппетита, связанное с внезапными приступами тошноты (если слизистая желудка сильно травмирована);
- беспричинная рвота на фоне нормальной температуры тела;
- изжога (жгучие ощущения в пищеводе и даже гортани) и отрыжка с неприятным кислым или горьким привкусом;
- хронические запоры (отсутствие дефекации в течение трех суток и более);
- разжижение каловых масс, появление пенистой или водянистой консистенции;
- кишечные спазмы и вздутие живота.
- снижение аппетита до полного его отсутствия;
- тошнота может сменяться рвотой со сгустками крови;
- резкое снижение массы тела, не являющееся нормой;
- сухость во рту и привкус металла;
- появление белого налета на языке;
- неприятный запах изо рта при отсутствии кариеса;
- заеды в уголках рта;
- кровоточивость десен.
Диагностика хеликобактериоза
Долгое время хеликобактериоз может никак себя не проявлять, при этом провоцируя развитие язвы, аденокарциномы или мальтомы желудка. В особой зоне риска люди, чьи родственники имеют эти заболевания в анамнезе.
Диагностика может быть инвазивной (эндоскопия с последующей биопсией желудочных тканей) и неинвазивной (лабораторные исследования).
Согласно международным рекомендациям, методами выбора для диагностики бактерии и оценки эффективности лечения H. pylori служат дыхательный̆ тест с мочевиной, меченной 13С и определение специфических антигенов H. pylori в кале иммунохроматографическим методом.
Синонимы: Дыхательный тест с 13С-меченной мочевиной. 13 UBT; 13C-UBT. Краткая характеристика 13С-уреазного дыхательного теста Дыхательный тест в текущей модификации предназначен для лиц старше 12 лет. 13С-уреазный дыхательный тест относится к неинвазивным безопасным методам исследования.
Что такое мукозит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Абдуллаевой Айтан Измировны, детского стоматолога со стажем в 8 лет.
Над статьей доктора Абдуллаевой Айтан Измировны работали литературный редактор Юлия Липовская , научный редактор Пётр Козлов и шеф-редактор Маргарита Тихонова

Определение болезни. Причины заболевания
Мукозит (mucositis) — это поражение слизистых оболочек ЖКТ в виде воспаления и язв, которое развивается из-за лучевой или химиотерапии при лечении рака. Появляется чаще в области рта и глотки: в основном поражает слизистую оболочку мягкого нёба, боковой границы языка, стенки глотки, а также слизистую губ, щёк, средней части языка и дна полости рта [1] [2] .

Мукозитом также называют воспаление мягких тканей вокруг зубного импланта, другое его название периимплантный мукозит. Но в этой статье речь пойдёт только об осложнении противоопухолевого лечения.
Это изнуряющее состояние, которое поражает более 40 % пациентов, получающих лучевую или химиотерапию [3] [4] . В тяжёлых случаях мукозит может быть настолько болезненным, что человек не может нормально питаться и принимать лекарства. Это не только ухудшает качество жизни, но и вынуждает врача уменьшить дозу препаратов или облучения или отложить курс, что снижает эффективность противоопухолевого лечения. Кроме того, поражение слизистой оболочки может привести к развитию инфекции.
Причины и факторы риска развития мукозита
Основная причина — ослабление иммунной системы, вызванное противоопухолевым лечением.
При лучевой и химиотерапии погибают не только быстро делящиеся раковые клетки, но и нормальные клетки, которые делятся более активно, например во рту или костном мозге. Поэтому и возникают такие побочные эффекты, как снижение иммунитета, мукозит, усталость, ухудшение аппетита и др.
Препараты, которые используются для лечения рака и могут привести к развитию мукозита:
- Антиметаболические и алкилирующие препараты. Они подавляют синтез ДНК, из-за этого эпителий слизистой оболочки не восстанавливается и, как правило, возникает мукозит.
- Противоопухолевые антибиотики, такие как Адриамицин. Агрессивно влияют на слизистые оболочки и подавляют выработку слюны, что способствует проникновению инфекции в слизистые оболочки у пациентов, ослабленных после лучевой и химиотерапии.
- Противоопухолевые препараты на основе алкалоидов растений (например, Винбластин или Винкристин). Они редко напрямую повреждают слизистую оболочку полости рта, но могут ослабить защитные свойства слизистой за счёт токсинов [3][4][5] .
Чтобы увеличить эффективность терапии, часто увеличивают её интенсивность. Но так как химиотерапия токсична и приводит к серьёзным побочным эффектам, её применение ограничено: приходится уменьшать дозу препарата, что снижает реакцию опухолей на лечение [6] [7] .
При лучевой терапии побочные эффекты наблюдаются только в области облучения. В большинстве случаев пациенты выздоравливают через 2–3 недели после окончания лучевой терапии [1] [5] [11] .
Тяжесть мукозита после лучевой и химиотерапии будет зависеть от множества факторов, включая дозу лекарства, интервал между дозами, тип облучения и объём обрабатываемой ткани.
К факторам риска развития мукозита также можно отнести курение, злоупотребление алкоголем, обезвоживание, заболевания почек, ВИЧ-инфекцию, СПИД, постоянные травмы слизистой из-за протезов, сухость во рту и низкий уровень лейкоцитов в крови [8] [27] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы мукозита
Симптомы мукозита могут возникнуть через 1–2 недели после лучевой или химиотерапии [8] [28] . Первый признак мукозита — эритема (покраснение), затем на месте эритемы появляются эрозии и язвы.

При язве нарушается целостность всех слоёв слизистой оболочки. Так как в слизистой много нервных волокон и окончаний, то её повреждение вызывает сильную боль. Она может быть настолько сильной, что человек не может нормально питаться и разговаривать. Это наиболее тяжёлая форма мукозита, обычно она наблюдается через 5–7 дней после приёма лекарств для химиотерапии [9] [10] .
![Язва в полости рта [25]](https://probolezny.ru/media/bolezny/mukozit/yazva-v-polosti-rta-25_s.jpg)
Язвы обычно покрыты псевдомембраной. Эта мембрана состоит из эпителиальных клеток и разрушенного белка фибрина. Она выглядит как белый, непрозрачный налёт, но если присоединяется инфекция, может казаться желтоватой или зеленоватой. Еда, напитки или местные лекарства также могут окрашивать псевдомембрану в жёлтый или зелёный цвет. При тщательном осмотре часто обнаруживается слегка приподнятая мембрана над уровнем подлежащей слизистой оболочки. Из-за псевдомембран мукозит можно принять за кандидоз.
![Псевдомембрана на язве [26]](https://probolezny.ru/media/bolezny/mukozit/psevdomembrana-na-yazve-26_s.jpg)
Жёсткая пища может травмировать псевдомембрану, и если мембрана отделяется от слизистой, возникает кровотечение.
При облучении и химиотерапии эпителий разрушается и не успевает восстанавливаться, из-за этого слизистая оболочка истончается [11] [12] .
При поражении слизистой кишечника или мочеполовых путей может беспокоить диарея и боль при мочеиспускании.
Патогенез мукозита
У мукозита можно выделить четыре фазы развития:
- Сосудистая (воспалительная) фаза.
- Эпителиальная фаза.
- Язвенная (бактериологическая) фаза.
- Фаза восстановления [2][4][7][13] .

1. Сосудистая (воспалительная) фаза. В первую фазу лучевая или химиотерапия напрямую повреждают клетки эпителия. В ответ на повреждение вырабатываются провоспалительные цитокины, которые запускают воспалительный процесс. Цитокины усиливают разрушение тканей, расширяют кровеносные сосуды и повышают проницаемость их стенок. На этой фазе никаких симптомов на слизистой оболочке ещё нет.
2. Эпителиальная фаза. Начинается на 4–5 день противоопухолевого лечения. Из-за действия цитокинов замедляется репликация (удвоение) эпителиальных базальных клеток, поэтому снижается скорость обновления эпителия. К концу фазы появляется эритема и чувство жжения.
3. Язвенная (бактериологическая) фаза. Начинается примерно на седьмые сутки. Клетки слизистой отмирают и начинают медленнее обновляться, из-за этого слизистая оболочка рта истончается и разрушаются связи между эпителием и подслизистым слоем. Фаза характеризуется выраженными клиническими проявлениями с образованием язв на слизистой оболочке. Язвы инфицируются из-за травмы эпителия.
4. Фаза восстановления. Если у пациента не снижен уровень лейкоцитов и тромбоцитов в крови и курс противоопухолевого лечения завершён, выздоровление наступает через 2–3 недели после начала терапии . Крупные и глубокие либо инфицированные язвы обычно заживают на 1–2 недели дольше. В зависимости от степени повреждения слизистая оболочка на этой фазе может казаться бледной и истончённой.
Чем медленнее развивается мукозит и чем дольше не заживают язвы на слизистой, тем тяжелее будет течение болезни. Чтобы лучше изучить механизм развития мукозита, необходимы дополнительные данные об эпидемиологии и факторах риска [4] [7] [15] [16] .
Классификация и стадии развития мукозита
В Международной классификации болезней 10-го пересмотра (МКБ-10) мукозит полости рта кодируется как K12.3 Оральный мукозит (язвенный). Он делится на несколько видов:
- БДУ, т. е. неуточнённый;
- медикаментозный;
- лучевой (радиационный);
- вирусный.
Классы мукозита полости рта в соответствии с системой оценок Всемирной организации здравоохранения (ВОЗ):
- 0 — признаков мукозита нет;
- I — безболезненная язва, эритема или лёгкая чувствительность;
- II — болезненная эритема или язва, которые не мешают пациенту принимать пищу;
- III — сливающиеся болезненные язвы, которые мешают пациенту принимать твёрдую пищу;
- IV — тяжёлые симптомы, при которых приходится вводить питание через зонд или внутривенно [1][4][10][16] .
Осложнения мукозита
Психологические проблемы. Из-за онкологического заболевания люди часто не могут работать и заниматься активным хобби, реже встречаются с друзьями и родными. Все их планы перестраиваются под болезнь. Если к основном диагнозу присоединяются осложнения терапии, например мукозит, то психологическое состояние пациента может ещё больше ухудшиться. Человек постепенно теряет силы и самостоятельность [17] [18] .
Перерыв в лечении или изменение режима. Если из-за лучевой или химиотерапии развивается тяжёлая степень мукозита, врачу приходится уменьшить дозу препаратов или радиации или отложить курс, что снижает эффективность лечения.
![Тяжёлая степень мукозита [24]](https://probolezny.ru/media/bolezny/mukozit/tyazhyolaya-stepen-mukozita-24_s.jpg)
Вторичная инфекция. Через поражённую слизистую оболочку полости рта в организм, ослабленный после лучевой или химиотерапии, могут попасть патогенные микроорганизмы. В этом случае на фоне мукозита развивается вторичная бактериальная, грибковая или вирусная инфекция. Проведённые исследования показывают, что у 29,1 % пациентов, проходящих лечение от рака, был выявлен простой герпес, который усугублял язвенный мукозит полости рта [3] [12] .
Сепсис. Если вторичную инфекцию не лечить, патогенные микроорганизмы могут массово попасть в кровоток и распространиться по всему организму. Такая тяжёлая системная инфекция называется сепсисом. Он может стать причиной смерти [17] [18] .

Диагностика мукозита
Диагностика мукозита основана на наличии лучевой или химиотерапии в анамнезе. Также важно, когда появились симптомы мукозита и где в полости рта расположены эрозии и язвы.
Мукозит, вызванный лучевой или химиотерапией, возникает на подвижных слизистых оболочках, т. е. в области щёк, губ и дна полости рта. Он редко поражает тыльную сторону языка, твердое нёбо или дёсны.
Вирусные инфекции, например кандидоз, в отличие от мукозита локальны и затрагивают слизистую оболочку твёрдого нёба, десневой и дорсальный язык. Кроме этого, их начало часто совпадает с лихорадкой. Чтобы отличить мукозит от вирусной инфекции, рекомендуется взять мазок со слизистой рта и определить с помощью бактериального посева или цитологического исследования, есть ли на её поверхности инфекция.
Важно оценить тяжесть мукозита, чтобы определить токсичность проводимого противоопухолевого лечения и дальнейшую тактику ведения пациента. Общепринятой шкалы, которая бы описывала тяжесть мукозита, не существует. Поэтому понять, насколько терапия вредит пациенту, бывает сложно. Чаще всего для описания токсичности терапии рака используют критерии Всемирной организации здравоохранения (ВОЗ) и Национального института рака (NCI). Эти шкалы описывают общее состояние полости рта [5] [6] [19] . Например, согласно шкале ВОЗ, нулевая степень тяжести — это отсутствие симптомов мукозита, а четвёртая соответствует тяжёлым симптомам, при которых пациент не может самостоятельно принимать пищу [20] .
Лечение мукозита
Терапия мукозита включает как местное воздействие (только на слизистую оболочку полости рта), так и системные лекарственные и нефармакологические методы лечения, которые действуют на весь организм.
Цели лечения орального мукозита: обеспечить питание, уменьшить болевой синдром и сухость во рту, предотвратить вторичное инфицирование и оральное кровотечение.
Лечение орального мукозита по большей части направлено на устранение симптомов и облегчение состояния пациента, но также разрабатываются средства, чтобы предотвратить его развитие.
Из симптоматических средств назначают анальгетики, так как мукозит III – IV степени тяжести обычно протекает очень болезненно. Согласно рекомендациям ВОЗ, в зависимости от интенсивности боли должны назначаться как системные, так и местные обезболивающие [19] [21] .
Во многих медицинских центрах онкологическим больным, получающим высокие дозы препаратов для химиотерапии, обычно назначают антибиотики и противогрибковые препараты, чтобы предотвратить вторичные инфекции в период снижения иммунитета.
Прогноз. Профилактика
Мукозит развивается на фоне тяжёлой онкологической патологии, поэтому прогноз зависит от тяжести основного заболевания, состояния пациента, а также от выраженности проявлений самого мукозита.
Чаще всего симптоматическое лечение мукозита помогает улучшить состояние пациента: язвы перестают болеть и распространяться. Как правило, всё заживает к 15–20 дню от начала терапии [1] [22] [23] .
Профилактика мукозита
Риск мукозита ниже, если у пациента здоровые зубы и полость рта. Но как показывает практика, почти у всех пациентов, поступающих для лечения в онкологические и онкогематологические стационары, есть проблемы с зубами или дёснами [2] [3] .
Перед лучевой или химиотерапией рекомендуется:
- вылечить зубы и дёсны, если есть такая необходимость;
- за 10–12 дней до начала противоопухолевой терапии сделать профессиональную гигиену полости рта, в которую входит ультразвуковая чистка, использование Air-flow и полировка пастой.

Во время лучевой или химиотерапии необходимо:
- выполнять рекомендации врача по гигиене полости рта;
- посещать стоматолога для осмотра слизистой оболочки полости рта [28] ;
- не травмировать слизистую оболочку: исключить приём горячей, острой, твёрдой пищи и алкоголя; отказаться от курения; как можно реже пользоваться съёмными зубными протезами; использовать только мягкую зубную щётку [3][6][17] .
Мукозит часто осложняет лечение рака. Стоматологическая подготовка и сопровождение пациента в процессе химиолучевой терапии позволяет не только улучшить качество жизни больных, но и избежать вынужденных перерывов в лечении, повышая тем самым эффективность противоопухолевой терапии [4] [21] .
Читайте также:

