Билирубин при красной волчанке
Обновлено: 28.04.2024
Системная красная волчанка (СКВ) – аутоиммунное заболевание, этиология которого остается неизвестной. Кожный синдром при СКВ зачастую имеет первостепенное диагностическое значение – поражение кожи в 20-30% случаев является самым ранним симптомом, а у 60-
Systemic lupus erythematosus: alertness in the practice of a dermatologist / M. M. Tlish, Zh. Yu. Naatyzh1, T. G. Kuznetsova, E. A. Chernenko /State Budgetary educational institution of higher professional education Kuban State Medical University of the Ministry of Healthcare of the Russian Federation, Krasnodar, Russia
Abstract. Systemic lupus erythematosus (SLE) is an autoimmune disease, the etiology of which remains unknown. Skin syndrome in SLE is often of paramount diagnostic value – skin lesion is the earliest symptom in 20-30% of cases, and in 60-70% it manifests itself at various stages of the course of the disease, which leads to the patient's primary referral to a dermatologist. Frequent diagnostic errors are due to the absence of clinical symptoms of systemic lesions in the presence of cutaneous manifestations of lupus erythematosus (LE). In this case, laboratory tests are an integral part of the algorithm for managing patients with LE at the stage of contacting a dermatologist. The most specific laboratory test is the determination of antinuclear antibodies by an indirect immunofluorescence reaction, referred to as antinuclear factor (ANF). An elevated ANF titer is included in the list of diagnostic criteria for SLE, its detection allows one to suggest a diagnosis of SLE and determine a further algorithm for the provision of medical care. The article presents two clinical cases illustrating that against the background of an isolated skin lesion and the absence of visible somatic pathology, abnormalities in immunological tests were identified. This made it possible to suspect the systemic course of the process at an early stage and refer patients to a rheumatologist's consultation, where the diagnosis of SLE was confirmed. For citation: Tlish M. M., Naatyzh Zh. Yu., Kuznetsova T. G., Chernenko E. A. Systemic lupus erythematosus: alertness in the practice of a dermatologist // Lechaschy Vrach. 2020; vol. 23 (11): 23-26. DOI: 110.26295/OS.2020.35.78.005
Согласно современным представлениям, системная красная волчанка (СКВ) – аутоиммунное заболевание неустановленной этиологии, характеризующееся гиперпродукцией органонеспецифических аутоантител с развитием иммуновоспалительного повреждения тканей внутренних органов [1]. Широкий ряд вырабатываемых аутоантител и их прямое или опосредованное воздействие на клеточные мишени обуславливают многообразие клинических проявлений при красной волчанке (КВ) [2]. СКВ может проявляться изолированным или сочетанным поражением систем и органов, включающим поражение кожи и слизистых оболочек (волчаночная бабочка, дискоидная эритема, фотосенсибилизация, алопеция, телеангиэктазии, сетчатое ливедо, язвы в полости рта), сердечно-сосудистой системы (перикардит, миокардит, эндокардит, коронарит), почек (волчаночный нефрит), центральной нервной системы (судороги, психоз), опорно-двигательного аппарата (артралгии, артриты), легких (плеврит, волчаночный пневмонит), гематологическими нарушениями (гемолитическая анемия, лейкопения, тромбоцитопения) и т. д. [3].
Ключевую роль в диагностике СКВ играет обнаружение клинических проявлений заболевания и данные лабораторной диагностики [3]. Кожный синдром при СКВ зачастую имеет первостепенное диагностическое значение – поражение кожи в 20-30% случаев является самым ранним симптомом, а у 60-70% проявляется на различных этапах течения болезни, что приводит к первичному обращению больного именно к дерматологу [4]. Поражения кожи при СКВ полиморфны и представлены различными изменениями – от незначительных телеангиэктазий до буллезных поражений [2]. Выделяют волчаночно-специфичные и волчаночно-неспецифичные поражения кожи, последние встречаются в несколько раз чаще. К волчаночно-специ-фичным относят различные проявления хронической, подострой и острой КВ [5]. Группа неспецифических поражений включает: фотосенсибилизацию, лейкоцитокластический и уртикарный васкулит, телеангиэктазии, сетчатое ливедо, злокачественный атрофический папулез и синдром Рейно [5]. Широкая вариабельность клинических проявлений кожного синдрома обуславливает необходимость проведения тщательного дифференциального диагноза [1].
Важным инструментом ранней диагностики системных заболеваний является обнаружение аутоантител с помощью лабораторных тестов [3]. Наиболее специ-фичными для СКВ являются антинуклеарные антитела (АНА) – это гетерогенная группа аутоантител к компонентам клеточного ядра, среди которых выделяют антитела к двуспиральной дезоксирибонуклеиновой кислоте (ДНК), гистонам, нуклеосомам, экстрагируемым ядерным антигенам, ядрышковым антигенам и другим клеточным структурам [6]. Стандартным методом обнаружения группы АНА является непрямая реакция иммунофлюоресценции (НРИФ) с использованием линии эпителиальных клеток аденокарциномы гортани человека (HЕp-2) [7]. Определение АНА методом НРИФ принято обозначать как антинуклеарный фактор (АНФ), содержание которого оценивается по максимальному выявленному титру в сыворотке крови, с указанием интенсивности и типа флюоресценции [8]. Количественное увеличение титра свыше 1:160 входит в перечень диагностических критериев СКВ согласно рекомендациям Американской коллегии ревматологов (American College of Rheumatology, ACR) и Европейской лиги борьбы с ревматизмом (European League Against Rheumatism, ULAR) и используется для оценки активности процесса, прогноза, так как является предиктором развития СКВ на доклинической стадии [8].
Длительное формирование патогномоничного клинического симптомокомплекса СКВ, отсутствие проведения необходимых лабораторных исследований и междисциплинарного взаимодействия являются причиной частых диагностических ошибок, приводящих к отсутствию своевременной противовоспалительной и иммуносупрессивной терапии у врача-ревматолога. Учитывая вышесказанное, считаем целесообразным привести собственные клинические наблюдения.
Клиническое наблюдение № 1
Больная М., 27 лет, считает себя больной с июля 2019 г., когда после длительного отдыха на побережье появились высыпания на коже лица. Обратилась к дерматологу по месту жительства, где был выставлен диагноз: «Розацеа, папулопустулезный подтип, среднетяжелое течение». Получала курсовое лечение (доксициклин, метронидазол гель). Видимого улучшения пациентка не отмечала, процесс на коже продолжал прогрессировать, в связи с чем обратилась на кафедру дерматовенерологии ФГБОУ ВО КубГМУ Минздрава России.
Данные со стороны других органов и систем: предъявляет жалобы на ноющие боли в мелких суставах кистей и коленных суставах, чувство утренней скованности. Соматически не обследована.
Объективно: кожный патологический процесс носит ограниченный симметричный характер, локализуется на коже крыльев носа, щек, подбородка. Представлен: эритематозные пятна, чешуйки, телеангиэктазии.
На коже лица (в области крыльев носа, щек, подбородка) расположены ярко-розовые эритематозные очаги, с четкими границами, слегка инфильтрированные, правильной округлой формы, диаметром 3-4 см, покрытые небольшим шелушением в центре очагов; в периферической зоне очагов визуализируются телеангиэктазии (рис. 1). Удаление чешуек сопровождается болезненностью (симптом Бенье–Мещерского).
.jpg)
Определена биодоза 20 секунд.
С предположительным диагнозом «Дискоидная красная волчанка?» больная была направлена на гистоморфологическое исследование кожи.
Результаты гистоморфологического исследования кожи из патологического очага на правой щеке: фолликулярный гиперкератоз; эпидермис с тенденцией к атрофии; вакуольная дистрофия клеток базального слоя. Под эпидермисом сосуды расширены. Во всех отделах дермы – густые диффузные и периваскулярные лимфогистиоцитарные инфильтраты с примесью нейтрофилов и плазмоцитов. Вокруг сально-волосяных фолликулов – густой лимфогистиоцитарный инфильтрат с примесью нейтрофилов, тучных клеток и фибробластов, проникающий в наружное эпителиальное влагалище. В дерме – участки мукоидного набухания коллагеновых волокон. Заключение: морфологическая картина может соответствовать красной волчанке.
Данные общеклинических исследований: общий и биохимический анализ крови – показатели в пределах нормы; общий анализ мочи – показатели в пределах нормы.
Настораживающими факторами в плане трансформации кожной формы в системный процесс у пациентки М. явились: дебют заболевания в молодом возрасте, длительная инсоляция в анамнезе, II фототип кожи, биодоза 20 секунд, наличие выраженного суставного синдрома.
Для исключения диагноза СКВ было проведено иммунологическое исследование:
- Антинуклеарный фактор на НЕр-2 клетках: 1:320 титр (норма менее 160); мелкогранулярный тип свечения.
- Антитела к двуспиральной ДНК (a-dsDNA) – 53 МЕ/мл (норма – менее 25 МЕ/мл).
- Анализ крови на антитела к фосфолипидам класса IgG (скрининг) – 10,13 МЕ/мл (референсные значения: до 10 МЕ/мл – не обнаружено).
- Анализ крови на антитела к фосфолипидам класса IgM (скрининг) – 12,68 МЕ/мл (референсные значения: до 10 МЕ/мл – не обнаружено).
С полученными данными больная направлена к ревматологу в Краевую клиническую больницу № 2, где был подтвержден диагноз СКВ. Больная взята на диспансерный учет ревматологом для определения дальнейшей тактики ведения и лечения.
Клиническое наблюдение № 2
Пациентка В., 66 лет, считает себя больной с апреля 2018 г., когда впервые появились высыпания на коже щек и подбородка. При сборе анамнеза установлено, что больная длительное время проживала в северном регионе и после переезда в Краснодарский край начала отмечать появление высыпаний. Самостоятельно использовала бетаметазон и декспантенол. Отмечала временное улучшение, но в весенне-летний период заболевание обострялось. Обратилась к дерматологу по месту жительства, где был выставлен диагноз «стероидпровоцированная розацеа» и назначено лечение (наружные и системные антибактериальные препараты, ангиопротекторы). Видимого улучшения не наблюдала, в связи с чем обратилась на кафедру дерматовенерологии ФГБОУ ВО КубГМУ МЗ РФ.
Объективно: кожный патологический процесс носит распространенный характер, локализован на коже лица, шеи. Представлен: пятна, телеангиэктазии, чешуйки.
На коже лица в области щек, левой околоушной области и шеи расположены отечные эритематозные очаги розовато-красного цвета, диаметром 2–3 см, преимущественно правильно-округлой формы с небольшим шелушением, визуализируются единичные телеангиэктазии. Удаление чешуек сопровождается болезненностью (симптом Бенье–Мещерского) (рис. 2).
.jpg)
С предварительным диагнозом «Дискоидная красная волчанка?» пациентка направлена на гистоморфологическое исследование.
Результаты гистоморфологического исследования кожи из патологического очага: на коже левой щеки – фолликулярный гиперкератоз; участки паракератоза; эпидермис местами атрофичен; вакуольная дистрофия клеток базального слоя эпидермиса; подэпидермальные пузыри. В сосочковом слое – отек, стенки сосудов утолщены. В дерме – густые очаговые и периваскулярные лимфогистиоцитарные инфильтраты с примесью нейтрофилов. Вокруг сально-волосяных фолликулов – густой лимфогистиоцитарный инфильтрат с примесью нейтрофилов, тучных клеток и фибробластов, проникающий в наружное эпителиальное влагалище. В дерме – участки мукоидного набухания коллагеновых волокон. Заключение: морфологическая картина больше соответствует красной волчанке.
Данные общеклинических исследований: в общем и биохимическом анализах крови выявлены следующие отклонения – лейкоциты 3,7 × 10 9 /л; холестерин 8,7 ммоль/л.
Учитывая длительность течения кожного патологического процесса, отсутствие результатов обследования смежных специалистов, для исключения диагноза СКВ было проведено иммунологическое исследование:
- Антинуклеарный фактор на НЕр-2 клетках: 12 560 титр (норма менее 160); крупногранулярный тип свечения.
- Антитела к двуспиральной ДНК (a-dsDNA) – 0,5 МЕ/мл (норма – менее 25 МЕ/мл).
- Анализ крови на антитела к фосфолипидам класса IgG (скрининг) 16,65 МЕ/мл (референсные значения: до 10 МЕ/мл – не обнаружено).
- Анализ крови на антитела к фосфолипидам класса IgM (скрининг) – 14,68 МЕ/мл (референсные значения до 10 МЕ/мл – не обнаружено).
С полученными результатами лабораторных исследований больная была направленна на консультацию к ревматологу в Краевую клиническую больницу № 2, где был установлен диагноз: «СКВ, хроническое течение, 1-й степени активности, с поражением кожи (эритема по типу «бабочки»), иммунологическими нарушениями (антинуклеарный фактор на НЕр-2 клетках, положительный анализ крови на антитела к фосфолипидам IgG, IgM)». Больную госпитализировали в ревматологическое отделение на стационарное лечение.
Таким образом, иммунологические исследования и их комплексный анализ являются неотъемлемой составляющей алгоритма ведения больных с КВ уже на этапе обращения к врачу-дерматологу и способствуют высокому качеству оказания медицинской помощи данному контингенту больных.
Литература/References
- Тлиш М. М., Наатыж Ж. Ю., Сычева Н. Л., Кузнецова Т. Г., Иризелян Г. А., Псавок Ф. А. Системная красная волчанка: междисциплинарный подход к диагностике // Российский журнал кожных и венерических болезней. 2016; 19 (3): 141-147. [Tlish M. M., Naatyzh Zh. Yu., Sycheva N. L., Kuznetsova T. G., Irizelyan G. A., Psavok F. A. Sistemnaya krasnaya volchanka: mezhdistsiplinarnyy podkhod k diagnostike [Systemic lupus erythematosus: an interdisciplinary approach to diagnosis] Rossiyskiy zhurnal kozhnykh i venericheskikh bolezney. 2016; 19 (3): pp. 141-147.]
- Мазуров В. И., ред. Диффузные болезни соединительной ткани: руководство для врачей. СПб: СпецЛит, 2009. 192 с. [Mazurov V. I., red. Diffuznyye bolezni soyedinitel'noy tkani: rukovodstvo dlya vrachey. [Diffuse connective tissue diseases: a guide for physicians.] SPb: SpetsLit, 2009. P. 192.]
- Насонов Е. Л., ред. Клинические рекомендации по ревматологии. 2-е изд., испр. и доп. М.: ГЭОТАРМедиа, 2010. 429 с. [Nasonov Ye. L., red. Klinicheskiye rekomendatsii po revmatologii. [Clinical practice guidelines to rheumatology.] 2-ye izd., ispr. i dop. M.: GEOTARMedia, 2010. P. 429.]
- Романова Н. В., Шилкина Н. П. Клинико-иммуноло-гическая характеристика кожного синдрома у больных красной волчанкой // Российский журнал кожных и венерических болезней. 2005; (4): 45-48. [Romanova N. V., Shilkina N. P. Kliniko-immuno-logicheskaya kharakteristika kozhnogo sindroma u bol'nykh krasnoy volchankoy [Clinical and immunological characteristics of skin syndrome in patients with lupus erythematosus] Rossiyskiy zhurnal kozhnykh i venericheskikh bolezney. 2005; (4): pp. 45-48.]
- Тлиш М. М., Наатыж Ж. Ю., Сычева Н. Л., Кузнецова Т. Г. Системная красная волчанка в практике дерматолога // Клиническая медицина. 2018; 96 (3): 277-281. [Tlish M. M., Naatyzh Zh. Yu., Sycheva N. L., Kuznetsova T. G. Sistemnaya krasnaya volchanka v praktike dermatologa [Systemic lupus erythematosus in the practice of a dermatologist] Klinicheskaya meditsina. 2018; 96 (3): pp. 277-281.]
- Клюквина Н. Г. Клиническое значение лабораторных нарушений при системной красной волчанке // Современная ревматология. 2014; (2): 41-47. [Klyukvina N. G. Klinicheskoye znacheniye laboratornykh narusheniy pri sistemnoy krasnoy volchanke [Clinical significance of laboratory disorders in systemic lupus erythematosus] Sovremennaya revmatologiya. 2014; (2): pp. 41-47.]
- Александрова Е. Н., Новиков А. А., Насонов Е. Л. Рекомендации по лабораторной диагностике ревматических заболеваний Общероссийской общественной организации «Ассоциация ревматологов России» – 2015 // Современная ревматология. 2015; 9 (4): 25-36. [Aleksandrova Ye. N., Novikov A. A., Nasonov Ye. L. Rekomendatsii po laboratornoy diagnostike revmaticheskikh zabolevaniy Obshcherossiyskoy obshchestvennoy organizatsii «Assotsiatsiya revmatologov Rossii» – 2015 [Recommendations for laboratory diagnostics of rheumatic diseases of the All-Russian public organization «Association of rheumatologists of Russia» – 2015] Sovremennaya revmatologiya. 2015; 9 (4): pp. 25-36.]
- Александрова Е. Н., Новиков А. А., Верижникова Ж. Г., Лукина Г. В. Современный взгляд на проблемы исследования антинуклеарных антител при системной красной волчанке (обзор литературы) // Клиническая лабораторная диагностика. 2018; 63 (6): 340-348. [Aleksandrova Ye. N., Novikov A. A., Verizhnikova Zh. G., Lukina G. V. Sovremennyy vzglyad na problemy issledovaniya antinuklearnykh antitel pri sistemnoy krasnoy volchanke (obzor literatury) [Modern view on the problems of studying antinuclear antibodies in systemic lupus erythematosus (literature review)] Klinicheskaya laboratornaya diagnostika. 2018; 63 (6): pp. 340-348.]
М. М. Тлиш, доктор медицинских наук, профессор
Ж. Ю. Наатыж 1 , кандидат медицинских наук
Т. Г. Кузнецова, кандидат медицинских наук
Е. А. Черненко
ФГБОУ ВО КубГМУ Минздрава России, Краснодар, Россия
Системная красная волчанка: настороженность в практике дерматолога/ М. М. Тлиш, Ж. Ю. Наатыж, Т. Г. Кузнецова, Е. А. Черненко
Для цитирования: Тлиш М. М., Наатыж Ж. Ю., Кузнецова Т. Г., Черненко Е. А. Системная красная волчанка: настороженность в практике дерматолога // Лечащий Врач. 2020; т. 23 (11), 23-26. DOI: 110.26295/OS.2020.35.78.005
Теги: аутоиммунное заболевание, кожный синдром, алгоритм лечения
Что такое синдром Жильбера? Причины возникновения, диагностику и методы лечения разберем в статье доктора Васильева Романа Владимировича, гастроэнтеролога со стажем в 15 лет.
Над статьей доктора Васильева Романа Владимировича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Синдром Жильбера — это генетический пигментный гепатоз с аутосомно-доминантным типом наследования, протекающий с повышением уровня неконъюгированного (свободного) билирубина, чаще проявляющееся в период полового созревания и характеризующийся доброкачественным течением [1] .
Краткое содержание статьи — в видео:
Синонимы названия болезни: простая семейная холемия, конституциональная или идиопатическая неконъюгированная гипербилирубинемия, негемолитическая семейная желтуха.
По распространённости данное заболевание встречается не менее, чем у 5 % населения, в соотношении мужчин и женщин — 4:1. Впервые заболевание описал французский терапевт Августин Жильбер в 1901 году.
Чаще синдром Жильбера проявляется в период полового созревания и характеризуется доброкачественным течением. Основным проявлением этого синдрома является желтуха.
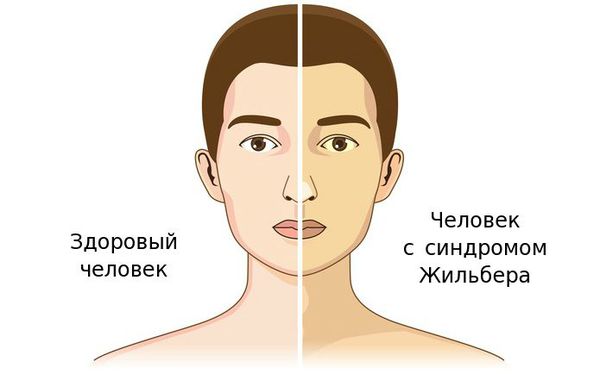
К провоцирующим факторам проявления синдрома можно отнести:
- голодание или переедание;
- жирную пищу;
- некоторые лекарственные средства;
- алкоголь;
- инфекции (грипп, ОРЗ, вирусный гепатит);
- физические и психические перегрузки;
- травмы и оперативные вмешательства.
Причина заболевания — генетический дефект фермента УДФГТ1*1, который возникает в результате его мутации. В связи с этим дефектом функциональная активность данного фермента снижается, а внутриклеточный транспорт билирубина в клетках печени к месту соединения свободного (несвязанного) билирубина с глюкуроновой кислотой нарушается. Это и приводит к увеличению свободного билирубина.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы синдрома Жильбера
Некоторые специалисты трактуют синдром Жильбера не как болезнь, а как физиологическую особенность организма.
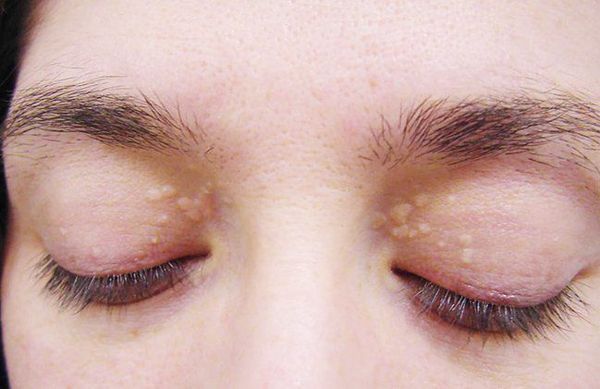
До периода полового созревания данный синдром может протекать бессимптомно. Позже (после 11 лет) возникает характерная триада признаков:
- желтуха различной степени выраженности;
- ксантелазмы век (жёлтые папулы);
- периодичность появления симптомов [1] .
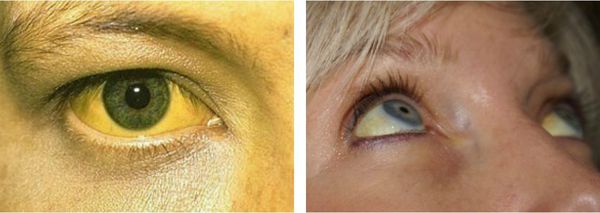
Желтуха чаще всего проявляется иктеричностью (желтушностью) склер, матовой желтушностью кожных покровов (особенно лица), иногда частичным поражением стоп, ладоней, подмышечных впадин и носогубного треугольника.
Заболевание нередко сочетается с генерализованной дисплазией (неправильным развитием) соединительной ткани.
Усиление желтухи может наблюдаться после перенесения инфекций, эмоциональной и физической нагрузки, приёма ряда лекарственных препаратов (в частности, антибиотиков), голодания и рвоты.
Клиническими проявлениями заболевания общего характера могут быть:
- слабость;
- недомогание;
- подавленность;
- плохой сон;
- снижение концентрации внимания.
В отношении ЖКТ синдром Жильбера проявляется снижением аппетита, изменением привкуса во рту (горечь, металлический привкус), реже возникает отрыжка, тяжесть в области правого подреберья, иногда наблюдается боль ноющего характера и плохая переносимость лекарственных препаратов.
При ухудшении течения синдрома Жильбера и существенном повышении токсичной (свободной) фракции билирубина может появляться скрытый гемолиз, усиливая при этом гипербилирубинемию и добавляя в клиническую картину системный зуд.
Патогенез синдрома Жильбера
В норме свободный билирубин появляется в крови преимущественно (в 80-85 % случаев) при разрушении эритроцитов, в частности комплекса ГЕМ, входящего в структуру гемоглобина. Это происходит в клетках макрофагической системы, особенно активно в селезёнке и купферовских клетках печени. Остальная часть билирубина образуется из разрушения других гемсодержащих белков (к примеру, цитохрома P-450).
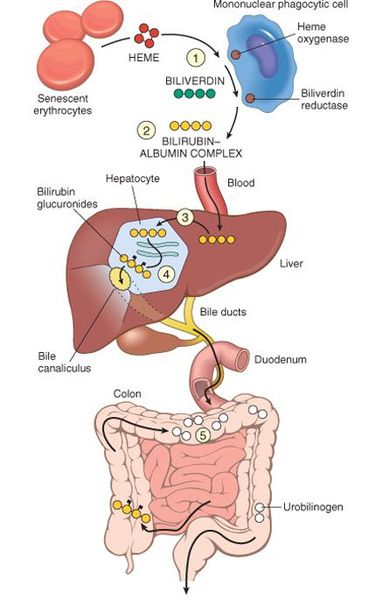
У взрослого человека в сутки образуется приблизительно от 200 мг до 350 мг свободного билирубина. Такой билирубин слаборастворим в воде, но при этом хорошо растворяется в жирах, поэтому он может взаимодействовать с фосфолипидами ("жирами") клеточных мембран, особенно головного мозга, чем можно объяснить его высокую токсичность, в частности токсичное влияние на нервную систему.
Первично после разрушения комплекса ГЕМ в плазме билирубин появляется в неконъюгированной (свободной или несвязанной) форме и транспортируется с кровью при помощи белков альбуминов. Свободный билирубин не может проникнуть через почечный барьер за счёт сцепления с белком альбумином, поэтому сохраняется в крови.
В печени несвязанный билирубин переходит на поверхность гепатоцитов. С целью снижения токсичности и выведения в клетках печени свободного билирубина при помощи фермента УДФГТ1*1 он связывается с глюкуроновой кислотой и превращается в конъюгированный (прямой или связанный) билирубин. Конъюгированный билирубин хорошо растворим в воде, он является менее токсичным для организма и в дальнейшем легко выводится через кишечник с желчью.
При синдроме Жильбера связывание свободного билирубина с глюкуроновой кислотой снижается до 30% от нормы, тогда как концентрация прямого билирубина в желчи увеличивается.
В основе синдрома Жильбера лежит генетический дефект — наличие на промонторном участке A(TA)6TAA гена, кодирующего фермент УДФГТ1*1, дополнительного динуклеотида ТА. Это становится причиной образования дефектного участка А(ТА)7ТАА. Удлинение промонторной последовательности нарушает связывание фактора транскрипции IID, в связи с чем уменьшается количество и качество синтезируемого фермента УДФГТ1, который участвует в процессе связывания свободного билирубина с глюкуроновой кислотой, преобразуя токсичный свободный билирубин в нетоксичный связанный.
Вторым механизмом развития синдрома Жильбера является нарушение захвата билирубина микросомами сосудистого полюса клетки печени и его транспорта глутатион-S-трансферазой, которая доставляет свободный билирубин к микросомам клеток печени.
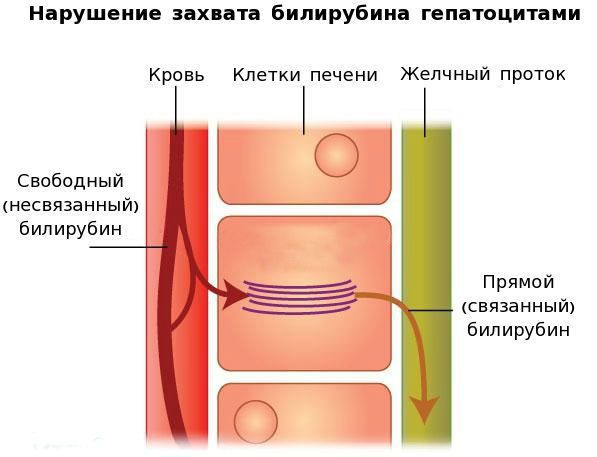
В конечном итоге вышеперечисленные патологические процессы приводят к увеличению содержания свободного (несвязанного) билирубина в плазме, что обуславливает клинические проявления заболевания [6] .
Классификация и стадии развития синдрома Жильбера
Общепринятой классификации синдрома Жильбера не существует, однако условно можно разделить генотипы синдрома по полиморфизму.

Красная волчанка — это аутоиммунное заболевание. Симптомы волчанки включают: сыпь, эритему (часто эритема в форме бабочки), лишайник на лице (лишайниковая пластинка), гиперчувствительность к свету, артрит, изъязвление на слизистых оболочках.
Красная волчанка может встречаться в различных формах — наиболее распространёнными из них являются: системная красная волчанка и кожная красная волчанка, реже встречаются отёки.
Красная волчанка очень коварное и неприятное аутоиммунное заболевание. Его нелегко лечить и причины его возникновения не полностью известны.
Иногда волчанка ограничивается проявлением на коже (кожная красная волчанка — внешняя), но чаще всего она поражает весь организм, автоматически повреждая следующие органы: почки, сердце, лёгкие, нервную систему. Затем возникает системная красная волчанка (внутренняя).
Красная волчанка — симптомы
В 75 процентов случаев изменения сначала появляются на коже и слизистых оболочках. Они принимают форму сыпи (часто появляющейся после длительного пребывания на солнце), шелушащихся овальных пятен на коже головы или безболезненных язвах в полости рта.
Наиболее типичным симптомом волчанки является появление характерных пятен на щеках и носу.
Латинское название волчанки происходит от слова волчанка (волк), потому что на лице людей, страдающих этим заболеванием, есть характерная эритема — форма напоминает пятна (окрашивание меха) как на морде волка (иногда эритема может напоминать форму бабочки).
- боль в суставах;
- артрит;
- головные боли;
- изменения кожи;
- синдром Рейно — покраснение и кровоподтёки кожи рук;
- усталость и слабость в сочетании с потерей веса;
- септическая лихорадка;
- нарушение функции суставов (симптомы схожи с симптомами ревматоидного артрита).
Заболевания сердечно-сосудистой системы очень опасны своими последствиями. Это может привести к воспалению сердечной мембраны и инфаркту миокарда. Антитела, присутствующие в организме, которые повреждают клетки крови, также могут вызывать многочисленные гематологические нарушения.
Пациенты жалуются на выпадение волос, изменения на ногтях (часто ошибочно диагностируется микоз).
Диагностика волчанки
Диагностировать волчанку очень сложно — диагноз ставится до 60% случаев.
У пациентов с волчанкой изменения поражают дыхательную систему. Различают: острую и хроническую пневмонию, плеврит (воспаление, покрывающее лёгкие).
Волчанка также влияет на нервную систему, что может привести к хроническим головным болям, конвульсиям и даже нервно-психическим расстройствам. У многих пациентов волчанка поражает почки, что в крайних случаях может привести к полному повреждению почек.
Первые симптомы волчанки трудно уловить — в диагностике часто допускаются ошибки. Симптомы волчанки, как правило, очень разнообразны и могут напоминать другие заболевания. Вот почему постановка правильного диагноза может длиться годами.
Американское общество ревматологов разработало 11 критериев, из которых по меньшей мере четыре симптома говорят о диагнозе волчанка:
- эритема на лице;
- лишай;
- гиперчувствительность к солнечному свету;
- раны на слизистых оболочках;
- артрит;
- плеврит или перикардит;
- изменения в почках — от лёгких до очень тяжёлых;
- расстройства нервной системы;
- гематологические расстройства;
- иммунологические сбои;
- антиядерные антитела.
Причины возникновения
Причины волчанки до конца не выяснены, однако известно, что тенденция к развитию волчанки является наследственной. Волчанка является аутоиммунным заболеванием, которое означает, что организм, вместо того, чтобы защищаться от бактерий и вирусов, атакует собственные клетки и ткани.
Как часто возникает волчанка? Кому угрожает?
Волчанка очень редкая — болеют всего несколько десятков сотен тысяч человек. Мужчины болеют в девять раз реже.
Волчанка и беременность
При диагностике волчанки планирование беременности должно быть тщательно обсуждено с врачами и должно быть проведены специальные тесты.
Диагностированная волчанка не означает, что женщина не сможет забеременеть, однако, это заболевание увеличивает риск самопроизвольного аборта, а его симптомы усиливаются во время беременности. У детей и младенцев волчанка встречается крайне редко.

Гематологические осложнения часто наблюдаются при системной красной волчанке (СКВ). Сюда входят гемолитическая анемия с ретикулоцитозом, лейкопения (
Анемия, лейкопения и тромбоцитопения могут возникать в результате недостаточности костного мозга или чрезмерного разрушения периферических клеток, оба из которых могут быть иммуноопосредованными. Другие частые причины - наркотики , включая психотропные препараты, и инфекция. Несмотря на то, что многим пациентам не требуется специфического лечения цитопении при системной красной волчанке , CS остаются основой лечения. Другие традиционные методы лечения включают AZA, CYC и нормальный иммуноглобулин человека. Совсем недавно MMF стал играть роль агента, сохраняющего CS и CYC.
Лейкопения
Нейтропения
Нейтропения также является частым признаком СКВ с распространенностью порядка 47%, и это может быть опосредовано антинейтрофильными антителами. Нарушение функции мононуклеарной фагоцитарной системы, позволяющей сенсибилизированным клеткам оставаться в кровотоке, может частично компенсировать это. Уровни G-CSF обычно повышены у пациентов с СКВ с нейтропенией. Это может отражать сниженную чувствительность миелоидных клеток к G-CSF или присутствие антител против G-CSF иммуноглобулина G (IgG) и иммуноглобулина M (IgM). Увеличение сывороточного TNF-связанного лиганда, индуцирующего апоптоз при СКВ, также может способствовать нейтропении из-за чрезмерного апоптоза нейтрофилов.
Хотя аутоиммунитет является наиболее вероятным объяснением нейтропении при СКВ, другие патологии, такие как миелофиброз, также могут иногда иметь значение. Как и лимфопения, нейтропения в легкой форме часто не имеет клинических последствий, но иногда может быть связана с опасным для жизни сепсисом . Нейтропения при СКВ также часто связана с приемом лекарств и, в отличие от тромбоцитопении, не связана с повышенной смертностью.
Тромбоцитопения
Сообщается, что тромбоцитопения имеет распространенность от 7 до 30% в большой группе пациентов с СКВ. Повышенная периферическая деструкция тромбоцитов, связанная с наличием антитромбоцитарных антител, является наиболее вероятным патогенетическим механизмом. Также могут быть задействованы aPL, наряду с антителами против тромбопоэтина (TPO) , рецептора TPO c-Mpl и CD40L. Также сообщалось о повышенных уровнях TPO. Тромбоцитопения при СКВ может быть острой в начале и чрезвычайно тяжелой. Это проявление обычно связано с активным заболеванием в других системах органов и, как правило, реагирует на CS. Также распространена более хроническая форма, менее связанная с активностью заболевания, и обычно менее поддается лечению CS. Иммунная тромбоцитопения может предшествовать СКВ у 16% пациентов, появляясь за 10 лет до того, как СКВ становится клинически очевидной.
В дополнение к терапии высокими дозами кортикостероидов (CS), тромбоцитопения является независимым фактором риска повышенной смертности при СКВ. ретроспективном исследовании 126 пациентов с СКВ поздняя тромбоцитопения была связана с повышенной смертностью. Не было обнаружено связи с aPL, и увеличение смертности не было связано с тромбоэмболическими событиями. Более недавнее ретроспективное исследование 632 пациентов выявило особенно высокую распространенность тромбоцитопении, которая присутствовала у 58% на момент постановки диагноза [ 38 ]. Была очевидна связь с активностью заболевания, повышенной смертностью и гипокомплементемией.
Тромбоцитопения может также возникать в других контекстах при СКВ, например, как осложнение лекарственной терапии, например, иммунодепрессантами, такими как АЗА и редко HCQ. Тромботическая тромбоцитопеническая пурпура (ТТП) также хорошо известна, но, к счастью, встречается редко. Сообщается также о тромботической микроангиопатической гемолитической анемии в сочетании с СКВ [ 41 ], характеризующейся тромбоцитопенией, микроангиопатической гемолитической анемией, лихорадкой, неврологическими симптомами и поражением почек.
Тромбоцитопения и анемия
Тромбоцитопения при СКВ часто связана с гемолитической анемией, наличием других цитопений и aPLs. Хотя может наблюдаться связь между антителами к дцДНК и гемолитической анемией, эта связь не очевидна в случаях тромбоцитопении.
Оценка причин цитопении при системной красной волчанке
Подробная история приема лекарств при лечении системной красной волчанки очень важна. При этом следует учитывать как препараты, назначаемые непосредственно для лечения этого патологического состояния, так и препараты для лечения его осложнений, такие как статины, антибиотики и ингибиторы АПФ. Лейкопения и тромбоцитопения могут осложнять лечение СКВ с помощью AZA, MTX и, реже, CSA, MMF или HCQ. Нейтропения может следовать за импульсным CYC, с надиром, обычно возникающим на 10-й день после инфузии, что частично зависит от дозы.
Выявление морфологии лимфоцитов может быть диагностикой конкретных лимфопролиферативных заболеваний. Сопутствующая анемия требует анализа крови, количества ретикулоцитов и прямого теста Кумба. Другие соответствующие исследования включают лактатдегидрогеназу (ЛДГ) в сыворотке крови, функциональные тесты печени, иммуноглобулины и электрофорез белков сыворотки. Исследования перестройки гена периферической крови (гена тяжелой цепи иммуноглобулина или перестройки гена рецептора Т-клеток) следует рассматривать, если есть высокий индекс подозрения на лимфопролиферативное заболевание.
Измерение антитромбоцитов и других антител в рутинной клинической практике является более спорным. Доступен ряд анализов для измерения антител к тромбоцитам, в основном направленных против гликопротеинов IIb / IIIa и Ib / IX. Из-за их стоимости, ограниченной доступности и времени, необходимого для получения результата, измерение антител к тромбоцитам с использованием таких методов, вероятно, не является необходимым. Однако их использование следует рассматривать в случаях тяжелой тромбоцитопении, особенно если они не поддаются лечению. Есть некоторые свидетельства того, что их уровень может коррелировать с активностью заболевания. Когда уровень тромбоцитов нормализуется у пролеченных пациентов, антитела к тромбоцитам могут значительно снизиться или стать неопределяемыми . Однако отсутствие антитромбоцитарных антител не исключает аутоиммунную этиологию тромбоцитопении у отдельного пациента с СКВ.\
IgG и IgM антинейтрофильные и антилимфоцитарные антитела также могут быть измерены с помощью IIF с использованием проточной цитометрии. Это определит клеточную специфичность и класс иммуноглобулинов антитела. Специфичность антител против лимфоцитов может быть дополнительно исследована с помощью ELISA на антитела HLA класса I. Тест хемилюминесценции нейтрофилов также используется некоторыми лабораториями. Он измеряет ответ человеческих моноцитов на опсонизированные антителами нейтрофилы пациента, положительный результат подтверждает наличие антител, реагирующих с нейтрофилами. Ограничения анализов, используемых для измерения антинейтрофильных антител у пациентов с нейтропенией, недавно были пересмотрены. APL также могут быть связаны с тромбоцитопенией и гемолитической анемией и обычно измеряются в большинстве лабораторий. Другие антитела, которые могут иметь патогенетическое значение при цитопении, связанной с волчанкой, например, против G-CSF и рецептора TPO , обычно не измеряются.
Исследование костного мозга
Аспирацию костного мозга (КМ) и трепан следует рассматривать во всех случаях тяжелой или стойкой лейкопении или тромбоцитопении у пациентов с СКВ. Точно так же обследование костного мозга важно в случаях панцитопении, особенно если пациент получает миелотоксическую терапию, такую как AZA, MMF или CYC. В костном мозге могут присутствовать специфические признаки, указывающие на миелотоксичность, вызванную лекарственными средствами. Например, AZA может вызывать апластическую анемию, гипоплазию эритроидов и мегалобластные изменения. Исследование BM также может выявить злокачественные гематологические заболевания и гемофагоцитоз. Посев на BM показан при лихорадке неизвестного происхождения у пациентов с подавленным иммунитетом и СКВ. Общие аномалии костного мозга у пациентов с СКВ включают увеличение предшественников гемопоэза, что свидетельствует о периферической деструкции или, альтернативно, гипоцеллюлярности, вызванной СКВ. Некроз BM с изменениями стромы также является частым. У пациентов с тромбоцитопенией может наблюдаться ряд аномалий мегакариоцитов. Эти клетки могут быть сгруппированными, гиполобулированными и пикнотическими и могут иметь оголенную цитоплазму.. Это подтверждает гипотезу о том, что костный мозг может быть органом-мишенью при болезни и что нормальные механизмы клиренса дефектны и / или подавлены при СКВ
Лечение цитопении при системной красной волчанке
Лейкопения и тромбоцитопения при СКВ часто протекают в легкой форме и не требуют специальной лекарственной терапии.
Кортикостероиды
Азатиоприн и др.
АZA традиционно используется в качестве стероидсберегающего средства при лечении тромбоцитопении при СКВ. Однако рандомизированных контролируемых испытаний его использования в этом контексте не проводилось. CSA является альтернативным иммунодепрессивным препаратом при лечении цитопении, связанной с волчанкой. В открытом исследовании с участием 16 пациентов с СКВ уровни тромбоцитов и лейкоцитов вернулись к норме у пациентов с тромбоцитопенией или лейкопенией, получавших CSA 3-5 мг / кг / день в течение среднего периода лечения 30 месяцев. Однако не рекомендуют использовать эти дозы из-за риска нефротоксичности и предпочитаем дозы до 2,5 мг / кг / день с тщательным контролем функции почек и артериального давления. . Кроме того, другие рекомендовали использовать еще более низкие дозы. Недавно сообщалось о его успехе в качестве стероидсберегающего средства при тромбоцитопении, связанной с волчанкой, с минимальными побочными эффектами . Несмотря на это, ассоциация гипертонии и почечных осложнений с циклоспорином предполагает, что его следует использовать с осторожностью и тщательно наблюдать за пациентами. Комбинация преднизолона и HCQ может быть адекватной альтернативой для контроля тромбоцитопении у многих пациентов.
Спленэктомия
Если лечение тромбоцитопении преднизолоном или стероидсберегающими препаратами оказалось безуспешным, следует рассмотреть возможность спленэктомии. Ответ на спленэктомию при тромбоцитопении, связанной с волчанкой, обычно благоприятен. Учитывая важную роль селезенки в клиренсе иммунных комплексов, после спленэктомии при СКВ предполагался риск обострения активности заболевания, но на практике это обычно не подтверждается .Важность соответствующих профилактических мер против инфицирования после спленэктомии при СКВ невозможно переоценить. Это включает использование вакцин против пневмококка, гемофильного гриппа типа B, менингита C и гриппа, а также профилактических антибиотиков, таких как пенициллин V, особенно у пациентов с дополнительной хронической гипокомплементемией. Пневмококковая вакцинация может потребоваться повторить через 5 л
Иммуноглобулинемия G
IVIG может быть очень эффективным у некоторых пациентов с тромбоцитопенией, связанной с волчанкой. Кроме того, при иммунной тромбоцитопении , IVIG может как блокировать активирующие, так и повышать ингибирующие рецепторы Fcγ. Даназол - еще один вариант специфического лечения тромбоцитопении при СКВ. Как правило, это безопасно и хорошо переносится, и в этом контексте можно применять IVIG в отличие от даназола во время беременности. Терапевтическая доза IVIG при тяжелой тромбоцитопении, осложняющей СКВ, составляет 2 г / кг, обычно вводимая пятью последовательными ежедневными дозами по 400 мг / кг. Также сообщалось о поддержании ремиссии с помощью повторных доз IVIG при тяжелой тромбоцитопении, осложняющей СКВ.
Механизм действия IVIG при системной красной волчанке , вероятно. мультмодален и включает в себя: понижающую регуляцию продукции аутоантител нейтрализацию патогенных аутоантител, антиидиопатическими антителами , ингибирование комплемент - опосредованного повреждения модулояцию продукции цитокинов , индукцию апоптоза лимфоцитов и моноцитов , модуляцию функции В - и Т - лимфоцитов.
Рефрактерные цитопении
Лечение тяжелой цитопении и апластической анемии при СКВ может потребовать лечения более сильными цитотоксическими средствами, включая CYC. Терапия CYC (назначается из расчета 0,75–1,0 г / м 2 площади поверхности тела или 10–15 мг / кг), вводимая внутривенно каждый месяц в течение не менее 4 месяцев, оказывается полезной при лечении тяжелой тромбоцитопении, связанной с волчанкой, не поддающейся стандартным методам лечения . Более низкие дозы, применяемые чаще, например, каждые 2 недели, все чаще используются в некоторых учреждениях для улучшения переносимости без потери эффективности. Сбалансировать риски и преимущества такой терапии может быть сложно, особенно при наличии тяжелой нейтропении. Однако сообщалось об успешном использовании высоких доз CYC в / в при лечении апластической анемии, осложняющей СКВ. Анализ BM перед терапией особенно полезен в этой ситуации, поскольку повышенное количество предшественников эритроцитов или лейкоцитов в костном мозге предполагает, что ответ на терапию более вероятен. Кроме того, одновременное использование рекомбинантного человеческого G-CSF (rhG-CSF) и антибиотиков снижает риск этой формы подхода.
MMF
Иммуноаблативная доза CYC и трансплантация стволовых клеток
ечение тяжелых и особенно рефрактерных аутоиммунных заболеваний было несколько улучшено за счет введения интенсивной иммуноаблативной иммуносупрессии с использованием трех различных подходов. Это аллогенная трансплантация гемопоэтических стволовых клеток (HSCT), аутологичная HSCT (с использованием костного мозга или периферической крови) и иммуноаблативная иммуносупрессия высокими дозами без поддержки стволовых клеток. Испытания при СКВ, включая пациентов с тяжелыми гематологическими проявлениями, и при других аутоиммунных заболеваниях показывают, что иммуносупрессивная терапия высокими дозами с поддержкой аутологичных гематопоэтических стволовых клеток или без нее может вызвать ремиссию ранее резистентного заболевания
Таким образом, альтернативным подходом является использование высоких доз CYC без трансплантации стволовых клеток. Это успешно применялось при апластической анемии и других аутоиммунных заболеваниях, включая СКВ
Анти-В-клеточная терапия
Центральная роль В-клеток в патогенезе СКВ дает основание для использования моноклонального антитела против CD20 ритуксимаба в его лечении. CD20 экспрессируется на промежуточных стадиях развития В-клеток, но теряется на терминальных стадиях и отсутствует в плазматических клетках. Ритуксимаб представляет собой химерное моноклональное антитело против CD20 человека, которое быстро истощает CD20-положительные В-клетки периферической крови за счет опосредованной комплементом и антителозависимой клеточной цитотоксичности. Хотя изначально ритуксимаб использовался для лечения рецидивов В-клеточной фолликулярной неходжкинской лимфомы низкой степени злокачественности, впоследствии он успешно применялся при лечении хронической иммунной тромоцитопении. Было показано, что у пациентов с СКВ ритуксимаб истощает популяции аутореактивных В-клеток и снижает продукцию аутоантител плазматическими клетками. При введении с использованием протокола повышения дозы от разовой дозы 100 мг / м 2 до четырех еженедельных доз 375 мг / м 2ритуксимаб приводил к истощению В-клеток, что коррелировало со снижением проявлений заболевания. Ритуксимаб также успешно применялся при лечении аутоиммунной гемолитической анемии, осложняющей СКВ.
Альтернативный подход включает аутореактивный стимулятор B-лимфоцитов фактора выживания B-клеток (BLyS). BLys - цитокин, связанный с TNF, может быть нацелен несколькими способами, например, через рецепторы-ловушки и моноклональные антитела против BLyS. LymphoStat-B (белимумаб) - полностью человеческое моноклональное антитело, которое связывается с BLyS с высокой аффинностью и нейтрализует биоактивность BLyS человека in vitro и in vivo. У пациентов, получавших белимумаб, наблюдалось более длительное время до обострения болезни по сравнению с плацебо, и наблюдалось снижение титров анти-дцДНК. В анализе подгрупп пациенты с серологически активным заболеванием значительно лучше ответили на терапию белимумабом. Хотя его влияние на цитопении при СКВ еще не известно, оно может представлять собой дополнительный терапевтический подход к их лечению. Abetimus (LJP 394), который индуцирует толерантность В-клеток к антителам против дцДНК, до сих пор исследовался только для предотвращения почечных обострений при волчанке.
Даназол
Ингибитор продукции гонадотропных гормонов. Вызывает обратимое подавление продукции ЛГ и ФСГ гипофизом у мужчин и женщин. Не обладает эстрогенной и гестагенной активностью. Обладает слабой андрогенной активностью с сопутствующим анаболическим эффектом. Подавляет пролиферацию и вызывает атрофию нормальной и эктопической ткани эндометрия. Уменьшает потерю менструальной крови, механизм данного действия окончательно не установлен. Ингибирует овуляцию и уменьшает уровень 17β-эстрадиола в плазме крови. Остается неясным, является ли ингибирование пролиферации эндометрия следствием уменьшения уровня эстрадиола или прямого влияния даназола на эстрогеновые рецепторы эндометрия. После отмены даназола овуляция обычно возобновляется в течение 5 недель, что сопровождается характерным резким повышением ЛГ и небольшим повышением ФСГ. Стандартны показания к назначению даназола : эндометриоз с сопутствующим бесплодием, доброкачественные новообразования молочной железы (фиброзно-кистозная мастопатия), первичные меноррагии, предменструальный синдром, гинекомастия; наследственный ангионевротический отек. Противопоказания : тяжелые нарушения функции печени и/или почек, хроническая сердечная недостаточность, порфирия, тромбоэмболические нарушения (в т.ч. в анамнезе), андрогенозависимые опухоли, вагинальное кровотечение неясного генеза, рак молочной железы, карцинома, беременность, период лактации, повышенная чувствительность к даназолу. Не рекомендуется применять даназол у детей и у лиц с заболеванием почек.
Новаторские подходы
Элтромбопаг - это агонист рецепторов тромбопоэтина на поздних стадиях развития для лечения тромбоцитопении. Недавно были опубликованы испытания фазы II, изучающие его роль в иммунной тромбоцитопении и в тромбоцитопении, связанной с инфекцией гепатита С. В исследовании ITP элтромбопаг вводили перорально в дозе 30, 50 или 75 мг в день 118 пациентам с количеством тромбоцитов 50 × 10 9 / л на 43-й день. Это было достигнуто в 28, 70 и 81% в трех группах дозировки элтромбопага, соответственно, по сравнению с 11% в группе плацебо. Среднее количество тромбоцитов на 43-й день составляло 26 × 10 9 / л, 126 × 10 9./ л, 183 × 10 9 / л и 16 × 10 9 / л соответственно.
Ромиплостим (AMG 531) - еще один агонист рецепторов ТПО, который в настоящее время лицензирован для лечения хронической рефрактерной иммунной тромбоцитопении. Он состоит из компонента Fc IgG 1, связанного с пептидным доменом с четырьмя сайтами связывания для Mpl, рецептора ТРО. В отличие от рекомбинантного фактора роста и развития мегакариоцитов первого поколения, ромиплостин не имеет гомологии последовательности с ТПО, следовательно, существует меньший риск выработки антител против эндогенного ТПО. Он имеет высокое сродство к рецептору ТПО и увеличивает дифференцировку мегакариоцитов. Его вводят в виде еженедельных подкожных инъекций, и ответ зависит от дозы, достигая пика на 12-15 дни

Системная красная волчанка (СКВ) является представителем патологий из группы так называемых аутоиммунных заболеваний. При таких патологиях иммунная система, естественной задачей которой является защита организма, борется и наносит ущерб собственным тканям и органам организма, например, коже, суставам, почкам, мозгу, сердцу, легким. Болезнь может поражать все органы человека.
Возникновение и причина заболевания
Волчанка поражает женщин чаще, чем мужчин (приблизительно 9:1), и первые симптомы болезни чаще всего появляются между 15 и 44 годами.
Причина волчанки неизвестна, но ученые определили комбинацию ряда факторов, которые способствуют заболеванию. Это генетические, гормональные причины и факторы окружающей среды, такие как солнечный свет, стресс, некоторые лекарства и инфекции.
Симптомы красной волчанки
Название болезни восходит к средневековью. Волчанка — по-латинский означает волк. Действительно, изменения кожи у больных напоминали волчьих укусов. Слово эритематоз указывает на красный цвет поражений.
Есть много симптомов системной волчанки, которые могут варьироваться от пациента к пациенту. Волчанка может поражать разные органы, и степень поражения варьируется — от легкой до очень тяжелой, потенциально опасной для жизни.
В течение заболевания пациенты испытывают чередование периодов обострения симптомов (активность заболевания, рецидивы) и периодов исчезновения или облегчения (ремиссия) признаков патологии.
Наиболее распространенными симптомами красной волчанки в целом являются: сильная усталость, повышенная температура, потеря веса, боль в суставах и отеки. Также может быть характерное покраснение «бабочки» на лице на носу и щечках. Сыпь также возникает на груди, плечах и верхних конечностях. Все кожные проявления могут усугубляться солнечным светом.
Другие возможные симптомы включают язвы в полости рта, выпадение волос, побеление и фиолетовый цвет пальцев на холоде, боль в груди (при вдыхании), одышка.


Диагностика красной волчанки
Так как волчанка поражает различные органы, и симптомы могут имитировать другие заболевания, постановка диагноза часто осложнена. При этом до сих пор в мире нет ни одного лабораторного теста, который мог бы окончательно подтвердить диагноз.
Диагноз основывается на сочетании симптомов. Для правильной диагностики врач использует данные:
- подробной истории болезни (информация о пациенте);
- детального медицинского осмотра;
- лабораторных анализов: анализ крови , седиментация, биохимическое исследование, исследование мочи, иммунологические тесты — уровень комплемента, антиядерные и другие аутоантитела;
- методов визуализации: рентген, ультразвук, эхокардиография, в конечном итоге магнитно-резонансная томография;
- обследования глаз;
- неврологического обследования;
- биопсии кожи;
- биопсии почек и др.

Волчанка может вызвать воспаление почек (волчаночный нефрит) и нарушить способность почек выводить продукты метаболизма. В этом случае в моче появляются кровь и белок. Если в моче наблюдается большая потеря белка, пациент может страдать от отеков. Но во многих случаях заболевание почек не сопровождается какими-либо симптомами, поэтому мочу следует обследовать у каждого больного волчанкой, даже без почечной симптоматики.
Для диагностики волчаночного нефрита и определения его типа и правильного лечения берется образец ткани почки (почечная биопсия).
Лечение волчанки
В настоящее время полностью вылечить системную красную волчанку невозможно. Тем не менее, существует ряд способов успешного лечения заболевания, до состояния, позволяющего пациенту жить нормальной жизнью.
Лечение волчанки варьируется в зависимости от степени и тяжести поражения органов и подбирается индивидуально для каждого пациента. Цель лечения состоит не только в том, чтобы вызвать ремиссию заболевания (т.е. облегчить или устранить симптомы заболевания) и предотвратить дальнейшие рецидивы, но также и в том, чтобы предотвратить полное повреждение органа и другие осложнения.
Препараты, используемые в терапии волчанки, включают в себя:
- кортикостероиды (например, преднизон, медрол), которые облегчают воспалительный ответ;
- противомалярийные препараты (например, плакунил) — особенно при кожных и суставных симптомах;
- иммунодепрессанты (например, азатиоприн, метотрексат, циклофосфамид, циклоспорин или микофенолат мофетил), которые облегчают воспалительный ответ и предотвращают повреждение основных органов (почек, сердца, легких, центральной нервной системы);
- нестероидные противовоспалительные препараты (например, ибупрофен, диклофенак, нимесулид) для контроля боли в суставах.
Несмотря на неоспоримую эффективность, прием этих препаратов может быть связан с рядом побочных эффектов, о возникновении которых необходимо сообщить лечащему врачу.
Что может сделать для себя больной красной волчанкой
- много отдыхать, избегать стрессов, инфекций, соблюдать рациональное питание;
- поддерживать мышечную силу и подвижность суставов путем регулярной адекватной физической активности;
- избегать солнечного света, используя солнцезащитный крем с высоким солнцезащитным фактором;
- регулярно посещать медицинские осмотры всю жизнь;
- немедленно сообщать врачу о любых новых симптомах, побочных эффектах или признаках инфекции.
СКВ и беременность
Диагноз волчанки не исключает возможности забеременеть и родить здорового ребенка. Однако из-за повышенного риска выкидыша, риска осложнений во время беременности, нежелательных эффектов ряда лекарств, применяемых при СКВ, а также некоторого риска для плода, беременность всегда следует тщательно планировать и контролировать у врача.
Обычно рекомендуется забеременеть не ранее, чем через 6 месяцев с момента последнего рецидива.
Перспективы
Системная красная волчанка — это хроническое заболевание, требующее регулярного мониторинга. Тем не менее, благодаря новым методам диагностики и лечения, прогноз пациентов с СКВ за последние 20 лет значительно улучшился. В настоящее время для поиска оптимальных методов лечения во всем мире проводятся дополнительные клинические испытания.
Читайте также:

