Атипичный эпителий в дпк что это
Обновлено: 24.04.2024
Исследование для определения количественных и качественных изменений клеток, наличия внутри- и внеклеточных включений и микроорганизмов в биоматериале, полученном при эндоскопии, которое используется для диагностики широкого спектра онкологических, инфекционных, аутоиммунных и идиопатических заболеваний различных систем органов.
Синонимы русские
- Цитологическое исследование смыва, лаважа, браш-биопсии, тонкоугольной аспирационной биопсии, полученных при эндоскопии
- Цитологический мазок
- Мазок на цитологию
Синонимы английские
Метод исследования
Какой биоматериал можно использовать для исследования?
Мазок на предметном стекле.
Общая информация об исследовании
Цитологическое исследование – метод лабораторной диагностики, позволяющий оценить качественные и количественные изменения клеток, наличие внутри- и внеклеточных включений и микроорганизмов. Метод нашел широкое применение в диагностике целого спектра заболеваний различных систем органов. Для диагностики злокачественных новообразований, инфекционных болезней, аутоиммунных и идиопатических состояний цитологическому исследованию могут быть подвергнуты смывы, браш-биоптаты, лаваж, пунктаты тонкоигольной аспирационной биопсии (ТАБ) и любой другой биоматериал, полученный при эндоскопическом исследовании.
В зависимости от того, каким способом был получен биоматериал при эндоскопии и с какой целью проводят цитологическое исследование, в образце оценивают следующие параметры: клеточный состав и его количественные изменения (макрофаги, нейтрофилы, лимфоциты, эозинофилы, эритроциты, эпителий, клетки Лангерганса), качественные изменения клеток (наличие многоядерных клеток, синцития, атипичных клеток эпителиального и неэпителиального происхождения), включения ("серные гранулы", пылевые частицы, асбестовые тельца, PAS-положительный материал при альвеолярном протеинозе, амилоид), микроорганизмы (бактерии, грибы, вирусы).
Цитологическое исследование показано при обследовании пациента с симптомами заболеваний дыхательной системы или при случайном выявлении новообразования, инфильтрата или полости в легких. Результаты цитологического исследования пунктата, полученного при ТАБ, характеризуются большей точностью по сравнению с результатами цитологического анализа браш-биоптата или бронхоальвеолярного лаважа или смыва с бронхов. При цитологическом анализе биоматериала, полученного от здорового человека, в норме обнаруживаются макрофаги, лимфоциты, клетки эпителия, а также нейтрофилы, эозинофилы и тучные клетки в небольшом количестве, фон мазка прозрачный. Биоматериал, полученный от курящего пациента, характеризуется большим общим количеством клеток, а также большим количеством нейтрофилов. Поэтому при интерпретации результата исследования необходимо учитывать дополнительные анамнестические данные, в первую очередь курение. Обнаружение большого количества лимфоцитов в мазке (лимфоцитоз) наблюдается при саркоидозе, туберкулезе, злокачественных новообразованиях, гиперсенситивном интерстициальном пневмоните и лекарственном пневмоните. Выраженная нейтрофилия характерна для инфекционных заболеваний и острого респираторного дистресс-синдрома. Отсутствие каких-либо изменений в мазке при цитологическом исследовании практически позволяет исключить активный саркоидоз, аллергический пневмонит, эозинофильную пневмонию, альвеолярный протеиноз, бериллиоз и диффузный альвеолярный геморрагический синдром. Многоядерные макрофаги характерны для гранулематозных воспалительных процессов (туберкулез, саркоидоз, гиперсенситивные пневмониты), вакуолизация цитоплазмы макрофагов наблюдается при аллергических альвеолитах. Обнаружение внутриядерных включений типично для заболеваний вирусной этиологии (пневмония, вызванная цитомегаловирусом, вирусом кори), а внутрицитоплазматических включений – для хронической сердечной недостаточности и альвеолярного кровотечения (гемосидерин), гистоплазмоза, асбестоза и других пневмокониозов, пневмонии, вызванной респираторно-синцитиальным вирусом. Цитологическое исследование позволяет выявить наличие внеклеточных включений, например асбестовых телец и аморфного PAS-положительного материала при альвеолярном протеинозе. Цитологическое исследование бронхоальвеолярного лаважа является основным методом диагностики пневмоцистной пневмонии у пациентов со СПИД. Кроме P. jiroveci, большое значение в диагностике заболеваний дыхательной системы имеет обнаружение в мазке мицелия грибов рода Aspergillus и Mycobacterium tuberculosis.
Цитологическое исследование незаменимо при диагностике многих заболеваний желудочно-кишечного тракта. Пищеварительный тракт может быть исследован практически на всем протяжении с помощью фиброгастродуоденоскопии (ФГДС), ректороманоскопии и колоноскопии. Полученные при этом смывы, браш-биопсии и ТАБ могут быть подвергнуты цитологическому исследованию. Этот метод особенно полезен в случае, если выполнение эксцизионной биопсии затруднено (например, при наличии стриктур), менее информативно (пациенты с метаплазией Барретта и неспецифическим язвенным колитом) или рискованно (риск кровотечения, перфорации, диссеминация опухоли). Если планируется выполнение и браш-биопсии для цитологического исследования, и эксцизионной биопсии для гистологического анализа из одного и того же подозрительного участка слизистой, рекомендуется сначала произвести взятие биоматериала на цитологическое исследование, а только затем – на гистологическое. Цитологическое исследование используют для выявления диспластических изменений эпителия различных участков слизистой ЖКТ и диагностики злокачественных новообразований. Кроме того, с помощью этого метода может быть диагностирован эзофагит, вызванный вирусом простого герпеса и цитомегаловирусом, а также обнаружен псевдомицелий Candida albicans. Цитологический метод применяют для диагностики инфекции H. pylori (чувствительность 98 %). Дистальная часть двенадцатиперстной кишки, тощая и подвздошная кишка не могут быть визуализированы с помощью эндоскопии и поэтому цитологическому исследованию не подвергаются.
Определенную роль цитологическое исследование играет при диагностике рака мочевого пузыря. Обнаружение атипичных клеток в смывах, полученных при цистоскопии, является специфичным признаком переходно-клеточной карциномы. Следует отметить, что наибольшая чувствительность исследования показана в отношении низкодифференцированных, агрессивных новообразований с распадом ткани. При этом атипичный уротелий попадает в смыв и может быть выявлен в мазке. Эпителий карциномы с низкой степенью злокачественности, как правило, не может быть получен методом смыва и не выявляется при цитологическом исследовании.
Цитологическое исследование является дополнительным методом диагностики злокачественных новообразований гортани. Его чувствительность уступает чувствительности гистологического метода.
Обнаружение в мазке каких-либо патологических признаков не всегда указывает на наличие того или иного заболевания, так как находка иногда может быть обусловлена контаминацией образца при проведении эндоскопического исследования. Также нормальный мазок не позволяет полностью исключить наличие заболевания. Результат цитологического исследования оценивается с учетом дополнительных клинических, инструментальных и лабораторных данных.
Для чего используется исследование?
- Для диагностики и контроля лечения онкологических, инфекционных, аутоиммунных и идиопатических заболеваний различных систем органов.
Когда назначается исследование?
- При проведении ФГДС, бронхоскопии, ларингоскопии, цистоскопии, ректороманоскопии и колоноскопии.
Что означают результаты?
Описывается микроскопическая картина + дается заключение по представленному материалу.
Обнаружение патологических признаков:
- атипичные клетки: специфичный признак злокачественных новообразований;
- многоядерные клетки: специфический признак гранулематозного воспаления (саркоидоз, туберкулез);
- внутриклеточные включения (бронхоскопия): пневмокониозы, альвеолярное кровотечение или застойная сердечная недостаточность (гемосидерин), гистоплазмоз;
- внеклеточные включения (бронхоскопия): "серные гранулы", асбестовые тельца, альвеолярный протеиноз;
- микроорганизмы (бронхоскопия): Pneumocystis, Toxoplasma, Legionella, Histoplasma, Cryptococcus, Mycobacterium tuberculosis, Influenza, RSV– инфекция;
- микроорганизмы (бронхоскопия или ФГДС): бактерии, Herpes simplex, CMV, Aspergillus, Candida – инфекция или контаминация;
- H. pylori (ФГДС) – геликобактериоз.
Отсутствие патологических признаков:
- норма;
- материал неполноценный (значительная примесь крови, слизи, недостаточное количество клеток, толстый слой материала и пр).
Что может влиять на результат?
- Способ взятия биоматериала на исследование (смыв, лаваж, браш-биопсия, тонкоигольная аспирационная биопсия);
- степень злокачественности опухоли;
- контаминация образца микрофлорой;
- наличие примеси крови, слизи.
Важные замечания
- Обнаружение в мазке каких-либо патологических признаков не всегда указывает на наличие заболевания;
- нормальный мазок не позволяет полностью исключить заболевание;
- результат цитологического исследования следует оценивать с учетом дополнительных клинических, инструментальных и лабораторных данных.
Также рекомендуется
12 Гистологическое исследование биопсийного диагностического материала (эндоскопического материала, тканей женской половой системы, кожи, мягких тканей)
12 Цитологическое исследование материала, полученного при оперативном вмешательстве
12 Цитологическое исследование пунктатов, соскобов других органов и тканей
Цитологическое исследование желудка. Гастрограммы.
При цитологическом изучении материала, полученного из желудка с помощью гастробиопсии, в препаратах отчетливо определяют клеточные элементы слизистой оболочки желудка: покровно-ямочный эпителий, главные и обкладочные клетки желез.
Соотношение в цитологических препаратах клеточных элементов слизистой оболочки желудка, различная степень их дифференцировки, появление признаков дегенерации и атипии, а также появление лейкоцитов, ретикулярных и гистиоидных элементов позволяют выявить типы гастроцитограмм. которые наиболее свойственны тому или другому заболеванию желудка.
Гастроцитограммы больных хроническим гастритом характеризуются наличием клеток покровно-ямочного эпителия, которые располагаются преимущественно небольшими пластами и скоплениями. Клетки имеют высоко- и низкоцилиндрическую форму, базально или центрально расположенное ядро. широкую,слабобазофильную цитоплазму. Ядра клеток отличаются некоторым полиморфизмом, имеются все переходы от незрелых относительно крупных, светлых с нежносетчатым рисунком хроматина до зрелых небольших размеров, интенсивно окрашенных ядер.
Главные и обкладочные клетки желез обнаруживают в различном количестве, расположены разрозненно, небольшими округлыми группами или ровными рядами, в которых отмечается правильное чередование главных и обкладочных клеток. В главных клетках отчетливо просматриваются окрашенные в сине-фиолетовый цвет грубые гранулы, заполняющие всю цитоплазму. Обкладочные клетки отличаются широкой светлой цитоплазмой, окрашенной в нежно-розовый цвет. В препаратах встречаются лимфоидные элементы и полиморфно-ядерные нейтрофильные лейкоциты.
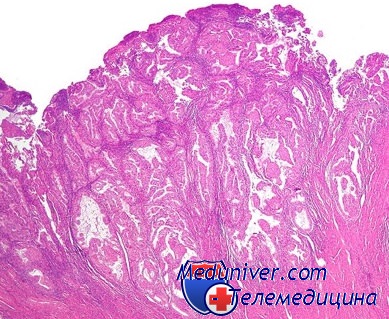
В цитограммах при полипах желудка большое количество пластов и больших скоплений покровно-ямочного эпителия, встречаются железисто-подобные структуры. По сравнению с цитограммами при гастрите можно отметить преобладание молодых, незрелых клеток с укрупненными ядрами и нежным рисунком хроматина в них.
При язвенной болезни желудка в гастроцитограммах преобладают сег менто-ядерные нейтрофилы, кроме того, обнаруживаются в значительном количестве лимфоциты, плазматические клетки, эозинофилы, клетки гистиоидного тина, скопления полиморфных эпителиальных клеток. В эпителии обычно отмечают признаки дегенерации в виде вакуолизации цитоплазмы и ядер, кариолизиса, кариорексиса и плазмолиза.
Однако необходимо отметить, что при цитологическом исследовании материала при неопухолевых и опухолеподобных поражениях желудка далеко не всегда возможно диагностировать эти заболевания. Последнее зависит от того, что изменения в клетках носят однотипный характер и часто можно обсуждать только степень клеточной пролиферации, атнпии и перестройки эпителия по кишечному типу.
Из злокачественных новообразований в желудке наиболее часто встречается аденокарцинома трех видов адеиокарцинома с высокой и низкой степенью дифференцировки, а также аденокарцинома с выраженным слизеобразованием. Реже встречаются перстневидноклеточный и недифференцированный рак, а также другие неэпителиальные опухоли.
Цитограммы больных раком желудка характеризуются наличием клеток с морфологическими признаками злокачественности. Клетки располагаются комплексами, в виде железисто-подобных или папиллярных структур, разрозненно. В комплексах и структурах отмечается беспорядочное нагромождение ядер. Клетки крупных размеров. Ядра занимают почтя всю клетку, преимущественно неправильной формы, гиперхромиые с грубым, неравномерно распределительным хроматином, гипертрофированными множественными нуклеоламн.
Гистологическую форму опухоли не всегда удается установить, чаше это возможно в случаях аденокарциномы, где, как правило, обнаруживаются железисто-подобные структуры. Коллоидный рак характеризуется наличием большого количества слизистых масс и перстневидных опухолевых клеток При малоднфференцированном раке резко анаплазированные клетки, с большим числом фигур деления, обычно располагающиеся разрозненно.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Цитологическое исследование материала из легких. Цитология эпителия пищеварительного тракта.
Созданная в 1959 г международная номенклатура опухолей человека послужила исходной основой для создания гистологическкх классификаций опухолей специальными комиссиями ВОЗ. В настоящее время имеются 2 серии цитологических классификаций ВОЗ и одна СЭВ, в которых отражены только некоторые локализации новообразований. В вышедшей в 1985 г. книге «Цитологическая диагностика опухолей и предопухолевых процессов» при описании новообразований за основу были взяты имеющиеся гистологические классификации ВОЗ с учетом возможностей цитологического метода и имеющиеся уже цитологические классификации.
При диагностике заболеваний органов дыхания цитологическому исследованию подвергают спонтанно выделенную или индуцированную ингаляцией трипсина мокроту, материал, полученный соскобом, аспирацией, смывом, пункцией, в том числе лимфатических узлов средостения во время бронхоскопии; трансторакальной плевральной пункцией лимфоузлов и средостения. Трудности, встречающиеся при цитологической диагностике заболеваний .четких, связаны с разнородностью клеточных элементов в исследуемом материале, разнородностью нозологических форм, являющихся поводом для цитологического исследования, часто встречающимися метастазами в легкие злокачественных новообразований других локализаций. При различных острых и хронических заболеваниях легких в цитологическом материале имеется комплекс изменений, включающих гиперплазию, метаплазию и дистрофию различных эпителиальных клеток.
При острых воспалительных заболеваниях в эпителии могут развиваться реактивные изменения, симулирующие новообразование и являющиеся причиной ошибочного диагноза, иногда же. наоборот, воспалительный процесс маскирует опухоль.
Достоверная цитологическая диагностика туберкулеза легких основана на обнаружении в мазках из мокроты или содержимого бронхов двух видов клеток эпителноидных и клеток Пирогова — Лангханса.
При цитологической диагностике опухолей легких процент обнаружения опухолевых клеток зависит от расположения опухоли в верхних или нижних долях, от формы роста. Около половины всех злокачественных опухолей легкого приходится на долю плоскоклеточного неороговевающего и ороговевающего рака. Цитологический материал при раке легкого характеризуется полиморфизмом размеров и формы клеток, которые располагаются среди слизи и бесструктурных масс.
Клетки плоскоклеточного ороговевающего рака лежат разрозненно или скоплениями. Изредка они располагаются в виде луковиц. Ядра опухолевых клеток, чаще всего гилерхромны, с грубым, неравномерно распределенным хроматином с неровными контурами. По форме ядра — неправильно округлые, палочковидные. Цитоплазма клеток плотная, часто с признаками жировой дегенерации. При плоскоклеточном ороговевающем раке нередко отмечают раннее ороговение.
Плоскоклеточный неороговевающий рак характеризуется наличием крупных округлых клеток, расположенных разрозненно или в виде комплексов. Ядра крупные, расположены центрально и занимают большую часть клетки, хроматин нежный, равномерно распределен по ядру. В ядрах нередко встречаются ядрышки, иногда гипертрофированные.
При железистой форме рака обнаруживают атипичные клетки крупных, средних и иногда мелких размеров округлой, овальной, призматической формы. Клетки расположены разрозненно, в виде железистых структур, папиллярных образований. Ядра крупные, округлой или овальной формы, расположены чаще всего эксцентрично. Хроматин нежный, в ядрах часто видно по нескольку гипертрофированных ядрышек. Встречаются дву- и трехъядерные клетки, цитоплазма очень нежная, в одних клетках она узким ободком окружает ядро, в других — занимает больший объем, вакуолизированная.
В зависимости от степени зрелости клеток можно говорить о степени дифференцировки данного варианта опухоли.
При недифференцированном мелкоклеточном раке опухолевые клетки расположены разрозненно, плотными группами, следующими друг за другом по ходу слизи, скоплениями. Клетки мелкие, округлые, напоминают лимфоциты. Ядра их крупные, плотные, гиперхромные, с компактным хроматином занимают почти всю клетку. Цитоплазма узеньким, еле заметным ободком окружает ядро. В комплексах клетки настолько тесно прилежат друг к другу, что в соседних клетках образуются вдавления, в связи с чем они принимают самую разнообразную форму треугольную, палочковидную, полулунную. Ядра принимают форму клетки.
Крупноклеточный недифференцированный рак характеризуется наличием крупных светлых клеток, расположенных разрозненно или в виде комплексов. Ядра повторяют форму клетки. Хроматин нежно-гранулярный или мелкопетлистый, равномерно распределен по ядру. Цитоплазма узеньким ободком окружает ядро, клетки часто выглядят голоядерными.
При цитологической диагностике заболеваний органов пищеварения исследуются смывы из пищевода, желудка, двенадцатиперстной, сигмовидной, прямой кишки («слепой» способ), целенаправленные смывы под визуальным контролем, аспираты через катетер, подведенный к участку поражения; соскобы нейлоновой щеткой во время эзофаго-, гастро-, дуодено-, сигмо-, ректоскопии; аспираты и соскобы щеткой из общего желчного и главного панкреатического протока во время ретроградной эндоскопической панкреатохолангиографии; пунктаты слюнных желез, печени; пунктаты, соскобы и отпечатки из различных органов брюшной полости при лапароскопии; асцитическая жидкость.
В пищеводе встречаются доброкачественные опухоли, такие как плоскоклеточная папиллома, а также некоторые неопухолевые заболевания эзофагиты различного происхождения, лейкоплакии. При цитологическом исследовании материала, полученного ил пищевода в этих случаях, в препаратах обнаруживается значительное количество клеток плоского эпителия и лейкоцитов. Нередко встречаются эпителиальные клетки в состоянии дистрофии
Из злокачественных новообразований в пищеводе встречают преимущественно плоскоклеточный рак, реже аденокарциному. Для цитологической картины плоскоклеточного рака характерно наличие детрита, разрушенных клеток-чешуек плоского эпителии, крупных полигональных клеток и клеток округлой формы. Ядра клеток грубые, пикнотизированные с неровными контурами, грубым глыбчатым хроматином. Цитоплазма преимущественно широкая, гомогенная от базофильной до почти бесцветной, местами с розоватым оттенком, мелковакуолизированная.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Рисунок 1. Язва препилорического отдела на фоне атрофического гастрита, ассоциированного с Hp В1983 году Б. Маршалл и Д. Уоррен описали выделенную из биоптата больного с антральным гастритом спиралевидную бактерию, которая получила названи
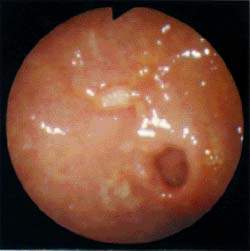 |
| Рисунок 1. Язва препилорического отдела на фоне атрофического гастрита, ассоциированного с Hp |
В1983 году Б. Маршалл и Д. Уоррен описали выделенную из биоптата больного с антральным гастритом спиралевидную бактерию, которая получила название Helicobacter pylori (Нр). В настоящее время описано 9 видов Нр и установлено, что это грамотрицательные, неспорообразующие микроорганизмы, продуцирующие некоторые ферменты (например, уреазу) и токсины и оказывающие деструктивный эффект на ткани желудка и двенадцатиперстной кишки, благодаря чему они имеют возможность преодолевать защитные барьеры в полости желудка и колонизировать слизистую оболочку. Помимо местного защелачивания, вокруг бактериальных клеток возникает и локальное снижение вязкости желудочной слизи, в результате разрушения муцина муциназой травмируются эпителиальные клетки, вызывается их дистрофия и снижается функциональная активность, открывая геликобактеру путь в глубь слизистой оболочки.
Кроме того, увеличивается секреция гастрина и подавляется продукция соматостатина, растет секреция соляной кислоты, что усиливает агрессивность желудочного сока в начальной стадии геликобактериоза и приводит к активному антральному гастриту. В подслизистом слое формируется воспалительная инфильтрация. К тому же бактериальная клетка, по сути, является комплексом антигенов, способных индуцировать иммунный ответ, т. е. выработку организмом антител.
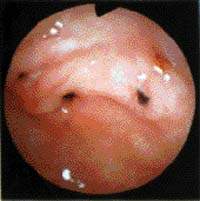 |
| Рисунок 2. Эрозии препилорического отдела |
Важную роль в развитии хронического гастрита играют медиаторы воспаления, которые либо продуцирует сам Нр, либо они высвобождаются из разрушенных клеток воспалительного очага. В процессе образования антител и при фагоцитозе выделяются цитотоксины, которые взаимно стимулируют участников воспалительной реакции. Например, тучные клетки выделяют гистамин, повышающий проницаемость сосудов и облегчающий миграцию из кровяного русла в очаг воспаления новых, составляющих инфильтрат клеток.
Синтезирующиеся в подслизистом слое антитела против Нр эффективно связываются с бактериальными клетками и способствуют их гибели. Таким образом, может установиться динамическое равновесие между популяцией геликобактера, с одной стороны, и факторами естественной резистентности к инфекции — с другой. Обычно защитных факторов макроорганизма бывает недостаточно, чтобы полностью уничтожить популяцию бактерий, и гастрит принимает хронический характер.
 |
| Рисунок 3. Язва луковицы двенадцатиперстной кишки |
Нр при неблагоприятных для него условиях (активизация факторов иммунитета, антибактериальная терапия и т. д.) может трансформироваться в атипичную кокковую форму, которая характеризуется утратой многих поверхностных антигенов и менее уязвима. При благоприятных условиях, если губительное воздействие на популяцию исчезает, Нр вновь превращается в полноценную S-образную форму, способную вырабатывать токсины (вакуолизирующий, гемолизирующий и др.), под влиянием которых слизистая оболочка желудка или двенадцатиперстной кишки может подвергаться «некротизирующим» изменениям с образованием эрозий и язв. Если же штамм Нр не способен синтезировать токсин, то вероятность изъязвления слизистой оболочки ничтожно мала. В этих случаях хронический гастрит сохранит активную форму либо пожизненно, либо на протяжении десятков лет.
Избыток соляной кислоты, неизбежно возникающий в ранней стадии гастрита, поступает в луковицу двенадцатиперстной кишки и сильно закисляет ее содержимое, в результате чего развивается желудочная метаплазия слизистой оболочки, т. е. переход к структурному варианту, напоминающему поверхностный эпителий антрального отдела желудка. На измененной слизистой оболочке луковицы появляются рецепторы для адгезинов Нр, на которых он и колонизирует, вызывая развитие дуоденита, точнее, гастродуоденита. Если же штамм может синтезировать токсин, вероятность изъязвления слизистой оболочки луковицы при обострении гастродуоденита становится чрезвычайно высокой.
Итак, хронический гастрит (гастродуоденит) и язвенную болезнь можно представить как единое в патогенетическом отношении заболевание, где ведущую роль играет Нр.
Целесообразно выделить несколько типичных клинико-морфологических форм пилорического геликобактериоза.
Острый гастрит. В дебюте эта форма может проявиться болевым симптомом, тошнотой, рвотой (иногда с примесью крови), диареей. Постепенно симптомы болезни купируются и гастрит, как правило, переходит в хроническую форму. Адекватная противомикробная терапия может обеспечить выздоровление.
Латентный гастрит. Практически здоровые люди, не предъявляющие жалоб, связанных с заболеванием желудочно-кишечного тракта. Инфицированность Нр на протяжении многих лет может протекать как «носительство», однако при гистологическом исследовании гастробиоптата всегда обнаруживаются изменения, характерные для ХГ, ассоциированного с Нр.
Хронический активный гастрит. Выделяют антральную (раннюю) и диффузную (позднюю) стадии. Основные критерии диагностики этих стадий (форм) приведены в таблице.
Таблица Основные критерии антральной и диффузной форм ХГ, ассоциированного с Нр
Хронический активный гастродуоденит, чаще антропилоробульбит. Форма хронического геликобактерного воспаления с вовлечением в процесс двенадцатиперстной кишки, преимущественно ее проксимального отдела (до фатерова соска). Клинически напоминает хронический активный антральный гастрит, а при эндоскопическом исследовании изменения обнаруживаются не только в желудке, но и в двенадцатиперстной кишке.
Язвенная болезнь (ЯБ) с локализацией рецидивирующей язвы или длительно не рубцующейся язвы в разных отделах желудка и (или) двенадцатиперстной кишки чаще всего возникает на фоне хронического активного геликобактерного гастродуоденита. Отсутствие в биоптате СО из антрального отдела желудка Нр является основанием предположить другие, более редкие причины гастродуоденальных изъязвлений: лекарственные препараты, синдром Золлингера — Элиссона, гиперпаратиреоидизм, изъязвленный рак, а также вторичные язвы, возникающие на фоне определенных заболеваний и внешних воздействий.
Инфекция Нр-фактор риска возникновения карциномы и лимфомы желудка. При карциноме и лимфоме желудка инфицированность слизистой оболочки достигает почти 100%. В последние годы проведено много исследований, направленных на выяснение роли Нр в возникновении данных заболеваний. Например, у большинства больных отмечается регрессия лимфомы желудка после медикаментозного подавления инфицированности СО Нр. На основании тщательного изучения литературы группа специалистов ВОЗ сделала вывод, что инфекция Нр является фактором риска рака желудка. Однако возможность предупреждения развития карцином и лимфом желудка путем раннего уничтожения инфекции ограниченна из-за отсутствия идеальной терапии и большого разнообразия штаммов Нр.
Существуют гистологический, цитологический и уреазный тесты.
Гистологический метод исследования получил широкое распространение, так как позволяет обнаружить Нр в биоптатах и одновременно изучить морфологические изменения, происходящие при этом в слизистой оболочке. Наиболее простым и доступным методом является окраска гистологических препаратов по Гимзе без дифференцировки. Нр окрашивается в темно-синий цвет, бактерии хорошо видны как на поверхности эпителия, так и в глубине ямок. Для оценки состояния слизистой оболочки и обнаружения Нр достаточно 2-3 биоптатов (из антрального отдела и тела желудка). Необходимо исследовать прицельно взятые биоптаты с выраженной гиперемией слизистой оболочки, но не из дна эрозий и язв. Частота выявления Нр с помощью гистологического метода коррелирует с другими методами и достигает не менее 80%.
В последнее время разработаны новые методы, среди которых наиболее чувствительный иммунноцитохимический с применением моноклональных антител.
Схема 1. Семидневная
Весьма обнадеживают результаты, полученные при выявлении Нр методом гибридизации ДНК в обычных парафиновых средах. Методика не только чувствительна, но и высокоспецифична, с ее помощью можно идентифицировать различные штаммы Нр и понять природу повторного заражения после успешного лечения.
Для цитологического исследования используются мазки-отпечатки (1-2 и более), полученные из биоптатов СО антрального отдела желудка. Биоптат берется прицельно из участков с наиболее выраженными визуальными отклонениями от нормы (гиперемия, отек), но не со дна язв и эрозий.
При обнаружении в мазках-отпечатках Нр обычно выявляется также и клеточная инфильтрация, характеризующаяся наличием лимфоцитов, плазматических клеток, нейтрофилов и эозинофилов. По преобладанию тех или иных клеточных элементов можно косвенно судить об активности и выраженности воспаления. Кроме того, цитологическое исследование позволяет выявить в клетках СО наличие пролиферативных процессов, метаплазии (кишечной в желудке и желудочной в дуоденуме), дисплазии и степени их выраженности, клеток злокачественного новообразования. Однако цитологический метод не дает информации о структуре исследуемой СО.
Схема 2. Десятидневная
По скорости выявления персистирующей Нр в СО цитологическому методу не уступает основанный на уреазной активности Нр экспресс-метод, получивший название кампи-теста. Тест состоит из геля-носителя в качестве индикатора рН. Индикатор меняет цвет от желтого к малиновому, когда под действием уреазы происходит гидролиз мочевины с образованием аммиака, сдвигающего рН среды в щелочную сторону. Изменение цвета среды происходит только в том случае, если в биоптате есть уреаза, «наработанная» Нр. Время появления малинового окрашивания косвенно свидетельствует о количестве жизнеспособных бактерий. Появление малинового окрашивания в течение первого часа соответствует значительной инфицированности СО Нр (+++), в течение последующих двух часов — умеренной (++), к концу суток — незначительной (+), если окрашивание наступает в более поздние сроки, результат считается отрицательным.
Ложноотрицательные результаты могут иметь место у больных при слабой обсемененности СО. Ложноположительные результаты возникают при неправильной обработке эндоскопов и биопсийных щипцов.
Схема 3. Семидневная
Среди дополнительных методов диагностики Нр следует отметить микробиологические, иммунологические и радионуклеидные методы. Например, 12-С-уреазный дыхательный тест. В большинстве стран мира он рассматривается в качестве основного теста выявления Нр-инфекции. Метод неинвазивный, абсолютно безопасный и позволяет определить степень колонизации СО Нр, является оптимальным способом контроля эффективности эрадикационной терапии.
В условиях обычной лаборатории эти методы малодоступны и на практике используются редко.
Абсолютными показаниями для проведения эрадикационной терапии являются следующие: язвенная болезнь желудка и двенадцатиперстной кишки (обострение и ремиссия), язвенные кровотечения, лимфома желудка, гастрит с выраженными эндоскопическими и гистологическими изменениями, состояния после хирургического лечения раннего рака желудка.
Схема 4. Десятидневная
К относительным показаниям относятся: функциональная диспепсия после полного обследования, длительное лечение ингибиторами протонового насоса, пищеводная рефлюксная болезнь, состояние после хирургического лечения язвенной болезни (ваготомия, дренирующие операции и др.), пожелания пациента при асимптоматичном (латентном) инфицировании Нр.
Лечение заболеваний, ассоциированных с пилорическим геликобактериозом, должно быть комплексным, но с обязательным включением в него антибактериальных средств — этиотропная терапия. Показаниями к назначению комплексной терапии являются выраженность клинико-морфологических проявлений различных форм гастрита, гастродуоденита и ЯБ, а этиотропной терапии — подтверждение инфицированности СОЖ Нр с помощью соответствующих диагностических тестов.
- ЗАДАЧИ ЛЕЧЕНИЯ: эрадикация Нр, заживление эрозий и язв, предупреждение обострений и осложнений
При гастритах и гастродуоденитах, ассоциированных с Нр, существует несколько схем медикаментозного лечения (схемы 1 и 2).
Кроме того, проводится симптоматическое лечение с использованием антацидных препаратов и прокинетиков.
Сроки стационарного интенсивного лечения 10 дней, но с учетом этиологии и выраженности клинико-морфологических проявлений болезни они могут быть изменены.
Схема 5. Четырнадцатидневная
Требования к результатам лечения: отсутствие клинических симптомов, эндоскопических и гистологических признаков активности воспаления и инфекционного агента (полная ремиссия) или прекращение боли и диспептических расстройств, уменьшение признаков активности процесса без эрадикации Нр. Больные активным гастритом (гастродуоденитом), ассоциированным с Нр, и аутоиммунным гастритом подлежат диспансерному наблюдению.
Медикаментозное лечение гастродуоденальных язв, ассоциированных с Нр, предполагает использование одной из схем (см. схемы 3, 4, 5).
После окончания комбинированной терапии продолжить лечение еще в течение 6 недель с использованием одного из следующих препаратов:
1. ранитидин (зантак и др. син.) — 300 мг в 19-20 ч.
2. фамотидин (гастросидин, квамател, ульфамид) — 40 мг в 19-20 ч.
3. сукрат гель — 1,0 х 2 раза в день за 30 мин до еды.
4. маалокс — 15 мл х 3 раза в день спустя 2 ч. после еды.
Требования к результатам лечения: купирование клинических и эндоскопических проявлений болезней (полная ремиссия) с двумя отрицательными тестами на Нp (гистологический и уреазный), которые проводятся не раньше 4-й недели после отмены медикаментозного лечения.
При частичной ремиссии, для которой является характерным наличие незарубцевавшейся язвы, необходимо проанализировать дисциплинированность пациента по режиму лечения и продолжить медикаментозную терапию с внесением в нее соответствующих корректив.
Для профилактики обострений язвенной болезни желудка и особенно язвенной болезни двенадцатиперстной кишки, а следовательно, и их осложнений, рекомендуется два вида терапии: непрерывная и «по требованию».
Непрерывная (месяцами и даже годами) поддерживающая терапия антисекреторным препаратом в половинной дозе, например, принимать ежедневно в 20 ч по 150 мг ранитидина (зантак и др. син.) или по 20 мг фамотидина (гастросидин, квамател, ульфамид) показана при:
— неэффективности проведенной эрадикационной терапии;
— осложненном течении язвенной болезни (в анамнезе язвенное кровотечение или перфорация);
— сопутствующих заболеваниях, требующих применения нестероидных противовоспалительных препаратов;
— эрозивно-язвенном рефлюкс-эзофагите, сопутствующем ЯБ;
— возрасте больных старше 60 лет с ежегодно рецидивирующим течением язвенной болезни, несмотря на адекватную курсовую терапию.
При наступлении ремиссии язвенной болезни, отсутствии активного гастродуоденита и инфицированности слизистой оболочки желудка Нp терапия прекращается, а при появлении симптомов обострения болезни она проводится «по требованию», т. е. с первых дней обострения:
— более строгое соблюдение диетического режима;
— прекращение курения (для курящих), приема «ульцерогенных» лекарств;
Если после 14-дневного курса противоязвенной терапии симптомы обострения полностью исчезают, то терапию следует прекратить, но если симптомы не исчезают или рецидивируют, то необходимо повторно провести эзофагогастродуоденоскопию и другие исследования.
Профилактика пилорического геликобактериоза принципиально не отличается от профилактических мероприятий, проводимых при других инфекциях: своевременная диагностика, санитарно-гигиенический режим, санация слизистой оболочки желудка и двенадцатиперстной кишки, противоэпидемические мероприятия в очаге инфекции. Разработка комплекса конкретных рекомендаций именно для этой инфекции — дело ближайшего будущего. Ясно, однако, что в первую очередь следует обратить внимание на те этапы, где наиболее высок риск инфицирования, гастроэнтерологические кабинеты поликлиник и отделения больниц.
В число первоочередных задач входит проведение скрининговых эпидемиологических исследований с целью установления уровня инфицированности Нр разных возрастных и социальных групп населения, частоты перехода инфицированности в манифестные формы и роли геликобактериоза в гастродуоденальной патологии.
Важнейшее значение в профилактике геликобактериоза имеет адекватное лечение больных гастритами, дуоденитами и язвенной болезнью, ассоциированных с Нр.
ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова»
ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова»
ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова»;
ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России
Классификация эпителиальных опухолей желудка ВОЗ 2019 г., 5-е издание
Журнал: Архив патологии. 2020;82(4): 58‑69
ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова»
Классификация эпителиальных новообразований желудка 2019 г. частично изменена по сравнению с изданием 2010 г.: выделены новые гистологические подтипы дисплазий (зубчатая дисплазия, дисплазия желудочных ямок/крипт), изменилась структура классификации доброкачественных новообразований (термин аденоматозный полип вновь вводится в обращение и представляет собой группу доброкачественных опухолей, ранее относимых к аденомам желудочного типа), раздел злокачественных эпителиальных опухолей расширен за счет карциномы из париетальных клеток, микропапиллярной и мукоэпидермоидной карцином, рака из клеток Панета. Факторы риска рака желудка разделены на две группы в зависимости от уровня доказательности их участия в канцерогенезе. Наиболее значимыми признаны: выявленная инфекция Helicobacter pylori, работа, связанная с производством резины, курение табака, рентгеновское и гамма-излучение. Изменены подходы к градации раков желудка по степени дифференцировки: подчеркивается предпочтительное использование двухступенчатой градации (low grade/ high grade). Нововведения также коснулись стадирования рака желудка. Раздел, посвященный нейроэндокринным опухолям, существенных изменений не претерпел. В целом новая классификация содержит более подробные данные по каждому из разделов, однако она не является интуитивно понятной. Пункты классификационной таблицы не соответствуют названиям разделов в тексте, что затрудняет понимание структуры и навигацию.
ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова»
ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова»
ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова»;
ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России
Дата принятия в печать:
В июле 2018 г. в Лионе состоялось заседание рабочей группы по опухолям пищеварительной системы под эгидой Международного агентства по изучению рака (International Agency for Research on Cancer, IARC). В результате классификация опухолей была пересмотрена и издана в 2019 г. в составе серии «WHO Classification of Tumors», 5-е издание [1]. Следует отметить, что разделы, посвященные отдельным локализациям, включают в себя только эпителиальные опухоли. Мезенхимальные опухоли и лимфомы представлены в виде отдельных глав. Другой особенностью новой классификации является наличие кодов классификации МКБ-11, которая официально вводится в России с 01.01.21, и отдельной главы, посвященной генетическим опухолевым синдромам желудочно-кишечного тракта. Разделы классификации 2019 г. (табл. 1) выглядят более структурированными, в каждый раздел добавлена чрезвычайно важная информация о необходимых и желательных диагностических критериях каждой конкретной опухоли, что упрощает работу с изданием для практического врача.
Таблица 1. Классификация эпителиальных опухолей желудка
Доброкачественные эпителиальные опухоли и предраковые поражения
Железистая интраэпителиальная неоплазия, low grade
Железистая интраэпителиальная неоплазия, high grade
Дисплазия зубчатая, low grade
Дисплазия зубчатая, high grade
Дисплазия кишечного типа
Дисплазия фовеолярного (желудочного) типа
Дисплазия желудочных ямок/крипт**
Аденома кишечного типа, low grade
Аденома кишечного типа, high grade
Аденома желудка кишечного типа, спорадическая
Аденома желудка кишечного типа, синдромная
Аденоматозный полип, low grade
Аденоматозный полип, high grade
Злокачественные эпителиальные опухоли
Карцинома из париетальных клеток
Папиллярная аденокарцинома NOS***
Микропапиллярная карцинома NOS***
Медуллярная карцинома с лимфоидной стромой
Карцинома клеток Панета
Плоскоклеточная карцинома NOS***
Крупноклеточная карцинома с рабдоидным фенотипом
Карцинома с остеокластоподобными гигантскими клетками
Нейроэндокринная опухоль NOS***
Нейроэндокринная опухоль, G1
Нейроэндокринная опухоль, G2
Нейроэндокринная опухоль, G3
Карциноид из энтерохромаффинных клеток
Злокачественный карциноид из ECL-клеток
Нейроэндокринная карцинома NOS***
Крупноклеточная нейроэндокринная карцинома
Мелкоклеточная нейроэндокринная карцинома
Смешанная нейроэндокринная и ненейроэндокринная опухоль (MiNEN)
Примечание. * — новые коды для МКБ-O; ** — см. пояснения в тексте статьи; *** — NOS — not otherwise specified (без дополнительных уточнений).
В 5-м издании классификации значительно увеличены разделы, касающиеся фоновых и предопухолевых поражений, а также доброкачественных эпителиальных опухолей желудка.
К фоновым состояниям относят:
— атрофию и кишечную метаплазию,
— полипы фундальных желез,
— гиперпластические полипы желудка.
Большое внимание уделяется гастриту, вызванному Helicobacter pylori, стадированию атрофических изменений по системе OLGA [2—4], а также различным видам кишечной метаплазии.
Предопухолевые изменения слизистой оболочки желудка (дисплазия /железистая интраэпителиальная неоплазия) определены как неопластические изменения эпителия слизистой оболочки без признаков стромальной инвазии. Наиболее часто дисплазия встречается в антруме, однако может наблюдаться в любых отделах желудка [5]. В 5-м издании, как и в 4-м, выделяется два основных вида дисплазии: кишечного и фовеолярного (желудочного) типа. При этом в 5-м издании выделяют также подтипы дисплазий желудка: зубчатую дисплазию высокой степени, зубчатую дисплазию низкой степени, дисплазию желудочных ямок/крипт. Однако, несмотря на то что эти подтипы вынесены в классификационную таблицу, в тексте обозначено, что их клиническое значение определено нечетко и приводятся крайне короткие описания. Таким образом, решение составителей классификации о внесении редких подтипов дисплазии с неясной клинической значимостью в основную классификационную таблицу остается труднообъяснимым.
Дисплазия/железистая интраэпителиальная неоплазия желудка может представлять собой плоский, втянутый или полиповидный участок поражения слизистой оболочки. Градация дисплазии желудка предусматривает выделение дисплазии низкой степени (low grade) и дисплазии высокой степени (high grade) [6, 7].
Дисплазия кишечного типа описывается как очаг, состоящий из тубулярных, тубулярно-ворсинчатых или ворсинчатых структур, выстланных высоким цилиндрическим эпителием с увеличенными, удлиненными, гиперхромными ядрами, расположенными в эпителиальном пласте в несколько рядов. Часто встречается терминальная дифференцировка в виде наличия бокаловидных или нейроэндокринных клеток, иногда клеток Панета. Выявляется экспрессия MUC2, CD10, CDX2 [8].
Дисплазия фовеолярного типа описывается как очаг из тубулярно-ворсинчатых и/или зубчатых железистых структур, выстланных кубическим или низким цилиндрическим эпителием, напоминающим фовеолярный эпителий. Ядра круглые или овальные, с четко различимыми ядрышками. Цитоплазма клеток бледно-эозинофильная. Выявляется положительное иммуногистохимическое окрашивание с маркерами MUC5AC, MUC6.
Дисплазия желудочных ямок/крипт. В оригинальном тексте классификации употреблен термин «ямки/крипты», в связи с чем обращаем внимание, что использование термина «крипты» для слизистой оболочки желудка не соответствует международной гистологической номенклатуре. Такой тип дисплазии наблюдается в базальных отделах желудочных ямок, где железистые структуры демонстрируют созревание до поверхностных эпителиальных клеток. В 49—72% случаев встречается по периферии традиционной неоплазии и считается независимым предиктором прогрессии в инвазивный рак [9], однако в тексте классификации не указано, чем она отличается от дисплазии фовеолярного типа.
Зубчатая дисплазия локализуется только в желудочных ямках, характеризуется наличием микропапиллярных структур, экспрессирующих MUC5AC. Подобные гистологические изменения в литературе иногда называют зубчатой аденомой желудка [10].
Классификация доброкачественных эпителиальных опухолей значительно изменена. Если ранее понятия «аденома кишечного типа» и «аденоматозный полип» являлись синонимами, то в новой редакции аденомы кишечного типа стоят особняком, а к аденоматозным полипам относят образования, ранее находившиеся в группе аденом желудочного типа (аденомы фовеолярного типа, аденомы из пилорических желез). К группе аденоматозных полипов в новой классификации также относят аденомы из кислотообразующих желез (oxyntic gland adenoma), не упоминавшиеся в предыдущей классификации. Полипы фундальных желез (fundic gland polyps) более не рассматриваются как истинные опухоли и не имеют кода МКБ-О. Итак, к доброкачественным эпителиальным опухолям относят аденомы кишечного типа и аденоматозные полипы (аденомы фовеолярного типа, аденомы из пилорических желез, аденомы из кислотообразующих желез (oxyntic gland adenoma). Причем каждая из этих категорий может сопровождаться дисплазией высокой или низкой степени. Аденомам кишечного типа соответствуют коды МКБ-О 8144/0 и 8144/2 в зависимости от степени дисплазии, а для всех разновидностей аденоматозных полипов предусмотрены единые коды 8210/0 и 8210/2.
Аденома кишечного типа является третьим по частоте встречаемости образованием среди полиповидных новообразований желудка (после гиперпластических полипов и полипов фундальных желез), локализуется преимущественно в тех отделах желудка, где распространена кишечная метаплазия (в 60% случаев поражаются дистальные отделы желудка) [11]. Пациенты обычно старше 60 лет. Аденомы кишечного типа часто сочетаются с атрофическим гастритом и выраженной кишечной метаплазией. Выделяют два подтипа аденом кишечного типа: спорадические и синдромные. Синдромные аденомы иногда являются одним из проявлений семейного аденоматозного полипоза. Размеры аденом не превышают 2 см. Гистологически аденомы кишечного типа представляют собой совокупность тубулярных структур, выстланных пролиферирующим эпителием с признаками дисплазии, которые формируют полиповидное образование. Аналогичная картина на плоской слизистой оболочке без формирования полиповидного образования обозначается как дисплазия (интраэпителиальная неоплазия). Большинство клеток имеют цилиндрическую форму, вытянутое вдоль длинной оси ядро, присутствуют бокаловидные клетки и клетки Панета. При наличии дисплазии высокой степени аденомы кишечного типа стадируются как Tis.
Аденома фовеолярного типа — доброкачественная опухоль из фовеолярного эпителия. Локализуются обычно в теле или дне желудка, развиваются без предшествующих фоновых процессов в виде гастрита или атрофии/метаплазии [12]. Спорадические опухоли крайне редки [13], обычно аденомы фовеолярного типа возникают при семейном аденоматозном полипозе и других наследственных синдромах. Гистологически опухоли состоят из сосочковых и тубулярных структур, покрытых цилиндрическим эпителием фовеолярного типа с удлиненными ядрами и признаками дисплазии (чаще всего низкой степени). Поверхностный эпителий содержит нейтральные (ШИК-позитивные) муцины, что отличает аденому фовеолярного типа от аденомы из пилорических желез. Отмечается выраженная диффузная экспрессия MUC5AC и локальная слабая экспрессия MUC6; реакции с MUC2 и CDX2 отрицательные. Однако ориентироваться при постановке диагноза необходимо в первую очередь на окраску гематоксилином и эозином и ШИК-реакцию, нежели чем на иммуногистохимию.
Аденома из пилорических желез — доброкачественная опухоль из эпителия пилорических желез, возникающая обычно в теле и дне желудка [14]. Большинство таких аденом выявляется у пациентов 60—70 лет и сочетается с атрофией/метаплазией слизистой оболочки дна и тела желудка, вызванной аутоиммунным или H. pylori-ассоциированным гастритом [14]. Размер от 0,3 до 10 см (средний — 2 см). Аденомы из пилорических желез представлены плотно лежащими железами пилорического типа, выстланными кубическим или низким цилиндрическим эпителием. Клетки со светлой или слегка эозинофильной цитоплазмой, ядра расположены базально, округлые или овоидные, со слабо различимыми ядрышками. Поверхностный эпителий не содержит нейтральные (ШИК-позитивные) муцины. В крупных опухолях железы могут быть кистозно-расширены. В 40—50% случаев в аденомах из пилорических желез встречаются дисплазия высокой степени и фокусы аденокарциномы, однако только в 10% случаев наблюдается инвазия в подслизистый слой [15]. Риск прогрессии в аденокарциному увеличивается с размером аденомы, при наличии тубуловорсинчатых структур. В связи с высоким риском прогрессии в рак желудка рекомендовано тотальное удаление образования.
Аденома из кислотообразующих желез (oxyntic gland adenoma) — доброкачественная опухоль из главных (зимогенных) и/или обкладочных (париетальных) клеток с высоким риском прогрессии в инвазивный рак. Локализуется в верхней трети желудка, точная частота встречаемости не установлена. Опухоль состоит из тубулярных структур, выстланных цилиндрическими клетками со светлой эозинофильной цитоплазмой, слабой ядерной атипией, похожих на клетки фундальных желез (преимущественно главные). Может находиться на поверхности, однако чаще встречается внутрислизистое расположение. Дифференцировку клеток можно подтвердить иммуногистохимически с помощью окраски на пепсиноген I (главные клетки) и Н+/К+ АТФазу (обкладочные клетки) [16]. Иногда в опухоли формируются солидные структуры и анастомозирующие тяжи, что может симулировать картину нейроэндокринной опухоли (NET) [17]. В таких случаях полезно определение экспрессии хромогранина А, в аденомах из кислотообразующих желез желудка данный маркер не выявляется.
Рак желудка занимает в мире 3-е место по уровню смертности [27], несмотря на снижение заболеваемости, ежегодно в мире выявляется около 1 млн новых случаев рака желудка [18, 19]. Наиболее высокий уровень заболеваемости отмечается в центральной и восточной Азии, восточной Европе и Южной Америке [18].
Рак желудка развивается под воздействием комбинации различных неблагоприятных факторов, в 90% случаев является спорадическим и только у 10% пациентов связан с наследственными/врожденными причинами. Факторы риска для развития рака желудка перечислены в табл. 2. В новом издании эти факторы разделены на две группы в зависимости от различного уровня доказательности. Следует отметить, что авторы придают большое значение инфекционным (H. pylori, вирус Эпштейна—Барр) и химическим агентам [20], а также особенностям диеты [19, 21—24], в то время как рефлюкс желчи больше не выносится как значимый фактор риска.
Таблица 2. Факторы риска возникновения рака желудка
Факторы, для которых имеются достаточные доказательства участия в канцерогенезе рака желудка у человека:
Читайте также:

