Актовегин при гематоме головы
Обновлено: 18.04.2024
В статье представлен современный взгляд на проблему диагностики и лечения детей в остром периоде ушиба мозга тяжелой степени тяжести. Подчеркивается актуальность своевременного обследования детей с черепно-мозговой травмой с помощью методов нейровизуализации (нейросонография, компьютерная томография головного мозга, дуплексное ультразвуковое сканирование, МРТ-ангиография). Показаны возможности патогенетической терапии, направленной на компенсацию нарушений ликвородинамики, микроциркуляции, восстановление антиоксидантного статуса, с использованием препарата Актовегин.
Черепно-мозговая травма (ЧМТ) (S.06 по МКБ-10) -это повреждение мягких тканей головы, черепа и/или головного мозга, этиологическим фактором которого является травма. ЧМТ относится к одному из наиболее частых и тяжелых видов травматизма и достигает, по некоторым данным, 350 случаев на 100 тысяч детского населения в год. Наиболее тяжелые ЧМТ (ушиб-размозжение головного мозга, внутричерепные гематомы, вдавленные переломы) требуют своевременной диагностики и срочного оперативного лечения. Основными причинами тяжелых ЧМТ являются дорожнотранспортные происшествия (среди подростков распространена мотоциклетная травма), спортивный травматизм, жестокое обращение с детьми. ЧМТ у детей раннего возраста в силу незавершенного онтогенеза мозга имеет свои особенности: несоответствие тяжести структурных нарушений головного мозга степени угнетения сознания, высокая вероятность переломов костей свода черепа (80%) [1, 2] с разрывом сосудов оболочек головного мозга, формированием внутричерепных гематом 6, цереброваскулярных осложнений (травматических артериальных и венозных инфарктов, кровоизлияний).
Классификация ЧМТ
Все ЧМТ разделяют на закрытые, открытые и проникающие травмы [7]. Открытые ЧМТ характеризуются нарушением целостности мягких тканей головы, апоневроза, костей черепа и головного мозга. Они могут быть непроникающими (с повреждением костей черепа, но сохранением твердой мозговой оболочки) и проникающими (с повреждением костей и твердой оболочки мозга). К закрытой ЧМТ относят переломы костей свода черепа без повреждения мягких тканей и апоневроза. Различают первичные повреждения, наблюдающиеся непосредственно в области травмы, и вторичные, являющиеся осложнением ЧМТ (гематомы, отек мозга, инсульт).
По степени тяжести ЧМТ подразделяют на травмы легкой степени (сотрясение головного мозга и ушиб мозга легкой степени), средней степени (ушиб мозга средней степени) и тяжелой степени (ушиб мозга тяжелой степени, внутричерепные гематомы, диффузное аксональное повреждение мозга). С учетом особенностей клинической картины ЧМТ у детей [2, 3], к ЧМТ легкой степени относят только сотрясение головного мозга, а к ЧМТ средней степени тяжести - ушиб мозга легкой и средней степени тяжести, а также эпидурально-поднадкостничную гематому без сдавления мозга и поднадкостничную гигрому.
Оценивая тяжесть больного в остром периоде ЧМТ, следует учитывать состояние сознания, жизненно важных функций и выраженность очаговых неврологических симптомов [7]. Для оценки глубины и длительности потери сознания и сопутствующих симптомов в баллах используется модифицированная шкала комы Глазго [9] (табл. 1).
Таблица 1
Модифицированная шкала комы Глазго (для детей). Адаптировано по [9]
Нормальная шкала по возрасту:
Классификация нарушений сознания при ЧМТ основывается на качественной оценке степени угнетения сознания [7]. Существуют следующие градации состояния сознания: ясное, умеренное оглушение, глубокое оглушение, умеренная кома, глубокая кома, запредельная кома. Наряду с этим выделяют 5 градаций состояния больных с ЧМТ: удовлетворительное, средней тяжести, тяжелое, крайне тяжелое, терминальное. Для удовлетворительного состояния типично наличие ясного сознания, отсутствие неврологической симптоматики. Для средней степени тяжести характерно наличие ясного сознания или умеренного оглушения, очаговых симптомов (полушарных, краниобазальных) и отсутствие нарушения витальных функций. Критериями тяжелого состояния являются глубокое оглушение, или сопор, нарушение витальных функций, наличие очаговых (стволовых, полушарных или краниобазальных) симптомов. Крайне тяжелое состояние характеризуется умеренной или глубокой комой, резко выраженными нарушениями витальных функций по нескольким параметрам, функций сердечно-сосудистой и дыхательной систем, наличием очаговых симптомов - стволовых (анизокория, дивергенция глазных яблок по вертикали, горизонтали, парез взора) и полушарных (парезы, параличи). Критериями терминального состояния являются запредельная кома, критические нарушения витальных функций, наличие очаговых симптомов (стволовые - мидриаз, отсутствие корнеальных и зрачковых рефлексов, атония, арефлексия), при этом полушарные симптомы обычно оттеняются общемозговыми и стволовыми. Функции сердечнососудистой и дыхательной системы декомпенсированы.
Клинические формы ЧМТ
Клиническими формами ЧМТ являются сотрясение головного мозга, ушиб мозга легкой, средней и тяжелой степени, сдавление мозга (внутричерепные гематомы - эпидуральная, субдуральная, внутримозговая), диффузное аксональное повреждение мозга.
Ушиб головного мозга тяжелой степени (S06.2-S06.3, S02.0-S02.1) [7, 9] наблюдается в 10-15% всех случаев ЧМТ. Нарушение сознания отмечается от нескольких часов до нескольких недель. Клиническую картину составляют стойкие стволовые, полушарные симптомы, угнетение сознания до степени комы. Среди стволовых расстройств можно выделить мидриаз, угнетение зрачковых и корнеальных рефлексов, плавающие движения глазных яблок, симптом Гертвига - Мажанди, расходящееся или сходящееся косоглазие по горизонтали, нистагм, проявление бульбарного или псевдобульбарного синдрома, лабильность мышечного тонуса, иногда горметония, децеребрационная ригидность. Кроме того, отмечаются полушарные симптомы (парезы или параличи, парциальные судорожные приступы), расстройства витальных функций (артериальная гипотензия или гипертензия, брадикардия или тахикардия, нередко нарушения сердечного ритма и ритма дыхания). Выявляется примесь крови в цереброспинальной жидкости при сочетании ушиба мозга и субарахноидального кровоизлияния. Характерны остаточные явления после выхода из комы - нарушение высших психических функций, ретроградная и антеградная амнезия, двигательные расстройства, эпилептические приступы [10].
К тяжелой ЧМТ относится диффузное аксональное повреждение головного мозга, при котором наблюдается структурное разобщение полушарий большого мозга и подкорково-стволовых структур. Клинически проявляется длительным коматозным состоянием, нарушением функции ствола мозга, тяжелым расстройством витальных функций. Исход часто в хроническое вегетативное состояние, которое может длиться до нескольких месяцев или лет.
Сдавление головного мозга протекает с компрессией и дислокацией мозга, которое вызвано внутричерепными гематомами (эпидуральными, субдуральными, внутримозговыми), вдавленными переломами костей черепа, ушибами мозга, субдуральными гигромами. Для внутричерепных гематом характерно прогредиентное течение, альтернирующий синдром (мидриаз на стороне гематомы и гемипарез на противоположной), нарастание общемозговых, очаговых и стволовых симптомов [7, 9]. Эпидуральная гематома располагается между внутренней поверхностью костей черепа и твердой мозговой оболочкой. Возникает вследствие повреждения средней менингеальной артерии и ее ветвей. Для диагностики обязательна краниография черепа, нейровизуализация. Субдуральная гематома располагается под твердой мозговой оболочкой головного мозга как на конвекситальной поверхности над двумя или тремя долями, так и над полушарием большого мозга. При внутримозговой гематоме кровь проникает в паренхиму мозга из-за разрыва артериол и венул в результате распространения энергии удара.
Методы обследования
Офтальмоскопия позволяет определить кровоизлияние в глазное дно у детей грудного возраста при сочетанном субарахноидальном кровоизлиянии. Отек диска зрительного нерва определяется на стороне гематомы. При ушибе головного мозга тяжелой степени у всех больных необходимо проводить рентгенографию черепа в двух проекциях с целью диагностики переломов костей свода черепа. Нейросонография у детей раннего возраста при наличии большого родничка дает возможность выявить гиперэхогенные очаги с четкими контурами гематом [14].
Компьютерная томография (КТ) головного мозга позволяет диагностировать повреждения костей и паренхимы мозга, обнаружить контузионные очаги пониженной плотности, локализующиеся в корково-подкорковых областях, внутричерепные кровоизлияния [5, 8]. При ушибах мозга тяжелой степени на КТ в 1/3 случаев могут выявляться зоны неоднородного повышения плотности, которые постепенно регрессируют через 2-3 недели. На КТ эпидуральная гематома имеет признаки двояковыпуклой зоны повышенной плотности, примыкающей к своду черепа, локализация ограничена в пределах 1-2 долей. Субдуральная гематома диагностируется по серповидному образованию повышенной плотности в случае острой ситуации и пониженной плотности - при хронической гематоме, локализуется над двумя-тремя долями мозга или над всем полушарием большого мозга, часто сочетается с дислокацией мозговых структур, деформацией желудочков мозга и опоясывающей цистерны. Внутримозговые гематомы образуются в результате разрыва артериол или венул, на КТ определяются в виде округлых зон повышенной плотности с очерченными краями. При отеке и набухании мозга обнаруживается сужение боковых и III желудочков, субарахноидального пространства.
Магнитно-резонансная томография (МРТ) в режиме трактографии является стандартом диагностики аксонального повреждения. Для исключения травматической артериальной диссекции необходимо проведение МРТ в режиме ангиографии. Ультразвуковое допплерографическое исследование позволяет выявить спазм сосудов головного мозга, признаком которого является увеличение линейной скорости кровотока средней мозговой артерии до 300 см в секунду. При судорогах рекомендуется провести электроэнцефалографию, позволяющую уточнить топографию эпилептической активности. Срок выполнения повторной компьютерной томографии зависит от нарушений, выявленных при первичном обследовании больного. При изолированных ушибах тяжелой степени повторное исследование проводится через 30-40 дней.
Лечение
Терапия ушиба головного мозга тяжелой степени представлена в таблице 2 [4, 7, 9, 11-13].
Таблица 2
Лечение детей с ушибом головного мозга тяжелой степени тяжести в остром периоде ЧМТ
Диазепам (0,25-0,4 мг/кг внутривенно)
Депакин (15-20 мг/кг внутривенно)
Фенитоин (20 мг/кг внутривенно)
До устранения судорог
Гемостатическая терапия:
Этамзилат (12,5% раствор - 2-4 мл внутривенно)
Викасол (1% раствор - 1 мл внутримышечно)
Аскорбиновая кислота (5% раствор внутривенно)
Наиболее часто при ЧМТ среди прочих лекарственных средств используется Актовегин - препарат, обладающий комплексным нейропротективным действием (антигипоксантным и антиоксидантным). Механизм действия Актовегина -многокомпонентный. Актовегин повышает инсулинзависимый, а также не зависящий от инсулина транспорт глюкозы внутрь клетки. Препарат способствует поглощению и утилизации кислорода, улучшая кислородный метаболизм и повышая энергетический обмен клеток. Улучшение кислородного метаболизма проявляется повышением концентрации непосредственных доноров свободной энергии, таких как АТФ, АДФ, креатинфосфат и аминокислоты -глютаминовая, аспарагиновая и гамма-аминомасляная (ГАМК). В результате улучшается функциональное состояние клеток нервной ткани и значительно повышаются их шансы на выживание в условиях недостаточного кровоснабжения. Применение Актовегина в дозах до 8 мг/кг является безопасным у детей и стабилизирует состояние больных с ушибом мозга тяжелой степени.
Лечение гематом обычно хирургическое. Консервативное лечение возможно при небольших хронических субдуральных гематомах без смещения мозговых структур. При диагностике травматического ишемического инсульта возможно использование рекомендаций Британского общества педиатров (2006).
Прогноз
Прогноз при ЧМТ зависит от локализации и размеров контузионного очага, внутричерепной гипертензии, отека мозга, симптомов дислокации, гидроцефалии, судорог, вторичной ишемии мозга. Оценивается состояние больных спустя 3, 6, 12 месяцев после травмы. Используется шкала исходов Глазго, при которой спустя год после ЧМТ выделяют группы: полное выздоровление, умеренная инвалидизация, тяжелая инвалидизация, вегетативное состояние, смерть. После ушиба головного мозга тяжелой степени у детей нередко развиваются паркинсонизм, посттравматическая энцефалопатия, поздняя посттравматическая эпилепсия, гидроцефалия, поражение отдельных черепных нервов [15]. Больные после тяжелой ЧМТ подлежат диспансерному наблюдению на протяжении 2 лет, а при наличии остаточных явлений - 3 года.
Актовегин - универсальный противоишемический препарат с комплексным антиоксидантным, антигипоксическим и нейрометаболическим действием
Актовегин (активное вещество: компоненты крови - депротеинизированный гемодериват крови телят) показан к применению в качестве поддерживающей терапии нарушений церебрального метаболизма и кровообращения (в том числе ишемический инсульт, черепно-мозговая травма). Препарат положительно влияет на транспорт и утилизацию глюкозы, стимулирует потребление кислорода. Это приводит к стабилизации плазматических мембран клеток при ишемии и снижению образования лактатов (антигипоксический эффект препарата). Помимо антиишемического эффекта Актовегин оказывает комплексное метаболическое действие, связанное с входящими в его состав микроэлеметами (в виде хелатных комплексов), аминокислотами, нуклеозидами и т.д. Актовегин улучшает работу внутриклеточных ферментных систем, усиливает синтетические процессы. В результате улучшается регенерация тканей, ускоряются процессы дифференцировки клеток и репарации повреждений, нормализуются функции тканей и органов.
Эффективность препарата в лечении целого ряда заболеваний (ишемический инсульт, черепно-мозговая травма, хронические энцефалопатии различного генеза, неврологические осложнения сахарного диабета, периферические артериальные и венозные нарушения кровообращения и их последствия) подтверждена многочисленными клиническими исследованиями.
Для цитирования: Михалович Н., Хак Дж. Антигипоксанты в неотложной терапии черепно-мозговых травм. РМЖ. 2004;10:621.
Не считая самой черепно–мозговой травмы (ЧМТ), требующей хирургического лечения, отек мозга является основной причиной гипоксии головного мозга и летальности больных. Реанимационные мероприятия при отеке мозга за последние десять лет свелись к единому подходу. Вся консервативная терапия направлена на прямое или косвенное обеспечение адекватного поступления кислорода к ишемизированным тканям мозга. Наше внимание привлек препарат Актовегин – безбелковый гемодиализат крови телят, в состав которого входят низкомолекулярные дериваты пептидов и аминокислот и который широко используется в терапии цереброваскулярных расстройств. Как было показано ранее, этот препарат увеличивает поступление кислорода и глюкозы в клетки, что наряду с нейропротективным эффектом в условиях гипоксии позволяет считать Актовегин препаратом с большим потенциалом в терапии черепно–мозговых травм.
Общий прогноз при черепно–мозговой травме за последние десять лет значительно улучшился. Большой вклад в этот процесс внесло расширение возможностей неотложной терапии пациентов с ЧМТ. Важность использования адекватных неотложных мер непосредственно после травмы не вызывает сомнений. К этим мерам относятся диагностика и коррекция угрожающих жизни респираторных нарушений и шоковых состояний, диагностика и исключение тяжелых сопутствующих повреждений, мероприятия по профилактике и лечению травматического отека мозга.
При использовании современных диагностических методов (КТ, ангиография) на относительно ранних сроках, стало возможным быстро и безопасно определить показания к оперативному лечению. Хирургический метод лечения черепно–мозговых травм уже давно усовершенствован и какие–либо принципиальные инновационные изменения в нем в ближайшее время не ожидаются.
Не говоря уже о черепно–мозговых травмах, требующих оперативного вмешательства, отек мозга является самой частой формой реакции мозга на различные повреждения и самым тяжелым осложнением ЧМТ. Как только истощаются внутричерепные защитные механизмы (ликворное пространство, перфузионное давление), дальнейшее увеличение объема приводит к повышению внутримозгового давления. Уровень внутримозгового давления выше 40 мм рт. ст. критичен для мозгового кровотока. При отеке мозга увеличение объема внутриклеточной жидкости приводит к увеличению в объеме ткани и смещению структур мозга. Существуют два основных типа отека головного мозга – вазогенный и цитотоксический. Вазогенная форма обусловлена повреждением структур гемато–энцефалического барьера, цитотоксическая форма развивается вследствие церебральной ишемии и токсического воздействия продуктов внутриклеточного метаболизма.
Головной мозг при ЧМТ особенно чувствителен к воздействию гипоксии. Из–за недостаточности регуляции мозгового кровотока отсутствует компенсация снижения артериального давления. Таким образом, церебральная ишемия легко переходит в необратимые гипоксические изменения и способствует развитию отека мозга. В этой связи самым важным фактором является адекватное кислородное обеспечение головного мозга при ЧМТ. Без постоянного контроля состояния гипоксии головного мозга лечение черепно–мозговой травмы не даст положительных результатов.
Профилактика и лечение
гипоксии головного мозга
Все консервативные терапевтические и профилактические процедуры направлены, прямо или опосредованно, к своей конечной цели. Интенсивная терапия отека мозга за последние десять лет достигла единого подхода, который лишь незначительно различается в различных лечебных учреждениях. Борьба с отеком головного мозга включает в себя подачу кислорода путем контролируемой искусственной вентиляции с контролируемой гипокапнией и с парциальным давлением СО2 между 30 и 35 мм рт.ст., приподнятое положение верхней половины тела, стабилизацию кровообращения, устранение боли и седация, при необходимости использование кортикостероидов и барбитуратов. Протективный эффект больших доз барбитуратов изначально приветствовался за счет развития эйфории, но в настоящее время эти препараты в основном используются для общей седации. Осмодиуретики назначаются по особым показаниям, к которым относят внезапное повышение внутричерепного давления с признаками вклинивания среднего мозга или ствола мозга (табл. 1).
Дополнительно к этим общепринятым мероприятиям интенсивной терапии предпринимались попытки в экспериментах на животных и в клинических исследованиях повысить толерантность головного мозга к ишемии путем применения специальных медикаментозных средств. Такие исследования, в частности, были проведены в отношении местных анестетиков и антагонистов кальция. Эти препараты снижают потребность ткани головного мозга в кислороде и в то же время, предположительно, замедляют пагубные биохимические реакции (накопление кальция в цитозоле, появление жирных кислот и свободных радикалов), которые наблюдаются при черепно–мозговых травмах.
Аналогичный эффект – в основном в подострую фазу лечения, при так называемом переходном синдроме – ожидался от ноотропных препаратов (например, пиритинола гидрохлорида, меклофеноксата дихлорида, пирацетама).
Имея в виду тот факт, что все консервативные меры, используемые в интенсивной терапии, направлены на поддержание адекватного обеспечения кислородом, мы обратили внимание на препарат, используемый в терапии церебральной и периферической сосудистой недостаточности. Этим препаратом является Актовегин, обладающий антигипоксической активностью. Его фармакодинамические эффекты обычно обусловлены именно входящими в состав низкомолекулярными пептидами. Было доказано следующие эффекты препарата: повышение захвата кислорода и усиление транспорта глюкозы в клетки (последнее описано как инсулиноподобная активность), повышение утилизации кислорода и глюкозы, стимуляция синтеза АТФ, улучшение кровоснабжения головного мозга и улучшение микроциркуляции, оптимизация вигильности и уменьшение концентраций аммиака и лактата в крови при портальной энцефалопатии и алкогольном делирии.
Этот препарат с успехом применяется при нарушениях церебрального метаболизма и кровоснабжения, при ожогах и радиологических травмах. Цереброваскулярная недостаточность выделилась в отдельное показание к применению этого препарата. На рисунке 1 схематически представлен механизм действия Актовегина. Данных о применении его в острой и реабилитационной фазе при черепно–мозговых травмах пока не существует. Благодаря своей способности увеличивать потребление кислороды и транспорт глюкозы внутрь клеток, а также благодаря своему протективному эффекту при гипоксии этот препарат очень подходит для консервативной терапии черепно–мозговой травмы. На этом основании мы решили включить в схему лечения пациентов с первого дня пребывания в стационаре после травмы парентеральное введение 250 мл 20% раствора Актовегина. В так называемом ориентировочном (пилотном) исследовании мы проследили эффект терапии у 10 невыборочных пациентов с черепно–мозговой травмой. Поскольку у этих 10 пациентов результаты терапии были очень обнадеживающими и положительными, в последующее время были получены результаты такой терапии еще у 25 пациентов.
Дизайн исследования
10 пациентов с черепно–мозговой травмой (табл. 2) ежедневно получали внутривенно 250 мл 20% раствора Актовегина. Такая терапия проводилась, начиная с 1–го дня после получения травмы.
В течение четырех месяцев все пациенты с черепно–мозговой травмой были включены в пилотное исследование без какого–либо отбора. При первичной терапии рассчитывался общий балл по Глазговской шкале комы (врачом скорой помощи на месте происшествия), и в среднем он составил 6,7 балла (минимум – 5, максимум – 10). Средний возраст 7 пациентов мужского пола и 3 пациенток составил 28 лет (15–46 лет).
Первичное проведение КТ выявило генерализованный отек мозга у 2–х пациентов, очаги ушиба и внутренние кровоизлияния, сопровождающиеся отеком ткани мозга у 5 пациентов. 2 пациента находились в состоянии комы после оперативного удаления эпидуральной гематомы, а 1 пациент имел кровоизлияния в ганглии ствола головного мозга и отек мозга. 5 пациентов имели изолированную черепно–мозговую травму. Еще четверо – имели сопутствующие переломы конечностей, один пациент имел травму грудной клетки с переломами двух ребер и правосторонним пневмотораксом. В дополнение к соответствующей терапии, адаптированной к состоянию пациентов, терапия черепно–мозговой травмы включала в себя контролируемую искусственную вентиляцию легких (в режиме легкой гипервентиляции, с уровнем артериального рСО2 от 27 до 35 мм рт.ст.), приподнятое положение верхней части тела, седативную терапию 200 мг фенобарбитала в/в от 3 до 4 раз в день (по необходимости в/в добавлялись флунитрозепам и пиритрамид), введение больших доз кортикостероидов (триамцинолон 40 мг каждые 6 часов). Такая интенсивная терапия проводилась в среднем в течение 6 дней.
Интересно отметить короткую и тихую фазу прояснения сознания у пациентов с черепно–мозговой травмой без органического субстрата (генерализованный отек мозга по данным КТ). Ни у кого из этих пациентов не развился транзиторный синдром с признаками беспокойства, возбуждения и ажитированного состояния. Пациенты с органическим поражением мозга (например, очагами ушиба, внутренними кровоизлияними) и последующей неврологической недостаточностью также имели спокойную фазу прояснения сознания после окончания интенсивной терапии.
Медленное, но стабильное улучшение сознания и неврологическим симптомов было типичным для подострой фазы у этих пациентов. Ни у кого их них не отмечалось длительного периода стагнации или ухудшения состояния.
После окончания терапии семь пациентов были выписаны без необходимости проведения дальнейшей реабилитационной терапии. Три других пациента были переведены в специализированный неврологический реабилитационный центр для последующего восстановительного лечения.
На сегодняшний день, спустя 3,5 года после этого пилотного исследования, мы знаем, что эти три пациента покинули реабилитационный центр. Двое из них полностью интегрировались в их прежний образ жизни, а один не смог вернуться к прежней работе из–за остаточных неврологических изменений.
После многочисленных малоудачных попыток свести к минимуму проявления транзиторного синдрома после черепно–мозговой травмы при помощи различных нейротропных препаратов, мы были также очень скептически настроены в отношении Актовегина.
Но, с другой стороны, клинически и экспериментально доказанные эффекты этого препарата в неврологии, ангиологии, диабетологии и хирургии были столь очевидными, что мы решили применить Актовегин при лечении черепно–мозговой травмы.
В экспериментах in vitro было показано, что депротеинизированный гемодиализат крови телят увеличивает поглощение кислорода митохондриями клеток, культурами клеток, гистологическими препаратами и отдельными органами. Также было показано, что в изолированных митохондриях увеличивается синтез АТФ. Эти эффекты позволяют сделать вывод о том, что этот препарат оказывает положительное воздействие на аэробный метаболизм и способствует процессам абсорбции и регенерации, которые требуют большого расхода энергии.
В экспериментах на животных было продемонстрировано, что гемодиализат крови телят обладает протективным эффектом в условиях гипоксии. Аналогичный протективный эффект был продемонстрирован Albrecht в его исследовании со здоровыми добровольцами, находившимися в высокогорных условиях гипоксии.
Кроме этого, указанный препарат обладает инсулиноподобной активностью. Bachmann и Heidrich сообщают о быстрой нормализации повышенного уровня глюкозы в крови при проведении внутривенного теста толерантности к глюкозе.
Большое количество положительных результатов было получено при использовании Актовегина при заболеваниях, обусловленных органическими поражениями головного мозга различной этиологии. Также имеется несколько публикаций, описывающих положительные результаты у пациентов с артериальной цереброваскулярной недостаточностью, церебральной интоксикацией и гериатрическими заболеваниями.
Эти исследования свидетельствуют о том, что усиление кровотока под действием гемодеривата в коре головного мозга и ганглиях ствола головного мозга, скорее всего, представляет собой вторичный эффект, то есть результат первичного усиления окислительного метаболизма в ганглиоцитах. Это предположение согласуется с исследованиями Бетманна (Bethmann) и Оттингера (Oettninger), которые подтвердили усиление церебрального кровотока и повышение церебрального потребления кислорода и глюкозы после внутривенного введения актовегина у собак. Эти данные коррелируют с результатами, полученными Хойером (Hoyer). Они использовали препарат для лечения пациентов с синдромом цереброваскулярной недостаточности и также отметили значительно увеличение потребления кислорода и глюкозы.
Протективный эффект в отношении непосредственно поврежденных и находящихся в потенциальной опасности участков головного мозга
Все эти работы свидетельствуют о том, что положительный эффект Актовегина можно в той же степени ожидать и при черепно–мозговых травмах и их последствиях. Положительный эффект в остром периоде черепно–мозговой травмы может быть объяснен антигипоксическим эффектом в отношении непосредственно поврежденной ткани головного мозга и в интактной ткани, которая может быть повреждена опосредованно. Использование глюкозы в терапии черепно–мозговой травмы является давним и общепринятым мероприятием. Проблемы возникали при введении высококалорийных растворов с высокой осмоляльностью (риск развития феномена «рикошета» при использовании растворов с осмотической активностью) и при частых превышениях нормального уровня глюкозы в крови за счет использования глюкокортикоидов. Использование гемодиализата в остром периоде черепно–мозговой травмы может избежать возникновения этих нежелательных эффектов использования больших количеств глюкозы. Поскольку этот препарат обладает инсулиноподобной активностью и способен увеличивать потребление глюкозы тканью головного мозга, нормокалорийные растворы глюкозы могут теоретически оказывать такое же терапевтическое воздействие, как и высококалорийные растворы.
Отсутствие резких колебаний
уровня глюкозы в крови
Факт того, что ни одного из наших пациентов с черепно–мозговой травмой не наблюдались резкие колебания уровня глюкозы в крови, еще раз косвенно свидетельствует о сказанном выше. Хотя здесь следует сразу оговориться: наше исследование не было двойным слепым и проводилось на небольшом числе пациентов. Все наши 25 пациентов получали одинаковую терапию. Они получали либо парентерально, либо энтерально 3000 ккал в день, а в первые 7 дней после травмы еще и большие дозы глюкокортикоидов. Мы ожидали, что у некоторых пациентов могут возникнуть проблемы с уровнем глюкозы в крови, учитывая и то, что пациенты были разных возрастных групп. Тем не менее таких проблем отмечено не было.
Кроме этого, улучшение микроциркуляции в ткани головного мозга под действием депротеинизированного гемодиализата крови телят гарантирует дальнейшее улучшение обеспечения кислородом травмированного мозга без увеличения объема циркулирующей крови. Это, несомненно, имеет большое значение в остром периоде после травмы.
В литературе неоднократно описывалось усиление репаративных процессов в стадии реабилитации и использование при них Актовегина. Таким образом, легко было провести экстраполяцию на черепно–мозговую травму, в особенности в случае ушибов головного мозга и внутренних кровоизлияний.
Короткая и спокойная фаза
восстановления сознания
У наших пациентов при проведении КТ было подтверждено наличие генерализованного отека мозга без органического субстрата. После прекращения интенсивной седативной терапии у них наблюдалась очень короткая и спокойная фаза восстановления сознания. Ни у кого из этих пациентов не наблюдался транзиторный синдром с выраженным беспокойством, возбуждением или агрессивностью. Напротив, пациенты были спокойны, как после продолжительного глубокого сна. И через 24 часа они продемонстрировали хорошую ориентацию во времени и пространстве с сохранением ретроградной и антеградной амнезии («синдром спящей красавицы»).
У пациентов с органическими поражениями головного мозга (например, кровоизлияния и участки ушиба) и последующим неврологическим дефицитом фаза восстановления сознания после прекращения интенсивной терапии также была отмечена спокойным пробуждением без побочного транзиторного синдрома. Медленное, но стабильное восстановление сознания и неврологических симптомов было характерно для подострой фазы у всех пациентов с церебральными повреждениями и неврологическим дефицитом. Ни у одного пациента не наблюдалось заметно пролонгированной стагнации или рецидива.
Поскольку эти результаты были получены в пилотном ориентировочном исследовании, невозможно сделать вывод о том, что без раннего использования Актовегина наблюдалось бы худшее течение заболевания.
Не вызывает вопросов тот факт, что наши результаты отражают наше собственное впечатление о положительном эффекте терапии с использованием Актовегина у пациентов с черепно–мозговой травмой, и то, что этим данным не достает объективизма. Наши первые наблюдения способствовали продолжению использования этого препарата, и вплоть до настоящего времени эта терапия давала хорошие результаты у пациентов с черепно–мозговой травмой. Мы убеждены, что положительные результаты, полученные при многих неврологических заболеваниях и подтвержденные во многих экспериментальных и клинических исследованиях, также оправдывают применение Актовегина при церебральных травмах.
Целью данной работы является привлечение внимания врачей к возможности расширения возможностей терапии при черепно–мозговой травме. Для объективизации результатов желательно проведение исследования по эффективности депротеинизированного гемодиализата крови телят при черепно–мозговой травме в расширенных по дизайну исследованиях в крупных неврологических центрах.
Обзор подготовлен по материалам
Aus Der Klinischen Praxis, 63, 11, 835–841 (1990)
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Что такое гематома головного мозга? Причины возникновения, диагностику и методы лечения разберем в статье доктора Яковлева Дмитрия Вячеславовича, нейрохирурга со стажем в 11 лет.
Над статьей доктора Яковлева Дмитрия Вячеславовича работали литературный редактор Вера Васина , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина

Определение болезни. Причины заболевания
Гематома головного мозга — это грозное патологическое состояние, при котором кровь изливается из повреждённого сосуда внутрь черепной коробки. Скапливаясь во внутричерепном пространстве или в веществе головного мозга, кровь сдавливает мозг и повреждает его. Стремительно появляются и прогрессируют неврологические симптомы, столь же быстро, а иногда и молниеносно, гематома приводит к угнетению сознания, вплоть до комы. Данное состояние является тяжёлым и зачастую угрожает жизни, поэтому требует своевременной диагностики и лечения [1] .
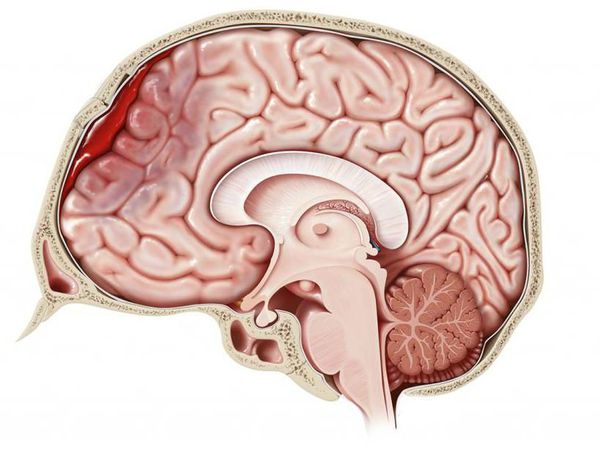
Согласно зарубежным источникам:
- ежегодно инсульт головного мозга с формированием гематомы случается у 2400 человек из 1 млн жителей западных развитых стран ;
- из них более 700 человек ежегодно погибает;
- менее половины из этих 2400 человек восстанавливаются и способны полноценно обслуживать себя [11] .
Причины развития гематомы головного мозга:
- Основная — артериальная гипертензия и атеросклеротическая болезнь[2] . Риск инсульта с формированием гематомы среди пациентов с артериальной гипертензией составляет 60 %;
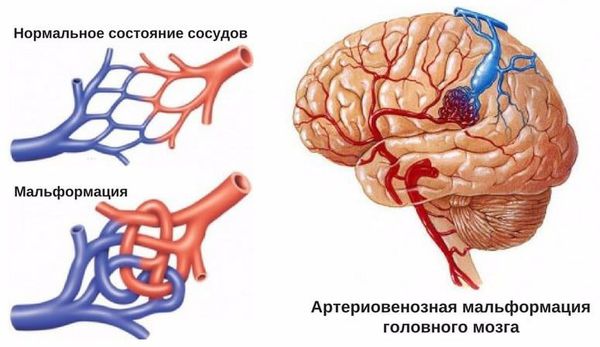
- Пороки развития сосудов головного мозга. К ним относят аневризму (выпячивание стенок мозговых артерий) и артериовенозную мальформацию (патологическое переплетение артерий и вен).
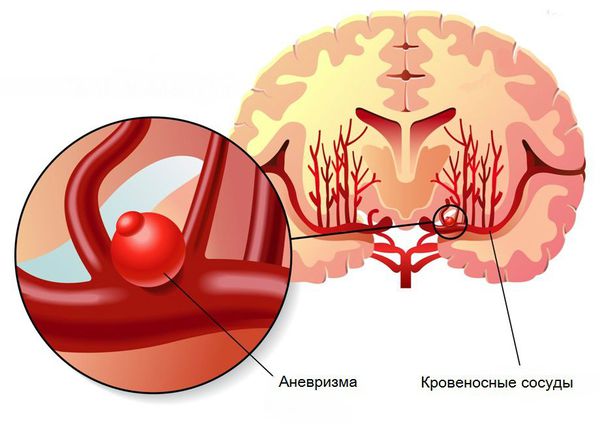
- Опухоли головного мозга, воспалительные заболевания сосудов, нарушения свёртывающей системы крови с повышением кровоточивости.
- Препараты, повышающие кровоточивость: антикоагулянты, антиагреганты и фибринолитики. Эти медикаменты назначают пациентам со склонностью к образованию тромбов и после тяжёлых шунтирующих операций. Приём лекарств необходим, но риск развития гематомы головного мозга при этом возрастает.
- Черепно-мозговые травмы. Гематомы возникают в 55 % всех случаев черепно-мозговых травм и являются причиной 2/3 смертей при данных повреждениях [12] . Травмы мозга — одна из самых частых причин смерти в развитых странах. По статистике они находятся на третьем месте после летальных исходов от сердечно-сосудистых заболеваний и онкологии [7] .
Причины развития гематом головного мозга зависят от возраста пациента:
- у детей — пороки развития сосудов головного мозга и болезни системы крови [3] ;
- у молодых взрослых — артериальная гипертензия, алкогольная и наркотическая интоксикации;
- у лиц среднего и пожилого возраста — артериальная гипертензия, опухоли головного мозга, артериовенозные мальформации и аневризмы.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы гематомы головного мозга
Гематома головного мозга проявляется различными способами. Симптомы делятся на две группы:
1. Общемозговые — головная боль, головокружение, тошнота или рвота. Вызваны значительным повышением внутричерепного давления.
2. Очаговые — слабость в руке или ноге, нарушение зрения или движений глаз и др. Напрямую зависят от расположения гематомы.
Симптомы острой нетравматической гематомы:
- интенсивная головная боль, вызванная физической нагрузкой, эмоциональным перенапряжением, повышенным артериальным давлением [3] ;
- тошнота, рвота;
- нарушение речи;
- слабость в руке или ноге;
- асимметрия лица;
- крайне важные и тяжёлые признаки — судороги, кратковременная потеря или стойкое угнетение сознания, кома;
- пульсирующий шум в голове, нарушение координации или зрения, икота.
Патогенез гематомы головного мозга
К кровоизлиянию могут приводить травмы и различные заболевания. Однако при патологии всегда повреждается кровеносный сосуд и внутри или снаружи от вещества головного мозга скапливается кровь, для которой в норме нет места. Она сдавливает головной мозг и повреждает его отделы.
При внутримозговом кровоизлиянии гематома может формироваться в больших полушариях головного мозга и мозжечке. Расположение влияет на клиническую картину и косвенно указывает на причину кровоизлияния:
- гематомы, вызванные повышенным артериальным давлением, располагаются в глубоких отделах полушарий головного мозга вблизи таламуса или в мозжечке;
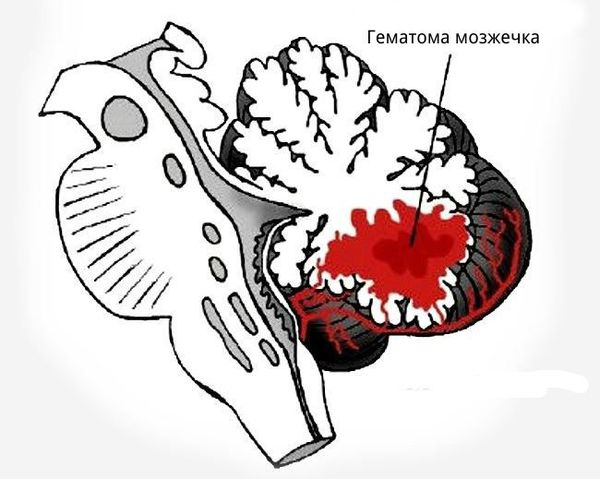
- более поверхностно локализованы гематомы, связанные с разрывом аневризм головного мозга, амилоидной ангиопатией (заболеванием мелких сосудов мозга), длительным приёмом препаратов, влияющих на свёртываемость крови, кавернозной ангиомой (сосудистой опухолью) или кровоизлиянием в опухоль;
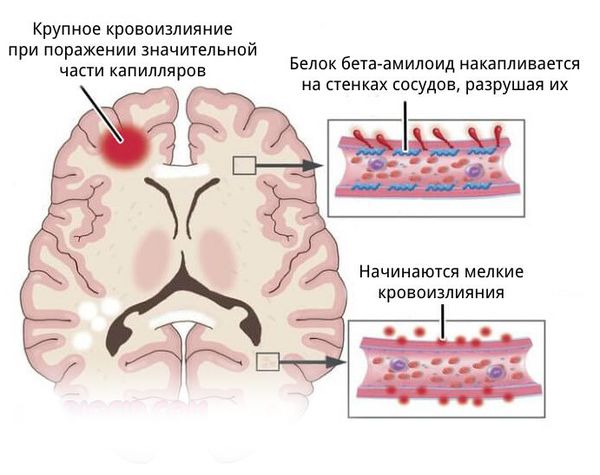
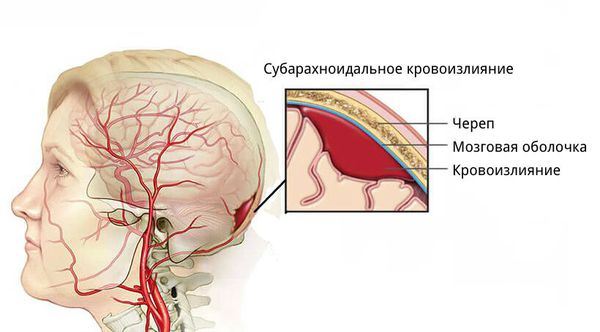
- для артериовенозных мальформаций характерно расположение гематомы под корой головного мозга, а также прорыв крови в полость между мозговыми оболочками.
Классификация и стадии развития гематомы головного мозга
Все гематомы головного мозга подразделяются на две группы:
- нетравматические, или спонтанные;
- травматические, возникшие при травме.
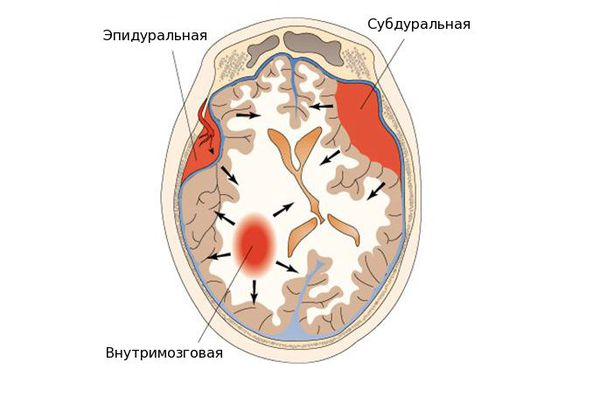
По локализации во внутричерепном пространстве выделяют:
- эпидуральные гематомы — располагаются между внутренней поверхностью костей черепа и твёрдой мозговой оболочкой;
- субдуральные — локализованы между твёрдой мозговой оболочкой и веществом головного мозга;
- внутримозговые гематомы — залегают в веществе головного мозга.
По срокам давности гематомы головного мозга подразделяются на три типа:
- острые — обнаружены в течение трёх суток после возникновения;
- подострые — выявлены через 3-21 день после травмы;
- хронические — после травмы и появления гематомы прошло более 21 дня.
Врач может определить приблизительный возраст гематомы по снимкам компьютерной и магнитно-резонансной томографии (КТ и МРТ). От срока давности зависит выбор методов лечения.
По глубине расположения гематомы делятся на два вида:
- поверхностные (подкорковые);
- глубокие (в центральных отделах полушария).
Внутримозговые кровоизлияния, приводящие к гематомам, разделяют на две группы:
- первичные, вызванные артериальной гипертензией (70-90 % всех внутримозговых гематом) [9] ;
- вторичные, связанные с нарушениями свёртываемости крови, сосудистой патологией и кровоизлиянием в опухоль.
Существует два механизма развития кровоизлияния:
- излившаяся кровь расслаивает вещество головного мозга и формирует полость с жидкой средой и кровяными свёртками;
- кровь пропитывает вещество мозга, перемешиваясь с ним.
Осложнения гематомы головного мозга
Внутричерепная гематома как частое последствие черепно-мозговых травм вызывает ряд нарушений, связанных с работой мозга. Так как череп является замкнутой жёсткой костной структурой, он не способен растягиваться и увеличиваться в объёме. Поэтому образовавшееся внутри черепной коробки скопление крови давит на головной мозг, спинномозговую жидкость и сосуды головного мозга, вытесняя и занимая их место. Именно из-за этого состояние пациента осложняется ещё сильнее [4] [5] .
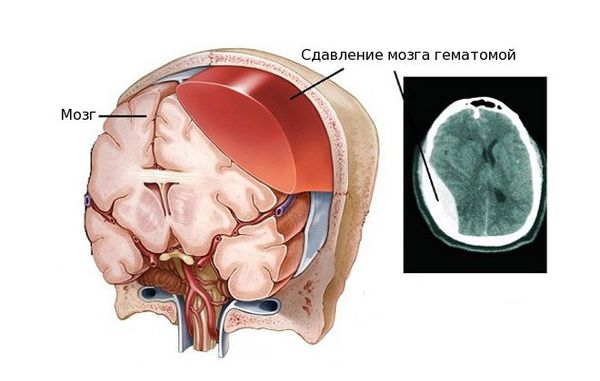
Вне зависимости от того, вызвана гематома травмой или заболеванием, проявление патологии схожее. Гематома вызывает следующие нарушения:
- Двигательные и чувствительные нарушения, например в ногах и руках. Возникают вследствие ограниченного проведения нервных импульсов.
- Гибель клеток мозга и отёк в результате сдавления сосудов головного мозга, ухудшения кровоснабжения и оттока крови.
- Смещение участков головного мозга.
- Повышение внутричерепного давления.
- Нарушение движения спинномозговой жидкости внутри черепа.
- Самое опасное последствие — вклинение ствола головного мозга в большое затылочное отверстие. Это приводит к остановке дыхания и сердечно-сосудистой деятельности.
Все вышеперечисленные процессы взаимосвязаны и влияют друг на друга. Последствия различаются в зависимости от объёма гематомы, расположения, наличия прорыва крови в желудочковую систему, нарушения циркуляции спинномозговой жидкости и других факторов. В самом худшем варианте — это смерть.
Часто после травмы головы с повреждением сосудов гематома развивается в течение трёх часов. Однако известны случаи отсроченных гематом, возникших через 72 часа. Невозможно точно указать время, когда гематома начнёт ухудшать состояние пациента, так как это зависит от её объёма. Малые гематомы, расположенные вне зон, регулирующих деятельность мышц и органов чувств, могут остаться незамеченными без проведения КТ и МРТ исследований.
Диагностика гематомы головного мозга
Как правило, пациенты или их родственники (если пациент находится в бессознательном состоянии) сперва сталкиваются не с неврологом или нейрохирургом, а с врачом скорой помощи, общей практики или терапевтом. Врач предполагает наличие внутричерепного кровоизлияния на основании состояния пациента, жалоб и сведений, полученных от него и сопровождающих лиц. В некоторых случаях определить гематому оказывается сложной задачей, и дальнейшую диагностику проводят врач-невролог или нейрохирург.
Для определения степени поражения головного мозга невролог и нейрохирург проводят оценку неврологического статуса (осмотр, проверка рефлексов). После этого подбирается тактика лечения.
Для подтверждения или опровержения гематомы, определения её расположения, сроков появления, размеров, степени сдавления головного мозга применяют методы нейровизуализации:
- Бесконтрастная компьютерная томография (КТ) — достоверный способ диагностики острых гематом головного мозга. КТ позволяет распознать гематому, её объём, воздействие на различные структуры головного мозга. На основании снимков КТ нейрохирург определяет тактику и объём оперативного вмешательства. Большинство стационаров, особенно оказывающих экстренную помощь, оснащены КТ аппаратами. Однако в хронической стадии и при пороках сосудов головного мозга без кровоизлияния КТ может не предоставить врачу нужной информации. В этих случаях применяют МРТ [8] .
- Магнитно-резонансная томография (МРТ) позволяет более подробно рассмотреть мягкотканные структуры. Поэтому в случае затруднений при диагностике, несмотря на проведённое КТ исследование, врач может назначить МРТ.
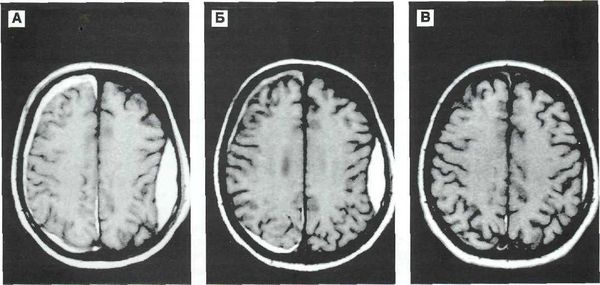
- Церебральная ангиография (золотой стандарт визуализации аневризм головного мозга [10] ), магнитно-резонансная ангиография (МРА) или КТ-ангиография дополняют МРТ исследования для определения патологии сосудов головного мозга. Преимущество КТ-ангиографии — возможность получить 3D-модель сосудов головного мозга и определить расположение относительно сосудистых или костных структур.
Ранее для диагностики широко применяли люмбальную пункцию. Однако этот метод имеет существенные недостатки и постепенно вытесняется вышеперечисленными, хотя в лечебных учреждениях, не оснащённых КТ и МРТ аппаратурой, применяется до сих пор.
Лечение гематомы головного мозга
Выделяют два вида лечения: консервативное и хирургическое.
Консервативное лечение
Методы консервативного (медикаментозного) лечения нормализуют жизненные функции организма:
- поддерживают артериальное давление на необходимом уровне: так, чтобы кровоснабжение головного мозга сохранялось, но объём гематомы при этом не увеличивался;
- воздействуют на свёртывающую систему крови;
- предотвращают и устраняют отёки;
- укрепляют сосудистую стенку.
Это крайне важный и ответственный этап лечения. Все мероприятия проводит врач, глубоко анализируя патогенетические процессы в организме человека. Многие методы основаны на лабораторных данных. Консервативную терапию ни в коей мере не могут контролировать или регулировать родственники либо сочувствующие лица из-за отсутствия у них этих знаний. Например снижение давления при гипотензивной терапии не должно быть резким. Его понижают до уровня, который не совпадает с показателями нормы для здорового человека. Давление поддерживают в определённых пределах: оно не должно быть слишком высоким, но и слишком низким. Это позволяет снизить риск продолжения кровоизлияния и сохранить адекватное кровенаполнение головного мозга для его защиты от вторичного повреждения из-за кислородного голодания.
Консервативные методы применяют для лечения в следующих случаях:
- гематомы небольших размеров и не оказывают значительного давления на мозг;
- гематомы не вызывают смещение структур головного мозга, грубого угнетения сознания, сопровождаются умеренными неврологическими нарушениями.
Хирургическое лечение
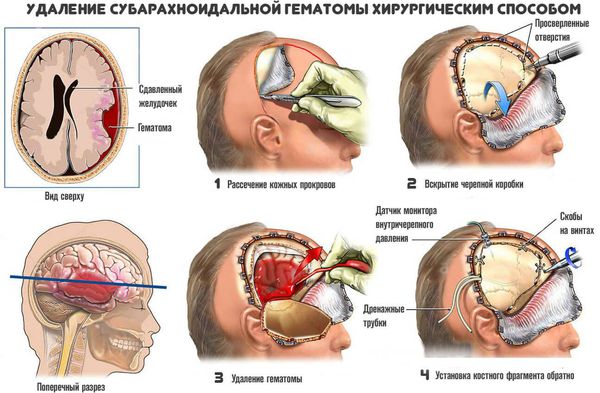
Хирургическое лечение заключается в механическом удалении гематомы. В результате прекращается давление гематомы на мозг.
Применяют несколько методов хирургичекого удаления внутримозговых гематом:
- Пункционный метод — выкачивание жидкой части гематомы (аспирация) через отверстие. Однако удалить всю гематому таким способом невозможно, так как обычно она на 80 % состоит из кровяных сгустков, а жидкий компонент составляет 20 % и меньше. Метод применяют только при тяжёлой форме заболевания для спасения жизни. Если после операции состояние пациента не улучшается, то используют радикальные методы удаления.
- Открытый метод — традиционный способ удаления гематомы путем создания отверстия в костной ткани черепа (трепанации), рассечения участка мозга (энцефалотомии) и аспирации отсосом как жидкой крови, так и её сгустков. Метод позволяет полностью удалить гематому. Однако сопровождается дополнительной хирургической травмой мозга, что приводит к нарастанию отёка, усилению смещения и деформации структур мозга и нередко вызывает повторное кровоизлияние.
- Эндоскопический метод — перспективная технология удаления внутримозговых гематом. Совмещает низкую травматичность пункционного метода с возможностью полного удаления гематомы. Но метод можно применять только при условии прозрачности среды в зоне операции. Например, при кровотечении проведение операции затруднено, а часто и невозможно.
- Стереотаксический метод — проводят при помощи специальных инструментов, погружённых в головной мозг через отверстие диаметром 5–10 мм. Особенность метода — перенос координат гематомы с помощью компьютерной томографии или рентгенографии. Технология уменьшила летальность глубоких гематом на 22 % в сравнении с консервативными методами лечения. Однако в 10-16 % случаев возможны повторные кровоизлияния в первые несколько суток после операции.
- Нейронавигационный метод — применяют нейронавигационные системы: ОртiсаI Тracking System «Radionics Inc» Compass Cygnus PFS System, «Compass» Vectorvision ВrаinLАВ. Метод с высокой точностью определяет расположение гематомы. Технология особенно эффективна при очагах в функционально значимых зонах мозга. Её широкое применение пока невозможно из-за высокой стоимости оборудования и ограниченного опыта операций у врачей [13] .
Тактика оперативного вмешательства, его объём, меры для устранения сдавления головного мозга, сроки проведения операции и многое другое зависят от конкретной ситуации. Решение принимает врач-нейрохирург на основании состояния пациента, лабораторных данных и КТ/МРТ снимков.
Прогноз. Профилактика
Гематома головного мозга — это результат патологических изменений в организме, которые формируются постепенно под влияние различных причин. Поэтому прогноз в каждом конкретном случае будет различаться [3] .
Исход во многом зависит от объёма и расположения гематомы. Быстрое ухудшение состояния с угнетением сознания является негативным признаком. Согласно зарубежным источникам, гематомы головного мозга в 55 % случаев приводят к значительному ухудшению состояния пациента и смерти [6] . Поэтому очень важно незамедлительно доставить пациента в специализированный стационар и оказать медицинскую помощь.
После выздоровления могут остаться последствия повреждения мозговой ткани: слабость в руке или ноге, когнитивные расстройства (нарушение мышления, памяти, снижение критики к своему состоянию и поведению).
Профилактика заболевания заключается в здоровом образе жизни в любом возрасте и внимательном отношении к своему состоянию в случае уже имеющихся болезней. Нередко пациенты с артериальной гипертензией не посещают кардиолога и терапевта, не контролируют уровень давления и показатели крови. Пациенты с сахарным диабетом зачастую игнорируют рекомендации эндокринолога, способствуя ухудшению своего состояния. Конечно, длительный приём препаратов и соблюдение диеты могут быть психологическим испытанием для человека, но это важный шаг к сохранению своего здоровья.
Представлены результаты исследования комбинированной терапии цераксоном и актовегином с участием 74 пациентов с сотрясением головного мозга давностью от 2 до 15 дней. Из них 54 человека получали традиционную терапию, а 20 пациентов помимо традиционной терапии в течение 3 месяцев принимали актовегин (400 мг 3 раза в сутки) и цераксон (200 мг 2 раза в сутки). В результате исследования установлено, что применение актовегина и цераксона приводит к более полному регрессу нейродинамических расстройств, повышению речевой активности, восстановлению ассоциативных взаимодействий в работе полушарий головного мозга. Кроме того, отмечено значительно более выраженное улучшение субъективных показателей (общего самочувствия, работоспособности, утомляемости). Терапия актовегином и цераксоном способствует уменьшению выраженности когнитивных нарушений при острой легкой черепно-мозговой травме. Данный клинический эффект препаратов способствует повышению качества жизни пациентов.
Ключевые слова: черепно-мозговая травма, сотрясение головного мозга, когнитивные нарушения, цераксон, актовегин
The article presents the results of study of combination therapy with ceraxon and аctovegin among 74 patients with brain concussion for 2 to 15 days after trauma. Of these, 54 patients received conventional therapy, and 20 patients, received аctovegin (400 mg 3 times daily) and ceraxon (200 mg 2 times a day) within 3 months in addition to conventional therapy. The study found that the use of ceraxon and аctovegin leads to a more complete regression of neurodynamic disorders, increase speech activity, and restoration of associative interactions in the cerebral hemispheres. In addition, significantly greater improvement in subjective measures (general health, performance capability, fatigue) was observed. Therapy with аctovegin and ceraxon provides decrease of severity of cognitive impairment in acute mild traumatic brain injury. This clinical effect of the drugs contributes improvement of quality of life of patients.
Key words: traumatic brain injury, brain concussion, cognitive disorders, ceraxon, аctovegin
В настоящее время проблема когнитивных нарушений у различных категорий пациентов стала одной из наиболее актуальных и исследуемых во всем мире. Современное развитие реабилитационной техники привело к тому, что даже тяжелый двигательный дефицит у пациента приводит к менее выраженной социальной дезадаптации, чем дефект когнитивных функций. В самом деле достаточно однократных материальных затрат на адаптацию жилого помещения (расширение дверных проемов, устранение бордюров, установление поручней в жилых и санитарных помещениях, пандусов на лестнице и в транспорте и т. п.), приобретения электроприводной инвалидной коляски — и вот уже пациент с пара- или гемиплегией, но сохранным интеллектом обретает значительную степень независимости от окружающих. Этот человек получает или продолжает образование, трудовую деятельность, он свободен в выборе способов и мест времяпровождения, получении информации, социальных благ. Другой пациент, неимеющий исходного двигательного дефицита, но утративший способность самостоятельно контролировать свою повседневную деятельность, тазовые функции, прием пищи, оказывается полностью зависимым от посторонней помощи и нуждается в уходе столько времени, сколько лет ему предстоит жить. Материальные затраты на этих пациентов несопоставимы.
В результате технического прогресса число травм растет и будет расти. В настоящее время черепно-мозговая травма (ЧМТ) является одной из ведущих причин смертности и инвалидизации трудоспособного населения в индустриально развитых странах. Как причина летальности травматизм занимает третье место, уступая лишь сердечно-сосудистым и онкологическим заболеваниям. Среди трудоспособного населения различные травмы являются ведущей причиной смерти, а смертность от ЧМТ превышает таковую от сердечно-сосудистых заболеваний в 10, а от рака - в 20 раз. Ежегодно только в дорожно-транспортных происшествиях в России погибают более 30 тыс. человек. Повреждения черепа и мозга служат причиной летальности почти половины пострадавших с травмами. Частота ЧМТ в России колеблется от 1,8 до 4,7 на 1000 населения в год, в среднем 4,0—4,5. По данным Федерального центра нейрохирургии, ежегодно в России госпитализируют около 1 млн пациентов с ЧМТ, из них порядка 270 тыс. — с тяжелой или среднетяжелой ЧМТ, а остальные 730 тыс. — с диагнозами "сотрясение головного мозга (СГМ)" или "ушиб мозга легкой степени".
Наиболее высок травматизм именно в категории молодого трудоспособного населения. При этом пациенты с посттравматическими нарушениями когнитивных функций более значительно ограничены в повседневной деятельности или даже обречены на многолетний повседневный уход, затраты на который грандиозны! Таким образом, не вызывает сомнений актуальность дальнейшего изучения влияния ЧМТ на когнитивную сферу человека и путей воздействия на данную проблему, чтобы в конечном итоге уменьшить как материальные, так и психологические затраты на пациентов с данной патологией.
Проблеме медикаментозной коррекции когнитивных нарушений у пациентов с острой ЧМТ посвящено множество научных трудов и клинических исследований. В ответ на повреждение мозга возникают нарушения мозгового кровообращения, ликвороциркуляции, проницаемости гематоэнцефалического барьера. Вследствие избыточного обводнения клеток мозга и межклеточного пространства развиваются отек и набухание мозга, что вместе с другими патологическими реакциями обусловливает повышение внутричерепного давления, дальнейшее ухудшение метаболизма и функциональной активности мозга.
Основным направлением лечения острой ЧМТ являются оперативное вмешательство и консервативная терапия. При СГМ в комплекс консервативной терапии традиционно включают соблюдение постельного режима в течение 7—10 дней, применение седативных (диазепам, хлордиазепоксид), гипосенсибилизирующих (дифенгидрамин, прометазин), вегетотропных (L-гиосциамина сульфат, платифиллин), дегидратирующих (фуросемид) препаратов. Общепризнанно, что консервативная терапия ЧМТ должна быть этапной и преемственной: стационарное лечение в острой фазе с дальнейшим продолжением терапии в амбулаторных условиях (А.Н. Коновалов и соавт., 1994). В качестве лечебных средств многие исследователи предлагают использовать препараты нейропротекторного действия. Так, В.Д. Даминов и В.В. Германович изучили положительный эффект холина альфосцерата в комплексном лечении больных, перенесших ЧМТ. Эффективность ривастигмина в лечении последствий ЧМТ показали Е.А. Кондратьева и соавт. (2009). Сравнительное исследование эффективности мемантина в терапии посттравматических когнитивных расстройств провели М.М. Одинак и соавт. (2005). Во всех исследованиях в большей степени анализировалось течение травматической болезни мозга у пациентов, перенесших тяжелую травму.
Однако, возвращаясь к рассмотренным выше данным о значительной выраженности и высокой частоте посттравматических когнитивных нарушений, подавляющей доле пациентов именно с “легкой” травмой среди всех лиц с ЧМТ необходимо в корне менять устаревшее представление о пациентах с СГМ и ушибами головного мозга легкой степени как о “легких” больных, которые не требуют существенной нейротропной терапии.
Учитывая существенную роль метаболических нарушений в патогенезе легкой ЧМТ, мы сделали попытку использовать в схеме лечения СГМ комбинацию препаратов цераксон (цераксон) и актовегин как эффективных корректоров различных звеньев патогенеза травматической болезни (электролитного дисбаланса, метаболического ацидоза, тканевой гипоксии, энергетического дефицита). Эффективность применения этой комбинации была убедительно показана ранее в работе кафедры фундаментальной и клинической неврологии и нейрохирургии Российского государственного медицинского университета на базе городской клинической больницы № 31 Москвы “Исследование безопасности и эффективности комбинированной терапии цераксоном и актовегином больных в остром периоде ишемического инсульта”. Безусловно патология пациентов в этом исследовании была иной, однако механизмы повреждающего действия ишемического и травматического факторов в значительной мере схожи и на определенном этапе течения заболевания морфологические изменения становятся однотипными (Н.А. Шамалов и соавт., 2009).
Материал и методы
Для оценки эффективности коррекции когнитивных нарушений при острой легкой ЧМТ была обследована группа пациентов, состоявшая из 74 человек в возрасте от 20 до 60 лет с СГМ давностью от 2 до 15 дней. Первую подгруппу составили 54 пациента, которые получали традиционную терапию, включавшую в остром периоде преимущественно препараты симптоматического действия (анальгетики и дегидратирующие средства), а на амбулаторном этапе - сосудистые препараты (винпоцетин) и мочегонные (диакарб). Двадцати пациентам второй подгруппы помимо традиционной терапии в течение 3 месяцев назначали актовегин в виде таблеток в дозе 400 мг 3 раза в сутки и цераксон в дозе 200 мг (2 мл) 2 раза в сутки в виде раствора для приема внутрь. В группу контроля вошли 40 условно здоровых добровольцев соответствующего возраста, не имевших острой ЧМТ и последствий ранее перенесенных травм.
Оценку когнитивных функций проводили с использованием тестов литеральных ассоциаций, категориальных ассоциаций, краткой шкалы оценки психического статуса, батареи лобных тестов, теста рисования часов, запоминания 10 и 12 слов, теста ориентации линий, теста на запоминание 6 абстрактных фигур, Бостонского теста, Trail marking test part A and B, теста узнавания недорисованных предметов. Пациентов обследовали дважды: в остром периоде травмы и спустя 3 месяца.
Результаты и обсуждение
Средний возраст пациентов составил 39,6 ± 8,4, здоровых добровольцев -40,2 ± 11,4 года. Среднее и среднее специальное образование среди пациентов с СГМ имели 42 % пациентов, высшее - 43 %, остальные 15 % - неполное среднее или начальное. В контрольной группе 40 % составили лица со средним и средним специальным образованием, 57,5 % - с высшим образованием, один человек (2,5 %) имел неполное среднее образование. По наличию сопутствующих заболеваний группы здоровых добровольцев и пациентов с легкой ЧМТ практически не различались. Средняя частота сопутствующих заболеваний среди лиц до 40 лет составила 40 % в группе здоровых и 32 % среди пациентов с СГМ. Среди лиц от 40 до 60 лет те или иные хронические заболевания отметили 82,5 % здоровых добровольцев и 68,0 % больных. Тяжелых сердечно-сосудистых, неврологических, эндокринных и других заболеваний в обеих группах выявлено не было. Таким образом, существенных различий между группой пациентов и контрольной группой по критериям возраста, уровня образования, наличия сопутствующей патологии не отмечено.
При исследовании клинических симптомов установлено, что наиболее частымижалобамиупациентовсСГМ на момент проведения исследования были головная боль различной интенсивности (69 %) и головокружение (29 %), реже отмечалась тошнота (17 %). Потерю сознания в момент травмы достоверно отметили 53 % пострадавших (необходимо заметить, что остальные пациенты не могли полностью исключить секундную потерю сознания, но точно оценить затруднялись из-за кратковременных амнестических нарушений). Нарушения памяти в перитравматическом периоде удалось выявить среди 62 % больных; как правило, они касались собственно момента получения травмы и ближайших последующих событий. В неврологическом статусе наиболее часто имели место атаксия в позе Ромберга (54 %) и вегетативные нарушения в виде гипергидроза кистей и стоп (66 %), реже выявлялись нистагм (23 %) и легкая асимметрия лицевой мускулатуры (9 %). В группе здоровых добровольцев активные жалобы отсутствовали, очаговой неврологической симптоматики также не наблюдалось, но явления акрогипергидроза были отмечены у 6 из10 молодых женщин (60 % в возрастной группе и 15 % от общего числа обследованных) и у 2 из 10 молодых мужчин (20 % в возрастной группе, 5 % от общего количества).
Таким образом, никакими абсолютно патогномоничными, специфическими, постоянными жалобами или неврологическими симптомами СГМ не характеризуется и клиническая диагностика данного состояния строится на весьма субъективных признаках (наличии факта механической травмы головы в сочетании с разнообразными жалобами и нестойкими полиморфными неврологическими симптомами).
Значительно более информативными оказались результаты нейропсихологического исследования пациентов с СГМ. Отклонения по результатам тестов были выявлены среди 96 % из них. При этом неспецифические, интегральные экспресс-тесты, единственно применяющиеся в повседневной врачебной практике, и то далеко не всеми врачами, практически не показали различий между здоровыми добровольцами и пациентами с острой травмой. Помимо экспресс-тестов были проведены стандартные нейропсихологические исследования. Наиболее отчетливые нарушения в остром периоде выявлены у пациентов при оценке памяти (при этом более отчетливо были нарушены процесс извлечения оперативной информации, а также вспоминание ранее знакомых словесных элементов), внимания, скорости переключения и избирательности выполнения задания, при выполнении заданий на сложный (симультанный) гнозис, что свидетельствует о значительном затруднении функционирования ассоциативных и комиссуральных связей и нарушении вследствие этого слаженной работы сложных интегративных структур. То есть в наибольшей степени у пациентов пострадали нейродинамические процессы в отсутствие отклонений в “очаговых” функциях (речь, гнозис, праксис как отдельные элементы мышления не пострадали).
При повторной оценке данных основной и контрольной групп также выявлены значительные различия. Результаты тестов как в подгруппе пациентов, получавших стандартную терапию, так и у тех, кто дополнительно принимал цераксон и актовегин, даже спустя 3 месяца после травмы по большинству показателей “не дотягивали” до уровня здоровых добровольцев, однако во второй подгруппе эти различия были значительно менее выражены. Наиболее отчетливая разница отмечена в тестах на вербальные и категориальные ассоциации, перевернутом тесте ориентации линий, тестах 12 слов (непосредственное и отсроченное воспроизведение без подсказки) и 6 предметов (общий балл), бостонском тесте (часть В), Trail Marking Test part A and B, узнавании недорисованных предметов (см. таблицу).
Таблица
Результаты тестов нейропсихологического исследования
Тесты для оценки когнитивных функций
Таким образом, в результате исследования установлено, что при СГМ применение актовегина и цераксона приводит к более полному регрессу нейродинамических расстройств, повышению речевой активности, восстановлению ассоциативных взаимодействий в работе полушарий головного мозга, чем стандартная терапия. Кроме того, отмечено значительно более выраженное улучшение субъективных показателей (общего самочувствия, работоспособности, утомляемости) при контрольном собеседовании спустя 3 месяца в подгруппе пациентов, получавших цераксон и актовегин. Переносимость терапии была удовлетворительной.
Заключение
Таким образом, острая ЧМТ остается важной медико-социальной проблемой как на этапе диагностики и лечения, так и в дальнейшем — при выходе пациента “в свет”. Наиболее постоянными и характерными для острой легкой ЧМТ являются вегетативные расстройства при оценке неврологического статуса и нейродинамические нарушения при исследовании когнитивных функций. Отсутствие жалоб и неврологических симптомов в ближайшие сроки после травмы не должно быть основанием для преждевременного возвращения пациента к трудовой и социальной деятельности, особенно когда его профессия требует повышенного внимания и связана с высоким риском (водители, диспетчеры, электрики). Терапия актовегином и цераксоном способствует уменьшению выраженности когнитивных нарушений при острой легкой ЧМТ и улучшению общего самочувствия и работоспособности. Данный клинический эффект препаратов способствует повышению качества жизни пациентов.
Информация об авторе:
Дроздова Е.А. — врач-невролог высшей категории, исполняющая обязанности заведующей 1-м неврологическим отделением для больных ОНМК МЛПУ "Городская больница № 13" Нижнего Новгорода.
ЛИТЕРАТУРА
Читайте также:


